Ηλεκτρονικό σύννεφο. Μορφή νεφών ηλεκτρονίων Τύποι και σχήματα νεφών ηλεκτρονίων
Διαβάστε επίσης
Δομή ηλεκτρονικών κελυφών
Σύμφωνα με τις κβαντομηχανικές έννοιες, ένα ηλεκτρόνιο, όπως κάθε άλλο μικροσωματίδιο, έχει ταυτόχρονα σωματιδιακές και κυματικές ιδιότητες (δυϊσμός σωματιδίων-κύματος), π.χ. ιδιότητες των σωματιδίων και των κυμάτων.Για την περιγραφή της κατάστασης (κίνησης) ενός ηλεκτρονίου σε ένα άτομο, χρησιμοποιείται μια πιθανολογική προσέγγιση, βασισμένη στις έννοιες του νέφους ηλεκτρονίων, του ατομικού τροχιακού και της πυκνότητας ηλεκτρονίων.
Ηλεκτρονικό σύννεφο – ένα μοντέλο της κίνησης ενός ηλεκτρονίου σε ένα άτομο, το οποίο υποθέτει ότι το αρνητικό φορτίο του ηλεκτρονίου είναι άνισα κατανεμημένο σε ολόκληρο τον όγκο του χώρου γύρω από τον πυρήνα (το ηλεκτρόνιο είναι, όπως λέγαμε, «λερωμένο» σε αυτόν τον όγκο) . Όταν απεικονίζεται γραφικά ένα σύννεφο ηλεκτρονίων, αυτό φαίνεται από την άνιση πυκνότητα των κουκκίδων: όπου οι κουκκίδες είναι πιο πυκνές, το ηλεκτρόνιο βρίσκεται εκεί πιο συχνά.
Η πυκνότητα του νέφους ηλεκτρονίων (πυκνότητα ηλεκτρονίων) μειώνεται με την απόσταση από τον πυρήνα.
Σε ένα άτομο πολλαπλών ηλεκτρονίων, τα ηλεκτρόνια βρίσκονται σε ατομικά τροχιακά (AO). Ατομικό τροχιακό – αυτή είναι η κατάσταση ενός ηλεκτρονίου με συγκεκριμένη ενεργειακή τιμή, σχήμα και χωρικό προσανατολισμό του νέφους ηλεκτρονίων.
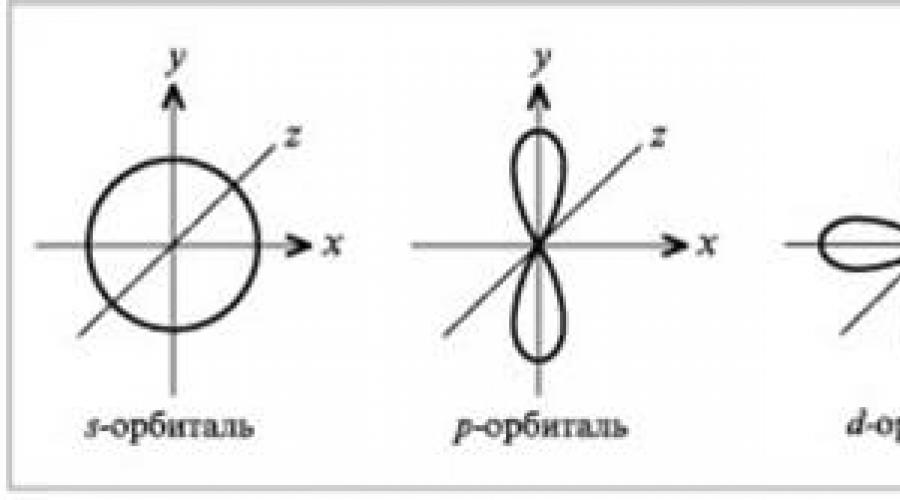
Τα σφαιρικά τροχιακά ορίζονται με το γράμμα s και τα ηλεκτρόνια που καταλαμβάνουν αυτά τα τροχιακά ονομάζονται ηλεκτρόνια s.
Τα τροχιακά με τη μορφή ενός τρισδιάστατου σχήματος οκτώ (αλτήρες) χαρακτηρίζονται από το γράμμα p και τα ηλεκτρόνια που βρίσκονται σε αυτά ονομάζονται p-ηλεκτρόνια.

Καθώς απομακρύνεται από τον πυρήνα, η ενέργεια του ηλεκτρονίου αυξάνεται (η ισχύς του δεσμού του με τον πυρήνα μειώνεται) και το μέγεθος του τροχιακού στο οποίο βρίσκεται το ηλεκτρόνιο αυξάνεται επίσης. Κατά συνέπεια, ενώ διατηρείται το σχήμα του τροχιακού και ο αριθμός των ηλεκτρονίων σε αυτό, η πυκνότητα των ηλεκτρονίων μειώνεται. Κατά την κατασκευή ηλεκτρονικών κυκλωμάτων γραφικών, ένα AO απεικονίζεται ως κύτταρο (κβαντικό κελί) και ένα ηλεκτρόνιο απεικονίζεται ως βέλος.

Το ηλεκτρόνιο χαρακτηρίζεται γνέθω, το οποίο μπορεί να απλοποιηθεί για να αναπαραστήσει την περιστροφή ενός ηλεκτρονίου γύρω από τον άξονά του δεξιόστροφα ή αριστερόστροφα. Ανάλογα με αυτό, το ηλεκτρόνιο χαρακτηρίζεται με βέλη: ή ↓.
Εάν υπάρχει ένα ηλεκτρόνιο σε ένα ΑΟ, τότε αυτό ονομάζεται ασύζευκτο. Τα δύο ηλεκτρόνια που βρίσκονται στην ανώνυμη εταιρεία ονομάζονται ζεύγη ζευγών ή ηλεκτρονίων (μοναχικά).
Δεν υπάρχουν περισσότερα από δύο ηλεκτρόνια σε ένα ΑΟ και τα σπιν τους πρέπει να είναι σε αντίθετες κατευθύνσεις.
| | | επόμενη διάλεξη ==> | |
Όχι μόνο η ενέργεια ενός ηλεκτρονίου σε ένα άτομο (και το σχετικό μέγεθος του νέφους ηλεκτρονίων) μπορεί να λάβει μόνο ορισμένες τιμές. Το σχήμα του νέφους ηλεκτρονίων δεν μπορεί να είναι αυθαίρετο. Καθορίζεται από τον τροχιακό κβαντικό αριθμό I (ονομάζεται επίσης δευτερεύων ή αζιμουθιακό), ο οποίος μπορεί να πάρει ακέραιες τιμές από 0 έως (n - 1), όπου n είναι ο κύριος κβαντικός αριθμός. Διαφορετικές τιμές του n αντιστοιχούν σε διαφορετικούς αριθμούς πιθανών τιμών του /. Έτσι, με n = 1, μόνο μία τιμή του τροχιακού κβαντικού αριθμού είναι δυνατή - μηδέν (/ = 0), με n = 2 / μπορεί να είναι ίση με 0 ή 1, με n = 3, οι πιθανές τιμές του / είναι ίσες με 0, 1 και 2, γενικά, μια δεδομένη τιμή του κύριου κβαντικού αριθμού n αντιστοιχεί σε n διαφορετικές πιθανές τιμές του τροχιακού κβαντικού αριθμού.
Το συμπέρασμα ότι τα σχήματα των ατομικών νεφών ηλεκτρονίων δεν μπορούν να είναι αυθαίρετα προκύπτει από τη φυσική έννοια του κβαντικού αριθμού /. Αυτό είναι που καθορίζει το νόημα τροχιακή γωνιακή ορμή του ηλεκτρονίου,αυτή η ποσότητα, όπως και η ενέργεια, είναι ένα κβαντισμένο φυσικό χαρακτηριστικό της κατάστασης ενός ηλεκτρονίου σε ένα άτομο.
Ο τύπος της τροχιακής γωνιακής ορμής Μ ενός σωματιδίου που κινείται γύρω από το κέντρο περιστροφής σε μια συγκεκριμένη τροχιά είναι το γινόμενο mvf,Οπου Τ- σωματιδιακή μάζα, v- η ταχύτητά του, ΣΟΛ-διάνυσμα ακτίνας που συνδέει το κέντρο περιστροφής με το σωματίδιο (Εικ. 7). Είναι σημαντικό να σημειωθεί ότι το M είναι ένα διανυσματικό μέγεθος. η διεύθυνση αυτού του διανύσματος είναι κάθετη στο επίπεδο στο οποίο βρίσκονται τα διανύσματα vΚαι ΣΟΛ.
Ένα συγκεκριμένο σχήμα του νέφους ηλεκτρονίων αντιστοιχεί σε μια πολύ συγκεκριμένη τιμή της τροχιακής γωνιακής ορμής του ηλεκτρονίου M. Αλλά επειδή το M μπορεί να λάβει μόνο διακριτές τιμές που καθορίζονται από τον τροχιακό κβαντικό αριθμό /, τα σχήματα των νεφών ηλεκτρονίων δεν μπορούν να είναι αυθαίρετα : κάθε πιθανή τιμή του / αντιστοιχεί σε ένα πολύ συγκεκριμένο σχήμα του νέφους ηλεκτρονίων.
Γνωρίζουμε ήδη ότι η ενέργεια ενός ηλεκτρονίου σε ένα άτομο εξαρτάται από τον κύριο κβαντικό αριθμό Π.Σε ένα άτομο υδρογόνου, η ενέργεια των ηλεκτρονίων είναι πλήρως
Ρύζι.

Ρύζι. 8. Για την έννοια του μεγέθους και του σχήματος του νέφους ηλεκτρονίων καθορίζεται από την τιμή Π.Ωστόσο, στα άτομα πολλών ηλεκτρονίων, η ενέργεια των ηλεκτρονίων εξαρτάται επίσης από την τιμή του τροχιακού κβαντικού αριθμού /; οι λόγοι αυτής της εξάρτησης θα εξεταστούν στην § 31. Επομένως, οι καταστάσεις ηλεκτρονίων που χαρακτηρίζονται από διαφορετικές τιμές του / ονομάζονται συνήθως ενεργειακά υποεπίπεδαηλεκτρόνιο σε ένα άτομο. Σε αυτά τα υποεπίπεδα εκχωρούνται οι ακόλουθες ονομασίες γραμμάτων:
Σύμφωνα με αυτές τις σημειώσεις, μιλούν για .s-s-sublevel, /^-sublevel, κ.λπ. Τα ηλεκτρόνια που χαρακτηρίζονται από πλευρικές τιμές κβαντικού αριθμού 0, 1, 2 και 3 ονομάζονται s-ηλεκτρόνια, p-ηλεκτρόνια, b/-ηλεκτρόνια και /-ηλεκτρόνια, αντίστοιχα. Για μια δεδομένη τιμή του κύριου κβαντικού αριθμού ΠΤα ηλεκτρόνια s έχουν λοιπόν τη χαμηλότερη ενέργεια p-, d-και /-ηλεκτρόνια.
Κατάσταση ενός ηλεκτρονίου σε ένα άτομο που αντιστοιχεί σε ορισμένες τιμές πι Ι,γράφεται ως εξής: πρώτα η τιμή του κύριου κβαντικού αριθμού υποδεικνύεται με έναν αριθμό και μετά ο τροχιακός κβαντικός αριθμός υποδεικνύεται με ένα γράμμα. Άρα, χαρακτηρισμός 2 Rαναφέρεται σε ένα ηλεκτρόνιο που έχει n = 2 και 1 = 1, ονομασία 3d- στο ηλεκτρόνιο, που έχει n = 3 και / = 2.
Το νέφος ηλεκτρονίων δεν έχει σαφώς καθορισμένα όρια στο διάστημα. Επομένως, η έννοια του μεγέθους και του σχήματός του απαιτεί διευκρίνιση. Ας εξετάσουμε, ως παράδειγμα, το νέφος ηλεκτρονίων ενός 15-ηλεκτρονίου σε ένα άτομο υδρογόνου (Εικ. 8). Στο σημείο ΕΝΑ,που βρίσκεται σε μια ορισμένη απόσταση από τον πυρήνα, η πυκνότητα του νέφους ηλεκτρονίων καθορίζεται από το τετράγωνο της κυματικής συνάρτησης Σχεδιάστε το σημείο ΕΝΑεπιφάνεια ίσης πυκνότητας ηλεκτρονίων,συνδέοντας τα σημεία στα οποία η πυκνότητα του ηλεκτρονιακού νέφους χαρακτηρίζεται από την ίδια τιμή j^. Στην περίπτωση ενός 15-ηλεκτρονίου, μια τέτοια επιφάνεια θα αποδειχθεί ότι είναι μια σφαίρα, μέσα στην οποία περιέχεται κάποιο τμήμα του νέφους ηλεκτρονίων (στο Σχήμα 8, απεικονίζεται η διατομή αυτής της σφαίρας από το επίπεδο του σχήματος από έναν κύκλο που διέρχεται από το σημείο ΕΝΑ).Ας επιλέξουμε τώρα ένα σημείο σι,βρίσκεται σε μεγαλύτερη απόσταση από τον πυρήνα, και επίσης να τραβήξει μια επιφάνεια ίσης πυκνότητας ηλεκτρονίων μέσω αυτού. Αυτή η επιφάνεια θα έχει επίσης σφαιρικό σχήμα, αλλά στο εσωτερικό της θα περιέχεται μεγαλύτερο μέρος του νέφους ηλεκτρονίων παρά μέσα στη σφαίρα ΕΝΑ.Τέλος, αφήστε το κυρίαρχο τμήμα του νέφους ηλεκτρονίων να περιέχεται σε μια επιφάνεια ίσης πυκνότητας ηλεκτρονίων που σύρεται από ένα ορισμένο σημείο c. Συνήθως αυτή η επιφάνεια σχεδιάζεται έτσι ώστε να περιέχει το 90% του φορτίου και της μάζας του ηλεκτρονίου. Μια τέτοια επιφάνεια ονομάζεται οριακή επιφάνεια,και είναι το σχήμα και οι διαστάσεις του που θεωρούνται το σχήμα και οι διαστάσεις του νέφους ηλεκτρονίων. Επιφάνεια ορίου

Ρύζι. 9.Γραφήματα συναρτήσεων fi 2 για 1 s-ηλεκτρόνιο

Ρύζι. 10.
Το 15-ηλεκτρόνιο είναι μια σφαίρα, αλλά οι οριακές επιφάνειες των ^- και ^-ηλεκτρονίων έχουν πιο πολύπλοκο σχήμα (βλ. παρακάτω).
Στο Σχ. Το σχήμα 9 δείχνει τις τιμές της κυματοσυνάρτησης φ (βλ. Εικ. 9, ΕΝΑ) και το τετράγωνό του (βλ. Εικ. 9, 6) για ένα 15-ηλεκτρόνιο ανάλογα με την απόσταση από τον πυρήνα r. Οι καμπύλες που απεικονίζονται δεν εξαρτώνται από την κατεύθυνση στην οποία απεικονίζεται η μετρούμενη απόσταση r. αυτό σημαίνει ότι το ηλεκτρονιακό νέφος του ηλεκτρονίου ls έχει σφαιρική συμμετρία, δηλ. έχει σχήμα μπάλας. Καμπύλη στο Σχ. 9, ΕΝΑπου βρίσκεται στη μία πλευρά του άξονα απόστασης (άξονας τετμημένης). Από αυτό προκύπτει ότι η κυματική συνάρτηση του 15-ηλεκτρονίου έχει σταθερό πρόσημο. θα το θεωρήσουμε θετικό.
Εικόνα 9 σιδείχνει επίσης ότι όσο αυξάνεται η απόσταση από τον πυρήνα, η τιμή του φ 2 μειώνεται μονοτονικά. Αυτό σημαίνει ότι καθώς απομακρύνεστε από τον πυρήνα, η πυκνότητα του νέφους ηλεκτρονίων του 15-ηλεκτρονίου μειώνεται. Αυτό το συμπέρασμα μπορεί να απεικονιστεί από το Σχ. 5.
Αυτό δεν σημαίνει, ωστόσο, ότι με την ανάπτυξη σολη πιθανότητα ανίχνευσης ενός 15-ηλεκτρονίου μειώνεται επίσης μονότονα. Στο Σχ. 10, επισημαίνεται ένα λεπτό στρώμα, που περικλείεται μεταξύ σφαιρών με ακτίνες σολκαι (g + Ar), όπου Ar είναι κάποια μικρή ποσότητα. Καθώς το r αυξάνεται, η πυκνότητα του νέφους ηλεκτρονίων στο υπό εξέταση σφαιρικό στρώμα μειώνεται. αλλά ταυτόχρονα αυξάνεται ο όγκος αυτού του στρώματος, ίσος με 4l g 2 Ar. Όπως υποδεικνύεται στην § 26, η πιθανότητα ανίχνευσης ηλεκτρονίου σε μικρό όγκο AK εκφράζεται από το γινόμενο φ 2 DK. Σε αυτή την περίπτωση, AK = 4lg 2 Ar; Επομένως, η πιθανότητα ανίχνευσης ενός ηλεκτρονίου σε ένα σφαιρικό στρώμα που περικλείεται μεταξύ r και (r + Ar) είναι ανάλογη με την τιμή 4r 2 f 2. Σε αυτό το γινόμενο, καθώς το r αυξάνεται, ο παράγοντας 4l r 2 αυξάνεται και ο παράγοντας φ 2 μειώνεται. Σε μικρές τιμές g, η τιμή 4l g 2 αυξάνεται γρηγορότερα από ότι μειώνεται το φ 2, σε μεγάλες τιμές - αντίστροφα. Επομένως, το γινόμενο 4lr 2 φ 2, που χαρακτηρίζει την πιθανότητα ανίχνευσης ηλεκτρονίου σε απόσταση r από τον πυρήνα, διέρχεται από ένα μέγιστο όσο αυξάνεται το r.
Η εξάρτηση της ποσότητας 4r 2 f 2 από το r φαίνεται για το 15-ηλεκτρόνιο στο Σχ. 11 (τέτοια γραφήματα ονομάζονται γραφήματα ακτινικής διάστασης

Ρύζι. έντεκα.

Ρύζι. 12.Σχεδιαγράμματα συνάρτησης κύματος για 25- (ΕΝΑ)και 35 ηλεκτρόνια (σι)
όρια πιθανότηταςβρίσκοντας ένα ηλεκτρόνιο). Όπως το Σχ. 11, η πιθανότητα ανίχνευσης ενός 15-ηλεκτρονίου σε μικρές αποστάσεις από τον πυρήνα είναι κοντά στο μηδέν, αφού σολλίγοι. Η πιθανότητα ανίχνευσης ενός ηλεκτρονίου σε πολύ μεγάλη απόσταση από τον πυρήνα είναι επίσης αμελητέα: εδώ ο παράγοντας φ 2 είναι κοντά στο μηδέν (βλ. Εικ. 9, 6). Σε κάποια απόσταση από τον πυρήνα g 0η πιθανότητα ανίχνευσης ηλεκτρονίου έχει μέγιστη τιμή. Για το άτομο υδρογόνου, αυτή η απόσταση είναι 0,053 nm, η οποία συμπίπτει με την τιμή της ακτίνας της τροχιάς του ηλεκτρονίου που βρίσκεται πλησιέστερα στον πυρήνα που υπολογίστηκε από τον Bohr. Ωστόσο, η ερμηνεία αυτής της ποσότητας στη θεωρία του Bohr και από την άποψη της κβαντικής μηχανικής είναι διαφορετική: σύμφωνα με τον Bohr, ένα ηλεκτρόνιο σε ένα άτομο υδρογόνου που βρίσκεταισε απόσταση 0,053 nm από τον πυρήνα και από την άποψη της κβαντικής μηχανικής αυτή η απόσταση αντιστοιχεί μόνο μέγιστη πιθανότηταανίχνευση ηλεκτρονίων.
Τα ηλεκτρονικά νέφη των 5 ηλεκτρονίων του δεύτερου, του τρίτου και των επόμενων στιβάδων έχουν, όπως στην περίπτωση των 15 ηλεκτρονίων, σφαιρική συμμετρία, δηλ. χαρακτηρίζεται από σφαιρικό σχήμα. Ωστόσο, εδώ η κυματική συνάρτηση αλλάζει με πιο πολύπλοκο τρόπο με την αύξηση της απόστασης από τον πυρήνα. Όπως το Σχ. 12, εξάρτηση του φ από σολγια τα ηλεκτρόνια 25 και 35 δεν είναι μονοτονικά· σε διαφορετικές αποστάσεις από τον πυρήνα η κυματική συνάρτηση έχει διαφορετικό πρόσημο και στις αντίστοιχες καμπύλες υπάρχει κομβικά σημεία(ή κόμβοι),στην οποία η τιμή της κυματικής συνάρτησης είναι μηδέν. Στην περίπτωση ενός 25-ηλεκτρονίου υπάρχει μία θέση, στην περίπτωση ενός 35-ηλεκτρονίου υπάρχουν 2 θέσεις κ.λπ. Σύμφωνα με αυτό, η δομή του νέφους ηλεκτρονίων εδώ είναι επίσης πιο περίπλοκη από αυτή του 15-ηλεκτρονίου. Στο Σχ. Το 13 δείχνει ένα σχηματικό διάγραμμα ενός νέφους ηλεκτρονίων ενός 25-ηλεκτρονίου ως παράδειγμα.
Τα γραφήματα της ακτινικής κατανομής πιθανοτήτων για 25 και 35 ηλεκτρόνια έχουν επίσης πιο σύνθετη εμφάνιση (Εικ. 14). Εδώ δεν υπάρχει πλέον ένα μέγιστο, όπως στην περίπτωση των 15 ηλεκτρονίων, αλλά, κατά συνέπεια, δύο ή τρία μέγιστα. Σε αυτήν την περίπτωση, το κύριο μέγιστο βρίσκεται όσο πιο μακριά από τον πυρήνα, τόσο μεγαλύτερη είναι η τιμή του κύριου κβαντικού αριθμού Π.

Ρύζι. 13.

Ρύζι. 14.Ακτινικά γραφήματα κατανομής πιθανότητας για 2s- (ΕΝΑ)και 35 ηλεκτρόνια ( 6 )
Ας εξετάσουμε τώρα τη δομή του νέφους ηλεκτρονίων του ηλεκτρονίου 2/β. Όταν απομακρύνεστε από τον πυρήνα σε μια συγκεκριμένη κατεύθυνση, η κυματική συνάρτηση του ηλεκτρονίου 2p αλλάζει σύμφωνα με την καμπύλη που φαίνεται στο Σχ. 15, ΕΝΑ.Στη μία πλευρά του πυρήνα (στα δεξιά στο σχήμα) η κυματική συνάρτηση είναι θετική, και εδώ υπάρχει ένα μέγιστο στην καμπύλη, στην άλλη πλευρά του πυρήνα (στα αριστερά στο σχήμα) η συνάρτηση κύματος είναι αρνητική , και υπάρχει ένα ελάχιστο στην καμπύλη. στην αρχή, η τιμή του φ γίνεται μηδέν. Σε αντίθεση με τα 5-ηλεκτρόνια, η κυματική συνάρτηση ενός ηλεκτρονίου 2p δεν έχει σφαιρική συμμετρία. Αυτό εκφράζεται στο γεγονός ότι το ύψος του μέγιστου (και, κατά συνέπεια, το βάθος του ελάχιστου) στο Σχ. 15 εξαρτάται από την επιλεγμένη κατεύθυνση του διανύσματος ακτίνας ΣΟΛ.Σε μια ορισμένη κατεύθυνση (για βεβαιότητα, θα τη θεωρήσουμε την κατεύθυνση του άξονα συντεταγμένων Χ)το ύψος του μέγιστου είναι το μεγαλύτερο (βλ. Εικ. 15, Ο).Σε κατευθύνσεις κάνοντας γωνία με τον άξονα Χ,Όσο μεγαλύτερη είναι αυτή η γωνία, τόσο μικρότερο είναι το ύψος της μέγιστης (βλ. Εικ. 15, σι, V); αν είναι ίση με 90°, τότε η τιμή του φ στην αντίστοιχη κατεύθυνση είναι μηδέν σε οποιαδήποτε απόσταση από τον πυρήνα.
Το γράφημα της ακτινικής κατανομής πιθανότητας για το ηλεκτρόνιο 2p (Εικ. 16) έχει μορφή παρόμοια με το Σχ. 15, με τη διαφορά ότι η πιθανότητα να βρεθεί ένα ηλεκτρόνιο σε κάποια απόσταση από τον πυρήνα είναι πάντα θετική. Η θέση του μέγιστου στην καμπύλη κατανομής είναι πιθανώς

Ρύζι. 16.

Ρύζι. 15.

Ρύζι.

Ρύζι.
δεν εξαρτάται από την επιλογή κατεύθυνσης. Ωστόσο, το ύψος αυτού του μέγιστου εξαρτάται από την κατεύθυνση: είναι μεγαλύτερο όταν το διάνυσμα ακτίνας συμπίπτει με την κατεύθυνση του άξονα Χ,και μειώνεται καθώς το διάνυσμα ακτίνας αποκλίνει από αυτή την κατεύθυνση.
Αυτή η κατανομή της πιθανότητας ανίχνευσης ηλεκτρονίου 2/β αντιστοιχεί στο σχήμα του νέφους ηλεκτρονίων, που θυμίζει διπλό αχλάδι ή αλτήρα (Εικ. 17). Όπως φαίνεται, το νέφος ηλεκτρονίων συγκεντρώνεται κοντά στον άξονα Χ,και στο αεροπλάνο yz,Δεν υπάρχει νέφος ηλεκτρονίων κάθετο σε αυτόν τον άξονα: η πιθανότητα ανίχνευσης ηλεκτρονίου 2p εδώ είναι μηδέν. Τα σημάδια "+" και "-" στο Σχ. 17 δεν αναφέρονται στην πιθανότητα ανίχνευσης ηλεκτρονίου (είναι πάντα θετικό!), αλλά στην κυματική συνάρτηση φ, η οποία έχει διαφορετικό πρόσημο σε διαφορετικά μέρη του νέφους ηλεκτρονίων.
Το σχήμα 17 μεταφέρει περίπου το σχήμα του νέφους ηλεκτρονίων όχι μόνο ηλεκτρονίων 2p, αλλά και ηλεκτρονίων p της τρίτης και των επόμενων στιβάδων. Αλλά τα γραφήματα της ακτινικής κατανομής πιθανοτήτων είναι πιο περίπλοκα εδώ: αντί για ένα μέγιστο που φαίνεται στη δεξιά πλευρά του Σχ. 16, δύο μέγιστα (3p-ηλεκτρόνιο), τρία μέγιστα (4p-ηλεκτρόνιο) κ.λπ. εμφανίζονται στις αντίστοιχες καμπύλες. Σε αυτή την περίπτωση, το μεγαλύτερο μέγιστο βρίσκεται όλο και πιο μακριά από τον πυρήνα.
Τα ηλεκτρονικά σύννεφα (7 ηλεκτρόνια (/ = 2)) έχουν ακόμη πιο περίπλοκο σχήμα.Κάθε ένα από αυτά είναι μια φιγούρα «τεσσάρων πετάλων» και τα σημάδια της κυματικής λειτουργίας στα «πέταλα» εναλλάσσονται (Εικ. 18).
Ηλεκτρονικό σύννεφο
Ηλεκτρονικό σύννεφοείναι ένα οπτικό μοντέλο που αντανακλά την κατανομή της πυκνότητας ηλεκτρονίων σε ένα άτομο ή μόριο.
Τον πρώτο καιρό μετά την εμφάνιση της περίφημης κυματικής εξίσωσης του E. Schrödinger, έγιναν πολλές προσπάθειες για να βρεθεί η πιθανή φυσική σημασία της κυματικής συνάρτησης και να αναπτυχθεί ένα μοντέλο της συμπεριφοράς ενός ηλεκτρονίου σε ένα άτομο. Από την αρχή, ο E. Schrödinger μίλησε για ένα «κηλιδωμένο ηλεκτρόνιο», το φορτίο του οποίου επίσης κηλιδώνεται σε όλο το διάστημα και κατανέμεται κατά μήκος των αντικόμβων των ταλαντώσεων και πρότεινε την έννοια του «πακέτου κυμάτων».
Ωστόσο, οι φυσικοί ήταν επικριτικοί σε αυτό το μοντέλο. Ο Max Born έδειξε ότι αυτά τα κύματα πρέπει να ερμηνεύονται στατιστικά από την άποψη της θεωρίας πιθανοτήτων. Τα ίδια τα κύματα δεν είναι υλικά, είναι μόνο μαθηματικές εκφράσεις που περιγράφουν την πιθανότητα ανίχνευσης ενός ηλεκτρονίου σε ένα συγκεκριμένο σημείο του χώρου.
Ως οπτικό μοντέλο της κατάστασης ενός ηλεκτρονίου σε ένα άτομο στη χημεία, υιοθετείται η εικόνα ενός νέφους, η πυκνότητα των αντίστοιχων τμημάτων του οποίου είναι ανάλογη με την πιθανότητα ανίχνευσης ηλεκτρονίου εκεί. Το νέφος ηλεκτρονίων σχεδιάζεται ως το πιο πυκνό (όπου υπάρχει ο μεγαλύτερος αριθμός σημείων) στις περιοχές όπου είναι πιο πιθανό να ανιχνευθεί το ηλεκτρόνιο.
Υπάρχουν άλλοι τρόποι απεικόνισης της ακτινικής κατανομής της πιθανότητας εύρεσης πυκνότητας ηλεκτρονίων σε σχέση με τον ατομικό πυρήνα.
Η καμπύλη ακτινικής κατανομής της πιθανότητας εύρεσης ηλεκτρονίου σε άτομο υδρογόνου δείχνει ότι η πιθανότητα εύρεσης ηλεκτρονίου είναι μέγιστη σε ένα λεπτό σφαιρικό στρώμα με κέντρο στη θέση του πρωτονίου και ακτίνα ίση με την ακτίνα Bohr a 0 .
Το νέφος ηλεκτρονίων απεικονίζεται συχνότερα ως οριακή επιφάνεια (που καλύπτει περίπου το 90% της πυκνότητας). Σε αυτήν την περίπτωση, ο προσδιορισμός της πυκνότητας με χρήση κουκκίδων παραλείπεται.
Σημειώσεις
δείτε επίσης
Ίδρυμα Wikimedia. 2010.
Δείτε τι είναι το "Ηλεκτρονικό σύννεφο" σε άλλα λεξικά:
σύννεφο ηλεκτρονίων
σύννεφο ηλεκτρονίων- elektronų debesis statusas T sritis chemija apibrėžtis Elektronų buvimo aplink atomo branduolį erdvė. ατιτικμενύς: αγγλ. ατμόσφαιρα ηλεκτρονίων? σύννεφο ηλεκτρονίων? ηλεκτρονική ατμόσφαιρα? ηλεκτρονικό σύννεφο rus. σύννεφο ηλεκτρονίων... Chemijos terminų aiškinamasis žodynas
σύννεφο ηλεκτρονίων- elektronų debesis statusas T sritis fizika atitikmenys: αγγλ. σύννεφο ηλεκτρονίων? ηλεκτρονική ατμόσφαιρα? ηλεκτρονικό σύννεφο vok. Elektronenatmosphäre, f; Elektronenwolke, f rus. σύννεφο ηλεκτρονίων, n; σύννεφο ηλεκτρονίων, n pranc. Ηλεκτρονική ατμόσφαιρα … Fizikos Terminų žodynas
Άτομο ηλίου Το άτομο (αρχαία ελληνικά: ἄτομος αδιαίρετο) είναι το μικρότερο μέρος ενός χημικού στοιχείου, το οποίο είναι ο φορέας των ιδιοτήτων του. Ένα άτομο αποτελείται από έναν ατομικό πυρήνα και ένα γύρω νέφος ηλεκτρονίων. Ο πυρήνας ενός ατόμου αποτελείται από θετικά φορτισμένα πρωτόνια και... ... Wikipedia
Άτομο ηλίου Το άτομο (αρχαία ελληνικά: ἄτομος αδιαίρετο) είναι το μικρότερο μέρος ενός χημικού στοιχείου, το οποίο είναι ο φορέας των ιδιοτήτων του. Ένα άτομο αποτελείται από έναν ατομικό πυρήνα και ένα γύρω νέφος ηλεκτρονίων. Ο πυρήνας ενός ατόμου αποτελείται από θετικά φορτισμένα πρωτόνια και... ... Wikipedia
ΔΙΠΛΑΣΙΑΣΜΟΣ ΛΑΜΒΔΑ (ΔΙΧΑΣΜΟΣ) ΕΝΕΡΓΕΙΑΣ ΕΠΙΠΕΔΑ ΜΟΡΙΩΝ Αδύναμη διάσπαση σε δύο επίπεδα κάθε ηλεκτρονικής δονητικής περιστροφικής ενέργειας. επίπεδο ενός μορίου με μη μηδενικούς κβαντικούς αριθμούς και J (βλ. Μόριο). Ο αριθμός L περιγράφει την προβολή... ... Φυσική εγκυκλοπαίδεια
- (από το ελληνικό atomos αδιαίρετο) σωματίδιο ουσίας μικροσκοπικού μεγέθους και πολύ μικρής μάζας (μικροσωματίδιο), το μικρότερο μέρος ενός χημικού στοιχείου, που είναι ο φορέας των ιδιοτήτων του. Κάθε στοιχείο αντιστοιχεί σε ένα συγκεκριμένο γένος A.,... ...
- (δεσμοί σ και π) ομοιοπολικοί χημικοί δεσμοί, που χαρακτηρίζονται από μια πιο συγκεκριμένη, αλλά διαφορετική χωρική συμμετρία της κατανομής της πυκνότητας των ηλεκτρονίων. Όπως είναι γνωστό, ένας ομοιοπολικός δεσμός σχηματίζεται ως αποτέλεσμα της κοινής χρήσης ηλεκτρονίων... ... Μεγάλη Σοβιετική Εγκυκλοπαίδεια
- (από το ελληνικό atomos αδιαίρετο), μέρος σε βα μικροσκοπικό. μέγεθος και μάζα (μικροσωματίδιο), το μικρότερο μέρος της χημικής ουσίας. στοιχείο, που είναι ο φορέας του Αγ. Κάθε χημ. στοιχείο αντιστοιχεί στον ορισμό. γένος Α., που χαρακτηρίζεται από χημικό. σύμβολο. Α. υπάρχουν σε…… Φυσική εγκυκλοπαίδεια
6. Η έννοια του ηλεκτρονικού νέφους. Λειτουργία κυμάτων.
Επειδή Το ηλεκτρόνιο φέρει αρνητικό φορτίο, τότε το τροχιακό του αντιπροσωπεύει μια ορισμένη κατανομή φορτίου, η οποία ονομάζεται ηλεκτρονικό σύννεφο.Η πιθανότητα εύρεσης ηλεκτρονίου σε μια συγκεκριμένη περιοχή του χώρου περιγράφεται από κυματική συνάρτηση ψ,που χαρακτηρίζει το πλάτος του κύματος ως συνάρτηση των συντεταγμένων των ηλεκτρονίων. Όπως το πλάτος οποιασδήποτε διαδικασίας κύματος, μπορεί να λάβει τόσο θετικές όσο και αρνητικές τιμές. Ωστόσο, η τιμή του ψ² είναι πάντα θετική. Ταυτόχρονα, έχει μια αξιοσημείωτη ιδιότητα: όσο μεγαλύτερη είναι η τιμή σε μια δεδομένη περιοχή του χώρου, τόσο μεγαλύτερη είναι η πιθανότητα το ηλεκτρόνιο να εκδηλώσει τη δράση του εδώ, δηλ. ότι η ύπαρξή του θα αποκαλυφθεί σε κάποια φυσική διαδικασία.
7. Κβαντικοί αριθμοί.
Το σύγχρονο μοντέλο βασίζεται σε 2 θεμελιώδεις αρχές της κβαντικής φυσικής. 1. ένα ηλεκτρόνιο έχει ταυτόχρονα τις ιδιότητες ενός σωματιδίου και ενός κύματος ( Louis de Broglie) 2. τα σωματίδια δεν έχουν αυστηρά καθορισμένες συντεταγμένες και ταχύτητες. Η κίνηση ενός ηλεκτρονίου περιγράφεται στην καντιανή μηχανική από την εξίσωση στάσιμων κυμάτων, σύμφωνα με την οποία το ηλεκτρόνιο σε οποιαδήποτε στιγμή του χρόνου μπορεί να βρίσκεται σε ένα αυθαίρετο σημείο του χώρου γύρω από τον πυρήνα. Το κβαντομηχανικό μοντέλο το αναπαριστά ως ένα νέφος ηλεκτρονίων που περιβάλλει τον πυρήνα. Η μέγιστη πυκνότητα του νέφους αντιστοιχεί στο τροχιακό των ηλεκτρονίων. Η κίνηση ενός ηλεκτρονίου σε ένα τροχιακό προσδιορίζεται από τις τιμές 4 κβαντικών αριθμών. Κύριος κβαντικός αριθμός n(ενεργειακό επίπεδο) – απόσταση από τον πυρήνα. Καθώς το n αυξάνεται, η ενέργεια των ηλεκτρονίων αυξάνεται. Ο αριθμός των ενεργειακών επιπέδων = ο αριθμός της περιόδου στην οποία βρίσκεται το στοιχείο. Ο μέγιστος αριθμός ηλεκτρονίων προσδιορίζεται από N=2n 2. το πρώτο ηλεκτρονικό επίπεδο δεν μπορεί να φιλοξενήσει περισσότερα από 2 ηλεκτρόνια, το δεύτερο - 8 και το τρίτο - 18. Τροχιακός κβαντικός αριθμός l(υποεπίπεδο ενέργειας) συμβολίζονται με τα γράμματα s (σφαιρικό), p (σε σχήμα αλτήρα), d (ροζέτα με 4 πέταλα), f (πιο πολύπλοκα). Αλληλεπίδραση μαγνητικού κβαντικού αριθμού ενός νέφους ηλεκτρονίων με εξωτερικά μαγνητικά πεδία. Ο κβαντικός αριθμός σπιν είναι η εγγενής περιστροφή ενός ηλεκτρονίου γύρω από τον άξονά του. Μαγνητικός κβαντικός αριθμός mαλληλεπίδραση του νέφους ηλεκτρονίων με εξωτερικά μαγνητικά πεδία. Όσο πιο περίπλοκο είναι το σχήμα του νέφους, τόσο περισσότερες παραλλαγές στον προσανατολισμό του νέφους στο διάστημα. Παίρνει την τιμή 2l+1. Spin κβαντικός αριθμός sτην περιστροφή του ίδιου του ηλεκτρονίου γύρω από τον άξονά του. Δέχεται 2 τιμές +1/2 και –1/2.
8. Η διαδικασία συμπλήρωσης ηλεκτρονικών επιπέδων και υποεπιπέδων. . Η αρχή της ελάχιστης ενέργειας. Αρχή Pauli. Ο κανόνας του Hund και ο Klechkovsky V.M.
Γεμισμένο με ηλεκτρόνιο Το υποεπίπεδο πρέπει να έχει ελάχιστη πλεονάζουσα ενέργεια σε σχέση με το υποεπίπεδο ενέργειας.
Al 18 1S 2 2S 2 2P 6 3S 2 3P 6 3d 0
K 19 1S 2 2S 2 2P 6 3S 2 3P 6 4S 1
1. Ο κανόνας του Κλετσκόφσκι.
Η γέμιση πηγαίνει από n+1 μικρότερο σε n+l μεγαλύτερο
4+0 < 3+2 (сначала 4S, потом 3d)
Εάν τα αθροίσματα n+l είναι ίσα μεταξύ τους, τότε τα επίπεδα και τα υποεπίπεδα συμπληρώνονται, για παράδειγμα, ο κύριος κβαντικός αριθμός n
4+1 3+2 => πρώτα  , μετά 4p
, μετά 4p
Ο κανόνας του Κλετσκόφσκι.
Αν το άθροισμα των n+l είναι ίσο
Το φαινόμενο του κανόνα της ολίσθησης ηλεκτρονίων.
Cr 24 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3d 4
§5. Νέφη ηλεκτρονίων – τροχιακά
Το μοναδικό ηλεκτρόνιο ενός ατόμου υδρογόνου σχηματίζεται γύρω από τον πυρήνα σφαιρικό τροχιακό- ένα σφαιρικό νέφος ηλεκτρονίων, σαν μια χαλαρά τυλιγμένη μπάλα από χνουδωτό μαλλί ή μια μπάλα βαμβακιού.
Οι επιστήμονες συμφώνησαν να ονομάσουν το σφαιρικό ατομικό τροχιακό μικρό-τροχιάς. Είναι το πιο σταθερό και βρίσκεται αρκετά κοντά στον πυρήνα.
Όσο μεγαλύτερη είναι η ενέργεια ενός ηλεκτρονίου σε ένα άτομο, τόσο πιο γρήγορα περιστρέφεται, τόσο περισσότερο εκτείνεται η περιοχή κατοικίας του και τελικά μετατρέπεται σε σχήμα αλτήρα Π-τροχιάς:
![]() Ένα νέφος ηλεκτρονίων αυτού του σχήματος μπορεί να καταλάβει ένα άτομο τρεις θέσειςκατά μήκος των αξόνων συντεταγμένων του χώρου Χ, yΚαι z. Αυτό εξηγείται εύκολα: στο κάτω-κάτω, όλα τα ηλεκτρόνια είναι αρνητικά φορτισμένα, άρα σύννεφα ηλεκτρονίων απωθούν ο ένας τον άλλονκαι προσπαθούν να βρίσκονται όσο το δυνατόν πιο μακριά ο ένας από τον άλλο.
Ένα νέφος ηλεκτρονίων αυτού του σχήματος μπορεί να καταλάβει ένα άτομο τρεις θέσειςκατά μήκος των αξόνων συντεταγμένων του χώρου Χ, yΚαι z. Αυτό εξηγείται εύκολα: στο κάτω-κάτω, όλα τα ηλεκτρόνια είναι αρνητικά φορτισμένα, άρα σύννεφα ηλεκτρονίων απωθούν ο ένας τον άλλονκαι προσπαθούν να βρίσκονται όσο το δυνατόν πιο μακριά ο ένας από τον άλλο.
Μαζί, τρία νέφη ηλεκτρονίων, τα οποία ονομάζονται p x-, p y- ή p z-τα τροχιακά σχηματίζουν ένα συμμετρικό γεωμετρικό σχήμα, στο κέντρο του οποίου βρίσκεται ο ατομικός πυρήνας. Μοιάζει με εξάκτινο πομπόν ή τριπλό τόξο - όπως σας αρέσει.
Ετσι, ΠΜπορεί να υπάρχουν τρία τροχιακά. Η ενέργειά τους, φυσικά, είναι η ίδια, αλλά η θέση τους στο διάστημα είναι διαφορετική.

Εκτός μικρό- Και Π- τροχιακά, υπάρχουν ηλεκτρονικά τροχιακά ακόμα πιο πολύπλοκων σχημάτων. προσδιορίζονται με γράμματα ρεΚαι φά. Τα ηλεκτρόνια που φτάνουν εδώ αποκτούν ακόμη μεγαλύτερη παροχή ενέργειας, κινούνται κατά μήκος σύνθετων μονοπατιών και ως αποτέλεσμα αποκτώνται πολύπλοκα και όμορφα τρισδιάστατα γεωμετρικά σχήματα.
Ολα ρε-τροχιακά(και μπορεί να υπάρχουν ήδη πέντε από αυτά) είναι πανομοιότυπα σε ενέργεια, αλλά βρίσκονται διαφορετικά στο διάστημα. Και σε σχήμα, που θυμίζει μαξιλάρι δεμένο με κορδέλες, μόνο τέσσερα είναι πανομοιότυπα.
Και το πέμπτο είναι σαν έναν αλτήρα που περνάει μέσα από ένα ντόνατ.
Νέφη ηλεκτρονίων με την ίδια ενέργεια, στα οποία δίνεται όνομα φά-τροχιακά, ίσως ήδη επτά. Διαφέρουν επίσης στο σχήμα και διαφορετικού προσανατολισμού στο χώρο.