القيمة الحرارية للغاز المصاحب. الغاز الطبيعي وقيمته الحرارية للاستخدام المنزلي
كمية الحرارة المنبعثة أثناء الاحتراق الكامل لوحدة كمية الوقود تسمى القيمة الحرارية (Q) أو ، كما يطلق عليها أحيانًا ، القيمة الحرارية ، أو القيمة الحرارية ، وهي إحدى الخصائص الرئيسية للوقود.
يشار عادةً إلى القيمة الحرارية للغازات بالرمز 1 م 3 ،تؤخذ في ظل الظروف العادية.
في الحسابات الفنية ، تُفهم الظروف العادية على أنها حالة الغاز عند درجة حرارة تساوي 0 درجة مئوية ، وعند ضغط 760 مم زئبق فن.يتم الإشارة إلى حجم الغاز في ظل هذه الظروف نانومتر 3(متر مكعب عادي).
بالنسبة لقياسات الغاز الصناعي وفقًا لـ GOST 2923-45 ، يتم أخذ درجة حرارة 20 درجة مئوية وضغط 760 كظروف طبيعية مم زئبق فن.يشير حجم الغاز إلى هذه الشروط ، على النقيض من نانومتر 3سنطالب م 3 (متر مكعب).
القيمة الحرارية للغازات (س))أعرب عن كيلو كالوري / نانومتر هأو في كيلو كالوري / م 3.
بالنسبة للغازات المسالة ، يشار إلى القيمة الحرارية 1 كلغ.
هناك قيمة حرارية أعلى (Q in) وأقل (Q n). تأخذ القيمة الحرارية الإجمالية في الاعتبار حرارة تكثيف بخار الماء المتكون أثناء احتراق الوقود. لا تأخذ القيمة الحرارية الصافية في الحسبان الحرارة الموجودة في بخار الماء لمنتجات الاحتراق ، لأن بخار الماء لا يتكثف ، بل يتم حمله بعيدًا مع منتجات الاحتراق.
تنطبق المفاهيم Q in و Q n فقط على تلك الغازات ، أثناء الاحتراق الذي يتم إطلاق بخار الماء منه (لا تنطبق هذه المفاهيم على أول أكسيد الكربون ، الذي لا يعطي بخار الماء أثناء الاحتراق).
عندما يتكثف بخار الماء ، يتم إطلاق حرارة تساوي 539 كيلو كالوري / كجم.بالإضافة إلى ذلك ، عندما يتم تبريد المكثف إلى 0 درجة مئوية (أو 20 درجة مئوية) ، يتم إطلاق الحرارة ، على التوالي ، بمقدار 100 أو 80 كيلو كالوري / كجم.
في المجموع ، بسبب تكثيف بخار الماء ، يتم إطلاق الحرارة أكثر من 600 كيلو كالوري / كجم ،وهو الفرق بين القيمة الحرارية الإجمالية والصافية للغاز. بالنسبة لمعظم الغازات المستخدمة في إمدادات الغاز في المناطق الحضرية ، فإن هذا الاختلاف هو 8-10٪.
يتم إعطاء قيم القيمة الحرارية لبعض الغازات في الجدول. 3.
بالنسبة لإمدادات الغاز في المناطق الحضرية ، يتم استخدام الغازات حاليًا ، والتي ، كقاعدة عامة ، لها قيمة حرارية لا تقل عن 3500 كيلو كالوري / نانومتر 3.ويفسر ذلك حقيقة أنه في ظروف المدن يتم توفير الغاز من خلال أنابيب على مسافات كبيرة. مع وجود قيمة منخفضة من السعرات الحرارية ، يلزم توفير كمية كبيرة. وهذا يؤدي حتما إلى زيادة أقطار أنابيب الغاز ، ونتيجة لذلك ، إلى زيادة الاستثمارات المعدنية والأموال لبناء شبكات الغاز ، وبالتالي زيادة في تكاليف التشغيل. من العيوب الكبيرة للغازات منخفضة السعرات الحرارية أنها تحتوي في معظم الحالات على كمية كبيرة من أول أكسيد الكربون ، مما يزيد من الخطر عند استخدام الغاز ، وكذلك عند خدمة الشبكات والمنشآت.
غاز ذو قيمة حرارية أقل من 3500 كيلو كالوري / نانومتر 3غالبًا ما تستخدم في الصناعة ، حيث لا يلزم نقلها لمسافات طويلة ويكون تنظيم الحرق أسهل. بالنسبة لإمدادات الغاز في المناطق الحضرية ، من المستحسن الحصول على قيمة حرارية ثابتة للغاز. التقلبات ، كما أثبتنا بالفعل ، لا يسمح بها بأكثر من 10 ٪. يتطلب التغيير الأكبر في القيمة الحرارية للغاز تعديلًا جديدًا ، وأحيانًا تغيير عدد كبير من الشعلات الموحدة للأجهزة المنزلية ، وهو ما يرتبط بصعوبات كبيرة.
تصنيف الغازات القابلة للاحتراق
لتزويد المدن والمؤسسات الصناعية بالغاز ، يتم استخدام غازات قابلة للاحتراق مختلفة ، تختلف في الأصل والتركيب الكيميائي والخصائص الفيزيائية.
حسب المنشأ ، تنقسم الغازات القابلة للاحتراق إلى طبيعية ، أو طبيعية ، ومصطنعة ، تنتج من الوقود الصلب والسائل.
يتم استخراج الغازات الطبيعية من آبار حقول الغاز البحت أو حقول النفط إلى جانب النفط. تسمى غازات حقول النفط بالغازات المصاحبة.
تتكون غازات حقول الغاز النقي بشكل أساسي من غاز الميثان الذي يحتوي على نسبة صغيرة من الهيدروكربونات الثقيلة. تتميز بثبات التركيب والقيمة الحرارية.
تحتوي الغازات المصاحبة ، إلى جانب الميثان ، على كمية كبيرة من الهيدروكربونات الثقيلة (البروبان والبيوتان). يختلف تكوين هذه الغازات وقيمتها الحرارية على نطاق واسع.
يتم إنتاج الغازات الاصطناعية في محطات الغاز الخاصة - أو يتم الحصول عليها كمنتج ثانوي من احتراق الفحم في مصانع التعدين ، وكذلك في مصافي النفط.
تُستخدم الغازات المُنتَجة من الفحم في بلدنا لتزويد الغاز الحضري بكميات محدودة للغاية ، وتتناقص جاذبيتها النوعية باستمرار. في الوقت نفسه ، يتزايد إنتاج واستهلاك غازات الهيدروكربون المسال ، التي يتم الحصول عليها من الغازات البترولية المصاحبة في مصانع الغاز والبنزين ومصافي النفط أثناء تكرير النفط. تتكون غازات الهيدروكربون السائلة المستخدمة في إمدادات الغاز في المناطق الحضرية بشكل أساسي من البروبان والبيوتان.
تكوين الغازات
يحدد نوع الغاز وتكوينه إلى حد كبير نطاق الغاز ومخطط شبكة الغاز وأقطارها وحلول تصميم مواقد الغاز ووحدات خطوط أنابيب الغاز الفردية.
يعتمد استهلاك الغاز على القيمة الحرارية ، وبالتالي على أقطار خطوط أنابيب الغاز وشروط احتراق الغاز. عند استخدام الغاز في المنشآت الصناعية ، فإن درجة حرارة الاحتراق وسرعة انتشار اللهب وثبات تركيبة وقود الغاز لها أهمية كبيرة. ويعتمد تكوين الغازات ، فضلاً عن خواصها الفيزيائية والكيميائية ، بشكل أساسي على نوع وطريقة الحصول عليها. غازات.
الغازات القابلة للاحتراق عبارة عن مخاليط ميكانيكية من غازات مختلفة<как горючих, так и негорючих.
الجزء القابل للاحتراق من الوقود الغازي يشمل: الهيدروجين (H 2) - غاز بدون لون وطعم ورائحة ، وقيمته الحرارية المنخفضة 2579 كيلو كالوري / نانومتر 3 \الميثان (CH 4) - غاز عديم اللون ، عديم الطعم والرائحة ، هو الجزء الرئيسي القابل للاحتراق من الغازات الطبيعية ، وقيمته الحرارية المنخفضة هي 8555 كيلو كالوري / نانومتر 3 ؛أول أكسيد الكربون (CO) - غاز عديم اللون ، عديم الطعم والرائحة ، يتم الحصول عليه من الاحتراق غير الكامل لأي وقود ، شديد السمية ، ذو قيمة حرارية منخفضة 3018 كيلو كالوري / نانومتر 3 ؛الهيدروكربونات الثقيلة (C p N t) ،بهذا الاسم<и формулой обозначается целый ряд углеводородов (этан - С2Н 6 , пропан - С 3 Нв, бутан- С4Н 10 и др.), низшая теплотворная способность этих газов колеблется от 15226 до 34890 كيلو كالوري / نانومتر *.
يشمل الجزء غير القابل للاحتراق من الوقود الغازي: ثاني أكسيد الكربون (CO 2) ، والأكسجين (O 2) والنيتروجين (N 2).
يسمى الجزء غير القابل للاحتراق من الغازات الصابورة. تتميز الغازات الطبيعية بقيمة حرارية عالية وغياب كامل لأول أكسيد الكربون. في الوقت نفسه ، يحتوي عدد من الحقول ، خاصة الغاز والنفط ، على مادة شديدة السمية (والغازات المسببة للتآكل) - كبريتيد الهيدروجين (H 2S). تحتوي معظم غازات الفحم الاصطناعي على كمية كبيرة من الغازات شديدة السمية - أول أكسيد الكربون (CO). ). إن وجود أكسيد في غاز الكربون ومواد سامة أخرى أمر غير مرغوب فيه إلى حد كبير ، لأنها تعقد إنتاج العمل التشغيلي وتزيد من الخطر عند استخدام الغاز.بالإضافة إلى المكونات الرئيسية ، تشتمل تركيبة الغازات على شوائب مختلفة ، قيمة محددة لا تذكر من حيث النسبة المئوية ، ومع ذلك ، نظرًا لوجود آلاف بل ملايين الأمتار المكعبة من الغاز ، فإن الكمية الإجمالية للشوائب تصل إلى قيمة كبيرة ، وتسقط العديد من الشوائب في أنابيب الغاز ، مما يؤدي في النهاية إلى انخفاض في حجمها الإنتاجية ، وأحيانًا إلى الوقف الكامل لتدفق الغاز ، لذلك يجب مراعاة وجود الشوائب في الغاز عند تصميم خطوط أنابيب الغاز ، وكذلك أثناء العملية.
تعتمد كمية وتركيب الشوائب على طريقة إنتاج الغاز أو استخراجه ودرجة تنقيته. أكثر الشوائب ضررًا هي الغبار والقطران والنفتالين والرطوبة ومركبات الكبريت.
يظهر الغبار في الغاز أثناء الإنتاج (الاستخراج) أو أثناء نقل الغاز عبر خطوط الأنابيب. الراتنج هو نتاج التحلل الحراري للوقود ويرافق العديد من الغازات الاصطناعية. في حالة وجود الغبار في الغاز ، يساهم الراتينج في تكوين سدادات طينية القطران وانسداد في أنابيب الغاز.
يوجد النفثالين بشكل شائع في غازات الفحم الاصطناعي. في درجات الحرارة المنخفضة ، يترسب النفثالين في الأنابيب ، جنبًا إلى جنب مع الشوائب الصلبة والسائلة الأخرى ، يقلل من مساحة التدفق لأنابيب الغاز.
توجد الرطوبة على شكل أبخرة في جميع الغازات الطبيعية والاصطناعية تقريبًا. يدخل الغازات الطبيعية في حقل الغاز نفسه بسبب ملامسة الغازات لسطح الماء ، ويتم تشبع الغازات الاصطناعية بالماء أثناء عملية الإنتاج. إن وجود الرطوبة في الغاز بكميات كبيرة أمر غير مرغوب فيه ، لأنه يقلل من السعرات الحرارية. بالإضافة إلى ذلك ، تتميز بقدرة عالية على التبخير ، حيث تحمل الرطوبة أثناء احتراق الغاز كمية كبيرة من الحرارة مع نواتج الاحتراق في الغلاف الجوي. كما أن المحتوى الرطوبي الكبير في الغاز غير مرغوب فيه لأن يتم تبريد الغاز في "عبء حركته عبر الأنابيب ، ويمكنه إنشاء سدادات مياه في خط أنابيب الغاز (في النقاط السفلية) ليتم حذفها. وهذا يتطلب تركيب مجمعات خاصة للمكثفات وضخها للخارج.
تشتمل مركبات الكبريت ، كما لوحظ بالفعل ، على كبريتيد الهيدروجين ، وكذلك ثاني كبريتيد الكربون ، والميركابتان ، وما إلى ذلك. ولا تؤثر هذه المركبات سلبًا على صحة الإنسان فحسب ، ولكنها تسبب أيضًا تآكلًا كبيرًا في الأنابيب.
تشمل الشوائب الضارة الأخرى مركبات الأمونيا والسيانيد ، والتي توجد بشكل رئيسي في غازات الفحم. يؤدي وجود الأمونيا ومركبات السيانيد إلى زيادة تآكل الأنابيب المعدنية.
وجود ثاني أكسيد الكربون والنيتروجين في الغازات القابلة للاحتراق أمر غير مرغوب فيه أيضًا. لا تشارك هذه الغازات في عملية الاحتراق ، كونها صابورة تقلل من القيمة الحرارية ، مما يؤدي إلى زيادة قطر أنابيب الغاز وانخفاض الكفاءة الاقتصادية لاستخدام الوقود الغازي.
يجب أن يفي تكوين الغازات المستخدمة في إمدادات الغاز في المناطق الحضرية بمتطلبات GOST 6542-50 (الجدول 1).
الجدول 1
يتم عرض متوسط قيم تكوين الغازات الطبيعية لأشهر الحقول في البلاد في الجدول. 2.
من حقول الغاز (جاف)
| أوكرانيا الغربية. . . | 81,2 | 7,5 | 4,5 | 3,7 | 2,5 | - . | 0,1 | 0,5 | 0,735 | |
| شبيلينسكوي .............................. | 92,9 | 4,5 | 0,8 | 0,6 | 0,6 | ____ . | 0,1 | 0,5 | 0,603 | |
| منطقة ستافروبول. . | 98,6 | 0,4 | 0,14 | 0,06 | - | 0,1 | 0,7 | 0,561 | ||
| منطقة كراسنودار. . | 92,9 | 0,5 | - | 0,5 | _ | 0,01 | 0,09 | 0,595 | ||
| ساراتوف ............................... | 93,4 | 2,1 | 0,8 | 0,4 | 0,3 | آثار | 0,3 | 2,7 | 0,576 | |
| غازلي ، منطقة بخارى | 96,7 | 0,35 | 0,4" | 0,1 | 0,45 | 0,575 | ||||
| من حقول النفط والغاز (المرتبطة) | ||||||||||
| روماشكينو ............................... | 18,5 | 6,2 | 4,7 | 0,1 | 11,5 | 1,07 | ||||
| 7,4 | 4,6 | ____ | آثار | 1,112 | __ . | |||||
| Tuymazy .................................. | 18,4 | 6,8 | 4,6 | ____ | 0,1 | 7,1 | 1,062 | - | ||
| عشي ....... | 23,5 | 9,3 | 3,5 | ____ | 0,2 | 4,5 | 1,132 | - | ||
| عريض.......... ............................. . | 2,5 | . ___ . | 1,5 | 0,721 | - | |||||
| زيت سيزران ............................... | 31,9 | 23,9 - | 5,9 | 2,7 | 0,8 | 1,7 | 1,6 | 31,5 | 0,932 | - |
| إيشيمباي ............................... | 42,4 | 20,5 | 7,2 | 3,1 | 2,8 | 1,040 | _ | |||
| أنديجان. ............................... | 66,5 | 16,6 | 9,4 | 3,1 | 3,1 | 0,03 | 0,2 | 4,17 | 0,801 ; | |
القيمة الحرارية للغازات
كمية الحرارة المنبعثة أثناء الاحتراق الكامل لوحدة كمية الوقود تسمى القيمة الحرارية (Q) أو ، كما يطلق عليها أحيانًا ، القيمة الحرارية ، أو القيمة الحرارية ، وهي إحدى الخصائص الرئيسية للوقود.
يشار عادةً إلى القيمة الحرارية للغازات بالرمز 1 م 3 ،تؤخذ في ظل الظروف العادية.
في الحسابات الفنية ، تُفهم الظروف العادية على أنها حالة الغاز عند درجة حرارة تساوي 0 درجة مئوية ، وعند ضغط 760 مم زئبق فن.يتم الإشارة إلى حجم الغاز في ظل هذه الظروف نانومتر 3(متر مكعب عادي).
بالنسبة لقياسات الغاز الصناعي وفقًا لـ GOST 2923-45 ، يتم أخذ درجة حرارة 20 درجة مئوية وضغط 760 كظروف طبيعية مم زئبق فن.يشير حجم الغاز إلى هذه الشروط ، على النقيض من نانومتر 3سنطالب م 3 (متر مكعب).
القيمة الحرارية للغازات (س))أعرب عن كيلو كالوري / نانومتر هأو في كيلو كالوري / م 3.
بالنسبة للغازات المسالة ، يشار إلى القيمة الحرارية 1 كلغ.
هناك قيمة حرارية أعلى (Q in) وأقل (Q n). تأخذ القيمة الحرارية الإجمالية في الاعتبار حرارة تكثيف بخار الماء المتكون أثناء احتراق الوقود. لا تأخذ القيمة الحرارية الصافية في الحسبان الحرارة الموجودة في بخار الماء لمنتجات الاحتراق ، لأن بخار الماء لا يتكثف ، بل يتم حمله بعيدًا مع منتجات الاحتراق.
تنطبق المفاهيم Q in و Q n فقط على تلك الغازات ، أثناء الاحتراق الذي يتم إطلاق بخار الماء منه (لا تنطبق هذه المفاهيم على أول أكسيد الكربون ، الذي لا يعطي بخار الماء أثناء الاحتراق).
عندما يتكثف بخار الماء ، يتم إطلاق حرارة تساوي 539 كيلو كالوري / كجم.بالإضافة إلى ذلك ، عندما يتم تبريد المكثف إلى 0 درجة مئوية (أو 20 درجة مئوية) ، يتم إطلاق الحرارة ، على التوالي ، بمقدار 100 أو 80 كيلو كالوري / كجم.
في المجموع ، بسبب تكثيف بخار الماء ، يتم إطلاق الحرارة أكثر من 600 كيلو كالوري / كجم ،وهو الفرق بين القيمة الحرارية الإجمالية والصافية للغاز. بالنسبة لمعظم الغازات المستخدمة في إمدادات الغاز في المناطق الحضرية ، فإن هذا الاختلاف هو 8-10٪.
يتم إعطاء قيم القيمة الحرارية لبعض الغازات في الجدول. 3.
بالنسبة لإمدادات الغاز في المناطق الحضرية ، يتم استخدام الغازات حاليًا ، والتي ، كقاعدة عامة ، لها قيمة حرارية لا تقل عن 3500 كيلو كالوري / نانومتر 3.ويفسر ذلك حقيقة أنه في ظروف المدن يتم توفير الغاز من خلال أنابيب على مسافات كبيرة. مع وجود قيمة منخفضة من السعرات الحرارية ، يلزم توفير كمية كبيرة. وهذا يؤدي حتما إلى زيادة أقطار أنابيب الغاز ، ونتيجة لذلك ، إلى زيادة الاستثمارات المعدنية والأموال لبناء شبكات الغاز ، وبالتالي زيادة في تكاليف التشغيل. من العيوب الكبيرة للغازات منخفضة السعرات الحرارية أنها تحتوي في معظم الحالات على كمية كبيرة من أول أكسيد الكربون ، مما يزيد من الخطر عند استخدام الغاز ، وكذلك عند خدمة الشبكات والمنشآت.
غاز ذو قيمة حرارية أقل من 3500 كيلو كالوري / نانومتر 3غالبًا ما تستخدم في الصناعة ، حيث لا يلزم نقلها لمسافات طويلة ويكون تنظيم الحرق أسهل. بالنسبة لإمدادات الغاز في المناطق الحضرية ، من المستحسن الحصول على قيمة حرارية ثابتة للغاز. التقلبات ، كما أثبتنا بالفعل ، لا يسمح بها بأكثر من 10 ٪. يتطلب التغيير الأكبر في القيمة الحرارية للغاز تعديلًا جديدًا ، وأحيانًا تغيير عدد كبير من الشعلات الموحدة للأجهزة المنزلية ، وهو ما يرتبط بصعوبات كبيرة.
يتم تحديد حرارة الاحتراق من خلال التركيب الكيميائي للمادة القابلة للاحتراق. تحدد العناصر الكيميائية الموجودة في المادة القابلة للاحتراق بالرموز المقبولة مع , ح , ا , ن , س، والرماد والماء رموز لكنو دبليوعلى التوالى.
موسوعي يوتيوب
-
1 / 5
يمكن أن ترتبط حرارة الاحتراق بالكتلة العاملة للمادة القابلة للاحتراق Q الفوسفور (displaystyle Q ^ (P))، أي إلى مادة قابلة للاحتراق بالشكل الذي تدخل فيه إلى المستهلك ؛ لتجفيف المادة س ج (displaystyle Q ^ (C))؛ إلى كتلة المادة القابلة للاحتراق ق Γ (displaystyle Q ^ (Gamma))، أي إلى مادة قابلة للاحتراق لا تحتوي على رطوبة ورماد.
تميز أعلى ( Q ب (displaystyle Q_ (B))) و اقل ( Q H (displaystyle Q_ (H))) حرارة الاحتراق.
تحت قيمة أعلى من السعرات الحراريةفهم مقدار الحرارة المنبعثة أثناء الاحتراق الكامل للمادة ، بما في ذلك حرارة تكثيف بخار الماء أثناء تبريد نواتج الاحتراق.
صافي القيمة الحراريةيتوافق مع كمية الحرارة المنبعثة أثناء الاحتراق الكامل ، دون مراعاة حرارة تكثف بخار الماء. وتسمى أيضًا حرارة تكثيف بخار الماء حرارة التبخر الكامنة (التكثيف).
ترتبط القيمة الحرارية المنخفضة والعالية بالنسبة: Q B = Q H + k (W + 9 H) (displaystyle Q_ (B) = Q_ (H) + k (W + 9H)),
حيث k هو معامل يساوي 25 كيلو جول / كجم (6 كيلو كالوري / كجم) ؛ W - كمية الماء في المادة القابلة للاحتراق ،٪ (بالوزن) ؛ H هي كمية الهيدروجين في المادة القابلة للاحتراق ،٪ (بالكتلة).
حساب حرارة الاحتراق
وبالتالي ، فإن القيمة الحرارية الأعلى هي مقدار الحرارة المنبعثة أثناء الاحتراق الكامل لوحدة كتلة أو حجم (للغاز) من مادة قابلة للاحتراق وتبريد نواتج الاحتراق إلى درجة حرارة نقطة الندى. في حسابات هندسة الحرارة ، يتم أخذ القيمة الحرارية الإجمالية على أنها 100٪. الحرارة الكامنة لاحتراق الغاز هي الحرارة التي يتم إطلاقها أثناء تكثيف بخار الماء الموجود في نواتج الاحتراق. نظريًا ، يمكن أن تصل إلى 11٪.
من الناحية العملية ، لا يمكن تبريد منتجات الاحتراق لإكمال التكثيف ، وبالتالي يتم إدخال مفهوم القيمة الحرارية الصافية (QHp) ، والتي يتم الحصول عليها عن طريق طرح حرارة تبخير بخار الماء من القيمة الحرارية الأعلى. المادة وتشكلت أثناء احتراقها. يتم إنفاق 2514 كيلو جول / كجم (600 كيلو كالوري / كجم) على تبخير 1 كجم من بخار الماء. يتم تحديد القيمة الحرارية الصافية بواسطة الصيغ (kJ / kg أو kcal / kg):
Q H P = Q B P - 2514 ⋅ ((9 H P + W P) / 100) (displaystyle Q_ (H) ^ (P) = Q_ (B) ^ (P) -2514 \ cdot ((9H ^ (P) + W ^ (ف)) / 100))(للصلب)
Q H P = Q B P - 600 ⋅ ((9 H P + W P) / 100) (displaystyle Q_ (H) ^ (P) = Q_ (B) ^ (P) -600 \ cdot ((9H ^ (P) + W ^ (ف)) / 100))(لمادة سائلة) ، حيث:
2514 - حرارة التبخر عند 0 درجة مئوية والضغط الجوي ، كيلوجول / كجم ؛
H الفوسفور (displaystyle H ^ (P))و ف الفوسفور (displaystyle W ^ (P))- محتوى الهيدروجين وبخار الماء في وقود التشغيل ،٪ ؛
9 هو معامل يوضح أنه عندما يتم حرق 1 كجم من الهيدروجين مع الأكسجين ، يتم تكوين 9 كجم من الماء.
تعتبر القيمة الحرارية أهم ما يميز الوقود ، حيث إنها تحدد كمية الحرارة الناتجة عن حرق 1 كجم من الوقود الصلب أو السائل أو 1 متر مكعب من الوقود الغازي في كيلو جول / كجم (كيلو كالوري / كجم). 1 كيلو كالوري = 4.1868 أو 4.19 كيلو جول.
يتم تحديد القيمة الحرارية الصافية بشكل تجريبي لكل مادة وهي قيمة مرجعية. يمكن أيضًا تحديده للمواد الصلبة والسائلة ، بتركيبة عنصرية معروفة ، عن طريق الحساب وفقًا لصيغة D. I. Mendeleev ، kJ / kg أو kcal / kg:
Q H الفوسفور = 339 ⋅ C الفوسفور + 1256 ⋅ H الفوسفور - 109 ⋅ (O P - S L P) - 25.14 ⋅ (9 ⋅ H الفوسفور + W الفوسفور) (displaystyle Q_ (H) ^ (P) = 339 cdot C ^ (P) +1256 cdot H ^ (P) -109 \ cdot (O ^ (P) -S_ (L) ^ (P)) - 25.14 \ cdot (9 \ cdot H ^ (P) + W ^ (P)))
Q H الفوسفور = 81 ⋅ C الفوسفور + 246 ⋅ H الفوسفور - 26 ⋅ (O P + S L P) - 6 ⋅ W الفوسفور (displaystyle Q_ (H) ^ (P) = 81 cdot C ^ (P) +246 cdot H ^ (P) -26 \ cdot (O ^ (P) + S_ (L) ^ (P)) - 6 \ cdot W ^ (P))، أين:
ج الفوسفور (displaystyle C_ (P)), الفوسفور (displaystyle H_ (P)), O الفوسفور (displaystyle O_ (P)), م. الفوسفور (displaystyle S_ (L) ^ (P)), ف الفوسفور (displaystyle W_ (P))- محتوى الكربون والهيدروجين والأكسجين والكبريت المتطاير والرطوبة في الكتلة العاملة للوقود كنسبة مئوية (بالكتلة).
بالنسبة للحسابات المقارنة ، يتم استخدام ما يسمى بالوقود التقليدي ، والذي له حرارة احتراق معينة تساوي 29308 كيلو جول / كجم (7000 كيلو كالوري / كجم).
في روسيا ، يتم إجراء الحسابات الحرارية (على سبيل المثال ، حساب الحمل الحراري لتحديد فئة الغرفة لخطر الانفجار والحريق) وفقًا لأدنى قيمة من السعرات الحرارية ، في الولايات المتحدة الأمريكية وبريطانيا العظمى وفرنسا - وفقًا لأعلى . في المملكة المتحدة والولايات المتحدة ، قبل إدخال النظام المتري ، تم قياس قيم تسخين محددة بالوحدات الحرارية البريطانية (BTU) لكل رطل (رطل) (1Btu / lb = 2.326 kJ / kg).
المواد والمواد صافي القيمة الحرارية Q H الفوسفور (displaystyle Q_ (H) ^ (P))، MJ / كجم بنزين 41,87 الكيروسين 43,54 الورق: الكتب والمجلات 13,4 خشب (قضبان W = 14٪) 13,8 المطاط الطبيعي 44,73 مشمع بولي فينيل كلوريد 14,31 ممحاة 33,52 الألياف الغذائية الأساسية 13,8 بولي ايثيلين 47,14 الستايروفوم 41,6 خففت القطن 15,7 بلاستيك 41,87 تعرض الجداول الحرارة النوعية للكتلة لاحتراق الوقود (السائل والصلب والغازي) وبعض المواد الأخرى القابلة للاحتراق. الوقود مثل: الفحم ، والحطب ، وفحم الكوك ، والجفت ، والكيروسين ، والزيت ، والكحول ، والبنزين ، والغاز الطبيعي ، وما إلى ذلك.
قائمة جداول:
في تفاعل أكسدة الوقود الطارد للحرارة ، يتم تحويل طاقته الكيميائية إلى طاقة حرارية مع إطلاق كمية معينة من الحرارة. تسمى الطاقة الحرارية الناتجة حرارة احتراق الوقود. يعتمد على التركيب الكيميائي للرطوبة وهو المكون الرئيسي. القيمة الحرارية للوقود ، المشار إليها 1 كجم من الكتلة أو 1 م 3 من الحجم ، تشكل الكتلة أو القيمة الحرارية النوعية النوعية.
الحرارة النوعية لاحتراق الوقود هي مقدار الحرارة المنبعثة أثناء الاحتراق الكامل لوحدة الكتلة أو حجم الوقود الصلب أو السائل أو الغازي. في النظام الدولي للوحدات ، تُقاس هذه القيمة بـ J / kg أو J / m 3.
يمكن تحديد الحرارة النوعية لاحتراق الوقود بشكل تجريبي أو حسابها تحليليًا.تعتمد الطرق التجريبية لتحديد القيمة الحرارية على القياس العملي لكمية الحرارة المنبعثة أثناء احتراق الوقود ، على سبيل المثال ، في المسعر مع منظم الحرارة وقنبلة الاحتراق. بالنسبة للوقود الذي يحتوي على تركيبة كيميائية معروفة ، يمكن تحديد الحرارة النوعية للاحتراق من صيغة Mendeleev.
هناك درجات حرارة احتراق أعلى وأقل.القيمة الحرارية الإجمالية تساوي الحد الأقصى لمقدار الحرارة المنبعثة أثناء الاحتراق الكامل للوقود ، مع مراعاة الحرارة التي يتم إنفاقها على تبخر الرطوبة الموجودة في الوقود. تكون القيمة الحرارية المنخفضة أقل من القيمة الأعلى من خلال قيمة حرارة التكثيف ، والتي تتكون من رطوبة الوقود وهيدروجين الكتلة العضوية ، والتي تتحول إلى ماء أثناء الاحتراق.
لتحديد مؤشرات جودة الوقود ، وكذلك في حسابات هندسة الحرارة عادة ما تستخدم أقل حرارة احتراق محددةوهي أهم خاصية حرارية وتشغيلية للوقود وهي مذكورة في الجداول أدناه.
الحرارة النوعية لاحتراق الوقود الصلب (الفحم ، الحطب ، الخث ، فحم الكوك)
يوضح الجدول قيم الحرارة النوعية لاحتراق الوقود الصلب الجاف بوحدة MJ / kg. الوقود في الجدول مرتبة حسب الاسم بترتيب أبجدي.
من بين أنواع الوقود الصلب المدروسة ، يحتوي فحم الكوك على أعلى قيمة حرارية - تبلغ حرارة احتراقه المحددة 36.3 ميجا جول / كجم (أو 36.3 · 10 6 جول / كجم في وحدات النظام الدولي). بالإضافة إلى ذلك ، تتميز قيمة السعرات الحرارية العالية بالفحم والأنثراسايت والفحم والفحم البني.
تشمل أنواع الوقود ذات الكفاءة المنخفضة في استخدام الطاقة الخشب والحطب والبارود و freztorf والصخر الزيتي. على سبيل المثال ، الحرارة النوعية لاحتراق الحطب هي 8.4 ... 12.5 ، والبارود - 3.8 ميجا جول / كجم فقط.
الحرارة النوعية لاحتراق الوقود الصلب (الفحم ، الحطب ، الخث ، فحم الكوك)
الوقود أنثراسايت 26,8…34,8 الكريات الخشبية (حبوب) 18,5 الحطب جاف 8,4…11 خشب البتولا الجاف 12,5 فحم الكوك الغازي 26,9 فحم الكوك في الفرن العالي 30,4 شبه فحم الكوك 27,3 مسحوق 3,8 سليت 4,6…9 الصخر الزيتي 5,9…15 دافع صلب 4,2…10,5 الخث 16,3 الخث الليفي 21,8 طحن الخث 8,1…10,5 كسرة الخث 10,8 الفحم البني 13…25 الفحم البني (قوالب) 20,2 الفحم البني (الغبار) 25 فحم دونيتسك 19,7…24 فحم 31,5…34,4 فحم 27 فحم الكوك 36,3 فحم كوزنيتسك 22,8…25,1 فحم تشيليابينسك 12,8 فحم إيكيباستوز 16,7 فريزتورف 8,1 الخبث 27,5 الحرارة النوعية لاحتراق الوقود السائل (كحول ، بنزين ، كيروسين ، زيت)
تم إعطاء جدول الحرارة النوعية لاحتراق الوقود السائل وبعض السوائل العضوية الأخرى. وتجدر الإشارة إلى أن أنواع الوقود مثل البنزين ووقود الديزل والنفط تتميز بإطلاق حرارة عالية أثناء الاحتراق.
تكون الحرارة النوعية لاحتراق الكحول والأسيتون أقل بكثير من حرارة وقود المحركات التقليدية. بالإضافة إلى ذلك ، فإن الوقود السائل له قيمة حرارية منخفضة نسبيًا ، ومع الاحتراق الكامل لـ 1 كجم من هذه الهيدروكربونات ، سيتم إطلاق كمية حرارة تساوي 9.2 و 13.3 ميجا جول ، على التوالي.
الحرارة النوعية لاحتراق الوقود السائل (كحول ، بنزين ، كيروسين ، زيت)
الوقود الحرارة النوعية للاحتراق ، MJ / كجم الأسيتون 31,4 بنزين A-72 (GOST 2084-67) 44,2 بنزين الطيران B-70 (GOST 1012-72) 44,1 بنزين AI-93 (GOST 2084-67) 43,6 البنزين 40,6 وقود الديزل الشتوي (GOST 305-73) 43,6 وقود الديزل الصيفي (GOST 305-73) 43,4 دافع سائل (كيروسين + أكسجين سائل) 9,2 كيروسين الطيران 42,9 كيروسين الإضاءة (GOST 4753-68) 43,7 زيلين 43,2 زيت وقود عالي الكبريت 39 زيت الوقود منخفض الكبريت 40,5 زيت وقود منخفض الكبريت 41,7 زيت الوقود الكبريتى 39,6 كحول الميثيل (ميثانول) 21,1 ن-كحول بوتيل 36,8 نفط 43,5…46 الميثان النفطي 21,5 التولوين 40,9 الروح البيضاء (GOST 313452) 44 أثلين كلايكول 13,3 الكحول الإيثيلي (الإيثانول) 30,6 الحرارة النوعية لاحتراق الوقود الغازي والغازات القابلة للاحتراق
تم تقديم جدول بالحرارة النوعية لاحتراق الوقود الغازي وبعض الغازات القابلة للاحتراق الأخرى في أبعاد MJ / kg. من بين الغازات المدروسة ، تختلف أكبر حرارة نوعية للاحتراق. مع الاحتراق الكامل لكل كيلوغرام واحد من هذا الغاز ، سيتم إطلاق 119.83 ميجا جول من الحرارة. أيضًا ، يحتوي وقود مثل الغاز الطبيعي على قيمة حرارية عالية - الحرارة النوعية لاحتراق الغاز الطبيعي هي 41 ... 49 ميجا جول / كجم (لـ 50 ميجا جول / كجم).
الحرارة النوعية لاحتراق الوقود الغازي والغازات القابلة للاحتراق (الهيدروجين والغاز الطبيعي والميثان)
الوقود الحرارة النوعية للاحتراق ، MJ / كجم 1-بوتين 45,3 الأمونيا 18,6 الأسيتيلين 48,3 هيدروجين 119,83 هيدروجين ، مخلوط مع ميثان (50٪ H 2 و 50٪ CH 4 بالكتلة) 85 الهيدروجين المخلوط مع الميثان وأول أكسيد الكربون (33-33-33٪ بالوزن) 60 هيدروجين ، مخلوط مع أول أكسيد الكربون (50٪ H 2 50٪ CO 2 بالكتلة) 65 غاز فرن الانفجار 3 غاز فرن الكوك 38,5 غاز الهيدروكربون المسال LPG (البروبان - البيوتان) 43,8 ايزوبيوتان 45,6 الميثان 50 ن- البيوتان 45,7 ن الهكسان 45,1 ن-بنتان 45,4 الغاز المصاحب 40,6…43 غاز طبيعي 41…49 بروبادين 46,3 البروبان 46,3 البروبيلين 45,8 البروبيلين ، خليط مع الهيدروجين وأول أكسيد الكربون (90٪ -9٪ -1٪ بالوزن) 52 الإيثان 47,5 الإيثيلين 47,2 الحرارة النوعية لاحتراق بعض المواد القابلة للاحتراق
جدول يوضح الحرارة النوعية لاحتراق بعض المواد القابلة للاشتعال (خشب ، ورق ، بلاستيك ، قش ، مطاط ، إلخ). وتجدر الإشارة إلى المواد التي تنبعث منها حرارة عالية أثناء الاحتراق. وتشمل هذه المواد: المطاط بأنواعه المختلفة ، والبوليسترين الممدد (البوليسترين) ، والبولي بروبيلين والبولي إيثيلين.
الحرارة النوعية لاحتراق بعض المواد القابلة للاحتراق
الوقود الحرارة النوعية للاحتراق ، MJ / كجم ورق 17,6 جلدي 21,5 خشب (قضبان ذات محتوى رطوبة 14٪) 13,8 خشب في أكوام 16,6 خشب البلوط 19,9 خشب الصنوبر 20,3 الخشب الأخضر 6,3 خشب الصنوبر 20,9 كابرون 31,1 منتجات الكربولايت 26,9 ورق مقوى 16,5 مطاط ستايرين بوتادين SKS-30AR 43,9 المطاط الطبيعي 44,8 مطاط صناعي 40,2 SCS المطاط 43,9 مطاط الكلوروبرين 28 مشمع بولي فينيل كلوريد 14,3 مشمع من طبقتين من البولي فينيل كلوريد 17,9 مشمع بولي فينيل كلوريد على أساس اللباد 16,6 مشمع بولي فينيل كلوريد على أساس دافئ 17,6 مشمع البولي فينيل كلوريد على أساس النسيج 20,3 مشمع المطاط (ريلين) 27,2 مادة البارافين الصلبة 11,2 رغوة PVC-1 19,5 رغوة FS-7 24,4 رغوة FF 31,4 البوليسترين الممدد PSB-S 41,6 رغوة البولي يوريثان 24,3 اللوح الليفي 20,9 كلوريد البوليفينيل (PVC) 20,7 بولي كربونات 31 بولى بروبلين 45,7 البوليسترين 39 بولي ايثيلين عالي الكثافة 47 بولي إيثيلين منخفض الضغط 46,7 ممحاة 33,5 روبرويد 29,5 قناة السخام 28,3 القش 16,7 قش 17 زجاج عضوي (زجاج شبكي) 27,7 نسيج 20,9 تول 16 مادة تي إن تي 15 قطن 17,5 السليلوز 16,4 ألياف الصوف والصوف 23,1 مصادر:
- 147-2013 GOST وقود معدني صلب. تحديد قيمة السعرات الحرارية الأعلى وحساب القيمة الحرارية المنخفضة.
- المنتجات البترولية GOST 21261-91. طريقة تقدير إجمالي القيمة الحرارية وحساب صافي القيمة الحرارية.
- غازات طبيعية قابلة للاحتراق GOST 22667-82. طريقة الحساب لتحديد القيمة الحرارية والكثافة النسبية ورقم Wobbe.
- GOST 31369-2008 الغاز الطبيعي. حساب القيمة الحرارية والكثافة والكثافة النسبية ورقم Wobbe بناءً على تكوين المكون.
- Zemsky G. T. الخصائص القابلة للاشتعال للمواد العضوية وغير العضوية: كتاب مرجعي M: VNIIPO ، 2016-970 ص.
ينقسم وقود الغاز إلى وقود طبيعي واصطناعي وهو خليط من غازات قابلة للاحتراق وغير قابلة للاحتراق تحتوي على كمية معينة من بخار الماء ، وأحيانًا الغبار والقطران. يتم التعبير عن كمية وقود الغاز بالمتر المكعب في ظل الظروف العادية (760 مم زئبق و 0 درجة مئوية) ، ويتم التعبير عن التركيب كنسبة مئوية من حيث الحجم. تحت تكوين الوقود فهم تكوين الجزء الغازي الجاف.
وقود الغاز الطبيعي
وقود الغاز الأكثر شيوعًا هو الغاز الطبيعي ، الذي يحتوي على قيمة حرارية عالية. أساس الغاز الطبيعي هو الميثان ، ويتراوح محتواه من 76.7-98٪. تعتبر مركبات الهيدروكربون الغازية الأخرى جزءًا من الغاز الطبيعي بنسبة تتراوح من 0.1 إلى 4.5٪.
الغاز المسال منتج لتكرير النفط - يتكون بشكل أساسي من خليط من البروبان والبيوتان.
الغاز الطبيعي (CNG ، NG): الميثان CH4 أكثر من 90٪ ، الإيثان C2 H5 أقل من 4٪ ، البروبان C3 H8 أقل من 1٪
الغاز المسال (LPG): البروبان C3 H8 أكثر من 65٪ ، البيوتان C4 H10 أقل من 35٪
تشمل الغازات القابلة للاحتراق: الهيدروجين H 2 والميثان CH 4 ومركبات الهيدروكربون الأخرى Cm H n وكبريتيد الهيدروجين H 2 S والغازات غير القابلة للاحتراق وثاني أكسيد الكربون CO2 والأكسجين O 2 والنيتروجين N 2 وكمية صغيرة من بخار الماء H 2 O. المؤشرات مو صعند C و H ، تميز مركبات من الهيدروكربونات المختلفة ، على سبيل المثال ، الميثان CH 4 ر = 1 و ن= 4 ، للإيثان С 2 Н ب ر = 2و ن= ب إلخ.
تكوين الوقود الغازي الجاف (بالنسبة المئوية بالحجم):
CO + H 2 + 2 C · m · H n + H 2 S + CO 2 + O 2 + N 2 = 100٪.الجزء غير القابل للاحتراق من الوقود الغازي الجاف - الصابورة - هو النيتروجين N وثاني أكسيد الكربون CO 2.
يتم التعبير عن تكوين الوقود الغازي الرطب على النحو التالي:
CO + H 2 + Σ C m H n + H 2 S + CO 2 + O 2 + N 2 + H 2 O \ u003d 100٪.
يتم تحديد حرارة الاحتراق ، kJ / m (kcal / m 3) ، 1 م 3 من الغاز الجاف النقي في ظل الظروف العادية على النحو التالي:
س ن ث \ u003d 0.01 ،
حيث Qco، Q n 2، Q with m n n Q n 2 س. - حرارة احتراق الغازات الفردية التي يتكون منها الخليط ، كيلو جول / م 3 (كيلو كالوري / م 3) ؛ ثاني أكسيد الكربون ، H 2 ،سم ح ن ، ح 2 س - المكونات التي يتكون منها خليط الغازات ،٪ من حيث الحجم.
تبلغ حرارة احتراق 1 متر مكعب من الغاز الطبيعي الجاف في الظروف العادية لمعظم الحقول المنزلية 33.29 - 35.87 ميجا جول / متر مكعب (7946 - 8560 كيلو كالوري / متر مكعب). ترد خصائص الوقود الغازي في الجدول 1.
مثال.تحديد القيمة الحرارية الصافية للغاز الطبيعي (في ظل الظروف العادية) للتكوين التالي:
H 2 S = 1٪ ؛ CH 4 = 76.7٪ ؛ ج 2 ح 6 = 4.5٪ ؛ ج 3 س 8 = 1.7٪ ؛ ج 4 ح 10 = 0.8٪ ؛ ج 5 س 12 = 0.6٪.
بالتعويض عن خصائص الغازات من الجدول 1 في الصيغة (26) ، نحصل على:
Q ns \ u003d 0.01 \ u003d 33981 kJ / m 3 أو
Q ns \ u003d 0.01 (5585.1 + 8555 76.7 + 15226 4.5 + 21795 1.7 + 28338 0.8 + 34890 0.6) \ u003d 8109 كيلو كالوري / م 3.
الجدول 1. خصائص الوقود الغازي
غاز
تعيين
حرارة الاحتراقس ن س
كيلوجول / م 3
كيلو كالوري / م 3
هيدروجين ح 10820 2579 أول أكسيد الكربون لذا 12640 3018 كبريتيد الهيدروجين H 2 ق 23450 5585 الميثان CH 4 35850 8555 الإيثان ج 2 ح 6 63 850 15226 البروبان ج 3 ح 8 91300 21795 البيوتان ج 4 ح 10 118700 22338 بنتان ج 5 ح 12 146200 34890 الإيثيلين ج 2 ح 4 59200 14107 البروبيلين ج 3 ح 6 85980 20541 بوتيلين ج 4 ح 8 113 400 27111 البنزين ج 6 ح 6 140400 33528 تستهلك غلايات من النوع DE من 71 إلى 75 م 3 من الغاز الطبيعي لإنتاج طن واحد من البخار. تكلفة الغاز في روسيا سبتمبر 2008 2.44 روبل لكل متر مكعب. وبالتالي ، سيكلف طن من البخار 71 × 2.44 = 173 روبل 24 كوبيل. التكلفة الحقيقية للطن من البخار في المصانع هي لمراجل DE ما لا يقل عن 189 روبل لكل طن من البخار.
تستهلك غلايات من نوع DKVR من 103 إلى 118 م 3 من الغاز الطبيعي لإنتاج طن واحد من البخار. التكلفة الدنيا المقدرة للطن من البخار لهذه الغلايات هي 103 × 2.44 = 251 روبل 32 كوبيل. التكلفة الحقيقية للبخار للنباتات لا تقل عن 290 روبل للطن.
كيف تحسب الحد الأقصى لاستهلاك الغاز الطبيعي للغلاية البخارية DE-25؟ هذه هي مواصفات المرجل. 1840 مكعبًا في الساعة. لكن يمكنك أيضًا الحساب. يجب ضرب 25 طنًا (25 ألف كجم) بالفرق بين المحتوى الحراري للبخار والماء (666.9-105) وكل هذا مقسومًا على كفاءة المرجل البالغة 92.8٪ وحرارة احتراق الغاز. 8300. وجميع
وقود الغاز الاصطناعي
الغازات القابلة للاحتراق الاصطناعية هي وقود محلي ، لأنها تحتوي على قيمة حرارية أقل بكثير. العناصر الرئيسية القابلة للاحتراق هي أول أكسيد الكربون وهيدروجين H2. تستخدم هذه الغازات في حدود الإنتاج حيث يتم الحصول عليها كوقود لمحطات الطاقة والتكنولوجية.
جميع الغازات القابلة للاحتراق الطبيعية والاصطناعية قابلة للانفجار ، ويمكنها الاشتعال عند اللهب المكشوف أو الشرارة. هناك حدود متفجرة سفلية وعالية للغاز ، أي أعلى وأقل نسبة تراكيز في الهواء. يتراوح الحد الأدنى للانفجار للغازات الطبيعية من 3٪ إلى 6٪ ، بينما يتراوح الحد الأعلى من 12٪ إلى 16٪. يمكن لجميع الغازات القابلة للاحتراق أن تسبب تسممًا لجسم الإنسان. المواد السامة الرئيسية للغازات القابلة للاحتراق هي: أول أكسيد الكربون CO ، كبريتيد الهيدروجين H2S ، الأمونيا NH3.
الغازات الطبيعية القابلة للاحتراق ، وكذلك الغازات الاصطناعية ، عديمة اللون (غير مرئية) وعديمة الرائحة ، مما يجعلها خطرة عندما تخترق داخل غرفة المرجل من خلال التسريبات في تجهيزات خطوط أنابيب الغاز. لتجنب التسمم ، يجب معالجة الغازات القابلة للاحتراق برائحة - مادة ذات رائحة كريهة.
الحصول على أول أكسيد الكربون CO في الصناعة عن طريق تغويز الوقود الصلب
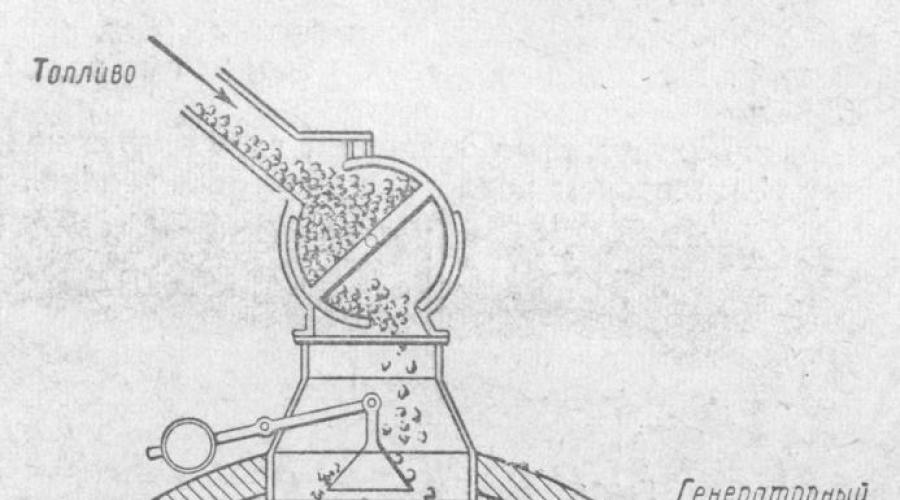
للأغراض الصناعية ، يتم الحصول على أول أكسيد الكربون عن طريق تغويز الوقود الصلب ، أي تحويله إلى وقود غازي. لذلك يمكنك الحصول على أول أكسيد الكربون من أي وقود صلب - الفحم الأحفوري ، والجفت ، والحطب ، إلخ.
تظهر عملية تغويز الوقود الصلب في تجربة معملية (الشكل 1). بعد أن ملأنا الأنبوب المقاوم للصهر بقطع من الفحم ، نقوم بتسخينه بقوة ونترك الأكسجين يمر عبر مقياس الغاز. دع الغازات الخارجة من الأنبوب تمر عبر غسالة ماء الجير ثم أشعل فيها النار. يصبح ماء الجير عكرًا ، ويحترق الغاز بلهب مزرق. يشير هذا إلى وجود ثاني أكسيد الكربون وأول أكسيد الكربون في منتجات التفاعل.
يمكن تفسير تكوين هذه المواد من خلال حقيقة أنه عندما يتلامس الأكسجين مع الفحم الساخن ، يتأكسد هذا الأخير أولاً إلى ثاني أكسيد الكربون: C + O 2 \ u003d CO 2
ثم ، بالمرور عبر الفحم الساخن ، يتم تقليل ثاني أكسيد الكربون جزئيًا بواسطته إلى أول أكسيد الكربون: CO 2 + C \ u003d 2CO
أرز. 1. الحصول على أول أكسيد الكربون (خبرة معملية).
في ظل الظروف الصناعية ، يتم تغويز الوقود الصلب في أفران تسمى مولدات الغاز.
يسمى خليط الغازات الناتج بالغاز المنتج.
يظهر جهاز مولد الغاز في الشكل. إنها أسطوانة فولاذية يبلغ ارتفاعها حوالي 5 مويبلغ قطرها حوالي 3.5 ممبطنة من الداخل بالطوب الحراري. من الأعلى ، يتم تحميل مولد الغاز بالوقود ؛ من الأسفل ، يتم توفير الهواء أو بخار الماء بواسطة مروحة عبر الشبكة.
يتفاعل الأكسجين الموجود في الهواء مع كربون الوقود ، مكونًا ثاني أكسيد الكربون ، الذي يرتفع من خلال طبقة من الوقود الساخن ، يتحول بواسطة الكربون إلى أول أكسيد الكربون.
إذا تم نفخ الهواء فقط في المولد ، فسيتم الحصول على غاز يحتوي في تركيبته على أول أكسيد الكربون والنيتروجين في الهواء (بالإضافة إلى كمية معينة من ثاني أكسيد الكربون والشوائب الأخرى). يسمى غاز المولد هذا بغاز الهواء.
ومع ذلك ، إذا تم نفخ بخار الماء في المولد بالفحم الساخن ، فإن أول أكسيد الكربون والهيدروجين يتشكلان نتيجة للتفاعل: C + H 2 O \ u003d CO + H 2
يسمى هذا الخليط من الغازات بغاز الماء. يحتوي غاز الماء على قيمة حرارية أعلى من غاز الهواء ، نظرًا لأن تركيبه ، إلى جانب أول أكسيد الكربون ، يشتمل أيضًا على غاز ثاني قابل للاحتراق - الهيدروجين. غاز الماء (غاز تخليقي) أحد منتجات تغويز الوقود. يتكون غاز الماء بشكل رئيسي من ثاني أكسيد الكربون (40٪) و H2 (50٪). غاز الماء هو وقود (قيمة حرارية 10500 كيلوجول / متر مكعب ، أو 2730 كيلو كالوري / مجم) وفي نفس الوقت مادة خام لتخليق الميثانول. ومع ذلك ، لا يمكن الحصول على غاز الماء لفترة طويلة ، لأن تفاعل تكوينه ماص للحرارة (مع امتصاص الحرارة) ، وبالتالي يبرد الوقود في المولد. من أجل الحفاظ على الفحم في حالة ساخنة ، يتم حقن بخار الماء في المولد بالتناوب مع حقن الهواء ، حيث يتفاعل الأكسجين ، كما هو معروف ، مع الوقود مع إطلاق الحرارة.
في الآونة الأخيرة ، تم استخدام انفجار البخار والأكسجين على نطاق واسع لتغويز الوقود. إن النفخ المتزامن لبخار الماء والأكسجين عبر طبقة الوقود يجعل من الممكن تنفيذ العملية بشكل مستمر ، وزيادة إنتاجية المولد بشكل كبير والحصول على غاز يحتوي على نسبة عالية من الهيدروجين وأول أكسيد الكربون.
مولدات الغاز الحديثة هي أجهزة قوية للعمل المستمر.
بحيث عندما يتم توفير الوقود لمولد الغاز ، لا تتغلغل الغازات السامة والقابلة للاحتراق في الغلاف الجوي ، فإن أسطوانة التحميل تكون مزدوجة. أثناء دخول الوقود إلى حجرة واحدة من الأسطوانة ، يتم سكب الوقود من الحجرة الأخرى في المولد ؛ عندما تدور الأسطوانة ، تتكرر هذه العمليات ، بينما يظل المولد معزولًا عن الغلاف الجوي طوال الوقت. يتم التوزيع الموحد للوقود في المولد باستخدام مخروط يمكن تثبيته على ارتفاعات مختلفة. عندما يتم خفضه ، يقع الفحم بالقرب من مركز المولد ؛ وعندما يتم رفع المخروط ، يتم إلقاء الفحم بالقرب من جدران المولد.
تتم عملية إزالة الرماد من مولد الغاز. يتم تدوير الشبكة المخروطية الشكل ببطء بواسطة محرك كهربائي. في هذه الحالة ، يتم نقل الرماد إلى جدران المولد ويتم إلقاؤه في صندوق الرماد بأجهزة خاصة ، حيث يتم إزالته بشكل دوري.
أضاءت مصابيح الغاز الأولى في سانت بطرسبرغ في جزيرة أبتيكارسكي في عام 1819. تم الحصول على الغاز المستخدم عن طريق تغويز الفحم. كان يطلق عليه الغاز الخفيف.
كان العالم الروسي العظيم د. آي مينديليف (1834-1907) أول من أعرب عن فكرة أن تغويز الفحم يمكن أن يتم مباشرة تحت الأرض ، دون رفعه. لم تقدر الحكومة القيصرية اقتراح مندليف.
فكرة التغويز تحت الأرض أيدها بشدة في. آي. لينين. ووصفه بأنه "أحد أعظم انتصارات التكنولوجيا." تم تنفيذ عملية التغويز تحت الأرض لأول مرة من قبل الدولة السوفيتية. قبل الحرب الوطنية العظمى ، كانت المولدات تحت الأرض تعمل في أحواض الفحم في منطقة دونيتسك وموسكو في الاتحاد السوفيتي.
يعطي الشكل 3 فكرة عن إحدى طرق التغويز تحت الأرض ، حيث يتم وضع بئرين في خط الفحم المتصلين في الأسفل بقناة. يتم إحراق الفحم في مثل هذه القناة بالقرب من أحد الآبار ويتم تفجيرها هناك. تتفاعل منتجات الاحتراق ، التي تتحرك على طول القناة ، مع الفحم الساخن ، مما يؤدي إلى تكوين غاز قابل للاحتراق ، كما هو الحال في المولد التقليدي. يخرج الغاز إلى السطح من خلال البئر الثاني.
يستخدم غاز المولد على نطاق واسع لتسخين الأفران الصناعية - المعدنية وفحم الكوك وكوقود في السيارات (الشكل 4).
أرز. 3. مخطط تغويز الفحم تحت الأرض.
يتم تصنيع عدد من المنتجات العضوية ، مثل الوقود السائل ، من الهيدروجين وأول أكسيد الكربون لغاز الماء. وقود سائل اصطناعي - وقود (بنزين بشكل أساسي) ، يتم الحصول عليه عن طريق التوليف من أول أكسيد الكربون والهيدروجين عند 150-170 درجة مئوية وضغط من 0.7 - 20 مليون نيوتن / م 2 (200 كجم / سم 2) ، في وجود عامل حفاز (نيكل ، الحديد والكوبالت). تم تنظيم أول إنتاج للوقود السائل الصناعي في ألمانيا خلال الحرب العالمية الثانية بسبب نقص النفط. لم يتم توزيع الوقود السائل الصناعي على نطاق واسع بسبب تكلفته العالية. يستخدم غاز الماء لإنتاج الهيدروجين. للقيام بذلك ، يتم تسخين غاز الماء في خليط مع بخار الماء في وجود محفز ونتيجة لذلك ، يتم الحصول على الهيدروجين بالإضافة إلى الموجود بالفعل في غاز الماء: CO + H 2 O \ u003d CO 2 + H 2