Potere calorifico del gas associato. Gas naturale e suo potere calorifico per uso domestico
La quantità di calore rilasciata durante la combustione completa di una quantità unitaria di combustibile è chiamata potere calorifico (Q) o, come viene talvolta chiamato, potere calorifico, o potere calorifico, che è una delle principali caratteristiche del combustibile.
Il potere calorifico dei gas è generalmente indicato come 1 m 3, assunto in condizioni normali.
Nei calcoli tecnici per condizioni normali si intende lo stato del gas ad una temperatura pari a 0°C, e, ad una pressione di 760°C mmHg Arte. Viene indicato il volume di gas in queste condizioni nm 3(normale metro cubo).
Per le misurazioni di gas industriali secondo GOST 2923-45, la temperatura di 20 ° C e la pressione di 760 sono considerate condizioni normali mmHg Arte. Il volume di gas riferito a queste condizioni, in contrasto con nm 3 chiameremo m 3 (metro cubo).
Potere calorifico dei gas (Q)) espresso in kcal/nm e o dentro kcal/m3.
Per i gas liquefatti il potere calorifico è riferito a 1 kg.
Ci sono potere calorifico superiore (Q in) e inferiore (Q n). Il potere calorifico lordo tiene conto del calore di condensazione del vapore acqueo formatosi durante la combustione del combustibile. Il potere calorifico netto non tiene conto del calore contenuto nel vapore acqueo dei prodotti della combustione, poiché il vapore acqueo non condensa, ma viene portato via con i prodotti della combustione.
I concetti Q in e Q n si applicano solo a quei gas, durante la cui combustione viene rilasciato vapore acqueo (questi concetti non si applicano al monossido di carbonio, che non cede vapore acqueo durante la combustione).
Quando il vapore acqueo condensa, viene rilasciato calore pari a 539 kcal/kg. Inoltre, quando la condensa viene raffreddata a 0°C (o 20°C), viene rilasciato calore, rispettivamente, nella quantità di 100 o 80 kcal/kg.
In totale, a causa della condensazione del vapore acqueo, il calore viene rilasciato più di 600 kcal/kg, che è la differenza tra il potere calorifico lordo e netto del gas. Per la maggior parte dei gas utilizzati nella fornitura di gas urbano, questa differenza è dell'8-10%.
I valori del potere calorifico di alcuni gas sono riportati in tabella. 3.
Per l'approvvigionamento di gas urbano si utilizzano attualmente gas che, di norma, hanno un potere calorifico di almeno 3500 kcal/nm 3. Ciò è spiegato dal fatto che nelle condizioni delle città il gas viene fornito attraverso tubazioni a distanze considerevoli. Con un basso potere calorifico, è necessario fornire una grande quantità. Ciò porta inevitabilmente ad un aumento dei diametri dei gasdotti e, di conseguenza, ad un aumento degli investimenti in metallo e dei fondi per la realizzazione delle reti gas, e, successivamente, ad un aumento dei costi di esercizio. Uno svantaggio significativo dei gas a basso contenuto calorico è che nella maggior parte dei casi contengono una quantità significativa di monossido di carbonio, che aumenta il pericolo quando si utilizza il gas, nonché durante la manutenzione di reti e impianti.
Gas con potere calorifico inferiore a 3500 kcal/nm 3 più spesso utilizzato nell'industria, dove non è necessario trasportarlo su lunghe distanze ed è più facile organizzare l'incenerimento. Per la fornitura di gas urbano, è auspicabile avere un potere calorifico costante del gas. Le fluttuazioni, come abbiamo già stabilito, non sono consentite più del 10%. Una maggiore variazione del potere calorifico del gas richiede un nuovo adeguamento, e talvolta una modifica di un gran numero di bruciatori unificati per elettrodomestici, che è associato a notevoli difficoltà.
Classificazione dei gas combustibili
Per l'approvvigionamento di gas di città e imprese industriali vengono utilizzati vari gas combustibili, diversi per origine, composizione chimica e proprietà fisiche.
Per origine, i gas combustibili si dividono in naturali, o naturali, e artificiali, prodotti da combustibili solidi e liquidi.
I gas naturali vengono estratti da pozzi di giacimenti di puro gas o giacimenti petroliferi insieme al petrolio. I gas dei giacimenti petroliferi sono chiamati gas associati.
I gas dei giacimenti di gas puro sono costituiti principalmente da metano con un piccolo contenuto di idrocarburi pesanti. Sono caratterizzati dalla costanza della composizione e dal potere calorifico.
I gas associati, insieme al metano, contengono una quantità significativa di idrocarburi pesanti (propano e butano). La composizione e il potere calorifico di questi gas variano ampiamente.
I gas artificiali sono prodotti in speciali impianti di gas - o ottenuti come sottoprodotto dalla combustione del carbone negli impianti metallurgici, nonché nelle raffinerie di petrolio.
I gas prodotti dal carbone sono utilizzati nel nostro Paese per l'approvvigionamento di gas urbano in quantità molto limitate e il loro peso specifico è in costante diminuzione. Allo stesso tempo, cresce la produzione e il consumo di gas idrocarburici liquefatti, ottenuti dai gas di petrolio associati negli impianti di gas-benzina e nelle raffinerie di petrolio durante la raffinazione del petrolio. I gas di idrocarburi liquidi utilizzati per l'approvvigionamento di gas urbano sono costituiti principalmente da propano e butano.
Composizione dei gas
Il tipo di gas e la sua composizione predeterminano in gran parte la portata del gas, lo schema e i diametri della rete del gas, le soluzioni di progettazione per bruciatori a gas e singole unità di gasdotti.
Il consumo di gas dipende dal potere calorifico, e quindi dai diametri dei gasdotti e dalle condizioni per la combustione del gas. Quando si utilizza il gas negli impianti industriali, la temperatura di combustione e la velocità di propagazione della fiamma e la costanza della composizione del gas combustibile sono di grande importanza.La composizione dei gas, nonché le loro proprietà fisico-chimiche, dipendono principalmente dal tipo e dal metodo di ottenimento gas.
I gas combustibili sono miscele meccaniche di vari gas<как горючих, так и негорючих.
La parte combustibile del combustibile gassoso comprende: idrogeno (H 2) - un gas senza colore, sapore e odore, il suo potere calorifico inferiore è 2579 kcal/nm 3 \ metano (CH 4) - un gas incolore, insapore e inodore, è la principale parte combustibile dei gas naturali, il suo potere calorifico inferiore è 8555 kcal/nm 3; monossido di carbonio (CO) - un gas incolore, insapore e inodore, ottenuto dalla combustione incompleta di qualsiasi combustibile, molto tossico, potere calorifico inferiore 3018 kcal/nm 3; idrocarburi pesanti (C p N t), Con questo nome<и формулой обозначается целый ряд углеводородов (этан - С2Н 6 , пропан - С 3 Нв, бутан- С4Н 10 и др.), низшая теплотворная способность этих газов колеблется от 15226 до 34890 kcal/nm*.
La parte non combustibile del combustibile gassoso comprende: anidride carbonica (CO 2), ossigeno (O 2) e azoto (N 2).
La parte non combustibile dei gas è chiamata zavorra. I gas naturali sono caratterizzati da un elevato potere calorifico e dalla completa assenza di monossido di carbonio. Allo stesso tempo, un certo numero di giacimenti, principalmente gas e petrolio, contengono un gas molto tossico (e corrosivo) - acido solfidrico (H 2 S). La maggior parte dei gas di carbone artificiale contiene una quantità significativa di gas altamente tossico - monossido di carbonio (CO ).La presenza di ossido nel carbonio del gas e di altre sostanze tossiche è altamente indesiderabile, poiché complicano la produzione del lavoro operativo e aumentano il pericolo quando si utilizza il gas.Oltre ai componenti principali, la composizione dei gas comprende varie impurità, il il cui valore specifico è trascurabile in termini percentuali. Tuttavia, dato che migliaia e anche milioni di metri cubi di gas, la quantità totale di impurità raggiunge un valore significativo. Molte impurità cadono nei gasdotti, il che alla fine porta ad una diminuzione della loro portata, e talvolta ad una completa cessazione del flusso di gas. Pertanto, la presenza di impurità nel gas deve essere presa in considerazione sia nella progettazione dei gasdotti, così come durante il funzionamento.
La quantità e la composizione delle impurità dipendono dal metodo di produzione o estrazione del gas e dal grado della sua purificazione. Le impurità più dannose sono polvere, catrame, naftalene, umidità e composti di zolfo.
La polvere appare nel gas durante la produzione (estrazione) o durante il trasporto del gas attraverso condotte. La resina è un prodotto della decomposizione termica del carburante e accompagna molti gas artificiali. In presenza di polvere nel gas, la resina contribuisce alla formazione di tappi di fango e catrame e di intasamenti nei gasdotti.
Il naftalene si trova comunemente nei gas di carbone artificiale. A basse temperature, il naftalene precipita nei tubi e, insieme ad altre impurità solide e liquide, riduce l'area di flusso dei gasdotti.
L'umidità sotto forma di vapori è contenuta in quasi tutti i gas naturali e artificiali. Entra nei gas naturali nel giacimento stesso a causa dei contatti dei gas con la superficie dell'acqua e i gas artificiali sono saturi di acqua durante il processo di produzione.La presenza di umidità nel gas in quantità significative è indesiderabile, poiché riduce il potere calorifico valore del gas.Inoltre, ha un'elevata capacità termica di vaporizzazione, l'umidità durante la combustione del gas porta via una quantità significativa di calore insieme ai prodotti della combustione nell'atmosfera.Anche un alto contenuto di umidità nel gas è indesiderabile perché, condensando quando il gas il gas viene raffreddato nel "carico del suo movimento attraverso i tubi, può creare tappi d'acqua nel gasdotto (nei punti inferiori) da eliminare. Ciò richiede l'installazione di speciali collettori di condensa e il loro pompaggio.
I composti di zolfo, come già notato, includono acido solfidrico, nonché disolfuro di carbonio, mercaptano, ecc. Questi composti non solo influiscono negativamente sulla salute umana, ma causano anche una significativa corrosione dei tubi.
Altre impurità nocive includono ammoniaca e composti di cianuro, che si trovano principalmente nei gas di carbone. La presenza di composti di ammoniaca e cianuro porta ad una maggiore corrosione del tubo metallico.
Anche la presenza di anidride carbonica e azoto nei gas combustibili è indesiderabile. Questi gas non partecipano al processo di combustione, essendo una zavorra che riduce il potere calorifico, il che porta ad un aumento del diametro dei gasdotti e ad una diminuzione dell'efficienza economica dell'utilizzo del combustibile gassoso.
La composizione dei gas utilizzati per l'approvvigionamento di gas urbano deve soddisfare i requisiti di GOST 6542-50 (Tabella 1).
Tabella 1
I valori medi della composizione dei gas naturali dei giacimenti più famosi del Paese sono presentati in Tabella. 2.
Da giacimenti di gas (secco)
| Ucraina occidentale. . . | 81,2 | 7,5 | 4,5 | 3,7 | 2,5 | - . | 0,1 | 0,5 | 0,735 | |
| Shebelinskoe ................................ | 92,9 | 4,5 | 0,8 | 0,6 | 0,6 | ____ . | 0,1 | 0,5 | 0,603 | |
| Regione di Stavropol. . | 98,6 | 0,4 | 0,14 | 0,06 | - | 0,1 | 0,7 | 0,561 | ||
| Regione di Krasnodar. . | 92,9 | 0,5 | - | 0,5 | _ | 0,01 | 0,09 | 0,595 | ||
| Saratov ............................. | 93,4 | 2,1 | 0,8 | 0,4 | 0,3 | Impronte | 0,3 | 2,7 | 0,576 | |
| Gazli, regione di Bukhara | 96,7 | 0,35 | 0,4" | 0,1 | 0,45 | 0,575 | ||||
| Da giacimenti di petrolio e gas (associati) | ||||||||||
| Romashkino ............................. | 18,5 | 6,2 | 4,7 | 0,1 | 11,5 | 1,07 | ||||
| 7,4 | 4,6 | ____ | Impronte | 1,112 | __ . | |||||
| Tuymazy ............................. | 18,4 | 6,8 | 4,6 | ____ | 0,1 | 7,1 | 1,062 | - | ||
| Ashy....... | 23,5 | 9,3 | 3,5 | ____ | 0,2 | 4,5 | 1,132 | - | ||
| Grassetto.......... ............................. . | 2,5 | . ___ . | 1,5 | 0,721 | - | |||||
| Syzran-olio ............................. | 31,9 | 23,9 - | 5,9 | 2,7 | 0,8 | 1,7 | 1,6 | 31,5 | 0,932 | - |
| Ishimbay ............................. | 42,4 | 20,5 | 7,2 | 3,1 | 2,8 | 1,040 | _ | |||
| Andijan. ............................. | 66,5 | 16,6 | 9,4 | 3,1 | 3,1 | 0,03 | 0,2 | 4,17 | 0,801 ; | |
Potere calorifico dei gas
La quantità di calore rilasciata durante la combustione completa di una quantità unitaria di combustibile è chiamata potere calorifico (Q) o, come viene talvolta chiamato, potere calorifico, o potere calorifico, che è una delle principali caratteristiche del combustibile.
Il potere calorifico dei gas è generalmente indicato come 1 m 3, assunto in condizioni normali.
Nei calcoli tecnici per condizioni normali si intende lo stato del gas ad una temperatura pari a 0°C, e, ad una pressione di 760°C mmHg Arte. Viene indicato il volume di gas in queste condizioni nm 3(normale metro cubo).
Per le misurazioni di gas industriali secondo GOST 2923-45, la temperatura di 20 ° C e la pressione di 760 sono considerate condizioni normali mmHg Arte. Il volume di gas riferito a queste condizioni, in contrasto con nm 3 chiameremo m 3 (metro cubo).
Potere calorifico dei gas (Q)) espresso in kcal/nm e o dentro kcal/m3.
Per i gas liquefatti il potere calorifico è riferito a 1 kg.
Ci sono potere calorifico superiore (Q in) e inferiore (Q n). Il potere calorifico lordo tiene conto del calore di condensazione del vapore acqueo formatosi durante la combustione del combustibile. Il potere calorifico netto non tiene conto del calore contenuto nel vapore acqueo dei prodotti della combustione, poiché il vapore acqueo non condensa, ma viene portato via con i prodotti della combustione.
I concetti Q in e Q n si applicano solo a quei gas, durante la cui combustione viene rilasciato vapore acqueo (questi concetti non si applicano al monossido di carbonio, che non cede vapore acqueo durante la combustione).
Quando il vapore acqueo condensa, viene rilasciato calore pari a 539 kcal/kg. Inoltre, quando la condensa viene raffreddata a 0°C (o 20°C), viene rilasciato calore, rispettivamente, nella quantità di 100 o 80 kcal/kg.
In totale, a causa della condensazione del vapore acqueo, il calore viene rilasciato più di 600 kcal/kg, che è la differenza tra il potere calorifico lordo e netto del gas. Per la maggior parte dei gas utilizzati nella fornitura di gas urbano, questa differenza è dell'8-10%.
I valori del potere calorifico di alcuni gas sono riportati in tabella. 3.
Per l'approvvigionamento di gas urbano si utilizzano attualmente gas che, di norma, hanno un potere calorifico di almeno 3500 kcal/nm 3. Ciò è spiegato dal fatto che nelle condizioni delle città il gas viene fornito attraverso tubazioni a distanze considerevoli. Con un basso potere calorifico, è necessario fornire una grande quantità. Ciò porta inevitabilmente ad un aumento dei diametri dei gasdotti e, di conseguenza, ad un aumento degli investimenti in metallo e dei fondi per la realizzazione delle reti gas, e, successivamente, ad un aumento dei costi di esercizio. Uno svantaggio significativo dei gas a basso contenuto calorico è che nella maggior parte dei casi contengono una quantità significativa di monossido di carbonio, che aumenta il pericolo quando si utilizza il gas, nonché durante la manutenzione di reti e impianti.
Gas con potere calorifico inferiore a 3500 kcal/nm 3 più spesso utilizzato nell'industria, dove non è necessario trasportarlo su lunghe distanze ed è più facile organizzare l'incenerimento. Per la fornitura di gas urbano, è auspicabile avere un potere calorifico costante del gas. Le fluttuazioni, come abbiamo già stabilito, non sono consentite più del 10%. Una maggiore variazione del potere calorifico del gas richiede un nuovo adeguamento, e talvolta una modifica di un gran numero di bruciatori unificati per elettrodomestici, che è associato a notevoli difficoltà.
Il calore di combustione è determinato dalla composizione chimica della sostanza combustibile. Gli elementi chimici contenuti nella sostanza combustibile sono indicati dai simboli accettati CON , h , o , n , S, e cenere e acqua sono simboli UN e w rispettivamente.
YouTube enciclopedico
-
1 / 5
Il calore di combustione può essere correlato alla massa di lavoro del combustibile Q P (\ displaystyle Q ^ (P)), cioè ad una sostanza combustibile nella forma in cui entra nel consumatore; alla materia secca Q C (\ displaystyle Q ^ (C)); alla massa combustibile della materia Q Γ (\ displaystyle Q ^ (\ Gamma )), cioè a una sostanza combustibile che non contiene umidità e cenere.
Distinguere più in alto ( Q B (\ displaystyle Q_ (B))) e inferiore ( Q H (\ displaystyle Q_ (H))) calore di combustione.
Sotto potere calorifico superiore comprendere la quantità di calore che viene rilasciata durante la combustione completa di una sostanza, compreso il calore di condensazione del vapore acqueo durante il raffreddamento dei prodotti della combustione.
Potere calorifico netto corrisponde alla quantità di calore che si sprigiona durante la combustione completa, senza tener conto del calore di condensazione del vapore acqueo. Viene anche chiamato il calore di condensazione del vapore acqueo calore latente di vaporizzazione (condensazione).
Il potere calorifico inferiore e superiore sono legati dal rapporto: Q B = Q H + k (L + 9 H) (\ displaystyle Q_ (B) = Q_ (H) + k (L + 9 H)),
dove k è un coefficiente pari a 25 kJ/kg (6 kcal/kg); W - la quantità di acqua nella sostanza combustibile,% (in peso); H è la quantità di idrogeno nella sostanza combustibile, % (in massa).
Calcolo del calore di combustione
Pertanto, il potere calorifico più elevato è la quantità di calore rilasciata durante la combustione completa di un'unità di massa o volume (per gas) di una sostanza combustibile e il raffreddamento dei prodotti della combustione alla temperatura del punto di rugiada. Nei calcoli dell'ingegneria del calore, il potere calorifico lordo è preso come 100%. Il calore latente di combustione dei gas è il calore che si sprigiona durante la condensazione del vapore acqueo contenuto nei prodotti della combustione. In teoria, può raggiungere l'11%.
In pratica non è possibile raffreddare i prodotti della combustione fino a completa condensazione, e quindi viene introdotto il concetto di potere calorifico netto (QHp), che si ottiene sottraendo al potere calorifico superiore il calore di vaporizzazione del vapore acqueo entrambi contenuti in la sostanza e si è formata durante la sua combustione. 2514 kJ/kg (600 kcal/kg) vengono spesi per la vaporizzazione di 1 kg di vapore acqueo. Il potere calorifico netto è determinato dalle formule (kJ/kg o kcal/kg):
QHP = QBP - 2514 ⋅ ((9 HP + WP) / 100) (\displaystyle Q_(H)^(P)=Q_(B)^(P)-2514\cdot ((9H^(P)+W^ (P))/100))(per solido)
QHP = QBP - 600 ⋅ ((9 HP + WP) / 100) (\ displaystyle Q_(H)^(P)=Q_(B)^(P)-600\cdot ((9H^(P)+W^ (P))/100))(per una sostanza liquida), dove:
2514 - calore di vaporizzazione a 0 °C e pressione atmosferica, kJ/kg;
HP (\ displaystyle H ^ (P)) e WP (\ displaystyle W ^ (P))- il contenuto di idrogeno e vapore acqueo nel combustibile di lavoro,%;
9 - coefficiente che mostra che quando 1 kg di idrogeno viene bruciato in combinazione con ossigeno, si formano 9 kg di acqua.
Il potere calorifico è la caratteristica più importante di un combustibile, in quanto determina la quantità di calore ottenuta bruciando 1 kg di combustibile solido o liquido o 1 m³ di combustibile gassoso in kJ/kg (kcal/kg). 1 kcal = 4,1868 o 4,19 kJ.
Il potere calorifico netto è determinato sperimentalmente per ciascuna sostanza ed è un valore di riferimento. Può anche essere determinato per materiali solidi e liquidi, con una composizione elementare nota, mediante calcolo secondo la formula di D. I. Mendeleev, kJ / kg o kcal / kg:
QHP = 339 ⋅ CP + 1256 ⋅ HP - 109 ⋅ (OP - SLP) - 25,14 ⋅ (9 ⋅ HP + WP) (\ displaystyle Q_(H)^(P)=339\cdot C^(P)+1256\ cpunto H^(P)-109\cpunto (O^(P)-S_(L)^(P))-25.14\cpunto (9\cpunto H^(P)+W^(P)))
QHP = 81 ⋅ CP + 246 ⋅ HP - 26 ⋅ (OP + SLP) - 6 ⋅ WP (\ displaystyle Q_(H)^(P)=81\cdot C^(P)+246\cdot H^(P) -26\cpunto (O^(P)+S_(L)^(P))-6\cpunto W^(P)), dove:
CP (\ displaystyle C_ (P)), HP (\ displaystyle H_ (P)), O P (\ displaystyle O_ (P)), SL P (\ displaystyle S_ (L) ^ (P)), WP (\ displaystyle W_ (P))- il contenuto di carbonio, idrogeno, ossigeno, zolfo volatile e umidità nella massa di lavoro del carburante in % (in massa).
Per i calcoli comparativi viene utilizzato il cosiddetto Combustibile Convenzionale, che ha un calore specifico di combustione pari a 29308 kJ/kg (7000 kcal/kg).
In Russia, i calcoli termici (ad esempio, il calcolo del carico termico per determinare la categoria di una stanza per il rischio di esplosione e incendio) vengono solitamente eseguiti in base al potere calorifico più basso, negli Stati Uniti, in Gran Bretagna, in Francia - in base al più alto . Nel Regno Unito e negli Stati Uniti, prima dell'introduzione del sistema metrico, i valori termici specifici venivano misurati in unità termiche britanniche (BTU) per libbra (lb) (1Btu/lb = 2,326 kJ/kg).
Sostanze e materiali Potere calorifico netto Q H P (\ displaystyle Q_ (H) ^ (P)), MJ/kg Benzina 41,87 Cherosene 43,54 Carta: libri, riviste 13,4 Legno (barre W = 14%) 13,8 Gomma naturale 44,73 Linoleum di cloruro di polivinile 14,31 Gomma 33,52 Fibra in fiocco 13,8 Polietilene 47,14 polistirolo 41,6 Cotone allentato 15,7 Plastica 41,87 Le tabelle presentano il calore specifico di massa della combustione del combustibile (liquido, solido e gassoso) e di alcuni altri materiali combustibili. Sono considerati combustibili come: carbone, legna da ardere, coke, torba, cherosene, petrolio, alcol, benzina, gas naturale, ecc.
Elenco delle tabelle:
In una reazione di ossidazione esotermica del combustibile, la sua energia chimica viene convertita in energia termica con il rilascio di una certa quantità di calore. L'energia termica risultante è chiamata calore di combustione del combustibile. Dipende dalla sua composizione chimica, dall'umidità ed è il principale. Il potere calorifico del combustibile, riferito a 1 kg di massa o 1 m 3 di volume, costituisce il potere calorifico specifico di massa o volumetrico.
Il calore specifico di combustione del combustibile è la quantità di calore rilasciata durante la combustione completa di un'unità di massa o volume di combustibile solido, liquido o gassoso. Nel Sistema internazionale di unità, questo valore è misurato in J / kg o J / m 3.
Il calore specifico di combustione di un combustibile può essere determinato sperimentalmente o calcolato analiticamente. I metodi sperimentali per determinare il potere calorifico si basano sulla misurazione pratica della quantità di calore rilasciata durante la combustione del combustibile, ad esempio in un calorimetro con un termostato e una bomba a combustione. Per un combustibile con una composizione chimica nota, il calore specifico di combustione può essere determinato dalla formula di Mendeleev.
Ci sono calori specifici di combustione superiori e inferiori. Il potere calorifico lordo è pari alla massima quantità di calore rilasciata durante la combustione completa del combustibile, tenendo conto del calore speso per l'evaporazione dell'umidità contenuta nel combustibile. Il potere calorifico inferiore è inferiore al valore superiore del valore del calore di condensazione, che è formato dall'umidità del combustibile e dall'idrogeno della massa organica, che si trasforma in acqua durante la combustione.
Per determinare gli indicatori di qualità del carburante, nonché nei calcoli di ingegneria del calore di solito usa il calore specifico di combustione più basso, che è la caratteristica termica e operativa più importante del combustibile ed è riportata nelle tabelle seguenti.
Calore specifico di combustione di combustibili solidi (carbone, legna da ardere, torba, coke)
La tabella riporta i valori del calore specifico di combustione del combustibile solido secco nell'unità di MJ/kg. Il carburante nella tabella è ordinato per nome in ordine alfabetico.
Tra i combustibili solidi considerati, il carbone da coke ha il potere calorifico più alto: il suo calore specifico di combustione è 36,3 MJ/kg (o 36,3·10 6 J/kg nelle unità SI). Inoltre, l'alto potere calorifico è caratteristico di carbone, antracite, carbone e lignite.
I combustibili a bassa efficienza energetica includono legno, legna da ardere, polvere da sparo, freztorf, scisti bituminosi. Ad esempio, il calore specifico della combustione della legna da ardere è 8,4 ... 12,5 e la polvere da sparo - solo 3,8 MJ / kg.
Calore specifico di combustione di combustibili solidi (carbone, legna da ardere, torba, coke)
Carburante Antracite 26,8…34,8 Pellet di legno (pallet) 18,5 Legna da ardere secca 8,4…11 Legna da ardere di betulla secca 12,5 coca cola 26,9 coke d'altoforno 30,4 semi-coca cola 27,3 Polvere 3,8 Ardesia 4,6…9 Scisto bituminoso 5,9…15 Propellente solido 4,2…10,5 Torba 16,3 torba fibrosa 21,8 Macinazione della torba 8,1…10,5 Briciola di torba 10,8 Carbone marrone 13…25 Lignite (bricchette) 20,2 Lignite (polvere) 25 carbone di Donetsk 19,7…24 Carbone 31,5…34,4 Carbone 27 Carbone da coke 36,3 carbone di Kuznetsk 22,8…25,1 carbone di Chelyabinsk 12,8 Ekibastuz carbone 16,7 freztorf 8,1 scorie 27,5 Calore specifico di combustione di combustibili liquidi (alcool, benzina, cherosene, olio)
Viene fornita la tabella del calore specifico di combustione del combustibile liquido e di alcuni altri liquidi organici. Va notato che combustibili come benzina, gasolio e olio sono caratterizzati da un elevato rilascio di calore durante la combustione.
Il calore specifico di combustione di alcol e acetone è notevolmente inferiore rispetto ai tradizionali carburanti per motori. Inoltre, il propellente liquido ha un potere calorifico relativamente basso e, con la combustione completa di 1 kg di questi idrocarburi, verrà rilasciata una quantità di calore pari rispettivamente a 9,2 e 13,3 MJ.
Calore specifico di combustione di combustibili liquidi (alcool, benzina, cherosene, olio)
Carburante Calore specifico di combustione, MJ/kg Acetone 31,4 Benzina A-72 (GOST 2084-67) 44,2 Benzina per aviazione B-70 (GOST 1012-72) 44,1 Benzina AI-93 (GOST 2084-67) 43,6 Benzene 40,6 Gasolio invernale (GOST 305-73) 43,6 Gasolio estivo (GOST 305-73) 43,4 Propellente liquido (cherosene + ossigeno liquido) 9,2 Cherosene per aviazione 42,9 Cherosene per illuminazione (GOST 4753-68) 43,7 xilene 43,2 Olio combustibile ad alto contenuto di zolfo 39 Olio combustibile a basso contenuto di zolfo 40,5 Olio combustibile a basso contenuto di zolfo 41,7 Olio combustibile solforoso 39,6 Alcool metilico (metanolo) 21,1 Alcool n-butilico 36,8 Olio 43,5…46 Olio metano 21,5 Toluene 40,9 Spirito bianco (GOST 313452) 44 glicole etilenico 13,3 Alcool etilico (etanolo) 30,6 Calore specifico di combustione di combustibili gassosi e gas combustibili
Viene presentata una tabella del calore specifico di combustione del combustibile gassoso e di alcuni altri gas combustibili nella dimensione di MJ/kg. Tra i gas considerati, il più grande calore specifico di combustione di massa differisce. Con la combustione completa di un chilogrammo di questo gas, verranno rilasciati 119,83 MJ di calore. Inoltre, un combustibile come il gas naturale ha un alto potere calorifico: il calore specifico della combustione del gas naturale è 41 ... 49 MJ / kg (per 50 MJ / kg puri).
Calore specifico di combustione di combustibili gassosi e gas combustibili (idrogeno, gas naturale, metano)
Carburante Calore specifico di combustione, MJ/kg 1-butene 45,3 Ammoniaca 18,6 Acetilene 48,3 Idrogeno 119,83 Idrogeno, miscela con metano (50% H 2 e 50% CH 4 in massa) 85 Idrogeno, miscela con metano e monossido di carbonio (33-33-33% in peso) 60 Idrogeno, miscela con monossido di carbonio (50% H 2 50% CO 2 in massa) 65 Gas d'altoforno 3 cokeria a gas 38,5 Gas di idrocarburi liquefatti GPL (propano-butano) 43,8 isobutano 45,6 Metano 50 n-butano 45,7 n-esano 45,1 n-pentano 45,4 Gas associato 40,6…43 Gas naturale 41…49 Propadien 46,3 Propano 46,3 propilene 45,8 Propilene, miscela con idrogeno e monossido di carbonio (90%-9%-1% in peso) 52 Etano 47,5 Etilene 47,2 Calore specifico di combustione di alcuni materiali combustibili
Viene data una tabella del calore specifico di combustione di alcuni materiali combustibili (, legno, carta, plastica, paglia, gomma, ecc.). Va notato materiali con elevato rilascio di calore durante la combustione. Tali materiali includono: gomma di vario tipo, polistirene espanso (polistirene), polipropilene e polietilene.
Calore specifico di combustione di alcuni materiali combustibili
Carburante Calore specifico di combustione, MJ/kg Carta 17,6 Similpelle 21,5 Legno (barre con un contenuto di umidità del 14%) 13,8 Legna in cataste 16,6 legno di quercia 19,9 Legno di abete rosso 20,3 verde legno 6,3 Legno di pino 20,9 Kapron 31,1 Prodotti in carbolite 26,9 Cartone 16,5 Gomma stirene-butadiene SKS-30AR 43,9 Gomma naturale 44,8 Gomma sintetica 40,2 Gomma SCS 43,9 Gomma cloroprenica 28 Linoleum di cloruro di polivinile 14,3 Linoleum di polivinilcloruro a due strati 17,9 Linoleum polivinilcloruro a base di feltro 16,6 Linoleum cloruro di polivinile a caldo 17,6 Linoleum polivinilcloruro a base di tessuto 20,3 Gomma linoleum (relin) 27,2 Solido di paraffina 11,2 Poliespanso PVC-1 19,5 Polischiuma FS-7 24,4 Polischiuma FF 31,4 Polistirene espanso PSB-S 41,6 schiuma poliuretanica 24,3 cartone di fibra 20,9 Cloruro di polivinile (PVC) 20,7 policarbonato 31 Polipropilene 45,7 Polistirolo 39 Polietilene ad alta densità 47 Polietilene a bassa pressione 46,7 Gomma 33,5 Ruberoid 29,5 Canale di fuliggine 28,3 Fieno 16,7 Cannuccia 17 Vetro organico (plexiglass) 27,7 Textolite 20,9 Toll 16 TNT 15 cotone 17,5 Cellulosa 16,4 Lana e fibre di lana 23,1 Fonti:
- GOST 147-2013 Combustibile minerale solido. Determinazione del potere calorifico superiore e calcolo del potere calorifico inferiore.
- GOST 21261-91 Prodotti petroliferi. Metodo per la determinazione del potere calorifico lordo e il calcolo del potere calorifico netto.
- GOST 22667-82 Gas naturali combustibili. Metodo di calcolo per la determinazione del potere calorifico, della densità relativa e del numero di Wobbe.
- GOST 31369-2008 Gas naturale. Calcolo del potere calorifico, della densità, della densità relativa e del numero di Wobbe in base alla composizione dei componenti.
- Zemsky G. T. Proprietà infiammabili dei materiali inorganici e organici: libro di riferimento M.: VNIIPO, 2016 - 970 p.
Il gas combustibile è diviso in naturale e artificiale ed è una miscela di gas combustibili e non combustibili contenente una certa quantità di vapore acqueo e talvolta polvere e catrame. La quantità di combustibile gassoso è espressa in metri cubi in condizioni normali (760 mm Hg e 0 ° C) e la composizione è espressa in percentuale in volume. Sotto la composizione del carburante si intende la composizione della sua parte gassosa secca.
combustibile a gas naturale
Il gas combustibile più comune è il gas naturale, che ha un alto potere calorifico. La base del gas naturale è il metano, il cui contenuto è del 76,7-98%. Altri composti di idrocarburi gassosi fanno parte del gas naturale dallo 0,1 al 4,5%.
Il gas liquefatto è un prodotto della raffinazione del petrolio: consiste principalmente in una miscela di propano e butano.
Gas naturale (GNC, NG): metano CH4 superiore al 90%, etano C2 H5 inferiore al 4%, propano C3 H8 inferiore all'1%
Gas liquefatto (GPL): propano C3 H8 superiore al 65%, butano C4 H10 inferiore al 35%
I gas combustibili includono: idrogeno H 2, metano CH 4, altri composti idrocarburici C m H n, idrogeno solforato H 2 S e gas non combustibili, anidride carbonica CO2, ossigeno O 2, azoto N 2 e una piccola quantità di vapore acqueo H 2 O. Indici m e P a C e H caratterizzare composti di vari idrocarburi, ad esempio per il metano CH 4 t = 1 e n= 4, per l'etano С 2 Н b t = 2 e n= b ecc.
Composizione del combustibile gassoso secco (in percentuale in volume):
CO + H 2 + 2 C m H n + H 2 S + CO 2 + O 2 + N 2 = 100%.La parte non combustibile del combustibile gassoso secco - zavorra - è azoto N e anidride carbonica CO 2 .
La composizione del combustibile gassoso umido è espressa come segue:
CO + H 2 + Σ C m H n + H 2 S + CO 2 + O 2 + N 2 + H 2 O \u003d 100%.
Il calore di combustione, kJ / m (kcal / m 3), 1 m 3 di gas secco puro in condizioni normali è determinato come segue:
Q n s \u003d 0,01,
dove Qco, Q n 2 , Q con m n n Q n 2 S. - calore di combustione dei singoli gas che compongono la miscela, kJ/m 3 (kcal/m 3); CO, H2, Cm H n , H 2 S - componenti che compongono la miscela di gas, % in volume.
Il calore di combustione di 1 m3 di gas naturale secco in condizioni normali per la maggior parte dei campi domestici è 33,29 - 35,87 MJ / m3 (7946 - 8560 kcal / m3). Le caratteristiche del combustibile gassoso sono riportate nella tabella 1.
Esempio. Determinare il potere calorifico netto del gas naturale (in condizioni normali) della seguente composizione:
H 2 S = 1%; CH 4 = 76,7%; C 2 H 6 = 4,5%; C 3 H 8 = 1,7%; C 4 H 10 = 0,8%; C 5 H 12 = 0,6%.
Sostituendo nella formula (26) le caratteristiche dei gas della tabella 1, si ottiene:
Q ns \u003d 0,01 \u003d 33981 kJ / m 3 o
Q ns \u003d 0,01 (5585,1 + 8555 76,7 + 15 226 4,5 + 21 795 1,7 + 28 338 0,8 + 34 890 0,6) \u003d 8109 kcal / m 3.
Tabella 1. Caratteristiche del combustibile gassoso
Gas
Designazione
Calore di combustione Q n s
KJ/m3
kcal/m3
Idrogeno H, 10820 2579 monossido di carbonio COSÌ 12640 3018 idrogeno solforato H 2 S 23450 5585 Metano CH 4 35850 8555 Etano C 2 H 6 63 850 15226 Propano C 3 H 8 91300 21795 Butano C 4 H 10 118700 22338 Pentano C 5 H 12 146200 34890 Etilene C 2 H 4 59200 14107 propilene C 3 H 6 85980 20541 Butilene C 4 H 8 113 400 27111 Benzene C 6 H 6 140400 33528 Le caldaie del tipo DE consumano da 71 a 75 m3 di gas naturale per produrre una tonnellata di vapore. Il costo del gas in Russia nel settembre 2008 è di 2,44 rubli per metro cubo. Di conseguenza, una tonnellata di vapore costerà 71 × 2,44 = 173 rubli 24 copechi. Il costo reale di una tonnellata di vapore nelle fabbriche è di almeno 189 rubli per tonnellata di vapore per le caldaie DE.
Le caldaie del tipo DKVR consumano da 103 a 118 m3 di gas naturale per produrre una tonnellata di vapore. Il costo minimo stimato di una tonnellata di vapore per queste caldaie è 103 × 2,44 = 251 rubli 32 copechi. Il costo reale del vapore per le piante è di almeno 290 rubli per tonnellata.
Come calcolare il consumo massimo di gas naturale per una caldaia a vapore DE-25? Questa è la specifica della caldaia. 1840 cubi all'ora. Ma puoi anche calcolare. 25 tonnellate (25mila kg) vanno moltiplicate per la differenza tra le entalpie del vapore e dell'acqua (666,9-105) e tutto questo diviso per il rendimento della caldaia del 92,8% e il calore di combustione del gas. 8300. e tutto
Combustibile a gas artificiale
I gas combustibili artificiali sono combustibili locali, poiché hanno un potere calorifico molto più basso. I loro principali elementi combustibili sono il monossido di carbonio CO e l'idrogeno H2. Questi gas sono utilizzati nei limiti della produzione dove sono ottenuti come combustibili per impianti tecnologici ed energetici.
Tutti i gas combustibili naturali e artificiali sono esplosivi, in grado di accendersi su fiamme libere o scintille. Esistono limiti di esplosività inferiore e superiore del gas, ad es. le concentrazioni percentuali più alte e più basse nell'aria. Il limite inferiore di esplosività dei gas naturali varia dal 3% al 6%, mentre il limite superiore varia dal 12% al 16%. Tutti i gas combustibili possono causare avvelenamento del corpo umano. Le principali sostanze tossiche dei gas combustibili sono: monossido di carbonio CO, acido solfidrico H2S, ammoniaca NH3.
I gas combustibili naturali, così come quelli artificiali, sono incolori (invisibili), inodori, il che li rende pericolosi quando penetrano all'interno del locale caldaia attraverso perdite nei raccordi dei gasdotti. Per evitare l'avvelenamento, i gas combustibili devono essere trattati con un odorizzante, una sostanza con un odore sgradevole.
Ottenere monossido di carbonio CO nell'industria mediante gassificazione di combustibili solidi
Per scopi industriali, il monossido di carbonio si ottiene per gassificazione del combustibile solido, cioè la sua trasformazione in combustibile gassoso. Quindi puoi ottenere monossido di carbonio da qualsiasi combustibile solido: carbone fossile, torba, legna da ardere, ecc.
Il processo di gassificazione del combustibile solido è mostrato in un esperimento di laboratorio (Fig. 1). Dopo aver riempito il tubo refrattario con pezzi di carbone, lo riscaldiamo fortemente e lasciamo passare l'ossigeno attraverso il gasometro. Lasciar passare i gas che escono dal tubo attraverso una rondella di acqua calcarea e poi dargli fuoco. L'acqua calcarea diventa torbida, il gas brucia con una fiamma bluastra. Ciò indica la presenza di biossido di CO2 e monossido di carbonio CO nei prodotti di reazione.
La formazione di queste sostanze può essere spiegata dal fatto che quando l'ossigeno viene a contatto con il carbone ardente, quest'ultimo viene prima ossidato in anidride carbonica: C + O 2 \u003d CO 2
Quindi, passando attraverso il carbone caldo, l'anidride carbonica viene da essa parzialmente ridotta a monossido di carbonio: CO 2 + C \u003d 2CO
Riso. 1. Ottenere monossido di carbonio (esperienza di laboratorio).
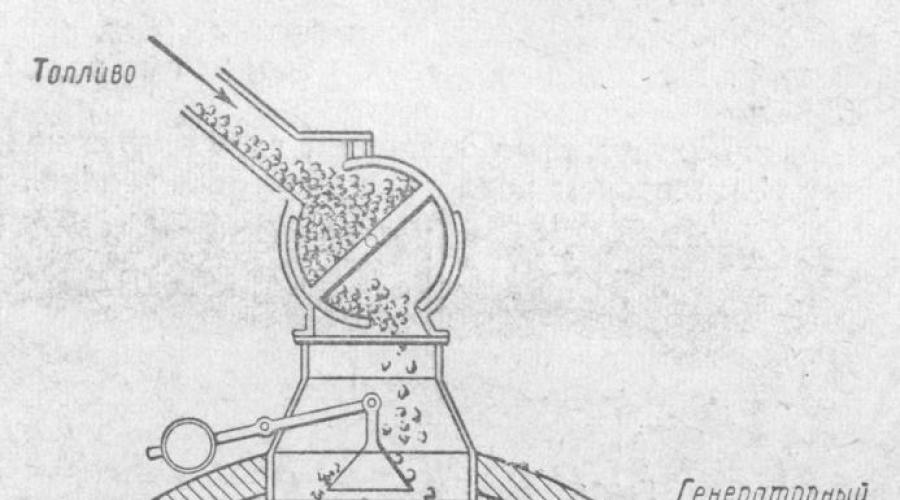
In condizioni industriali, la gassificazione dei combustibili solidi viene effettuata in forni detti generatori di gas.
La miscela di gas risultante è chiamata gas produttore.
Il dispositivo generatore di gas è mostrato in figura. Si tratta di un cilindro in acciaio con un'altezza di circa 5 m e un diametro di circa 3,5 m, rivestito internamente con mattoni refrattari. Dall'alto, il generatore di gas viene caricato di carburante; Dal basso, l'aria o il vapore acqueo viene fornito da un ventilatore attraverso la griglia.
L'ossigeno nell'aria reagisce con il carbonio del carburante, formando anidride carbonica che, salendo attraverso uno strato di carburante caldo, viene ridotta dal carbonio in monossido di carbonio.
Se nel generatore viene soffiata solo aria, si ottiene un gas che nella sua composizione contiene monossido di carbonio e azoto dell'aria (oltre a una certa quantità di CO 2 e altre impurità). Questo gas generatore è chiamato gas d'aria.
Se, tuttavia, il vapore acqueo viene soffiato nel generatore con carbone caldo, si formano monossido di carbonio e idrogeno come risultato della reazione: C + H 2 O \u003d CO + H 2
Questa miscela di gas è chiamata gas d'acqua. Il gas d'acqua ha un potere calorifico superiore rispetto al gas d'aria, poiché, insieme al monossido di carbonio, contiene anche un secondo gas combustibile: l'idrogeno. Gas d'acqua (gas di sintesi), uno dei prodotti della gassificazione dei combustibili. Il gas d'acqua è costituito principalmente da CO (40%) e H2 (50%). Il gas d'acqua è un combustibile (potere calorifico 10.500 kJ/m3, o 2730 kcal/mg) e allo stesso tempo materia prima per la sintesi del metanolo. Il gas d'acqua, tuttavia, non può essere ottenuto per molto tempo, poiché la reazione della sua formazione è endotermica (con assorbimento di calore), e quindi il combustibile nel generatore si raffredda. Per mantenere caldo il carbone, l'iniezione di vapore acqueo nel generatore è alternata all'iniezione di aria, il cui ossigeno, come è noto, reagisce con il combustibile cedendo calore.
Recentemente, il getto di vapore e ossigeno è stato ampiamente utilizzato per la gassificazione del carburante. Il soffiaggio simultaneo di vapore acqueo e ossigeno attraverso lo strato di combustibile consente di eseguire il processo in modo continuo, aumentare notevolmente la produttività del generatore e ottenere gas con un alto contenuto di idrogeno e monossido di carbonio.
I moderni generatori di gas sono potenti dispositivi ad azione continua.
In modo che quando il carburante viene fornito al generatore di gas, i gas combustibili e tossici non penetrino nell'atmosfera, il tamburo di caricamento viene raddoppiato. Mentre il carburante entra in uno scomparto del tamburo, il carburante viene versato dall'altro scomparto nel generatore; quando il tamburo ruota, questi processi si ripetono, mentre il generatore rimane sempre isolato dall'atmosfera. La distribuzione uniforme del carburante nel generatore viene effettuata utilizzando un cono, che può essere installato a diverse altezze. Quando è abbassato, il carbone si trova più vicino al centro del generatore; quando il cono è sollevato, il carbone viene lanciato più vicino alle pareti del generatore.
La rimozione della cenere dal generatore di gas è meccanizzata. La griglia a forma di cono viene fatta ruotare lentamente da un motore elettrico. In questo caso, la cenere viene spostata sulle pareti del generatore e gettata nel box cenere con appositi dispositivi, da dove viene periodicamente rimossa.
Le prime lampade a gas furono accese a San Pietroburgo sull'isola di Aptekarsky nel 1819. Il gas utilizzato è stato ottenuto dalla gassificazione del carbone. Si chiamava gas leggero.
Il grande scienziato russo D. I. Mendeleev (1834-1907) fu il primo ad esprimere l'idea che la gassificazione del carbone può essere effettuata direttamente sottoterra, senza sollevarlo. Il governo zarista non ha apprezzato la proposta di Mendeleev.
L'idea della gassificazione sotterranea è stata caldamente sostenuta da V. I. Lenin. Lo definì "uno dei grandi trionfi della tecnologia". La gassificazione sotterranea è stata effettuata per la prima volta dallo stato sovietico. Già prima della Grande Guerra Patriottica, i generatori sotterranei operavano nei bacini carboniferi della regione di Donetsk e Mosca nell'Unione Sovietica.
La figura 3 dà un'idea di uno dei metodi di gassificazione sotterranea: nel giacimento di carbone sono posati due pozzi, collegati nella parte inferiore da un canale. Il carbone viene dato alle fiamme in un tale canale vicino a uno dei pozzi e lì viene fornita l'esplosione. I prodotti della combustione, muovendosi lungo il canale, interagiscono con il carbone caldo, determinando la formazione di gas combustibile, come in un generatore convenzionale. Il gas viene in superficie attraverso il secondo pozzo.
Il gas del generatore è ampiamente utilizzato per il riscaldamento di forni industriali - metallurgici, coke e come combustibile nelle automobili (Fig. 4).
Riso. 3. Schema di gassificazione sotterranea del carbone.
Un certo numero di prodotti organici, come i combustibili liquidi, sono sintetizzati dall'idrogeno e dal monossido di carbonio dell'acqua gassosa. Combustibile liquido sintetico - carburante (principalmente benzina), ottenuto per sintesi da monossido di carbonio e idrogeno a 150-170 gradi Celsius e una pressione di 0,7 - 20 MN / m2 (200 kgf / cm2), in presenza di un catalizzatore (nichel, ferro, cobalto). La prima produzione di combustibili liquidi sintetici fu organizzata in Germania durante la seconda guerra mondiale a causa della scarsità di petrolio. I combustibili liquidi sintetici non hanno ricevuto un'ampia distribuzione a causa del loro costo elevato. Il gas d'acqua viene utilizzato per produrre idrogeno. Per fare ciò, l'acqua gassosa in miscela con vapore acqueo viene riscaldata in presenza di un catalizzatore e di conseguenza si ottiene idrogeno in aggiunta a quello già presente nell'acqua gassosa: CO + H 2 O \u003d CO 2 + H 2