Reaktsiyalarning issiqlik ta'sirini hisoblash. Turli haroratlarda kimyoviy reaktsiyalarning issiqlik ta'sirini hisoblash usullari
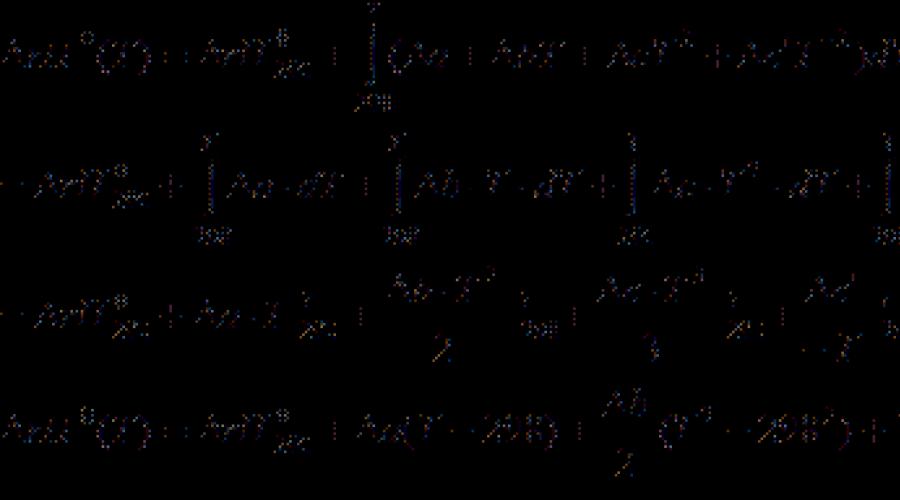
Issiqlik effektlarini hisoblashning barcha usullari intruzoflik tenglamasida integral shaklda joylashgan.
Ko'pincha, 298.15k birinchi harorat sifatida ishlatiladi.
Issiqlik effektlarini hisoblashning barcha usullari tenglamaning o'ng qismida ajralib turadigan usullarga qisqartirildi.
Integral qabul qilish usullari:
I. o'rta issiqlik qopqoqlari. Ushbu usul eng oson va eng aniq. Bunday holda, integratsiony belgisi bo'yicha ibora tanlangan oralig'idagi haroratga bog'liq bo'lmagan o'rtacha issiqlik quvvatining o'zgarishi bilan almashtiriladi.
O'rtacha issiqlik quvvati juda ko'p reaktsiyalar uchun o'lchanadi va o'lchanadi. Ular ma'lumot ma'lumotlarini hisoblash oson.
II. Haqiqiy issiqlik qopqoqlariga ko'ra. (Haroratda satrlar yordamida)
Ushbu usulda, issiqlik quvvati, ichak sig'imi harorat doirasi sifatida yozilgan:

III. Yuqori haroratning yuqori harorat qismlariga ko'ra. Ushbu usul yuqori haroratdagi issiqlik ta'sirini hisoblashda raketa texnologiyasining rivojlanishi bilan keng tarqaldi. Bu Izobar issiqlik quvvati aniqlanishiga asoslanadi:

Atrofning yuqori harorati. Bu ma'lum bir soniyada isitilganda, individual moddaning har qiynoqlari o'zgarishi haqida shunchalik ta'sir ko'rsatadi.
Kimyoviy reaktsiya uchun:

Shunday qilib:
3-ma'ruza.
Ma'ruza rejasi:
1. II termodinamikaning qonuni, ta'rifi, matematik rekord.
2. Termodinamika qonunining II tahlili
3. Ba'zi jarayonlarda entropiyani hisoblash
bu erda va qo'shimcha indekslar i. boshlang'ich moddalar yoki reaktivlar va indekslarga murojaat qiling j.- miqdordagi moddalar yoki reaktsiya mahsulotlari; va boshlang'ich materiallar va reaktsiya mahsulotlari uchun reaktsiya tenglamasida stoichiometrik koeffitsientlar mos ravishda.
Misol:Standart sharoitlarda metanol sintez reaktsiyasining issiqlik ta'sirini hisoblang.
Qaror: Hisob-kitoblar uchun biz moddalar reaktsiyasiga jalb qilingan shaklning standart isishi bo'yicha ma'lumot ma'lumotlaridan foydalanamiz (ma'lumotnomaning 72-sahifasida 44-jadval).
GES qonunining birinchi natijasi bo'yicha (1.15 tenglamasi) standart sharoitlar asosida metanol sintez reaktsiyasining termal ta'siri teng:
Kimyoviy reaktsiyalarning issiqlik ta'sirini hisoblashda, issiqlik effekti reaktentlarning umumiy holatiga va kimyoviy reaktsiyani yozib olish turiga bog'liqligini hisobga olish kerak.
Gessa qonunining ikkinchi natijasi bo'yicha issiqlik ismi yordamida issiqlik effekti hisoblash mumkin D c h.Boshlang'ich materiallar va reaktsiya mahsulotlarining isitmasi issiqligidagi farq (stoichiometrik koeffitsientlarni hisobga olgan holda):
u erda d. R c p. - kimyoviy reaktsiya oqimi natijasida tizimning Izobarik issiqlik sig'imining o'zgarishini tavsiflaydi va reaktsiyaning termal effekti harorat samaradorligi koeffitsienti deb ataladi.
Differentoffechning differentsial tenglamasidan, haroratdagi issiqlik ta'sirining qaramligi Sight Dount tomonidan belgilanadi R c p.. Bu ko'proq, boshlang'ich moddalarning umumiy issiqlik sig'imi yoki reaktsiya mahsulotlarining umumiy hajmining umumiy hajmiga bog'liqligiga bog'liq. Kirlikning differentsial tenglamasini tahlil qilaylik.
1. Agar harorat koeffitsienti bo'lsa R c p.\u003e 0, keyin hosila  \u003e 0 va funktsiya
\u003e 0 va funktsiya  o'sib bormoqda. Binobarin, reaktsiyaning harorat ko'tarilishi bilan issiqlik ta'siri oshadi.
o'sib bormoqda. Binobarin, reaktsiyaning harorat ko'tarilishi bilan issiqlik ta'siri oshadi.
2. Agar harorat koeffitsienti bo'lsa R c p.< 0, то производная  < 0 и функция
< 0 и функция  kamayish pasayishi. Binobarin, reaktsiyaning haroratining oshishi bilan termal ta'sir pasayadi.
kamayish pasayishi. Binobarin, reaktsiyaning haroratining oshishi bilan termal ta'sir pasayadi.
3. Agar harorat koeffitsienti bo'lsa R c p. \u003d 0, keyin hosila  \u003d 0 I.
\u003d 0 I.  . Shunday qilib, reaktsiyaning issiqlik ta'siri haroratga bog'liq emas. Bu holat amalda sodir bo'lmaydi.
. Shunday qilib, reaktsiyaning issiqlik ta'siri haroratga bog'liq emas. Bu holat amalda sodir bo'lmaydi.
Tahlil qilish uchun differentsial tenglamalar qulay, ammo hisob-kitoblar uchun noqulay. Kimyoviy reaktsiyaning issiqlik ta'sirini hisoblash uchun, o'zgaruvchini ajratib turadigan Kirchhoffning differentsial tenglamasini kesib o'tish uchun:


Moddalarning issiqlik quvvati haroratga bog'liq va  . Biroq, kimyoviy va texnologik jarayonlarda odatda qo'llaniladigan harorat mintaqada bu qaram muhim emas. Amaliy maqsadlar uchun 298 ta haroratgacha harorat oralig'ida qo'llaniladi.
. Biroq, kimyoviy va texnologik jarayonlarda odatda qo'llaniladigan harorat mintaqada bu qaram muhim emas. Amaliy maqsadlar uchun 298 ta haroratgacha harorat oralig'ida qo'llaniladi.  ma'lumotnomalarda berilgan. Termal effektning harorat koeffitsienti o'rtacha issiqlik quvvati yordamida hisoblangan:
ma'lumotnomalarda berilgan. Termal effektning harorat koeffitsienti o'rtacha issiqlik quvvati yordamida hisoblangan:
Misol:1000 harorat va standart bosimning harorati va standart bosimida metanol sintez reaktsiyasining issiqlik ta'sirini hisoblash.
Qaror: Hisob-kitoblar uchun biz 298 dan 1000 k gacha bo'lgan harorat oralig'ida bo'lgan moddalarning o'rtacha issiqlik sig'imidagi moddalar ma'lumotlarini ishlatamiz (katalogning 56 sahifasida):
Kimyoviy reaktsiya oqimi natijasida tizimning o'rtacha issiqlik sig'imida o'zgarishlar:
Termodinamikaning ikkinchi boshi
Kimyoviy termodinamikaning eng muhim vazifalaridan biri bu ko'rib chiqilayotgan yo'nalishdagi kimyoviy reaktsiyaning o'z-o'zidan reaktsiyasining o'z-o'zidan paydo bo'lishi ehtimolini aniqlashtirishdir. Ushbu kimyoviy o'zaro ta'sir bo'lishi mumkin bo'lgan hollarda, ushbu moddalarning manbalari va reaktsiya mahsulotlarining hosildorligini, ya'ni reaktsiyaning to'liqligi to'g'risida aniqlanishi kerakligi aniq bo'ladi
O'z-o'zidan jarayonning yo'nalishi ikkinchi qonun asosida yoki, masalan, Klasius postulyosi shaklida shakllantirilgan termodinamika boshlanishi to'g'risida aniqlanishi mumkin:
Issiqlikning o'zi sovuq tanadan issiq, ya'ni bunday jarayonning eng yuqori natijasi, uning natijasi, bu tananing harorati yuqori haroratli tanaga haroratga ega bo'lgan tanadagi issiqlikning yagona natijasi edi.
Termodinamikaning ikkinchi boshlanishining turli xil formulasi taklif etiladi. Tomsonning so'zlari - Plankk:
Ikkinchi turning abadiy dvigateli imkonsiz, i.e., bunday vaqti-vaqti bilan faol mashinasi imkonsiz, bu faqat issiqlik manbasini sovutish orqali olish imkonini beradi.
Termodinamikaning ikkinchi boshlanishini matematik shakllantirish, N. Carno va R. Klasius asarlarida termal mashinalarning ishlashini tahlil qilishda yuzaga keladi.
Klasius davlat funktsiyasini joriy etdi S., entopiya, o'zgarishi, o'zgaruvchan jarayonning haroratiga yuboriladigan o'zgaruvchan jarayonning jaziramaga teng
Har qanday jarayon uchun
 | (1.22) |
Olingan ifoda - termodinamikaning ikkinchi boshlanishining matematik ifodasi.
Ta'limning standart iliqligi (ta'limning boshi) moddalar Ushbu moddaning 1 shakllanishini shakllantirishda ushbu moddani elementlardan (oddiy moddalar, ya'ni atomlardan tashkil topgan oddiy moddalar) shakllanishiga duchor bo'lishiga qaramay, eng barqaror standart holatda. Standart ekologik yoshlar (CJ / MO MOS) ma'lumotnomalarda beriladi. Ma'lumot qiymatlaridan foydalanganda, reaktsiyaga jalb qilingan moddalarning faza holatiga e'tibor berish kerak. Eng barqaror oddiy moddalarning shakllanishi 0.
Ta'lim issiqligidagi kimyoviy reaktsiyalarning issiqlik ta'sirini hisoblash to'g'risidagi qonun qonunidan; : standart kimyoviy reaktsiyaning issiqlik ta'siri reaktsiya mahsulotlarini shakllantirish issiqligining jaziramaga va reaktivometrik koeffitsientlar (mollarning soni) reaktiv koeffitsientlarini (miqdoridagi stoykiometrik koeffitsientlar (miqdoridagi moddalar) shakllantiradigan issiqlik issiqligiga tengdir:
T 4 + 2 co \u003d 3 c ( grafit ) + 2 H. 2 O. o.
gaz gazli televizor. gaz
Ushbu bosqichda moddalardagi moddalar shakllanishining issiqligi jadvalda keltirilgan. 1.2.
1.2-jadval.
Moddalarning iliq shakllanishi
Qaror
Reaktsiya qachon sodir bo'lganligi sababli P.\u003d Konst, keyin standart issiqlik ta'siri ma'lum bir jazirama issiqlik bo'yicha taniqli issiqlikka muvofiq taniqli ta'limga binoan (1 formula (1.17):
DN. haqida 298 \u003d (2 · (-241.81) + 3 · 0) - (-74.85 + 2 · 2 · 2 (-110,53)) \u003d187,71 kj \u003d -187710 j.
DN. haqida 298 < 0, реакция является экзотермической, протекает с выделением теплоты.
Bizni tenglama asosida topamiz (1.16):
Du. haqida 298 = DHH. haqida 298 – Δ ntuch..
Kimyoviy reaktsiyani o'tishi sababli gaz gazli moddalarning sonini o'zgartirish uchun Δν = 2 – (1 + 2) = –1; T.\u003d 298 K, keyin
Δ U. haqida 298 \u003d -187710 - (-1) · 814 · 298 \u003d -1852322 J.
Kimyoviy reaktsiyalarning reaktsiyaga jalb qilingan moddalarning turiga qarab, kimyoviy reaktsiyalarning standart issiqlik effektini hisoblash
Standart issiqlik yonish (yonish boshpaniyasi) moddalar
ushbu moddaning to'liq oksidlanishining issiqlik ta'siri (yuqori okksidlar yoki maxsus ko'rsatilgan birikmalarga) kislorodli moddalarning namozini kislorod bilan, ular standart haroratga ega ekanligini anglatadi. Standart unutionlik healpiya moddalari  (KJ / MOC) ma'lumotnomada berilgan. Ma'lumotli qiymatlardan foydalanganda, har doim ekstototermik ( Δ
H.
<0), а в таблицах указаны величины
(KJ / MOC) ma'lumotnomada berilgan. Ma'lumotli qiymatlardan foydalanganda, har doim ekstototermik ( Δ
H.
<0), а в таблицах указаны величины
 .
. Yuqori oksidlashning yong'iniga qarshi kurashish (masalan, suv va karbonat angidrid) 0 ga teng.
Yuqori oksidlashning yong'iniga qarshi kurashish (masalan, suv va karbonat angidrid) 0 ga teng.
Yonuvning isishi uchun kimyoviy reaktsiyalarning issiqlik ta'sirini hisoblash to'g'risidagi qonun hujjatlaridan : kimyoviy reaktsiyaning standart termal effekti boshlang'ich moddalarning yonishi va reaktsiya mahsulotlarining yonish issiqligining jaziramaga, reaktivometrik koeffitsientlar (mollar soni) hisobiga:
C. 2 H. 4 + H. 2 O. o. \u003d S. 2 N. 5 U.
Odamning jismoniy xususiyatlaridan biri bu jismoniy kuchdir, har qanday kimyoviy aloqaning eng muhim xususiyati - bu aloqa kuchidir, I.E. Uning energiyasi.
Eslatib o'tamiz, kimyoviy obligatsiyasining energiyasi - kimyoviy obligatsiya yoki ushbu ulanishni buzish uchun sarflanadigan energiya sarflash uchun ajratilgan energiya.
Umuman kimyoviy reaktsiya - bu bitta moddaning boshqalarga konversiya. Binobarin, kimyoviy reaktsiya paytida ba'zi ulanishlar va boshqalarning shakllanishi bor, i.e. Energiyani aylantirish.
Fizikaning asosiy qonuni energiya hech narsadan kelib chiqmaydi va izsiz g'oyib bo'lmaydi, faqat bir turdan boshqasiga o'tadi. Universalligi tufayli bu tamoyil, shubhasiz kimyoviy reaktsiyaga tegishli.
Kimyoviy reaktsiyaning issiqlik ta'siri issiqlik miqdorini chaqirdi,
reaktsiya paytida va 1 ta mol reaktsiya qilingan (yoki natijada) moddani qayta ko'rib chiqilgan (yoki paydo bo'lgan) ajratilgan.
Issiqlik ta'sirida Q va qoida tariqasida, KJ / MOL yoki KCAL / MOLda o'lchanadi.
Agar reaktsiya issiqlik bo'shlig'ida (Q\u003e 0), ekerotermik deb ataladi va issiqlik singdirish (q< 0) – эндотермической.
Agar bu reaktsiyaning energiya profilini tasvirlash uchun sekatsiyani, keyinchalik enotermik reaktsiyalar uchun mahsulotlar energiyadan yuqori, aksincha, reaktsiya mahsulotlari reaktivlardan ko'ra ko'proq (yanada barqaror) ostida joylashgan.
Moddaning reaktsiyalari reaktsiya qanchalik katta ekanligi aniq, bu energiya miqdori qancha ko'p bo'lsa (yoki so'rilgan), i.e. Issiqlik ta'siri moddaning miqdoriga bevosita mutanosib. Shuning uchun, issiqlik ta'sirining 1 moliga munosabati har xil reaktsiyalarning issiqlik ta'sirini taqqoslash istagimiz tufayli.
6. Therochemiya. Kimyoviy reaktsion misolning issiqlik ta'siri 1. 8,0 g mis (ii) va vodorodning oksidi, vodorod, metall mis va suv juftlari shakllangan va 7,9 kj issiqlik shaklida. Mis oksidi (II) qisqarish reaktsiyasining issiqlik ta'sirini hisoblang.
Qaror. Cuo Reefortion tengati (televidenie) + h2 (g.) \u003d cu (televizor) + h2 o (g.) + q (*) + Q (*)
1 mol - x kJ ni tiklash paytida 0,1 Mozni tiklash jarayonida mablag 'ajrating
U erda x \u003d + 79 kj / mol. Tenglama (*) oladi
Cuo (televidenie) + h2 (g.) \u003d cu (televizor) + h2 o (g.) +79 kj +79 kj
Terkokimyoviy tenglama- Bu kimyoviy reaktsion tenglama, bu reaktsiya aralashmasining tarkibiy qismlarini (reakentlar va mahsulotlar) va reaktsiyaning issiqlik ta'sirini ko'rsatadigan kimyoviy reaktsiya tengligi.
Muz yoki bug'lanish suvini eritib, ma'lum miqdordagi issiqlikni, suyuq suvni muzlatish paytida yoki suv bug'ini kondensatsiya qilish paytida bir xil miqdorda ajratilgan. Shuning uchun suvdan chiqqanimizda sovuq (tana yuzasidan suvning bug'lanishi energiya talab etiladi) va terlash tananing haddan tashqari qizib ketishining biologik himoya mexanizmi. Aksincha, muzlatgich suvni muzlatadi va atrofdagi xonani isitadi, uni ortiqcha olov beradi.
Ushbu misolda suvning umumiy holatidagi o'zgarishlarning issiqlik ta'siri ko'rsatilgan. Eritilgan issiqlik (0O C) ü \u003d 3.34 × 105 j / kg (fizika) yoki QL. \u003d - - 6.02 kj / Mol (kimyosi), issiq bug'lanish (bug'lanish) (100o C) q \u003d 2.26 × 106 j / kg (fizika) yoki qipp. \u003d - 40,68 kj / Mol (kimyo).
erish
bug'lanish |
|||||
obr, 298.
6. Therochemiya. Kimyoviy reaktsiyaning issiqlik ta'siri, albatta, sublimatsiya jarayoni qattiq bo'lganda mumkin
bu gaz bosqichidan chetga chiqib, gaz bosqichi (kristallanishi) ni chetlab o'tish jarayonida gaz bosqichiga kiradi, bu issiqlik ta'sirini hisoblash yoki o'lchash mumkin.
Har bir moddada kimyoviy obligatsiyalar mavjudligi aniq, shuning uchun har bir moddaning ba'zi energiya zaxirasi mavjud. Biroq, barcha moddalar bitta kimyoviy reaktsiya bilan bir-birlariga aylantirilmasligi mumkin. Shuning uchun, standart davlatni joriy etishga rozi bo'ldi.
Moddaning standart holati- Bu 298 k haroratda moddaning umumiy holati, ushbu sharoitda 1 atmosfera bosimi 1 atmosfera bosimi.
Standart shartlar- Bu 298 k harorat va 1 atmosfera bosimidir. Standart shartlar (standart holat) indeks0 bilan ko'rsatilgan.
Standart issiqlik shakllanishi ushbu birikmaning standart holatida olingan oddiy moddalardan olingan oddiy moddalardan kelib chiqishi kimyoviy ta'siri deb ataladi. Murakkab shakllanishning issiqligi Q belgisi bilan ko'rsatilgan.0 Turli xil aralashmalar uchun standart issiqlik ta'limi fizik-kimyoviy qadriyatlar bo'yicha ma'lumotnomada beriladi.
Oddiy moddalar shakllanishining standart isitish darajasi 0 ga teng. Masalan, 29-son., 298 (O2, Gas) \u003d \u200b\u200b0, 2, TV, Grafit) \u003d 0.
Masalan . Mis sulfati (II) shakllanishi uchun termokimyoviy tenglamani yozib oling. Ma'lumotlar kitobidan Q0T, 298 (Cuso4) \u003d 770 kj / mol.
Cu (televidenie) + s (televizor) + 2O2 (g.) \u003d cuso4 (TV) + 770 kJ.
Izoh: Har qanday modda uchun terimik tenglama yozilishi mumkin, ammo haqiqiy hayotda reaktsiya mutlaqo boshqa usulda sodir bo'lishi kerak: ro'yxatlangan reaktivlar mis (II) va oltingugurt (IV ), ammo mis sulfat (ii) hosil bo'lmaydi. Muhim xulosa: Therokimyoviy tenglama hisob-kitoblarga ega bo'lgan model bo'lib, u boshqa termoksial ma'lumotlarga yaxshi mos keladi, ammo amaliyotni tasdiqlovchi hujjatlarga mos keladi (ya'ni reaktsiyaga yoki reaktsiyaga to'g'ri kelmaslik).
(B j) - men 0, 298 i
6. Therochemiya. Kimyoviy reaktsiyaning issiqlik ta'siri
Tushuntirish. Sizni yo'ldan ozdirmaslik uchun darhol bu kimyoviy termodinamikani qo'shaman ehtimol, reaktsiyaning iloji yo'qligini taxmin qilishi mumkinBiroq, bu maktab kursidan tashqarida bo'lgan jiddiy "vositalarni" talab qiladi. Ushbu usullar bilan taqqoslaganda termoksial tenglama - piramida xiyomining fonida birinchi qadam - bu qilolmaydi, lekin baland emas.
2-misol. Suv kondensatsiyasining issiqlik ta'sirini 5,8 g. Kondensat jarayoni H2 O (G.) + O (g.) + q - kondensatsiya natijasida 25o C 37 kj / MOL (katalog) ekstresat jarayoni tomonidan tasvirlangan.
Binobarin, q \u003d 37 × 0.32 \u003d 11.84 KJ.
XIX asrda reaktsiyalarning issiqlik ta'sirini o'rgangan rossiyalik kimyogar energiya tejash qonunini kimyoviy reaktsiyalarga nisbatan energiya tejash qonunini eksperimentik ravishda yo'lga qo'ydi - hess qonuni.
Kimyoviy reaktsiyaning issiqlik ta'siri jarayon yo'liga bog'liq emas va faqat cheklangan va dastlabki holatlar o'zgarishi bilan belgilanadi.
Kimyo va matematika nuqtai nazaridan, ushbu Qonunda biz har qanday "trafik hisoblash" ni tanlash jarayonini hisoblashimiz kerak, chunki natija unga bog'liq emas. Shuning uchun, Gessning juda muhim qonuni nihoyatda muhimdir gESS qonunining mutanosibligi.
Kimyoviy reaktsiyaning issiqlik ta'siri reaktsiya mahsulotlarini shakllantirishning issiqligi summasiga teng, reagentlarni shakllantirish issiqligining isishi (stoichiometrik koeffitsientlarni hisobga olgan holda).
Aqlli nuqtai nazardan, ushbu tergov barcha reaktiv reaktivlar avvalgi oddiy moddalarga aylantirilgan jarayonga mos keladi, shunda reaktsiya mahsulotlari olinishi uchun yangi yo'l bilan to'plandi.
Tenglama shaklida, gbolar qonunining oqibati reaktsiya tenglamasiga o'xshaydi: a 1 a 1 + a 2 a 2 a 2 a 2 a 2 a 2 a 2 a 2 a 2 a 2 a 2 a 2 b 1 B 1 B 2 B 2 B 2 B 2 B 2 B 2 B 2 B 2 B 2 B 2 B 2 B 2 + ... B
Shu bilan birga, A i i IB J - bu stoichiometrik koeffitsientlar, b - reaktivlar, b j - reaktsiya mahsulotlari.
Keyin Gessa qonunining natijasi Q \u003d B × Q Ar. 0, 298
k Bk + Q
(A i i)
6. Therochemiya. Kimyoviy reaktsiyaning ko'plab moddalar hosil bo'lishining standart isishi uchun issiqlik ta'siri
a) maxsus jadvallar yoki b) sinakni aniqlash mumkin, ular juda ko'p aniqlik bilan reaktsiyalarning termal ta'sirini bashorat qilish (hisoblash) ni taxmin qilish (hisoblash).
3-misol. (GES qonunining oqibati). Namunaviy sharoitda gaz bosqichiga yoqilgan metanning bug 'konversiyasining issiqlik ta'sirini hisoblang:
Ch4 (g.) + + H2 O (G.) \u003d CO (G.) + + 3 H2 ()
Ushbu reaktsiya ekzotermik yoki endotermik ekanligini aniqlangmi?
Qaror: GESS qonunining oqibati
Q \u003d 3 Q0 | D) + 5 | (CO, D) -q 0 | D) -q 0 | O, d) - umuman. |
|||||
obr, 298. | obr, 298. | obr, 298. | obr, 298. | ||||||
Q OB0. | 298 (H 2, D) \u003d 0 | Standart holatdagi oddiy modda |
|||||||
Ma'lumot kitobidan biz aralashmaning qolgan qismlarini shakllantirishning iliqligini topamiz.
O, d) \u003d 241.8 | (CO, D) \u003d 110.5 | D) \u003d 74.6 | |||||||||
obr, 298. | obr, 298. | obr, 298. | |||||||||
Biz qiymatlarni tenglamaga almashtiramiz
Q \u003d 0 + 110.5 - 74.6 - 241.8 \u003d -205.9 kj / mod, reaktsiya juda endertimomich.
Javob: q \u003d -205.9 kj / mol, endotermal
4. Masalan 4. (Gessaning qo'llanilishi). Reaktsiyalarning iliqligi ma'lum
C (televizor) + g.) \u003d CO (g.) + 110,5 kJ
C (televizor) + o2 (g.) \u003d CO2 (G.) + 393.5 KJ reaktsiyaning qayta ishlash samarasini topadi (G.) \u003d 2co2 (g.). Birinchi va ikkinchisini ko'paytirish 2 ga tenglama
2c (televizor) + O2 (g.) \u003d 2co (g.) + 221 kj 2C + 2O2 (g.) + 2O2 (g.) + 787 kj + 787 kj
Birinchi tenglamani to'ldiring
O2 (g.) \u003d 2co2 (G.) + 787 kj - 2co (G.) - 221 kj,
2co (g.) + O2 (g.) \u003d 2co2 (g.) + 566 kj Javob: 566 kj / mol.
Izoh: Termokimyihani o'rganayotganda, biz tashqi tomondan kimyoviy reaktsiyani ko'rib chiqamiz. Aksincha, kimyoviy termodinamika - kimyoviy tizimlarning xatti-harakati fanlari - tizimning ichki qismidan, tizimning issiqlik energiyasi deb hisoblaydi va "Kuzalish" ning issiqlik energiyasi bilan ishlaydi. Kechki
6. Therochemiya. Kimyoviy reaktsiyaning issiqlik ta'siri issiqlik miqdori kabi bir xil ma'noga ega, ammo agar energiya tizimdan ajralib chiqsa, uning atrof-muhiti olinadi va tizim energiya yo'qotadi va tizim energiyasini yo'qotadi.
Adabiyotlar:
1. O'quv, V.V. Eremin, N.e. Kuzmenko va boshqalar, kimyo 9-sinf, 19-band,
2. O'quv va uslubiy qo'llanma "Umumiy kimyo asoslari" 1 qism.
Birorliklar - S.G. Baram, I.N. Mironova. - o'zi bilan olmoq! Keyingi seminar mashg'ulot uchun
3. A.V. Maduilllar. Kimyo asoslari. http://hemi.nsu.ru/index.htm.
§9.1 Kimyoviy reaktsiyaning issiqlik ta'siri. Termokimyo asosiy qonunlari.
§9.2 ** Termokimyo (davomi). Elementlardan modda hosil bo'lishining issiqligi.
Standart markaziy ta'lim.
Diqqat!
Biz hisob-kitob vazifalarini hal qilish uchun boramiz, shuning uchun kalkulyator ham kimyo bo'yicha seminarlar uchun kerak.
Therokimyo kimyoviy reaktsiyalarning termal ta'sirini o'rganadi. Ko'pgina hollarda, bu reaktsiyalar doimiy hajmda yoki doimiy bosimda sodir bo'ladi. Termodinamikaning birinchi qonunidan kelib chiqqan holda, bu issiqlik sharoitida funktsiya funktsiyasi hisoblanadi. Ichki energiya o'zgarishi bilan doimiy issiqlik hajmiga teng:
va doimiy bosimda, entralishning o'zgarishi:
Kimyoviy reaktsiyalarga ariza berish zarurdir gessa qonuni:
Doimiy bosimda yoki doimiy hajmda oqib chiqadigan kimyoviy reaktsiyaning issiqlik ta'siri reaktsiya yo'liga bog'liq emas va faqat reaktentlar va reaktsiya mahsulotlari holatida aniqlanadi.
Boshqacha qilib aytganda, kimyoviy reaktsiyaning issiqlik ta'siri holat funktsiyasini o'zgartirishdir.
Termokimyoda, boshqa termodinamik dasturlardan farqli o'laroq, issiqlik atrof-muhitda ta'kidlangan bo'lsa, ijobiy hisoblanadi, I.E. Agar a H. < 0 или U.
< 0. Под тепловым эффектом химической реакции
понимают значение H. (bu shunchaki "entallyatsiya reaktsiyasi" deb nomlanadi) yoki U. reaktsiyalar.
Agar reaktsiya eritmada yoki qattiq bosqichda davom etsa, bu erda ovozning o'zgarishi bir oz bo'lsa,
H. = U. + (pv) U.. (3.3)
Agar mukammal gazlar reaktsiyada bo'lsa, unda doimiy haroratda
H. = U. + (pv) = U. + n. Rt, (3.4)
qayerda n reaktsiyada gazlarning sonini o'zgartirish.
Turli reaktsiyalar qudratini taqqoslashga yordam berish uchun "standart davlat" tushunchasidan foydalaning. Standart holat - bu 1 bar (\u003d 10 5 pa) va ma'lum bir haroratning bosimida sof moddaning holati. Gazlar uchun bu cheksiz siyrak gazning xususiyatlariga ega bo'lgan 1 barning bosimida gipotetik holat. Haroratda me'yorlar o'rtasidagi reaktsiya atrofidagi haroratda T., belgilang ( r. "Reaktsiya" degan ma'noni anglatadi). Terkozlikali tenglamalarda nafaqat moddalar formulasida, balki ularning yalpi davlatlari yoki kristalli o'zgartirishlar ko'rsatilgan.
ISS qonunidan, kimyoviy reaktsiyalarga duch keladigan muhim oqibatlarga olib keladigan muhim oqibatlarga olib keladi.
1 ta roziyaly.
![]()
standam, reaktsiya mahsulotlari va reaktivlar (stoichiometrik koeffitsientlarni hisobga olgan holda) normaning odatiy ashyo binosining farqiga teng:
Moddani shakllantirishning standart qahramoni (issiqlik) (f. ushbu haroratda "shakllanish" degan ma'noni anglatadi. Ushbu moddaning namozini shakllantirishning shakllanishini shakllantirishning paydo bo'lishiga chaqirilgan elementlardaneng barqaror standart davlatda joylashgan. Ushbu ta'rifga ko'ra, standart holatda eng barqaror oddiy moddalarning shakllanishi har qanday haroratda 0 ni tashkil qiladi. Moddalardagi moddalarni shakllantirishning standart qarashlari 298 k haroratda ma'lumotnomalarda beriladi.
"Ta'lim taxtasi" tushunchalari nafaqat an'anaviy moddalar, balki ionlari uchun ham echimda ham qo'llaniladi. Shu bilan birga, H + ion mos yozuvlar uchun qabul qilinadi, buning uchun suvli eritmadagi standart eritmaning eritmasi nolga teng bo'lishi kerak: ![]()
2 ta roziyaly. Kimyoviy reaktsiyaning standart qahramonlari
![]()
reaktivlar va reaktsion mahsulotlarning yonishi (stoichiometrik koeffitsientlarni hisobga olgan holda) atrofidagi qarshunoslikning farqiga teng:
(c. "Kombitator" degan ma'noni anglatadi. Moddaning yonishning standart qiyshaygan (issiqlik), bitta namozning umumiy oksidlanishining reaktsiyasiga ta'sir qiladi. Ushbu oqibatlar odatda organik reaktsiyalarning issiqlik ta'sirini hisoblashda ishlatiladi.
3 ta korpus. Kimyoviy reaktsiyaga engashlik yirtilgan va ishlab chiqarilgan kimyoviy aloqalarning energiyasining farqiga tengdir.
Aloqa energiyasi A- B, natijada olingan zarralarni berish va cheklangan zarralarni suyultirishni infinitdan masofadan kamaytirish uchun zarur bo'lgan energiya deb ataladi:
AB (g) a (g) + b (g).
Aloqa energiyasi har doim ijobiy.
Malumot kitoblaridagi eng ko'p termokdiy ma'lumotlar 298 K. Boshqa haroratlarda foydalanish uchun issiqlik effektini hisoblash uchun beriladi kirchhofe tenglamasi:
(Differentsial shakl) (3.7)
 (Integral shakl) (3.8)
(Integral shakl) (3.8)
qayerda C p. - reaktsiya mahsulotlari va boshlang'ich materiallarning imobilik issiqlik sig'imining farq. Agar farq bo'lsa T. 2 - T. 1 kichik, keyin siz olishingiz mumkin C p. \u003d tog '. Katta harorat farqli bo'lsa, haroratga bog'liqlikni ishlatish kerak C p.(T.) Turi:
koeffitsientlar qayerda a., b., c. va hokazo. Shaxsiy moddalar uchun ular katalogdan olishadi va belgi mahsulotlar va reaktivlar o'rtasidagi farqni bildiradi (koeffitsientlarni hisobga olgan holda).
Misollar
3-1 misol. Suyuq va gazsimon suvni shakllantirishning standart va gazli suvlari 2988 va -241,8 va -241.8 kj / MO ga teng. Ushbu haroratda suvning bug'lanishining atrof-muhitini hisoblang.
Qaror. Ta'limning boshi quyidagi reaktsiyalarga mos keladi:
H 2 (g) + 2 (G) \u003d H 2 O (g), H. 1 0 = -285.8;
H 2 (g) + 2 (G) \u003d H 2 O (g), H. 2 0 = -241.8.
Ikkinchi reaktsiya ikki bosqichda amalga oshirilishi mumkin: birinchi marta vodorodni yoqish birinchi reaktsiya bilan suyuq suvni shakllantirish uchun yoqing va keyin suvni bug'lang.
H 2 o (g) \u003d h 2 o (g), H. 0 \u003d?
Keyin, Gess qonuniga ko'ra,
H. 1 0 + H. 0 \u003d. H. 2 0 ,
dan H. 0 ISP \u003d -241.8 - (-285.8) \u003d 44.0 Kj / MOL.
Javob. 44.0 kj / mol.
3-2 misol. Entralply reaktsiyasini hisoblang
6c (g) + 6h (g) \u003d c 6 h 6 (g)
a) Ta'lim yaqinida; b) aloqa energiyasida, molekulada ikki baravar rishtalar bilan ikki baravar rishtalar o'rnatilgan.
Qaror. a) Ta'lim Kuzi (masalan, kj / mol) biz katalogda topamiz (masalan, P.W.ATKIN, FOYDALANMANID, AYLANMAND, HP. C9-C15): F H. 0 (C 6 H 6 (G)) \u003d 82.93, F H. 0 (c (g)) \u003d 716.68, F H. 0 (h (g)) \u003d 217.97. Qilding reaktsiyasi:
R h. 0 \u003d 82.93 - 6 716.68 - 6 217.97 \u003d -5525 kj / mol.
b) ushbu reaktsiyada kimyoviy obligatsiyalar buzilgan, ammo faqat hosil bo'lgan. Bo'latli ikki tomonlama obligatsiyalar, c 6 H 6 molekulada 6 ta obligatsiyalar mavjud, C-H + 3 aloqa c - C va 3 ta aloqa c \u003d c. Energiya aloqalari (kj / mitda) (p.w.atkins, fizik kimyo, 5-nashr, p. C7): E.(C- H) \u003d 412, E.(C- C) \u003d 348, E.(C \u003d C) \u003d 612. Reaksiya boshi quyidagilarga tengdir:
R h. 0 \u003d - (6 412 + 348 + 3 612) \u003d -5352 kj / mol.
Aniq natijalar bilan farq bu -5525 kJ / MO Benzene molekulada C \u003d C-ning keng obligatsiyalari yo'qligi va C C \u003d C bilan birga bo'lgan 6 ta obligatsiyalar mavjudligi sababli.
Javob. a) -5525 kj / mol; b) -5352 kj / mol.
3-3 misol. Ma'lumot ma'lumotlaridan foydalanish, reaktsiya atrofini hisoblang
3CU (TV) + 8hno 3 (Yo'q 3) 2 (G) + 4H 2 O (g)
Qaror. Qisqartirilgan ion reaktsiyasi tenglama shakli:
3Ku (TV) + 8h + (AK) + 2NO 3 - (AQ) \u003d 3CU 2+ (G) + 2No + O (g).
GES qonuniga ko'ra, entralchak reaktsiyasi quyidagilarga teng:
R h. 0 = 4 F H. 0 (H 2 O (g)) + 2 F H. 0 (yo'q (g)) + 3 F H. 0 (Cu 2+ (AK)) - 2 F H. 0 (3-son - (AQ))
(Mis va Ionni shakllantirish xlifioni 1-ta'rif bo'yicha tengdir. Ta'lim sohasi Ta'lim (P.W.ATkins, fizik kimyo, 5-nashr, HP. C9-C15), biz topamiz:
R h. 0 \u003d 4 (-285.8) + 2 90.25 + 3 64.77 - 2 (-205.0) \u003d -358.4 kJ
(uchta ibodatda mis).
Javob. -358.4 kJ.
3-4 misol. Metanning yong'og'ini 1000 kada hisoblang, agar 298 yilda shakllantirilgan bo'lsa: F H. 0 (ch 4) \u003d -17.9 kkal / mol F H. 0 (CO 2) \u003d -94.1 kkal / mol F H. 0 (H 2 O (g)) \u003d -57.8 kkal / mol. 298 dan 1000 K gacha bo'lgan gazning issiqlik quvvati (KAT / (k)).
C p (ch 4) \u003d 3.422 + 0.0178. T., C p.(O 2) \u003d 6.095 + 0.0033. T.,
C p (CO 2) \u003d 6.396 + 0.0102. T., C p.(H 2 O (g)) \u003d 7.188 + 0.0024. T..
Qaror. MonanalubAlubPia metan yonish reaktsiyasi
Ch 4 (g) + 2o 2 (g) \u003d CO 2 (g) + 2h 2 o (g)
298 yilda:
94.1 + 2 (-57.8) - (-17.9) \u003d -191.8 kkal / mol.
Harorat funktsiyasi sifatida issiqlik quvvati farqini toping:
C p. = C p.(CO 2) + 2 C p.(H 2 O (g)) - C p.(Ch 4) - 2 C p.(O 2) \u003d
= 5.16 - 0.0094T. (Kal / (k)).
Kiryxoff tenglamasi bo'yicha 1000-daqiqada reaktsiyaning entralbalida:
= +  = -191800 + 5.16
= -191800 + 5.16
(1000-298) - 0.0094 (1000 2 -298 2) / 2 \u003d -192500 kal / mol.
Javob. -192.5 kkal / mol.
Vazifalar
3-1. 500 g AL (T.PPL. 658 C ni tarjima qilish uchun qancha issiqlik talab qilinadi, H. 0 pl \u003d 92.4 kal / g), xona haroratida, eritilgan holatda, agar C p.(Al TV) \u003d 0.183 + 1.096 10 -4 T. Cal / (G K)?
3-2. Standart qahramonning reaktsiyasi Cako 3 (TV) \u003d CAO (TV) + CA 2 (g) harorat 169 kj / molga tengdir. Ushbu reaktsiyaning bir xil haroratda oqadigan narsa, ammo yopiq kemada nima?
3-3. 298 k yilda suyuq benzin shakllanishining standart ichki energiyasini hisoblang, agar standart uning shakllanishi uning shakllanishi 49,0 kj / mol bo'lsa.
3-4. Shaklning qadimgi qiymati 2 (d) T. \u003d 298 K quyidagi ma'lumotlarga asoslanadi:
2No (g) + o 1 (g) \u003d 2no 2 (g), H. 1 0 \u003d -11.2 KJ / MOL,
4No 2 (g) + o 2 (g) \u003d 2n 2 O 5 (g), H. 2 0 \u003d -110.2 KJ / MOL,
N 2 (g) + o 1 (g) \u003d 2no (g), H. 3 0 \u003d 182.6 kj / mol.
3-5. Angliyaulpi bilan yonish-glyukoza, - 25 ° C da saxaroza -2802 ga teng
Mos ravishda -2810 va -5644 kj / mol. Saxarozning gidrolizining iliqligini hisoblang.
3-6. B 2 H 6 (g) shakllanishining shakllanishiga olib keladi T. \u003d 298 quyidagi ma'lumotlardan:
B 2 H 6 (g) + 3o 2 (g) \u003d b 2 o 3 (TV) + 3h 2 O (g), H. 1 0 \u003d -2035.6 kj / mol
2b (TV) + 3/2 O 2 (G) \u003d B 2 O 3 (TV), H. 2 0 \u003d -1273.5 KJ / MOL,
H 2 (g) + 1/2 o 2 (g) \u003d h 2 o (g), H. 3 0 \u003d -2241.8 kj / mol.
3-7. Qachon bo'lgan oddiy moddalardan rux sulfatini shakllantirish issiqligini hisoblang T. \u003d Keyingi ma'lumotlarga asoslanib.