Aşağıda listelenen elementlerin özelliklerinin özellikleri. Kimya
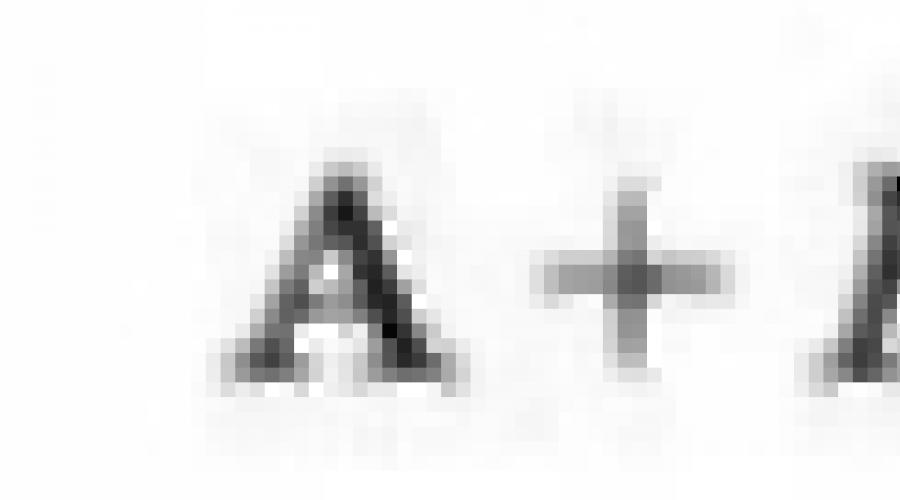
Sınav No. 2, aşağıdaki konulara yapılan görevleri içerir:
- Periyodik sistem
- Elementlerin özelliklerini ve bileşiklerini değiştirme sıklığı.
- Kimyasal bağ. Yöntem Günesi.
- Kimyasal bağ. MO yöntemi.
- Kimyasal bağ. İyon bağlantısı.
- Karmaşık bileşiklerde kimyasal bağ.
Bilgi kontrolü için test:
1. Aşağıda listelenen elementlerin özelliklerinin periyodik olarak değişmesi
(1) Atom Çekirdeği Ücreti;
(2) Göreceli atom kütlesi;
(3) Atomdaki enerji seviyelerinin sayısı;
(4) Dış enerji seviyesindeki elektronların sayısı.
2. Sürenin içinde, elemanın sekans numarasındaki bir artış genellikle eşlik eder.
(1) Atomik yarıçapta bir düşüş ve atomun elektronegativasyonunda bir artışla;
(2) Atomik yarıçapın içindeki bir artış ve atomun elektronezlenebilirliğinde bir azalma;
(3) atomik yarıçapta bir azalma ve atomun elektronejeğinde azalma;
(4) Atomik yarıçapındaki bir artış ve atomun elektronezlenebilirliğinde bir artış.
3. Elemanın bir elektron vermenin en kolay yolu olan atom (sayılar elemanın sıra numarası anlamına gelir):
(1) Sodyum, 11; (2) magnezyum, 12; (3) Alüminyum, 13; (4) Silikon, 14?
4. Elementlerin 1a atomları, elemanların periyodik sisteminin 1A aynı sayıya sahiptir.
(1) Elektronik elektronik seviyesindeki elektronlar;
(2) Nötronlar;
(3) tüm elektronlar.
5. Elementler, satırdaki elektroniklik kabiliyetinin sırasına göre bulunur.
(1) AS, SE, CL, F; (2) c, i, b, si; (3) br, p, h, sb; (4) o, se, br, te.
6. Periyodik sistemin ikinci ve üçüncü dönemlerinde, elementlerin boyutu azalır.
(1) iyonlarının boyutu da azalır;
(2) Elektrik azalır;
(3) elementlerin metal özellikleri zayıflatmak;
(4) elementlerin metal özellikleri geliştirilmiştir.
7. Hangi numara yalnızca geçiş elemanları içerir:
(1) elemanlar 11, 14, 22, 42; (2) Elementler 13, 33, 54, 83;
(3) Elementler 24, 39, 74, 80; (4) Öğeler 19, 32, 51, 101?
8. Aşağıdaki elementlerden hangisi, kalsiyum elemanıyla benzerliği hakkında konuşmanıza olanak tanıyan kimyasal özelliklere sahiptir:
(1) karbon. Dan; (2) Sodyum, NA; (3) Potasyum. İçin; (4) Stronsiyum, Sr?
9. Periyodik sistemin ana alt gruplarında yer alan elementlerin metalik olmayan özellikleri D. I. Mendeleev, en çok bulunanların bulunduğu kişilerde belirgindir.
(1) alt grubun tepesinde;
(2) alt grubun dibinde;
(3) alt grubun ortasında;
(4) Tüm unsurlarda, alt grup yaklaşık aynı derecede ifade edilir.
10. Atomik yarıçapın artan sırasına göre hangi eleman sayılır:
(1) o, s, se, bunlar; (2) C, n, o, f; (3) na, mg, al, si; (4) i, br, cl, f?
11. MG-CA-SR-BA bir dizi elementlerin özelliklerinin metal doğası
(1) azalır;
(2) artar;
(3) değişmez;
12. Bir dizi N-P-AS-SB-Bi'deki elementlerin özelliklerinin metalik olmayan niteliği
(1) azalır;
(2) artar;
(3) değişmez;
(4) azalır ve sonra artar.
13. Belirtilen öğelerdeki hangi buhar - CA, P, Si, AG, NI, AS - en benzer kimyasal özelliklere sahiptir:
(1) SA, SI; (2) AG, Ni; (3) P, olarak; (4) ni, r?
14. Kimyasal özelliklerine göre, radyumun radyoaktif elemanı en yakın
(1) Sezyum; (2) Baryum; (3) Lanthan; (4) Actinia.
15. Lanthan öğesinin periyodik sistemdeki konumuna dayanarak, lantanitler için, en karakteristik oksidasyon derecesinin olacağını iddia etmek güvenlidir.
(1) +1; (2) +2; (3) +3; (4) +4.
16. Sıra numarası arttıkça, grup 1a unsurlarının hidroksitlerinin ana özellikleri
(1) azalma;
(2) artış;
(3) değişmeden kalır;
(4) azalır ve daha sonra arttırın.
17. Periyodik sistemdeki elemanların konumuna dayanarak, Selenyum ile Almanya'nın en muhtemel eklemi, formül tarafından gösterilebilir.
18. Hipotetik eleman Z ZCL 5 klorür oluşturur. Oksit için en muhtemel formül nedir:
(1) zo 2; (2) ZO 5; (3) Z20 5; (4) z 5 o 2?
19. Elementlerin fiziksel ve kimyasal özelliklerin en büyük benzerliğine sahip olan basit maddeler:
(1) LI, S; (2), cl; (3) f, cl; (4) li, f?
20. Aşağıdaki üçüncü periyodun unsurlarının en belirgin metalik olmayan özelliklerin
(1) alüminyum; (2) Silikon; (3) Kükürt; (4) Klor.
21. Yukarıdaki elementlerin IIIA'sının, Grup belirgin metalik olmayan özelliklere sahip
(1) bor; (2) alüminyum; (3) galyum; (4) Hindistan.
22. Periyodik sistemin dördüncü periyodunun yukarıdaki unsurlarından hangisi, hidrojen bileşiklerinde ve en yüksek oksitte aynı değerlik değerlerini gösterir.
(1) brom; (2) Almanya; (3) arsenik; (4) Selenyum?
23. Sıradaki oksitlerin doğası, p205 -Sio 2 -L20 z-mgo aşağıdaki gibi değiştirilir:
(1) anaden asidikten;
(2) asitten ana için;
(3) Ana'dan Amfoter'a;
(4) amfoterik ila asidik.
24. Elementlerin ve karşılık gelen asitlerin daha yüksek oksitlerinin formüllerini yazın; Bu asitleri adlandırın:
25. Öğenin periyodik sistemdeki konumuna dayanarak, aşağıda listelenen bileşiklerini yazın:
26. Yukarıdaki unsurların listesinden: BE, B, C, N, AL, SI, P, S, GA, GE, AS, BR - EO 2 tipi oksitler formu ve Tip A 4'ün hidritleri.
27. Öğenin periyodik sistemdeki konumuna dayanarak, formülleri en yüksek oksit ve hidroksit için çıkarın ve doğalarını belirtin:
28. Sıra numarası olan eleman, bir hidrojen bileşiği, daha yüksek oksit ve hidroksit oluşturur. İkincisi tezahür edilir
(1) Asit özellikleri;
(2) Temel özellikler;
(3) amfoterik özellikleri.
29. Periyodik sistemin altıncı döneminde doldurabilecek maksimum kimyasal element sayısı eşit olmalıdır.
(1) 8; (2) 18; (3) 32; (4) 50.
30. Seventserioddaki maksimum madde sayısı olmalıdır
(1) 18; (2) 32; (3) 50; (4) 72.
31. Yedinci dönemde, ikincisi sıra numarası ile eleman olmalıdır.
(1) 118; (2) 114; (3) 112; (4) 110.
32. Alkali metallerinin özellikleri, sıra numaraları olan unsurlardan beklenmelidir.
(1) 111 ve 190; (2) 119 ve 169; (3) 137 ve 187; (4) 155 ve 211.
33. Valans elektronlarının bizmut yörüngelerinin yapılandırılması ile çakışıyor
(1) Selenyum ve Tellurium;
(2) azot ve fosfor;
(3) Silikon ve germanyum;
(4) Niobium ve Tantal.
34. 117 numaralı sekansla olan eleman atfedilmelidir.
(1) Alkalin metal lamaz; (3) halojenler;
(2) Alkali toprak metalleri; (4) Geçiş elemanları.
35. Oksijen bileşiklerinde liderliğin maksimum değerliği:
(1) II; (2) iv; (3) vi; (4) VIII.
36. Hindistan'daki değerlik elektronlarının orbitallerinin türü ile çakışmaktadır.
(1) am ve fr; (2) pb ve sn; (3) al ve ga; (4) CU ve AG.
37. Titan anlamına gelir
(1) s.-; (2) p.-; (3) d.-; (4) f.- elementler.
38. Oksijen bileşiklerinde maksimum brom değerliği
(1) ben; (2) III; (3) v; (4) VII.
39. Öğe sisteminin yedinci periyodu elemanı sıra numarası ile bitmelidir.
(1) 108; (2) 110; (3) 118; (4) 128.
40. H-E bağlantıları arasındaki açı, bağlantının molekülündeki en büyüğüdür.
(1) H 2, (2) H 2 SE; (3) H 2 s; (4) H 2 O.
41. K-CA-SC-TI satırında, atomların yarıçapı (azalır, artar).
42. SL ° (G.) → CL + Denkleminde (G.) belirtilen enerji. + E - 1254 KJ, klorin atomu içindir
(1) Kimyasal bağ enerjisi;
(2) iyonlaşma enerjisi;
(3) elektronezite;
(4) elektrona afinite.
43. Elektronun afinitesi denir
(1) bir elektronun beklenmedik bir atomdan ayrılması için gereken enerji;
(2) Bu öğenin atomunun elektron yoğunluğunu geciktirmesi için yeteneği;
(3) yüksek enerji seviyesine elektron geçişi;
(4) Bir elektron bir atoma veya iyona tutturulduğunda enerji izolasyonu.
44. Elementlerden hangisi iyonizasyon enerjisinin en büyük değeridir:
(1) li; (2) f; (3) Fe; (4) ben?
45. Bir elektronun bir eleman atomundan bir eleman atomundan, magnezyumda sökülmesi için harcanan enerji
(1) sodyumdan az ve alüminyumdan daha fazlası;
(2) sodyumdan daha fazla ve alüminyumdan daha az;
(3) sodyumdan ve alüminyumdan az;
(4) Sodyumdan ve alüminyumdan daha fazla.
46. \u200b\u200bPeriyodik sistemdeki elementlerin elektronik yapılarının elektronik yapılarının analizine dayanarak, aşağıdaki her iki atomdan hangisinin elektrona daha fazla afiniteye sahip olduğunu belirtin:
(1) potasyum veya kalsiyum;
(2) kükürt veya klor;
(3) Hidrojen veya lityum?
47. Kimyasal elementler, satırdaki elektronik kabiliyetin arttırılması sırasına yerleştirilmiştir.
(1) SI, P, SE, RR, SL, O; (2) si, p, r, se, c1, o;
(3) p, si, fra, se, c1, o; (4) SE, SI, P, R, C1, O.
48. Atomik yarıçaplarını arttırdıklarında, ne kadar sayıda unsur bulunur:
(1) na, mg, al, si; (3) o, s, se, bunlar;
(2) c, o, n, f; (4) i, br, c1, f?
49. Birkaç alkali metalinde (LI'den CS'ye), sezyum en az elektronegatiftir. Bu, sahip olduğu şey tarafından açıklandı.
(1) çekirdeğindeki en fazla nötron sayısı;
(2) Diğer unsurlara kıyasla daha fazla sayıda değerlik elektron;
(3) büyük bir atom kütlesi;
(4) Valentli elektronlar, atomun çekirdeğinden çıkarılan en yüksek dereceye kadar.
50. Isoelektronik, aynı sayıda elektrona sahip iyonlar ve harici elektron seviyesinin aynı yapısını denir. 2-, F -, Na +, Mg2 +, A1 3+ ile ilgili iyonlar, öğlen Noo gazının elektronik bir konfigürasyonuna sahiptir ve elementlerin atom kütlelerinin artan sırasına göre düzenlenir. Aynı zamanda iyon yarıçapları
(1) pratik olarak değişmez;
(2) azalma;
(3) artış;
(4) azaltın, ardından arttırın.
51. Kutupsal kovalent bağına sahip olan polar olmayan bir molekülün bir örneği
(1) n 2; (2) H20; (3) NH3; (4) CCl4.
52. Yukarıdaki moleküllerin: H2, O2, H20, C02, CH4, H2S - Polar.
53. Atomlar arasındaki bileşiklerden hangisinde, donör alıcı mekanizması üzerinde kovalent bir bağ oluşturulur:
(1) KSL; (2) nh 4 cl; (3) CCl4; (4) CO 2?
54. Berilyum atomunun valental orbitleri, tipte hibritleşmiş berilyum hidrit molekülünde
(1) sP.; (2) sP 2.; (3) sP3.;(4) d 2 SP 3,
ve molekülün bir yapısı vardır:
55. TF3 molekülündeki bor atomunun valental orbitleri tipte hibritlenir
(1) sP.; (2) sP 2.; (3) sP3.;(4) d 2 SP 3,
ve molekülün bir yapısı vardır:
(a) doğrusal; (c) tetrahedral;
(b) düz; (d) oktahedral.
56. Metan molekülündeki C - H'nin dört eşdeğer bağının varlığı, gerçeği ile açıklanmaktadır.
(1) Dört elektronik çiftin karşılıklı itme meydana gelir;
(2) karbon atomu dört oluşturmak için hibritlenir sP3.orbitaller;
(3) karbon atomunun bir tane var s.- ve üç r- valence elektronu;
(4) karbon atomunun iki S ve iki r- valence elektronu.
Yanıtlar:
1. (4) Dış enerji seviyesindeki elektronların sayısı.
2. (1) Atomik yarıçapta azalma ve atomun elektronegativasyonunda bir artışla.
3. (1) Sodyum, 11.
4. (1) dış elektronik seviyesindeki elektronlar.
5. (1) AS, SE, CL, F.
6. (3) elementlerin metal özellikleri zayıflatır.
7. (3) Elementler 24, 39, 74, 80.
8. (4) Strontsia, Sr.
9. (1) alt grubun üstünde.
10. (1) o, s, se, bunlar.
11. (2) artar.
12. (1) azalır.
14. (2) Baryum.
16. (2) artış.
18. (3) Z20 5.
20. (4) Klor.
22. (2) Almanya.
23. (2) asitten ana olana.
26. EO 2 Tip Oksitler Formu C, SI, GE ve Tip A 4 - C, SI, GE'nin hidritleri.
28. H 2 S, SEO 3 ve H2 SEO 4. (1) Asit özellikleri.
32. (2) 119 ve 169.
33. (2) azot ve fosfor.
34. (3) Halojenler.
36. (3) Al ve GA.
37. (3) d.- elementler.
41. azalır.
42. (2) iyonlaşma enerjisi.
43. (4) Bir elektron bir atoma veya iyonuna bağlandığında enerji izolasyonu.
45. (4) Sodyumdan ve alüminyumdan daha fazlası.
46. \u200b\u200b(1) Potasyum; (2) Klor; (3) hidrojen.
47. (1) Si, P, Se, Wr, SL, O.
48. (3) o, s, se, bunlar.
49. (4) Değerlik elektronları, atomun çekirdeğinden çıkarılan en yüksek dereceye kadar.
50. (2) azalma.
52. H20, H 2 S.
53. (2) NH4 CL.
54. (1) sP., (a) doğrusal.
55. (2) sP 2., (b) düz.
56. (2) karbon atomu, dört oluşumuyla hibritlenir sP3.orbitaller.
Bireysel Tahmini Grafik Çalışması için Görevler:
Aşağıdaki hesaplamaları gerçekleştirmek için seçenek sayısına eşit bir sıra numarası olan bir öğe için:
1. Elemanın elektronik bir formülünü yazın ve tüm atomik orbitallerin elektronlarıyla grafiksel olarak doldurun.
3. Bir eleman atomunun ve hacminin kütlesini belirleyin.
4. Öğenin basit bir maddesinin bir molekülünün kütlesini belirleyin.
5. Elemanın PS'deki konumuna dayanarak, elemanın atomunun atomunun olası oksidasyonunu diğer elemanlarla bağlantılarla listeler.
6. Bir oksit formülü, klorür, hidrit, sülfit yazın.
8. Elemanın hidrojen ve oksijen bağlantısının dipolünün uzunluğunu hesaplayın.
9. Güneş metodunu kullanarak elemanın basit bir maddesinin molekülünde temas halinde.
10. MO yönteminin enerji diyagramını kullanarak eleman basit maddesinin molekülüne kovalar, iletişimin çokluğunu belirtin ve bir formül yazın.
11. Tüm olası oksitlerin moleküllerinde bir elemanın bir atomunun hibridizasyonu türünü belirtin (oksijen - hidrojen bağlantılarının molekülleri durumunda).
12. Oksit moleküllerinde (oksijen - hidrojen bileşikleri durumunda) her türlü bağları (Σ, π, δ) belirtin.
13. Oksit moleküllerdeki değerlik açılarının değerlerini belirtin (oksijen - hidrojen bileşikleri molekülleri durumunda).
14. Oksit moleküllerinin formunu belirtin (oksijen - hidrojen bileşikleri molekülleri durumunda).
15. İyonik AV bileşiğinin enerjisini ve iyonların A + ve B etkileşiminin enerjisini hesaplayın.
Seçenekler için 1, 5, 6, 7, 8, 9, 14, 15, 16, 17: A - Potasyum, B, element numarasına eşit bir sıra numarası olan bir elementtir.
Seçenekler 3, 4, 11, 12, 13, 19, 20, 21, 22, 23, 24, 25, 26, 22, 23: 24, 25, 26, 27, 28: B - Klor, eleman numarasına eşit bir sıra numarasına sahip bir eleman.
Seçenekler 2, 10, 18: A - (+ 1'in) (+ 1 sürümüne) eşit bir sekans numarası olan bir eleman, B, (seçenek -1) eşit bir sıra elemanına sahip bir elementtir.
Edebiyat.
1. Kulman A.G. Genel kimya için görevlerin toplanması, ed. 2., rekreasyon ve ekleyin. - m.: Daha yüksek. shk. 1975.
2. Maslov e.i. , Holboray z.e. Kimyada Görev ve Alıştırma Koleksiyonu, 5. ed., Pererab. ve eklenti.: daha yüksek. shk. 1997.
Elemanın atom numarası şunları gösterir:
a) Atomdaki ilköğretim parçacıklarının sayısı; b) Atomdaki nükleon sayısı;
c) Atomdaki nötronların sayısı; d) Atomdaki proton sayısı.
En doğru olanı, PSE'deki kimyasal elementlerin artan sırada düzenlendiği ifadesidir:
a) atomlarının mutlak kitlesi; b) Göreceli atom kütlesi;
c) atom çekirdeğindeki nükleon sayısı; d) atom çekirdeğinin sorumluluğu.
Kimyasal elementlerin özelliklerini değiştirme sıklığı sonuçtur:
a) Atomlarda elektron sayısını arttırmak;
b) atom çekirdeğinin suçlanmasını arttırmak;
c) atom kütlesini arttırmak;
d) Atomların elektronik yapılarındaki değişimde periyodiklik.
Aşağıda listelenen özelliklerin, eleman atomları, elemanın sıra numarası olarak yetiştirilirken periyodik olarak değiştirilir:
a) Atomdaki enerji seviyelerinin sayısı;
b) Göreceli atom kütlesi;
c) dış enerji seviyesindeki elektronların sayısı;
d) Atom çekirdeğinin şarjı.
Atomun her bir özelliğinin, elemanın proton numarasındaki bir artışla periyodik olarak değiştiği çiftleri seçin:
a) Bir elektron afinitesinin iyonlaştırma ve enerjisinin enerjisi;
b) yarıçapı ve kütle;
c) elektronegativasyon ve toplam elektronlar;
d) Metal özellikleri ve değerlik elektronların sayısı.
Elemanlar için uygun onay seçinV.Bir grup:
a) Tüm atomlar aynı sayıda elektron vardır;
b) Tüm atomlar aynı yarıçapa sahiptir;
c) Tüm atomlar dış tabakadaki aynı elektronlara sahiptir;
d) Tüm atomlar, grup numarasına eşit maksimum değere sahiptir.
Bazı eleman aşağıdaki elektron yapılandırmasına sahiptir:ns. 2 (n.-1) d. 10 np. 4 . Periyodik sistem grubunun hangi grupta bu unsurdur?
a) ivt grubu; b) VIV Grubu; c) IVA grubu; d) Grup üzerinden.
PSE dönemlerinde atom nüklei suçlamaları iledeğil Değişiklikler: a) atom kütlesi; b) elektronik katmanların sayısı; c) Dış elektronik tabakadaki elektronların sayısı; d) Atomların yarıçapı. |
|
Atomik yarıçaplarını artırmak için hangi sıra kimyasal elemanları bulunur? a) li, ol, b, c; b) olmak, mg, ca, sr; c) n, o, f, ne; d) na, mg, al, si. |
|
İstikrarlı atomlar arasındaki en düşük iyonlaşma enerjisi: a) lityum; b) Barry; c) sezyum; d) sodyum. |
|
Elementlerin elektrik üst üste artar: a) p, si, s, o; b) cl, f, s, o; c) te, se, s, o; d) o, s, se, te. |
|
Bir sıra elementteNa. MG. AL Sİ P. S. Cl. soldan sağa: a) elektronegacılığı arttırır; b) iyonlaşmanın enerjisi azalır; c) Değerlik elektronların sayısı artmaktadır; d) Metal özellikleri azalır. |
|
Dördüncü periyodun en aktif metali belirtin: a) kalsiyum; b) potasyum; c) krom; d) çinko. |
|
En aktif metal IIA grubunu belirtin: a) berilyum; b) Barry; c) magnezyum; d) Kalsiyum. |
|
En aktif olmayan metal olmayan VIIA grubunu belirtin: a) iyot; b) brom; c) flor; d) Klor. |
|
Doğru ifadeleri seçin: a) IA-VIII'de, sadece unsurlar b) IV-VIIIV gruplarında sadece D-Elements vardır; c) Tüm D-elements metaldir; d) PSE'deki toplam S elementlerinin sayısı 13'tür. |
|
VA grubundaki elemanın atom sayısında artışla artışla: a) Metal özellikleri; b) Enerji seviyelerinin sayısı; c) toplam elektron sayısı; d) değerlik elektronların sayısı. |
|
P-elements ifade eder: a) potasyum; b) sodyum; c) magnezyum; d) Arsenik. |
|
Hangi unsurların ailesi alüminyumdur? a) S-Elements; b) p-elemanları; c) D-Elements; d) F-elements. |
|
Sadece olduğu bir dizi belirtind.- elementler: a) al, se, la; b) ti, ge, sn; c) ti, v, cr; d) la, ce, hf. |
Öğelerinin S, P ve D-Ailelerin karakterlerini hangi sırayı gösterir? a) H, o, li; b) h, ba, al; c) olmak, c, f; d) mg, p, cu. |
|
IV periyodunun hangi unsurunun atomu en fazla elektronu içeriyor? a) çinko; b) krom; c) brom; d) Krypton. |
|
Hangi unsurun atomunda, dış enerji seviyesinin elektronları en sıkı bir şekilde çekirdeğe bağlı mı? a) potasyum; b) karbon; c) flor; d) Fransa. |
|
Değerlik elektronlarının atomun çekirdeğine gübresi bir dizi elemana göre azalır: a) na, mg, al, si; b) rb, k, na, li; c) sr, ca, mg; d) Li, na, k, rb. |
|
31 numaralı sırayla eleman: a) III grubunda; b) küçük dönem; c) büyük dönem; d) A Grubu'nda |
|
Aşağıdaki elektronik formüllerden, P-elements ile eşleşenleri seçinV. Dönem: a) 1S 2 2S 2 2P 6 3S 2 3P 6 3D 1 4S 2 4P 6 4D 1 5S 2 5P 1; b) 1S 2 2S 2 2P 6 3 S 2 3P 6 3D 1 4S 2 4P 6 5 S2; c) 1S 2 2S 2 2P 6 3S 2 3P 6 3D 1 4S 2 4P 2; d) 1S 2 2S 2 2P 6 3S 2 3P 6 3D 1 4S 2 4P 6 4D 1 5S 2 5P 6. |
|
Yukarıdaki elektronik formüllerden, bileşimin en yüksek oksitini oluşturan kimyasal elementlere karşılık gelen bunları seçin. 2 HAKKINDA 3 : a) 1S 2 2S 2 2P 6 3S 2 3P 1; B) 1S 2 2S 2 2P 6 3S 2 3P 6 3D 1 4S 2 4P 3; c) 1S 2 2S 2 2P 6 3S 2 3P 6 3D 1 4 S2; d) 1S 2 2S 2 2P 6 3S 2 3P 6 3D 3 4S 2. |
|
Elektronun 4P-Pylon 4'ünde atomu içeren elemanı belirleyin. Hangi dönem ve grup? a) Arsenik, IV Dönemi, VA Grubu; b) Grup üzerinden Tellur, V dönemi; c) Selenyum, IV dönemi, Grup üzerinden; d) Tungsten, VI dönemi, VIB Grubu. |
Kalsiyum ve Scandium Atomları birbirinden farklıdır: a) Enerji seviyelerinin sayısı; b) yarıçapı; c) değerlik elektronların sayısı; d) Yüksek oksit formülü. |
|
Kükürt ve krom atomları için aynı şekilde: a) Valans elektronlarının sayısı; b) Enerji seviyelerinin sayısı; c) en yüksek değerlik; d) Yüksek oksit formülü. |
|
Azot ve fosfor atomları: a) Aynı sayıda elektronik katman; b) çekirdeğindeki aynı proton sayısı; c) Aynı sayıda değerlik elektronu; d) Aynı yarıçap. |
|
Alt III Döneminin Yüksek Oksit'in Formülü, ATOM'taki durumun temelde halde üç eşsiz elektron bulunur: a) e 2 o 3; b) eo 2; c) e 2 o 5; d) e 2 o 7. |
|
Yüksek oksit elemanının formülü EO 3. Hidrojen bileşiğinin formülünü belirtin: a) tr 2; b) tr; c) tr 3; d) tr 4. |
|
Ana asit içindeki oksitlerin doğası, rütbelere göre değişir: a) Na 2 O, MGO, SiO 2; B) CL20, S02, P2 O 5, NO 2; c) BEO, MGO, B 2 O 3, AL 2 O 3,; d) CO 2, B20 3, AL 2 O 3, LI 2 O; e) SAO, FE 2 O 3, AL 2 O 3, SO 2. |
|
Formüllerin, bileşiklerin asit özelliklerinin artan sırasına göre düzenlendiği sıraları seçin: a) n205, p2 o 5, 2 O 5; c) H 2 SEO 3, H2S03, H2S0; b) hf, hbr, merhaba; d) AL 2 O 3, p 2 O 5, CL20 7. |
|
Ana özelliklerini arttırmanın sırasıyla hidroksitlerin düzenlendiği bir seri belirtin: a) Lioh, Koh, NaOH; c) LiOH, CA (OH) 2, AL (OH) 3; b) LiOH, NaOH, MG (OH) 2; d) Lioh, Naoh, Koh. |
Görevler
Fosfor örneği iki nükledi içerir: fosfor-31 ve fosfor-33. Fosfor-33'ün molar fraksiyonu% 10'dur. Bu numune içinde fosforun nispi atomik kütlesini hesaplayın.
Doğal bakır CU 63 ve CU 65 nüklidlerinden oluşur. CU 63 atomunun sayısının, karışımdaki CU 65 atomunun sayısına oranı 2.45: 1.05'tir. Bakırın göreceli atomik kütlesini hesaplar.
Doğal klorin ortalama göreceli atomik kütlesi 35.45'tir. Kütle numaralarının 35 ve 37'ye eşit olduğu biliniyorsa, iki izotopunun molar fraksiyonlarını hesaplayın.
Oksijen numunesi iki nükledi içerir: 16 o ve 18 O, bunlar buna göre 4.0 g ve 9.0 g olan. Bu numunedeki oksijenin göreceli atomik kütlesini belirler.
Kimyasal eleman iki nüklidden oluşur. İlk nüklidin çekirdeği 10 proton ve 10 nötron içerir. İkinci nükledin çekirdeğinde 2 kişi daha. 9 atomunda, daha ağır bir nüklidin bir atomunu oluşturur. Öğenin ortalama atomik ağırlığını hesaplar.
Niseli atom kütlesinin, her 4 oksijen atomu-16 için doğal karışımda, 3 oksijen-17 atomu ve 1 oksijen atomu-18 için muhasebeleştirilmiş olması durumunda oksijen olacaktır.
Yanıtlar:1. 31,2. 2. 63,6. 3. 35 CL:% 77.5 ve 37 CL:% 22.5. 4. 17,3. 5. 20,2. 6. 16,6.
Kimyasal İletişim
Eğitimsel materyalin ana hacmi:
Kimyasal bağların niteliği ve türleri. Kimyasal bağın ana parametreleri: enerji, uzunluk.
Kovalent bağlantı. Kovalent iletişimin oluşumu için değiş tokuş edilmiş ve donör-alıcı mekanizmalar. Kovalent bağın yönü ve doygunluğu. Kovalent bir bağın kutuplılığı ve kutuplanabilirliği. Değerleme ve oksidasyon derecesi. A-Grup unsurlarının atomlarının valental yetenekleri ve değerlik koşulları. Tek ve çoklu bağlantı. Atom kristal keçeleri. Atomik orbitallerin hibridizasyonu kavramı. Ana hibridizasyon türleri. Bağların köşeleri. Moleküllerin mekansal yapısı. Moleküllerin ampirik, moleküler ve yapısal (grafik) formülü.
İyon İletişim. İyonik kristal kafesler. Moleküler, atomik ve iyonik yapıya sahip maddelerin kimyasal formülleri.
Metal İletişim. Crystal Metals Kafesleri.
Moleküler etkileşim. Moleküler kristal kafes. İntermoleküler etkileşimin enerjisi ve toplu maddelerin hali.
Hidrojen bağı.Doğal nesnelerde hidrojen bağlarının değeri.
Çalışma sonucunda öğrenciler bilmelidir:
kimyasal bir ilişki nedir;
ana kimyasal tahvil türleri;
kovalent iletişim eğitimi mekanizmaları (değişim ve donör-alıcı);
kovalent bağın ana özellikleri (doygunluk, yön, polarite, çokluk, S ve P-iletişim);
İyonik, metal ve hidrojen bağlarının ana özellikleri;
ana kristal kafes türleri;
enerji kaynağının nasıl değiştiği ve bir agrega durumdan diğerine geçişte moleküllerin doğası;
amorf bir yapıya sahip maddelerden kristal bir yapıya sahip olan maddeler tarafından ayırt edilir.
Konuyu incelemek sonucunda öğrenciler beceri kazanmalıdır:
Çeşitli bileşiklerde atomlar arasındaki kimyasal bağ tipinin tanımları;
kimyasal bağların enerjilerinin gücünün karşılaştırılması;
çeşitli maddelerin formülleri ile oksidasyon derecelerinin belirlenmesi;
atomik orbitallerin hibridizasyonu teorisine dayanan bazı moleküllerin geometrik şeklinin kurulması;
maddelerin özelliklerinin tahmin edilmesi ve karşılaştırılması, ilişkinin niteliğine ve kristal kafes türüne bağlı olarak.
Konuyu öğrenmeyi bitirmiş olan öğrenciler sunum yapmalı:
- Moleküllerin mekansal yapısında (kovalent bağların yönü, değerlik açısı);
- Atomik orbitallerin hibridizasyonu teorisi üzerine (SP3 -, SP2 -, SP-Hibridizasyon)
Konuyu incelemek, öğrenciler hatırlamalıdır:
sabit bir oksidasyon derecesine sahip unsurlar;
bu elemanların bunların bunların oksidasyon derecesinin karakteristik olmadığı hidrojen ve oksijen bileşikleri;
su molekülündeki bağlantılar arasındaki açının büyüklüğü.
Bölüm 1. Kimyasal niteliği ve türleri
Maddelerin formülleri verilmektedir: Na2 O, SO 3, KCL, PCL 3, HC1, H2, CL2, NaCl, CO2, (NH4) 2 S04, H20 2, CO, H2S, NH 4 CL, SO 2, HI, RB 2 SO 4, SR (OH) 2, H 2 SEO 4, HE, SCCL 3, N 2, ALBR 3, HBR, H 2 SE, H20, H2, CH 4, nh 3, ki, cabr 2, bao, hayır, fcl, sic. Bağlantıları seçin:
moleküler ve elastik olmayan yapı;
sadece kovalent polar bağlarla;
sadece kovalent polar olmayan bağlarla;
sadece iyonik bağlantılarla;
İyonik ve kovalent bağların yapısında birleştirilmesi;
kovalent polar ve kovalent polar olmayan bağlantıların birleştirilmesi;
hidrojen bağları oluşturabilme;
donör-alıcı mekanizma tarafından oluşturulan iletişimin yapısına sahip olmak;
Rütbelerdeki bağlantıların polaritesi nasıl?
a) H20; H 2 S; H 2 se; H 2 te b) pH 3; H 2 S; Hcl.
Ana veya heyecanlı olan hangi durumda, aşağıdaki bağlantılarda izole elemanların atomları vardır:
B.Cl3; P.Cl3; SİO 2; Olmak.F 2; H 2. S.; C.H 4; H. Cl.O 4?
Kimyasal etkileşimde bu unsurların bir çiftinin iyon iletişimi oluşturma eğiliminde olduğu şeyleri vardır:
Ca, c, k, o, i, cl, f?
Aşağıda önerilen kimyasallardan hangisinde, Bond rüptürünün iyonların oluşumuna devam etme olasılığı daha yüksektir ve bunların ücretsiz radikaller oluşturacağı, NaCl, CS 2, CH4, K2 O, H 2 S04, KOH, CL 2?
Dana Halojen ırkları: HF, HCL, HBR, HI. Bir halojen bahçe seçin:
sulu çözeltisi, en güçlü asit olan (en zayıf asit);
en polar bağ ile (en az polar bağ);
en yüksek iletişim uzunluğu (en düşük iletişim uzunluğu ile);
en büyük kaynama noktasıyla (en küçük kaynama noktasıyla).
Bir kimyasal bağ oluştururken, floro florosu 2.64'ü serbest bırakılır.
10 -19 J Enerji. 1.00 KJ'yi 1,00 KJ'yi ayırt etmek için kimyasal sayıda flor moleküllerinin oluşması gerektiğini hesaplayın.
Test 6.
Molekül iki izole atomdan oluştuğunda, sistemdeki enerji: a) artışlar; b) azalır; c) değişmez; d) Hem düşüş hem de enerjide bir artış olası. |
|
Hangi tür maddelerin, genel elektronik çiftlerin oksijen atomuna doğru kaydırıldığını gösterir: a) 2 ve co; b) cl 2 o ve hayır; c) h20 ve n203; d) H20 2 ve 02 f 2. |
|
Kovalent polar olmayan bir bağlantı ile bağlantıları belirtin: a) o 2; b) n 2; c) cl 2; d) PCL 5. |
|
Bir kovalent polar bağ ile bağlantıları belirtin: a) H20; b) br 2; c) cl20; d) SO 2. |
|
Birkaç molekül seçin, kovalent olan tüm bağlantılar: a) NaCl, HC1; b) CO 2, Na 2 O; c) ch3 cl, ch 3 na; d) SO 2, NO 2. |
|
Kovalent polar ve kovalent olmayan polar iletişimi olan bağlantılar sırasıyla: a) su ve hidrojen sülfit; b) Bromür potasyum ve azot; c) amonyak ve hidrojen; d) oksijen ve metan. |
|
Kovalent bağların hiçbiri, bir parçacıktaki bir donör-alıcı mekanizma tarafından oluşturulmaz: a) CO 2; b) co; c) bf 4 -; d) NH4 +. |
|
Bağlı atomların elektriksel olumsuzluğundaki fark meydana gelir: a) İletişim kutuplarının azaltılması; b) İletişim kutuplarının güçlendirilmesi; c) İyonik iletişimin derecesinde bir artış; d) İyonik iletişimin derecesini azaltmak. |
|
İletişim kutuplarının arttırılması sırasına göre hangi moleküller bulunur? a) HF, HCL, HBR; b) NH3, pH 3, kül 3; c) H 2 SE, H 2 S, H20; d) CO2, CS 2, CSE 2. |
|
Moleküldeki en büyük bağlayıcı enerji: a) h 2 te; b) h 2 se; c) h 2 s; d) H 2 O. |
|
Kimyasal bağ, molekülde en az dayanıklıdır: a) bromomodorod; b) Klorür; c) iyododorodor; d) Fluoroodorod. |
|
İletişimin uzunluğu, formüllere sahip bir maddede artışlar: a) CCl 4, CBR 4, CF 4; b) SO 2, SEO 2, TEO 2; c) H 2 S, H20, H 2 SE; d) HBR, HCL, HF. |
|
Azami sayıs.- Moleküldeki iki atom arasında bulunabilecek iletişim: a) 1; b) 2; 3'te; d) 4. |
|
İki atom arasındaki üçlü bağlantı aşağıdakileri içerir: a) 2 s-tahvil ve 1 π-bond; b) 3 s iletişim; c) 3 π-tahvil; d) 1S iletişim ve 2π-tahviller. |
|
Molekül S. 2 Kimyasal bağlantılar içerir: a) 1s ve 1π; b) 2s ve 2π; c) 3s ve 1π; d) 4s. |
|
Toplamaks.- BEN.π- bağlantılar (s. + π) moleküldeYANİ. 2 Cl. 2 eşittir: a) 3 + 3; b) 3 + 2; c) 4 + 2; d) 4 + 3. |
|
İyon Bond ile bağlantıları belirtin: a) sodyum klorür; b) karbon oksit (ii); c) iyot; d) Nitrat potasyum. |
|
Sadece iyonik iletişim, maddenin yapısını destekler: a) sodyum peroksit; b) Kireçli limon; c) bakır sipop; d) sylvinit. |
|
Hangi elemanın metal ve iyon iletişiminin oluşumuna katılabileceğini belirtin: a) olarak; b) br; c) k; d) se. |
|
Bileşikteki iyonik iletişimin en belirgin karakteri: a) kalsiyum klorür; b) Potasyum florür; c) alüminyum florür; d) sodyum klorür. |
|
Toplam durumun, normal koşullar altında, moleküller arasındaki hidrojen bağlarıyla belirlendiği maddeleri belirtin: a) hidrojen; b) Klorür; c) sıvı flor bahçesi; d) Su. |
|
En dayanıklı hidrojen bağı belirtin: a) -N .... h-; b) -o .... h-; c) -cl .... h-; d) -s .... H-. |
|
Hangi kimyasal ilişki en az güçlüdür? metal; b) İyonik; c) hidrojen; d) kovalent. |
|
NF molekülündeki iletişim türünü belirtin 3 : a) İyonik; b) Kutupsuz kovalent; c) polar kovalent d) Hidrojen. |
|
Sıra numaraları 8 ve 16 ile elemanların atomları arasındaki kimyasal bağ: a) İyonik; b) kovalent polar; c) kovalent polar olmayan; d) Hidrojen. |
|
Periyodik hukuk.
Bina atomu
Makale, 8. sınıfta tematik kontrol için yazarlar tarafından hazırlanan test görevleri konusundaki test görevlerini sunar. (Banka kapasitesi - 8. sınıfta incelenen altı konunun her biri için 80 görev ve "temel inorganik bileşiklerin temel sınıfı" konusundaki 120 görev.) Şu anda, 8. sınıftaki kimya eğitimi dokuz ders kitaplarında gerçekleştirilir. Bu nedenle, makalenin sonunda, görev numaralarını belirten kontrollü bilgi unsurlarının bir listesi verilir. Bu, öğretmenlerin hem bir konudan hem uygun görev dizisini hem de son kontrol için de dahil olmak üzere farklı konulardan bir dizi test görevi kombinasyonunu seçmek için öğretmenlerin farklı programlarda çalışmasına izin verecek.
Önerilen 80 test görevleri, benzer işlerin tekrarlandığı dört seçenekte 20 soru ile gruplandırılır. Bilgi öğeleri listesinden daha fazla seçenek derlemek için, incelenen her öğenin tematik planlamanıza uygun olarak (rastgele) görev numaralarını seçin. Her konu için böyle bir görev sunumu, hataların hızlı bir eleman analizini ve zamanında düzeltmelerini sağlar. Benzer görevlerin bir düzenlemede kullanılması, bir veya iki doğru cevabın alternasyonu, cevabı tahmin etme olasılığını azaltır. Sorunların karmaşıklığı, kural olarak, 1. ve 2. seçeneklerden 3. ve 4. seçeneklere kadar artar.
Testlerin "tahmin" olduğu görüşü var. Olup olmadığını kontrol etmenizi öneririz. Testten sonra sonuçları işaretleriyle karşılaştırın. Test sonuçları aşağıdaysa, aşağıdaki nedenlerle açıklanabilir.
İlk olarak, böyle (test) öğrenciler için sıradışıdır. İkincisi, öğretmen konunun çalışmasında vurgu yapar (eğitim ve öğretim metodolojisinin içeriğinde ana belirleyici).
seçenek 1
Görevler.
1. 4. dönemde, Grup üzerinden dizisi numarasına sahip bir elementtir:
1) 25; 2) 22; 3) 24; 4) 34.
2. ATOM +12'nin çekirdeğinin şarjı olan eleman bir dizi numarası vardır:
1) 3; 2) 12; 3) 2; 4) 24.
3. Öğenin sıra numarası bu özelliklere karşılık gelir:
1) Atom çekirdeğinin şarjı;
2) proton sayısı;
3) nötron sayısı;
4. Grup numarasıyla elemanların atomlarında dış enerji seviyesindeki altı elektron:
1) II; 2) III; 3) vi; 4) iv.
5. Yüksek oksit klor formülü:
1) SL 2 O; 2) CL20 3;
3) CL20 5; 4) CL20 7.
6. Alüminyum atomunun değerliği:
1) 1; 2) 2; 3) 3; 4) 4.
7. Grup VI'nin elemanlarının uçucu hidrojen bileşiklerinin toplam formülü:
1) EN 4; 2) tr 3;
3) ne; 4) H 2 E.
8. Kalsiyum Atomundaki Dış Elektronik Katmanın Sayısı:
1) 1; 2) 2; 3) 3; 4) 4.
9.
1) li; 2) na; 3) k; 4) CS.
10. Elements-Metals belirtin:
1) k; 2) cu; 3) o; 4) N.
11. Tabloda D.i. Imeleeva nerede, elementler, kimyasal reaksiyonlarda atomları yalnızca elektronlar verir?
1) Grup II'de;
2) 2. periyodun başında;
3) 2. periyodun ortasında;
4) via grupta.
12.
2) ve, mg; Al;
3) mg, ca, sr;
13. Metalsız olmayan elemanları belirtin:
1) CL; 2) s; 3) mn; 4) mg.
14. Metalik olmayan özellikler üst üste artış:
15. Periyodik olarak atom değişiminin özellikleri nedir?
1) şarj çekirdeği atomu;
2) Atomdaki enerji seviyelerinin sayısı;
3) Dış enerji seviyesindeki elektronların sayısı;
4) Nötron sayısı.
16.
1 İLA; 2) al; 3) p; 4) cl.
17. Çekirdeğin sorumluluğunda artışa sahip bir dönemde, elemanların atomlarının yarıçapları:
1) azalma;
2) Değiştirmeyin;
3) artış;
4) Periyodik olarak değiştirin.
18. Bir elemanın atomlarının izotopları:
1) nötron sayısı;
2) proton sayısı;
3) değerlik elektronların sayısı;
4) D.i. IMENDEEVA tablosundaki hüküm.
19. 12 S atomun çekirdeğindeki nötron sayısı:
1) 12; 2) 4; 3) 6; 4) 2.
20. Elektronların florin atomunda enerji seviyeleri ile dağılımı:
1) 2, 8, 4; 2) 2,6;
3) 2, 7; 4) 2, 8, 5.
Seçenek 2.
Görevler. Bir veya iki doğru cevap seçin.
21. 35 numaralı sıra ile olan eleman:
1) 7. Dönem, IVA Grubu;
2) 4. Dönem, VIIA Group;
3) 4. Dönem, VIIB Grubu;
4) 7. Dönem, IVB Grubu.
22. +9'un atomunun çekirdeğinin şarjı olan eleman bir dizi numarası vardır:
1) 19; 2) 10; 3) 4; 4) 9.
23. Tarafsız atomdaki proton sayısı ile çakışıyor:
1) nötron sayısı;
2) Atom kütlesi;
3) Sıra numarası;
4) Elektron sayısı.
24. Bir grup numarası olan elemanların atomlarında harici enerji seviyesindeki beş elektron:
1) ben; 2) III; 3) v; 4) VII.
25. Yüksek azot oksit formülü:
1) n20; 2) n 2 o 3;
3) n205; 4) Hayır;
26. Kalsiyum atomunun en yüksek hidroksitindeki değere eşittir:
1) 1; 2) 2; 3) 3; 4) 4.
27. Hidrojen bileşiğindeki arsenik atomun değerliği:
1) 1; 2) 2; 3) 3; 4) 4.
28. Potasyum Atomundaki Dış Elektronik Katmanın Sayısı:
1) 1; 2) 2; 3) 3; 4) 4.
29. Atomun elementten en büyük yarıçapı:
1) b; 2) o; 3) c; 4) N.
30. Elements-Metals belirtin:
1 İLA; 2) h; 3) f; 4) cu.
31. Elektronlar alıp verebilen elementlerin atomları bulunur:
1) IA grubunda;
2) via grupta;
3) 2. periyodun başında;
4) 3. periyodun sonunda.
32.
1) na, k, li; 2) al, mg, na;
3) p, s, сl; 4) na, mg, al.
33. Metalsız olmayan elemanları belirtin:
1) na; 2) mg; 3) si; 4) P.
34.
35. Kimyasal elemanın ana özelliği:
1) Atom kütle;
2) Çekirdeğin şarjı;
3) Enerji seviyelerinin sayısı;
4) Nötron sayısı.
36. Atomları amfoterik oksit formu olan elemanın sembolü:
1) n; 2) k; 3) s; 4) zn.
37. Nucleus'un sorumluluğunda bir artışa sahip kimyasal elementlerin periyodik sisteminin (A) ana alt gruplarında, atom yarıçapı:
1) artışlar;
2) azalır;
3) değişmez;
4) periyodik olarak değişir.
38. Atomun çekirdeğindeki nötronların sayısı:
1) elektron sayısı;
2) proton sayısı;
3) göreceli atom kütlesi ile proton sayısı arasındaki fark;
4) Atom kütlesi.
39. Hidrojen izotopları sayısında farklılık gösterir:
1) elektronlar;
2) Nötronlar;
3) protonlar;
4) Tablodaki pozisyon.
40. Elektronların enerji seviyelerinin sodyum atomunda dağılımı:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5.
Seçenek 3.
Görevler. Bir veya iki doğru cevap seçin.
41. D.I.I. Iveleeva'nın 4. periyodu olan IVA grubunda bulunan elemanın sekans numarasını belirtin:
1) 24; 2) 34; 3) 32; 4) 82.
42. 13 numaralı bir element atomunun çekirdeğinin şarjı:
1) +27; 2) +14; 3) +13; 4) +3.
43. Atomdaki elektron sayısı:
1) nötron sayısı;
2) proton sayısı;
3) Atom kütlesi;
4) Sıra numarası.
44. Grubun IVA unsurlarının atomları, değerlik elektronların sayısı:
1) 5; 2) 6; 3) 3; 4) 4.
45. Genel formül R 2 O 3 formundaki oksitler:
1) na, k, li; 2) mg, ca, olmak;
3) b, al, ga; 4) c, si, ge.
46. Fosfor atomunun en yüksek oksitinde değerliği:
1) 1; 2) 3; 3) 5; 4) 4.
47. Grup VIIA unsurlarının hidrojen bileşikleri:
1) HCLO 4; 2) HCL;
3) HBRO; 4) hbr.
48. Selena Atomundaki elektronik katmanların sayısı:
1) 1; 2) 2; 3) 3; 4) 4.
49. Atomun elementten en büyük yarıçapı:
1) li; 2) na; 3) mg;
50. Elements-Metals belirtin:
1) na; 2) mg; 3) si; 4) P.
51. Hangi elementlerin kolayca elektronlara verdiği atomlar?
1) k; 2) CL; 3) na; 4) S.
52. Metal özelliklerin arttığı çeşitli öğeler:
1) c, n, b, f;
2) al, si, p, mg;
53. Metalsız olmayan elemanları belirtin:
1) na; 2) mg; 3) n; 4) S.
54. Metalik olmayan özelliklerin arttığında bir dizi unsurlar:
1) li, na, k, n;
2) al, si, p, mg;
3) c, n, o, f;
4) NA, MG, AL, K.
55. Atomun çekirdeğinin şarjında, elementlerin metalik olmayan özellikleri:
1) periyodik olarak değiştirin;
2) büyütülmüş;
3) değişmeyin;
4) zayıflar.
56. Atomları amfoterik hidroksit olan elemanın sembolü:
1) na; 2) al; 3) n; 4) S.
57. Elementlerin özelliklerini değiştirme sıklığı ve bileşikleri açıklanmaktadır:
1) dış elektronik tabakanın yapısının tekrarı;
2) Elektronik katman sayısında bir artış;
3) Nötronların sayısında bir artış;
4) Atom kütlesinde bir artış.
58. Sodyum atomunun çekirdeğindeki proton sayısı:
1) 23; 2) 12; 3) 1; 4) 11.
59. Bir elemanın izotoplarının atomları arasındaki fark nedir?
1) proton sayısı;
2) nötron sayısı;
3) Elektron sayısı;
4) Çekirdeğin sorumluluğu.
60. Elektronların lityum atomunda enerji seviyelerine göre dağılımı:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5;
Seçenek 4.
Görevler. Bir veya iki doğru cevap seçin.
61. 29 numaralı sırayla eleman:
1) 4. Dönem, IA Group;
2) 4. Dönem, IB Grubu;
3) 1. Dönem, IA Group;
4) 5. Dönem, IA Group.
62. 15 No'lu bir element atomunun çekirdeğinin şarjı:
1) +31; 2) 5; 3) +3; 4) +15.
63. Atom çekirdeğinin şarjı tarafından belirlenir:
1) elemanın sıra numarası;
2) Grup numarası;
3) Dönem numarası;
4) Atom kütlesi.
64. Grup'un III unsurlarının atomlarında, değerlik elektronların sayısı:
1) 1; 2) 2; 3) 3; 4) 5.
65. En yüksek kükürt oksit bir formüle sahiptir:
1) H 2 S03; 2) H 2 S04;
3) SO 3; 4) SO 2.
66. Yüksek fosfor oksit formülü:
1) p 2 o 3; 2) H 3 PO 4;
3) NRU 3; 4) p 2 o 5.
67. Nitrojen atomunun hidrojen bileşiğinde değerlemesi:
1) 1; 2) 2; 3) 3; 4) 4.
68. D.i.i. REMELEEVA'daki Dönem numarası, atomun aşağıdaki özelliklerine karşılık gelir:
1) değerlik elektronların sayısı;
2) Oksijenli bileşikte daha yüksek değerlik;
3) Toplam elektron sayısı;
4) Enerji seviyelerinin sayısı.
69. Atomun elementten en büyük yarıçapı:
1) CL; 2) br; 3) ben; 4) F.
70. Elements-Metals belirtin:
1) mg; 2) li; 3) h; 4) S.
71. Hangi elemanın bir elektron yapılması daha kolay olduğu atomunda?
1) Sodyum; 2) Sezyum;
3) Potasyum; 4) lityum.
72. Bir satırdaki metal özellikleri artış:
1) na, mg, al; 2) na, k, rb;
3) rb, k, na; 4) p, s, cl.
73. Metalsız olmayan elemanları belirtin:
1) cu; 2); 3) n; 4) cr.
74. N-P-AS-SB Metalik olmayan özellikler:
1) azalma;
2) Değiştirmeyin;
3) artış;
4) azalır ve daha sonra arttırın.
75. Atomun hangi özellikleri periyodik olarak değişir?
1) Göreceli atom kütlesi;
2) Çekirdeğin şarjı;
3) Atomdaki enerji seviyelerinin sayısı;
4) Dış düzeydeki elektronların sayısı.
76. Amfoterik oksit hangi element formundaki atomları?
1 İLA; 2) ve; 3) c; 4) SA.
77. Atomun sorumluluğunda artışa sahip olan dönemde çekirdeği çekirdeği ve metal özelliklerine elektronların çekiciliğini arttırır:
1) büyütülmüş;
2) periyodik olarak değiştirin;
3) zayıflatmak;
4) Değiştirmeyin.
78. Elemanın göreceli atom kütlesi, sayısal olarak aşağıdakilere eşittir:
1) Çekirdekteki protonların sayısı;
2) çekirdekteki nötronların sayısı;
3) toplam nötron ve proton sayısı;
4) Atomdaki elektronların sayısı.
79. Bir atomun 16 O çekirdeğindeki nötronların sayısı:
1) 1; 2) 0; 3) 8; 4) 32.
80. Elektronların silikon atomunda enerji seviyelerine göre dağılımı:
1) 2, 8, 4; 2) 2, 6;
3) 2, 7; 4) 2, 8, 5.
Konudaki kontrollü bilgi unsurlarının listesi
"Periyodik hukuk. Atomun yapısı
(Parantez içinde iş numaraları ile verilir)
Elemanın (1, 3, 21, 41, 61) dizisi, atomun çekirdeğinin (2, 22, 42, 62, 63), proton sayısı (23) ve elektron sayısı (43) atomda.
Grup numarası, dış enerji seviyesindeki elektronlar (4, 24, 44, 64), daha yüksek oksit formülleri (5, 25, 45, 65), elemanın en yüksek değerliği (6, 26, 46, 66), formüller hidrojen bileşiklerinin (7, 27, 47, 67).
Dönem numarası, elektronik seviye sayısı (8, 28, 48, 68).
Bir atomun yarıçapını değiştirin (9, 17, 29, 37, 49, 67, 69).
Tablo D.I. REMEFELEEVA Elements-Metals (10, 30, 50, 70) ve metal olmayan unsurlar (13, 33, 53, 73).
Atomların elektronlar vermesi ve kabul etme yeteneği (11, 31, 51, 71).
Basit maddelerin özelliklerini değiştirme: Gruplara (12, 14, 34, 52, 54, 74) ve periyotlar (32, 72, 77).
Atın elektronik yapısında periyodik değişim ve basit maddelerin özellikleri ve bileşikleri (15, 35, 55, 57, 75, 77).
Amphoteri Oksitler ve Hidroksitler (16, 36, 56, 76).
Kütle numarası, atomun, izotoplardaki protonların ve nötronların sayısı (18, 19, 38, 39, 58, 59, 78, 79).
Elektronların Atomun (20, 40, 60, 80) enerji seviyelerine göre dağılımı.
Konudaki Görevleri Test Cevapları
"Periyodik hukuk. Atomun yapısı
| seçenek 1 | Seçenek 2. | Seçenek 3. | Seçenek 4. | ||||
|---|---|---|---|---|---|---|---|
| Arayış numarası | Yanıt numarası | Arayış numarası | Yanıt numarası | Arayış numarası | Yanıt numarası | Arayış numarası | Yanıt numarası |
| 1 | 4 | 21 | 2 | 41 | 3 | 61 | 2 |
| 2 | 2 | 22 | 4 | 42 | 3 | 62 | 4 |
| 3 | 1, 2 | 23 | 3, 4 | 43 | 2, 4 | 63 | 1 |
| 4 | 3 | 24 | 3 | 44 | 4 | 64 | 3 |
| 5 | 4 | 25 | 3 | 45 | 3 | 65 | 3 |
| 6 | 3 | 26 | 2 | 46 | 3 | 66 | 4 |
| 7 | 4 | 27 | 3 | 47 | 2, 4 | 67 | 3 |
| 8 | 4 | 28 | 4 | 48 | 4 | 68 | 4 |
| 9 | 4 | 29 | 1 | 49 | 5 | 69 | 3 |
| 10 | 1, 2 | 30 | 1, 4 | 50 | 1, 2 | 70 | 1, 2 |
| 11 | 1, 2 | 31 | 2, 4 | 51 | 1, 3 | 71 | 2 |
| 12 | 3 | 32 | 2 | 52 | 3 | 72 | 2 |
| 13 | 1, 2 | 33 | 3, 4 | 53 | 3, 4 | 73 | 2, 3 |
| 14 | 1 | 34 | 4 | 54 | 3 | 74 | 1 |
| 15 | 3 | 35 | 2 | 55 | 1 | 75 | 4 |
| 16 | 2 | 36 | 4 | 56 | 2 | 76 | 2 |
| 17 | 1 | 37 | 1 | 57 | 1 | 77 | 3 |
| 18 | 1 | 38 | 3 | 58 | 4 | 78 | 3 |
| 19 | 3 | 39 | 2 | 59 | 2 | 79 | 3 |
| 20 | 3 | 40 | 2 | 60 | 1 | 80 | 1 |
Edebiyat
Gorodnichev I.N.. Kimyanın kontrolü ve doğrulanması. M.: Akvaryum, 1997; Sorokin v.v., zlotnikov e.g. Kimya testleri. M.: Eğitim, 1991.
Atomların en önemli özelliklerindeki değişikliklerin periyodikliği üzerine yukarıda belirtilmiştir (s. 172). Değişimi frekans ile karakterize olan başka önemli özellikler de vardır. Bu özellikler, atomun boyutunu (yarıçapı) içerir. Atomun yok yüzeylerve kenarlık belirsizdir, harici elektron bulutlarının yoğunluğu olduğu için sorunsuz bir şekilde azalır. Atom yarıçapındaki veriler, moleküller ve kristal yapılardaki merkezleri arasındaki mesafelerin belirlenmesinden elde edilir. Hesaplamalar, kuantum mekaniğinin denklemlerine dayanarak da yapıldı. İncirde. 5.10
İncir. 5.10. Atomik yarıçaptaki değişikliklerin sıklığı
Çekirdeğin sorumluluğuna bağlı olarak atomik yarıçaptaki değişikliklerin eğrisi.
Hidrojenden Helyum'a kadar, yarıçap azalır ve ardından lityumda keskin bir şekilde artmaktadır. Bu, ikinci enerji seviyesindeki bir elektronun ortaya çıkmasından kaynaklanmaktadır. Lityumdan neo'ya ikinci dönemde, çekirdeğin sorumluluğu arttıkça, Radii azalır.
Aynı zamanda, bu enerji seviyesindeki elektron sayısındaki bir artış, karşılıklı itmelerinde bir artışa yol açar. Bu nedenle, dönemin sonunda, yarıçaptaki düşüş yavaşlar.
Neondan sodyumdan sodyumdan geçerken - üçüncü periyodun ilk elemanı - yarıçap tekrar keskin bir şekilde artar ve daha sonra argon'a yavaş yavaş azalır. Bundan sonra, potasyumda yarıçapta keskin bir artış var. Karakteristik bir periyodik testere eğrisi ortaya çıkar. Alkali metal eğrisinin asil bir gaza kadar her bölüm, dönemdeki yarıçaptaki değişimi karakterize eder: geçiş sırasında yarıçapta soldan sağa doğru bir düşüş vardır. Radii'deki değişimin niteliğini unsur gruplarında bulmanın ilginç olması da ilginçtir. Bunu yapmak için, aynı grubun unsurları arasında bir çizgi tutmanız gerekir. Maxima'nın Alkali Metal'deki konumuna göre, gruptaki geçiş sırasında atomların tepesine yukarıdan aşağıya doğru arttığını doğrudan görülmektedir. Bu, elektronik kabuk sayısındaki artıştan kaynaklanmaktadır.
görev 5.17. Atomların F 'dan değişimini nasıl değiştirir? Bunu incir. 5.10.
Atomların diğer birçok özelliği, hem fiziksel hem de kimyasal, yarıçaplara bağlıdır. Örneğin, atomların yarıçapındaki bir artış, lityumdan sezyumdan sezyumdan gelen alkali metal erime sıcaklıklarındaki düşüşü açıklayabilir:
Atomların boyutları, enerji özellikleriyle ilişkilidir. Harici elektron bulutlarının yarıçapı ne kadar yüksek olursa, bir elektronun bir elektronun kaybedilmesi daha kolaydır. Aynı zamanda, pozitif yüklü bir şekilde dönüşür. ve o.
İyon, elektronların kaybı veya eklenmesi nedeniyle elektrik yükünün olası durumlarından biridir.
Bir atomun pozitif yüklü bir iyona taşınmasıdır. İyonlaşma enerjisi E I.Bu, harici bir elektronun gaz durumundaki bir atomdan ayrılması için gereken minimum enerjidir:
![]()
Elde edilen pozitif iyon, elektronları da kaybedebilir, iki zincir, üç grafik vb. Olabilir. İyonizasyon enerjisinin büyüklüğü büyük ölçüde artmaktadır.
Atomların iyonlaşma enerjisi, soldan sağa doğru ilerlediklerinde ve yukarıdan aşağıya doğru geçiş yaparken gruplar halinde azalırken dönemde artmaktadır.
Birçok, ancak tüm atomlar ek bir elektron ekleyebilir, olumsuz yüklü bir iyon a ~. Bu özellik karakterizedir elektron Enerji E Enerji E cf. Bu, elektron, gaz durumunda bulunan atoma bağlandığında ayırt edilen enerjidir:
![]()
Hem iyonlaşmanın enerjisi hem de elektronun çimlenmesinin enerjisi gelenekseldir. 1 köstebek atomları ve KJ / Mol'deki ekspres. Bir elektronun bağlanması ve kaybı sonucu sodyum atomunun iyonizasyonunu düşünün (Şekil 5.11) . Şekilden itibaren, bir elektronun sodyum atomundan hariç tutulması gerektiği açıktır. 10 bir elektron bağlı olduğunda tahsis edilenden bir kez daha enerji. Negatif sodyum iyonu dengesiz ve karmaşık maddelerde neredeyse hiç bulunmaz.

İncir. 5.11. Sodyum atomunun iyonizasyonu
Atomların iyonlaştırma enerjisi, atomların yarıçapındaki değişimin karşısındaki yöndeki dönemlerde ve gruplar halinde değişir. Dönemdeki elektrona afinite enerjisindeki değişim, IIA ve VIIIA-RPYNN afinitesinin unsurları olmadığından daha zordur. Bir elektron afinitesinin enerjisinin gibiyeceğini varsayabiliriz. Edönemlerde artar (VII'ye dahil olmak üzere) ve yukarıdan aşağıya doğru gruplar halinde azalır (Şek. 5.12).
görev 5 .Eighten. Magnezyum ve argon atomları, olumsuz yüklü iyonlardan oluşan gaz halinde mi?
Olumlu ve olumsuz ücretli iyonlar, kendi aralarında çeşitli dönüşümlere yol açar. En basit durum, iyonik bağlantıların oluşumu, yani elektrostatik çekim eylemi altındaki bir maddedeki iyonların birleştirilmesidir. Daha sonra iyonik kristal yapısı, NaCl gıda tuzunun ve diğer birçok tuzunun özelliği oluşur. Ama belki

İncir. 5.12. Gruplardaki ve dönemlerde bir elektron afinitesinin iyonlaştırma ve enerjisinin enerjisindeki değişikliklerin niteliği
bu nedenle, negatif iyon fazla elektronunu çok sıkı tutmaz ve aksine pozitif bir iyon, elektronikliğini geri yüklemeyi amaçlamaktadır. Daha sonra iyonlar arasındaki etkileşim moleküllerin oluşumuna yol açabilir. Açıkçası, C1 + ve C1'in farklı işaretinin iyonları, kendi aralarında çekilir. Ancak bunların aynı atomların iyonları olması nedeniyle, atomlarda sıfır masraflarla C12 molekülü oluştururlar.
Sorular ve alıştırmalar
1. Kaç proton, nötron ve elektronlar bromin atomlarından oluşur?
2.
İzotoping yapısının kütle kesirlerini hesaplar. ![]()
3. Oluşum 16 sırasında ne kadar enerji yayınlanır? g.reaksiyona göre oksijen ![]() Yıldızların derinliklerinde akıyor?
Yıldızların derinliklerinde akıyor?
4. Elektron enerjisini, ne zaman heyecanlı bir hidrojen atomunda hesaplayın. n \u003d3.
5. İyot atomunun tamamını ve kısaltılmış elektronik formüllerini yazın.
6. Azaltılmış bir elektronik iyon formülü yazın.
7. Komple ve kısaltılmış elektronik formüller atomu ve IONA 2 yazın.
8. Fosfor ve arsenik atomların enerji diyagramları oluşturun.
9. Çinko ve galyum atomlarının tam enerji diyagramları oluşturun.
10. Aşağıdaki atomları yarıçapı arttırma sırasına göre yerleştirin: alüminyum, bor, azot.
11. Aşağıdaki iyonlardan hangisi kendi aralarında iyonik kristal yapılar oluşturuyorlar: R + R -, K +, K -, I +, I -, Li +, Li -? İyonların diğer kombinasyonlarda etkileşiminde ne beklenebilir?
12. Periodik sistemin çapraz yönündeki geçiş sırasında atomların yarıçapının olası niteliğini, örneğin LI - MG - SC.