Karakteristika elemenata atoma navedenih u nastavku. Kemija
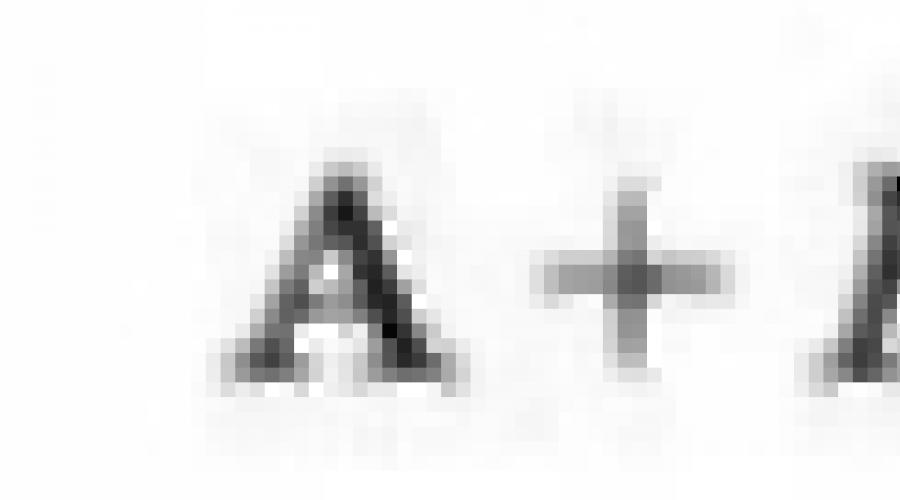
Ispit br. 2 sadrži zadatke na sljedeće teme:
- Periodični sustav
- Učestalost mijenjanja svojstava elemenata i njihovih spojeva.
- Kemijska veza. Metoda Sunca
- Kemijska veza. Metoda MO.
- Kemijska veza. Ionska veza.
- Kemijska veza u složenim spojevima.
Test za provjeru znanja:
1. Od karakteristika elemenata atoma navedenih u nastavku se povremeno mijenjaju
(1) naknada za jezgru atoma;
(2) relativna atomska masa;
(3) broj razina energije u atomu;
(4) broj elektrona u vanjskoj razini energije.
2. Unutar razdoblja, povećanje sekvence broj elementa obično je popraćeno
(1) s smanjenjem atomskog radijusa i povećanje elektronegativnosti atoma;
(2) povećanje atomskog radijusa i smanjenje elektronegabilnosti atoma;
(3) s smanjenjem atomskog radijusa i smanjenja elektronegabilnosti atoma;
(4) povećanje atomskog radijusa i povećanje elektronegabilnosti atoma.
3. Atoma od kojih je element najlakši način da se jedan elektron (brojevi znače da je broj sekvence elementa):
(1) natrij, 11; (2) magnezij, 12; (3) aluminij, 13; (4) silicij, 14?
4. Atomi elemenata 1A periodičnog sustava elemenata imaju isti broj
(1) elektroni na vanjskoj elektroničkoj razini;
(2) neutroni;
(3) Svi elektroni.
5. Elementi se nalaze u redoslijedu povećanja elektronegabilnosti u redu
(1) kao, SE, Cl, f; (2) c, i, b, si; (3) br, p, h, sb; (4) o, se, br.
6. U drugom i trećem razdoblju periodnog sustava kako se veličina elemenata smanjuje
(1) smanjena je i veličina njihovih iona;
(2) Smanjenje električne energije;
(3) Svojstva metala elemenata oslabiti;
(4) Poboljšana su metalna svojstva elemenata.
7. Koji broj uključuje samo prijelazne elemente:
(1) elementi 11, 14, 22, 42; (2) Elementi 13, 33, 54, 83;
(3) Elementi 24, 39, 74, 80; (4) Elementi 19, 32, 51, 101?
8. Koji od dolje navedenih elemenata ima kemijska svojstva, omogućujući govoriti o svojoj sličnosti s elementom kalcija:
(1) ugljik. IZ; (2) natrij, na; (3) kalij. DO; (4) stroncij, sr?
9. Nemetalna svojstva elemenata koji se nalaze u glavnim podskupinama periodičnog sustava D. I. Mendeleev su najizraženiji u onima koji se nalaze
(1) na vrhu podskupine;
(2) na dnu podskupine;
(3) u sredini podskupine;
(4) U svim elementima, podskupina se izražava u istom stupnju.
10. Koji je broj elemenata predstavljen u uzlaznom redoslijedu atomskog radijusa:
(1) O, S, SE, oni; (2) C, N, O, f; (3) Na, mg, al, si; (4) i, br, cl, f?
11. Metalna priroda svojstava elemenata u nizu Mg-ca-SR-BA
(1) se smanjuje;
(2) se povećava;
(3) ne mijenja;
12. Nemetalna priroda svojstava elemenata u brojnom N-p-as-sb-bi
(1) se smanjuje;
(2) se povećava;
(3) ne mijenja;
(4) se smanjuje, a zatim se povećava.
13. Koja parna u određenom skupu elemenata - CA, P, SI, AG, N, kao - ima najsličnije kemijska svojstva:
(1) SA, SI; (2) AG, ni; (3) p, kao; (4) ni, r?
14. Prema njegovim kemijskim svojstvima, radioaktivni element radija je najbliži
(1) cezij; (2) barij; (3) landhan; (4) Actinia.
15. Na temelju položaja lantanskog elementa u periodnom sustavu, sigurno je tvrditi da će lanthanidi biti najkarakterističniji stupanj oksidacije
(1) +1; (2) +2; (3) +3; (4) +4.
16. Glavna svojstva hidroksida elemenata skupine 1A kao broj sekvenci se povećava
(1) smanjenje;
(2) povećanje;
(3) ostaju nepromijenjeni;
(4) smanjenje, a zatim povećati.
17. Na temelju položaja elemenata u periodnom sustavu, najvjerojatniji zglob Njemačke selena može se prikazati formulom.
18. Hipotetički element z oblikuje ZCl 5 klorid. Koja je najvjerojatnija formula za oksid:
(1) ZO 2; (2) ZO 5; (3) Z205; (4) z 5 o2?
19. Jednostavne tvari koje elementi imaju najveću sličnost fizikalnih i kemijskih svojstava:
(1) li, s; (2) biti, Cl; (3) f, Cl; (4) li, f?
20. Od elemenata trećeg perioda, najizraženija nemetalna svojstva ima
(1) aluminij; (2) silicij; (3) sumpor; (4) klor.
21. Od gore navedenih elemenata IIIA, izrečena nemetalna svojstva
(1) bor; (2) aluminij; (3) galij; (4) Indija.
22. Koji od gore navedenih elemenata četvrtog razdoblja periodnog sustava manifestira iste vrijednosti valencije u njihovom hidrogenskom spoju i na najvišem oksidu:
(1) brom; (2) germanij; (3) arsen; (4) selenium?
23. Promijenjena je priroda oksida u retku P2O5 -SIO 2-l 2 o z-MGGO:
(1) od glavnog do kiselog;
(2) iz kiseline do glavnog;
(3) od glavnog do amfotera;
(4) od amfotere do kiselog.
24. Napišite formule viših oksida elemenata i odgovarajuće kiseline; Navedite ove kiseline:
25. Na temelju položaja elementa u periodnom sustavu napišite njegove spojeve koji su navedeni u nastavku:
26. Iz gore navedenog popisa elemenata: BE, B, C, N, Al, SI, P, S, GA, GE, kao, FR - EO 2 tipi oksidi, i hidridi tipa 4 -.
27. Na temelju položaja elementa u periodnom sustavu, ispišite formule za svoj najviši oksid i hidroksid i ukazuju na njihovu prirodu:
28. Element s sekvencom broj 34 tvori vodikov spoj, viši oksid i hidroksid. Potonji se manifestira
(1) svojstva kiselina;
(2) osnovna svojstva;
(3) amfoterična svojstva.
29. Maksimalan broj kemijskih elemenata koji mogu ispuniti šesto razdoblje periodnog sustava trebaju biti jednaki
(1) 8; (2) 18; (3) 32; (4) 50.
30. Maksimalni broj stavki u sedmomeriodu trebao bi biti
(1) 18; (2) 32; (3) 50; (4) 72.
31. U sedmom razdoblju, potonji mora biti element prema broju slijeda
(1) 118; (2) 114; (3) 112; (4) 110.
32. Svojstva alkalijskih metala treba očekivati \u200b\u200bod elemenata s brojevima sekvence
(1) 111 i 190; (2) 119 i 169; (3) 137 i 187; (4) 155 i 211.
33. Konfiguracija bizmutnih orbitala valentnih elektrona se podudara s
(1) selen i Tellurium;
(2) dušik i fosfor;
(3) silicij i germanij;
(4) niobij i tanthal.
34. Treba pripisati element s redoslijedom broja 117
(1) lame alkalne metalne; (3) halogeni;
(2) alkalna zemljana metala; (4) prijelazni elementi.
35. Maksimalna valencija olova u spojevima kisika je:
(1) II; (2) iv; (3) VI; (4) VIII.
36. Vrsta orbitala valentnih elektrona u Indiji podudara se s
(1) am i fr; (2) pb i SN; (3) Al i GA; (4) Cu i AG.
37. Titan se odnosi na
(1) s.-; (2) p.-; (3) d.-; (4) f.- elementi.
38. Maksimalna valencija broma u spojevima kisika
(1) i; (2) iii; (3) v; (4) VII.
39. Sedmo razdoblje sustava elemenata mora završiti element s brojem slijeda
(1) 108; (2) 110; (3) 118; (4) 128.
40. Kut između veza H-E najveći je u molekuli veze
(1) h 2, (2) H2 SE; (3) H2 s; (4) H2O.
41. U nizu K-CA-SC-TI, radijus atoma (smanjuje se, povećava).
42. Energija koja je navedena u SL ° (G.) → CL + jednadžba (G.) + E - 1254 KJ, je za atom klora
(1) energija kemijske veze;
(2) ionizacijska energija;
(3) elektronebijabilnost;
(4) afinitet na elektron.
43. Afinitet za elektron se zove
(1) energija potrebna za odvajanje elektrona iz neopravdanog atoma;
(2) sposobnost atoma ove stavke za odgodu gustoće elektrona;
(3) elektronski prijelaz na višu razinu energije;
(4) energetski izoliranje kada je elektron pričvršćen na atom ili ion.
44. Koji je od elemenata najveća vrijednost ionizacijske energije:
(1) li; (2) f; (3) FE; (4) i?
45. Energija potrošena na uklanjanje jednog elektrona iz atom elemenata u plinovitom stanju, u magneziju
(1) manje od natrija, i više od aluminija;
(2) više od natrija, a manje od aluminijskog;
(3) manje od natrija i aluminija;
(4) više od natrija i aluminija.
46. \u200b\u200bNa temelju analize elektroničkih struktura atoma i položaja elemenata u periodnom sustavu, navedite koji od svih dvaju atoma ispod ima veći afinitet za elektron:
(1) kalij ili kalcij;
(2) sumpor ili klor;
(3) vodik ili litij?
47. Kemijski elementi se nalaze u redu povećanja elektronegabilnosti u redu
(1) SI, P, SE, RR, SL, O; (2) Si, P, R, SE, C1, O;
(3) p, SI, Fra, SE, C1, O; (4) SE, SI, P, R, C1, O.
48. Kakav se broj elemenata nalazi jer povećavaju svoje atomske radijuse:
(1) Na, mg, al, si; (3) o, S, SE, oni;
(2) C, O, n, f; (4) i, br, c1, f?
49. U nizu alkalijskog metala (od Li do CS), cezij je najmanje elektronegativan. To je objašnjeno onim što ima
(1) najveći broj neutrona u kernelu;
(2) veći broj valentnih elektrona u usporedbi s drugim elementima;
(3) velika atomska masa;
(4) Valentirani elektroni, u najveći stupanj uklonjen iz jezgre atoma.
50. Isoelektronic se zove ioni koji imaju isti broj elektrona i istu strukturu vanjske razine elektrona. Ioni oko 2-, F-, Na +, Mg2 +, A1 3+ imaju elektroničku konfiguraciju NOONE NOO plina i postavljene su u uzlaznom redoslijedu atomskih masa elemenata. U isto vrijeme njihove ion radiju
(1) praktično se ne mijenjaju;
(2) smanjenje;
(3) povećanje;
(4) Smanjenje, zatim povećajte.
51. Primjer ne-polarne molekule koja ima polarnu kovalentnu vezu bit će
(1) n2; (2) H20; (3) NH3; (4) CCL 4.
52. Od gore navedenih molekula: H2, O2, H20, CO2, CH4, H2S-polar su.
53. U kojem od spojeva između atoma, formira se kovalentna veza na mehanizmu donatorskog acceptore:
(1) ksl; (2) NH4C1; (3) CCl 4; (4) CO 2?
54. Valentalne orbitale berilija atom u hidrid molekule berilija hibridiziranog prema tipu
(1) sp.; (2) sp 2.; (3) sP 3.;(4) d 2 sp 3,
i molekula ima strukturu:
55. Kamenske orbitale atom bora u molekuli TF3 su hibridizirani prema vrsti
(1) sp.; (2) sp 2.; (3) sP 3.;(4) d 2 sp 3,
i molekula ima strukturu:
(a) linearni; (c) tetraedar;
(b) stan; (d) oktaedar.
56. Prisutnost četiriju ekvivalentne veze C-H u molekuli metana objašnjava se činjenicom da
(1) javlja se uzajamno odbojnost četiri elektronička parova;
(2) ugljikov atom hibridiziran u četiri sP 3.orbitala;
(3) ugljikov atom ima jedan s.- i tri r- valence elektron;
(4) ugljikov atom ima dva S- i dva r- Valence Electron.
Odgovori:
1. (4) Broj elektrona u vanjskoj razini energije.
2. (1) s smanjenjem atomskog radijusa i povećanje elektronegativnosti atoma.
3. (1) natrij, 11.
4. (1) elektroni na vanjskoj elektroničkoj razini.
5. (1) kao, SE, CL, F.
6. (3) Svojstva metala elemenata slabe.
7. (3) Elementi 24, 39, 74, 80.
8. (4) Strontsia, s.
9. (1) na vrhu podskupine.
10. (1) O, S, SE, oni.
11. (2) se povećava.
12. (1) se smanjuje.
14. (2) barij.
16. (2) Povećanje.
18. (3) Z205.
20. (4) klor.
22. (2) Njemačka.
23. (2) iz kiseline do glavnog.
26. EO 2 vrste oksidi formiraju C, Si, G i hidridi tipa 4 - C, SI, GE.
28. H2S, SEO 3 i H2 SEO 4. (1) svojstva kiselina.
32. (2) 119 i 169.
33. (2) dušik i fosfor.
34. (3) halogeni.
36. (3) Al i GA.
37. (3) d.- elementi.
41. Smanjenje.
42. (2) ionizacijska energija.
43. (4) Energetski izoliranje kada je elektron spojen na atom ili ion.
45. (4) više od natrija i aluminija.
46. \u200b\u200b(1) kalij; (2) klor; (3) vodik.
47. (1) SI, P, SE, WR, SL, O.
48. (3) O, S, SE, oni.
49. (4) Valence elektroni, u najveći stupanj uklonjen iz jezgre atoma.
50. (2) Smanjenje.
52.H2O, H2S.
53. (2) NH4 Cl.
54. (1) sp., (a) linearni.
55. (2) sp 2., (b) stan.
56. (2) Atom ugljika je hibridiziran sa stvaranjem četiri sP 3.orbitali.
Zadaci za pojedinačni procijenjeni grafički rad:
Za element s brojem slijeda jednak broju opcija za obavljanje sljedećih izračuna:
1. Napišite elektroničku formulu elementa i prikažite grafički punjenje elektronima svih atomskih orbitala.
3. Odredite masu jednog elementa atoma i njegovog volumena.
4. Odredite masu jedne molekule jednostavne tvari elementa.
5. Na temelju položaja elementa u PS-u, navodi moguće stupnjeve oksidacije atoma elementa u spojevima s drugim elementima.
6. Napišite oksidnu formulu, klorid, hidrid, sulfid.
8. Izračunajte duljinu dipola vodika i veze kisika elementa.
9. Poučica u dodir u molekuli jednostavne tvari elementa pomoću metode sunca.
10. Pouil u molekulu elementa Jednostavna tvar Koristeći energiju dijagrama MO metode, navedite mnoštvo komunikacije i napišite formulu.
11. Navedite vrstu hibridizacije atoma elementa u molekulama svih mogućih oksida (u slučaju kisika - molekula vodikovih priključaka).
12. Navedite sve vrste obveznica (σ, π, δ) u molekulama oksida (u slučaju kisika - vodikovih spojeva).
13. Navedite vrijednosti kutova valencije u molekulama oksida (u slučaju molekula kisika - vodikovih spojeva).
14. Navedite oblik molekula oksida (u slučaju molekula kisika - vodikovih spojeva).
15. Izračunajte energiju ionskog spoja AV i energije interakcije iona A + i B.
Za opcije 1, 5, 6, 7, 8, 9, 14, 15, 16, 17: a - kalij, B je element s redoslijedom broja jednak broj elemenata.
Za opcije 3, 4, 11, 12, 13, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28: B-klor, element s nizom broj jednak broj elemenata.
Za opcije 2, 10, 18: a - element s nizom koji je jednak (verzija od +1), B je element s elementom sekvence jednak (opcija -1).
Književnost.
1. Kulman A.G. Prikupljanje zadataka za opću kemiju, Ed. 2., rekreacija. I dodajte. - M.: Više. shek. 1975.
2. Maslov e.i. , Holboray Z.E. Prikupljanje zadataka i vježbi u kemiji, 5. Ed., Pererab. i Add-M: Viši. shek. 1997.
Atomski broj elemenata pokazuje:
a) broj elementarnih čestica u atomu; b) broj nukleona u atomu;
c) broj neutrona u atomu; d) broj protona u atomu.
Najznačajnija je izjava da su kemijski elementi u PSE raspoređeni u uzlaznom redoslijedu:
a) apsolutnu masu njihovih atoma; b) relativna atomska masa;
c) broj nukleona u atomskim jezgrama; d) naknada atomske jezgre.
Frekvencija u promjeni svojstava kemijskih elemenata rezultat je:
a) povećati broj elektrona u atomima;
b) povećanje optužbi atomskih jezgri;
c) povećati atomsku masu;
d) periodičnost u promjeni elektroničkih struktura atoma.
Od dolje navedenih karakteristika, atomi elemenata se periodično mijenjaju jer se niz se slijed elementa uzgaja:
a) broj energetskih razina u atomu;
b) relativna atomska masa;
c) broj elektrona u vanjskoj razini energije;
d) naknada atomske jezgre.
Odaberite parove u kojima se svaka karakteristika atoma povremeno razlikuje uz povećanje broja protona elementa:
a) energiju ionizacije i energije afiniteta elektrona;
b) radijus i masa;
c) elektronegativnosti i ukupne elektrone;
d) Svojstva metala i broj elektrona valencija.
Odaberite odgovarajuće odobrenje za elementeVlanGrupa:
a) svi atomi imaju isti broj elektrona;
b) svi atomi imaju isti radijus;
c) svi atomi imaju isti broj elektrona na vanjskom sloju;
d) Svi atomi imaju maksimalnu valenciju jednaku broj grupe.
Neki element ima sljedeće konfiguracije elektrona:ns. 2 (n.-1) d. 10 np. 4 , U kojoj skupini periodnog sustava je taj element?
a) Grupa IVT; b) VIV grupa; c) skupina IVa; d) putem grupe.
U PSE razdobljima s povećanjem optužbi atomskih jezgrine Promjene: a) masu atoma; b) broj elektroničkih slojeva; c) broj elektrona na vanjskom elektroničkom sloju; d) radijus atoma. |
|
U kojem retku se kemijski elementi nalaze u redu povećanja njihovog atomskog radijusa? a) Li, B, C; b) biti, mg, CA, SR; c) n, O, f, ne; d) Na, mg, al, si. |
|
Najniža ionizacijska energija među stabilnim atomima ima: a) litij; b) Barry; c) cezij; d) natrij. |
|
Struja elemenata povećava se za redom: a) p, si, s, O; b) Cl, F, S, O; c), SE, S, O; d) O, S, SE, TE. |
|
U nizu elemenataNa Mg. Al SI P. S. Cl. s lijeva na desno: a) povećava elektronegabilnost; b) energija ionizacije se smanjuje; c) povećava se broj elektrona valencija; d) smanjenje metalnih svojstava. |
|
Navedite najaktivniji metal četvrtog razdoblja: a) kalcij; b) kalij; c) chrome; d) cink. |
|
Navedite najaktivniju metalnu IIA grupu: a) berillium; b) Barry; c) magnezij; d) kalcij. |
|
Navedite najaktivniju nemetalnu VIIA Grupu: a) jod; b) brom; c) fluor; d) klor. |
|
Odaberite prave izjave: a) u IA-VIII, samo elementi S- i b) u IV-VIIIV skupinama postoje samo d-elementi; c) Svi D-elementi su metali; d) Ukupan broj S elemenata u PSE je 13. |
|
Uz povećanje atomskog broja elemenata u VA skupini povećanje: a) svojstva metala; b) broj razina energije; c) ukupan broj elektrona; d) broj valentnih elektrona. |
|
P-elementi se odnose: a) kalij; b) natrij; c) magnezij; d) arsen. |
|
Koja je obitelj elemenata aluminijska? a) S-elementi; b) p-elementi; c) d-elementi; d) F-elementi. |
|
Navedite seriju u kojoj postoje samod.- elementi: a) al, SE, LA; b) TI, GE, SN; c) TI, V, CR; d) LA, CE, HF. |
Koji redak prikazuje znakove elemenata S, P i D-obitelji? a) h, on, li; b) H, ba, al; c) biti, c, f; d) mg, p, Cu. |
|
Atom od kojih element IV sadrži najveći broj elektrona? a) cink; b) chrome; c) brom; d) Krypton. |
|
Na atomu od kojih element, elektroni vanjske razine energije najčvršnije su povezane s jezgrom? a) kalij; b) ugljik; c) fluor; d) Francuska. |
|
Sila privlačnosti valentnih elektrona na jezgru atoma se smanjuje u brojne elemente: a) Na, mg, al, si; b) Rb, K, Na, li; c) SR, Ca, mg, biti; d) Li, Na, K, Rb. |
|
Element s redoslijedom broj 31 je: a) u skupini III; b) malo razdoblje; c) veliko razdoblje; d) u skupini A. |
|
Od sljedećih elektroničkih formula odaberite one koji odgovaraju P-elementimaVlan Razdoblje: a) 1S 2S 2 2p 6 3S 2 3p 6 3d 1 4s 2 4p 6 4d 1 5s 2 5p 1; b) 1S 2S 2 2p6 3S 2 3p 6 3d 1 4S 2 4p 6 5S 2; c) 1S 2 2S 2 2p 6 3S 2 3p 6 3d 1 4s 2 4p 2; d) 1S 2S 2 2p 6 3S 2 3p 6 3d 1 4s 2 4p 6 4d 1 5s 2 5p 6. |
|
Iz gore navedenih elektroničkih formula odaberite one koji odgovaraju kemijskim elementima koji tvore najviši oksid pripravka 2 OKO 3 : a) 1S 2S 2 2p 6 3S 2 3p 1; b) 1S 2S 2 2p 6 3S 2 3p 6 3d 1 4S 2 4p3; c) 1S 2S 2 2p 6 3S 2 3p 6 3d 1 4S 2; d) 1S 2 2S 2 2p 6 3S 2 3p 6 3d 3 4S 2. |
|
Odredite element čiji atomom sadrži 4p-pylon 4 elektrona. Koje je razdoblje i grupa? a) Arsen, iv razdoblje, VA grupa; b) Telluur, V razdoblje, preko grupe; c) selenij, iv razdoblje, preko grupe; d) volfram, VI razdoblje, vib grupa. |
Atomi kalcija i skandij razlikuju se međusobno: a) broj razina energije; b) radijus; c) broj valentskih elektrona; d) formulu viših oksida. |
|
Za atome sumpora i kroma na isti način: a) broj elektrona valencija; b) broj razina energije; c) najviša valencija; d) formulu viših oksida. |
|
Atomi dušika i fosfora imaju: a) isti broj elektroničkih slojeva; b) isti broj protona u kernelu; c) isti broj valentnih elektrona; d) identični radijusi. |
|
Formula viših oksida perioda Element III, čija je atoma u osnovi, stanje sadrži tri nesparene elektrone: a) e 2 o 3; b) EO 2; c) e 2 o 5; d) e 2 o 7. |
|
Formula viših oksidnih elemenata EO3. Navedite formulu njegovog hidrogenskog spoja: a) EN 2; b) en; c) en 3; d) hr 4. |
|
Priroda oksida iz glavne do kiseline varira u redovima: a) na 2 o, MgO, SiO2; b) Cl2O, S02, P205, br2; c) beo, MgO, B2O3, Al203,; d) CO2, b2O3, Al203, LI20; e) SAO, FE2O3, Al2O3, tako 2. |
|
Odaberite redove u kojima su formule raspoređene u uzlaznom redoslijedu kiselinskih svojstava spojeva: a) n2O5, p2O5, kao 205; c) H2 SEO 3, H2S03, H2S04; b) hf, hbre, hi; d) Al2O3, p2O5, Cl2O7. |
|
Navedite seriju u kojoj su hidroksidi raspoređeni prema redoslijedu povećanja njihovih glavnih svojstava: a) LioH, KOH, NaOH; c) LiOH, Ca (OH) 2, Al (OH) 3; b) LiOH, NaOH, mg (OH) 2; d) LioH, NaOH, KOH. |
Zadatke
Uzorak fosfora sadrži dva nuklida: fosforna-31 i fosfor-33. Molarni frakcija fosfora-33 je 10%. Izračunajte relativnu atomsku masu fosfora u ovom uzorku.
Prirodni bakar se sastoji od Cu 63 i Cu 65 nuklida. Odnos broja CU 63 atoma na broj CU 65 atoma u smjesi je 2,45: 1,05. Izračunajte relativnu atomsku masu bakra.
Prosječna relativna atomska masa prirodnog klora je 35,45. Izračunajte molarne frakcije svojih dvaju izotopa, ako je poznato da su njihovi masovni brojevi jednaki 35 i 37.
Uzorak kisika sadrži dva nuklida: 16 o i 18 o, čije se mase odgovaraju 4,0 g i 9,0 g. Odrediti relativnu atomsku masu kisika u ovom uzorku.
Kemijski element se sastoji od dva nulida. Jezgra prvog nuklida sadrži 10 protona i 10 neutrona. U kernelu drugog nuluta od još 2. Na 9 atoma lakših nuklida čini jedan atom težeg nuklida. Izračunajte prosječnu atomsku težinu elementa.
Kakva bi relativna atomska masa imala kisik ako je u prirodnoj smjesi za svakih 4 kisika atom-16 iznosio 3 atoma kisika-17 atoma i 1 kisik atom-18?
Odgovori:1. 31,2. 2. 63,6. 3. 35 CL: 77,5% i 37 CL: 22,5%. 4. 17,3. 5. 20,2. 6. 16,6.
Kemijska komunikacija
Glavni volumen obrazovnog materijala:
Priroda i vrste kemijskih veza. Glavni parametri kemijske veze: energija, duljina.
Kovalentna veza. Razmijenjeni i mehanizmi donatora za formiranje kovalentne komunikacije. Smjeru i zasićenju kovalentne veze. Polaritet i polarizabilnost kovalentne veze. Vrednovanje i stupanj oksidacije. Kamenske sposobnosti i valencije uvjeti atoma elemenata skupina. Pojedinačne i višestruke veze. Atomske kristalne rešetke. Koncept hibridizacije atomskih orbitala. Glavne vrste hibridizacije. Kutovi kravaca. Prostorna struktura molekula. Empirijska, molekularna i strukturna (grafička) formula molekula.
Komunikacija, Ionske kristalne rešetke. Kemijske formule tvari s molekularnom, atomskom i ionskom strukturom.
Metalna komunikacija, Kristalne metale rešetke.
Intermolekularna interakcija. Molekularna rešetka. Energija intermolekularne interakcije i agregatnog stanja tvari.
Vodik.Vrijednost vodikovih veza u prirodnim objektima.
Kao rezultat studije, studenti bi trebali znati:
Što je kemijski odnos;
glavne vrste kemijskih veza;
kovalentni komunikacijski obrazovni mehanizmi (razmjena i donator-akceptor);
glavne karakteristike kovalentne veze (zasićenja, smjer, polaritet, mnoštvo, S- i P-komunikacije);
glavna svojstva ionskih, metalnih i vodikovih veza;
glavne vrste kristalnih rešetaka;
kako se opskrba energijom mijenja i priroda molekula u tranziciji s jednog agregatnog stanja u drugu;
Što se odlikuju tvari koje imaju kristalnu strukturu iz tvari koje imaju amorfnu strukturu.
Kao rezultat proučavanja teme, studenti bi trebali steći vještine:
definicije vrste kemijske veze između atoma u različitim spojevima;
usporedba čvrstoće kemijskih obveznica njihovom energijom;
određivanje stupnjeva oksidacije formulama različitih tvari;
uspostavljanje geometrijskog oblika nekih molekula na temelju teorije hibridizacije atomskih orbitala;
prognoziranje i usporedbu svojstava tvari ovisno o prirodi odnosa i vrsti kristalne rešetke.
Nakon što je završio učenje teme, studenti bi trebali imati prezentaciju:
- na prostornoj strukturi molekula (smjer kovalentnih veza, kut valencije);
- o teoriji hibridizacije atomskih orbitala (SP 3 -, SP 2 -, SP-hibridizacija)
Nakon što je proučavao temu, studenti bi trebali zapamtiti:
elementi s konstantnim stupnjem oksidacije;
spojevi vodika i kisika u kojem ovi elementi nisu karakteristični za njih stupanj oksidacije;
veličina kuta između spojeva u molekuli vode.
Odjeljak 1. Priroda i vrste kemikalija
Formule tvari su dane: Na2O, SO3, KCl, PCI3, HCl, H2, C12, NaCl, CO2, (NH4) 2S04, H202, CO, H2S, NH4 Cl, SO2, HI, RB 2, SR (OH) 2, H2 SEO 4, on, SCCI3, N2, AlBr3, HBr, H2 SE, H20, od 2, CH 4, NH3, Ki, Cabr 2, Bao, ne, FCL, Sic. Odaberite veze:
molekularna i neelastična struktura;
samo s kovalentnim polarnim vezama;
samo s kovalentnim nepolarnim obveznicama;
samo s ionskim priključcima;
kombiniranje u strukturi ionskih i kovalentnih veza;
kombiniranje kovalentnih polarnih i kovalentnih ne-polarskih spojeva;
sposoban formiranje vodikovih veza;
u strukturi komunikacije formiran mehanizmom za prihvaćanje donatora;
Kako polaritet veza u redovima?
a) H2O; H2 s; H2 SE; H2O b) pH 3; H2 s; HCl.
U kojem stanju je glavno ili uzbuđeno - postoje atomi izoliranih elemenata u sljedećim spojevima:
B.Cl3; P.Cl3; SIO2; BITI.F2; H 2. S.; C.H 4; H. Cl.O 4?
Što par ovih elemenata u kemijskoj interakciji ima maksimalnu tendenciju formiranja ionske komunikacije:
Ca, C, K, O, I, Cl, F?
U kojoj od predloženih kemikalija, ruptura veze će biti veća vjerojatnost da će nastaviti s formiranjem iona, te u kojima se formirati slobodne radikale: NaCl, CS2, CH4, K20, H2S04, KOH, Cl2?
Dana halogene pasmine: HF, HCl, HBr, Bok. Odaberite halogen vrt:
vodena otopina koja je najjača kiselina (najslabija kiselina);
s najviše polarne veze (najmanje polarna veza);
s najvišom duljinom komunikacije (s najnižom duljinom komunikacije);
s najvećom točkom vrenja (s najmanjom točkom vrenja).
Kada formira jednu kemijsku vezu, fluor fluoro se oslobađa 2.64 ''
10 -19 j energije. Izračunajte koji bi kemijski broj molekula fluora trebao formirati kako bi se razlikovalo 1,00 KJ energije.
Test 6.
Kada se molekula formira iz dva izolirana atoma, energija u sustavu: a) povećava se; b) smanjenje; c) ne mijenja; d) moguće i smanjenje i povećanje energije. |
|
Navedite, u kojem par tvari, opći elektronički parovi se pomaknu prema atomu kisika: a) od 2 i CO; b) Cl2 o i ne; c) H20 i N203; d) H202 i O2F2. |
|
Navedite veze s kovalentnom ne-polarnom vezom: a) o 2; b) n2; c) Cl2; d) PCL 5. |
|
Navedite veze s kovalentnom polarnom vezom: a) H2O; b) Br 2; c) Cl2 o; d) tako 2. |
|
Odaberite nekoliko molekula, sve veze u kojima su kovalentni: a) NaCl, HCl; b) CO2, Na2O; c) CH3C1, CH3A; d) 2, br. 2. |
|
Priključci s kovalentnom polarnom i kovalentnom ne-polarnom komunikacijom: a) voda i vodikov sulfid; b) bromidni kalij i dušik; c) amonijak i vodik; d) kisik i metan. |
|
Nijedna od kovalentnih obveznica ne formira mehanizam za prihvatljive donora u čestici: a) CO 2; b) CO; c) 4 -; d) NH4 +. |
|
Kako se razlika u električnoj negativnosti vezanih atoma pojavljuje: a) smanjenje polariteta komunikacije; b) jačanje polariteta komunikacije; c) povećanje stupnja ionske komunikacije; d) Smanjenje stupnja ionske komunikacije. |
|
U kojem redu molekula nalaze se u redu povećanja polariteta komunikacije? a) HF, HCl, HBr; b) NH3, pH 3, pepeo 3; c) H2 SE, H2S, H20; d) CO2, CS 2, CSE 2. |
|
Najveća obvezujuća energija u molekuli: a) h 2 te; b) H2 SE; c) H2 s; d) H2O. |
|
Kemijska veza je najmanje izdržljiva u molekuli: a) bromomodorod; b) klorid; c) jododorodor; d) fluoroodorod. |
|
Duljina komunikacije povećava se u nizu tvari koje imaju formule: a) CC14, CBr 4, CF4; b) 2, SEO 2, TEO 2; c) H2 s, H20, H2 SE; d) HBr, HCl, HF. |
|
Maksimalni brojs.- komunikacije koje mogu postojati između dva atoma u molekuli: a) 1; b) 2; u 3; d) 4. |
|
Trostruka veza između dva atoma uključuje: a) 2 S-veze i 1 π-veza; b) 3 s komunikacijom; c) 3 π-veze; d) 1s komunikacija i 2π-obveznice. |
|
Molekula S. 2 Sadrži kemijske veze: a) 1s i 1π; b) 2S i 2π; c) 3S i 1π; d) 4s. |
|
Iznoss.- I.π- veze (s. + π) u molekuliTAKO. 2 Cl. 2 jednak: a) 3 + 3; b) 3 + 2; c) 4 + 2; d) 4 + 3. |
|
Navedite veze s ionskim obveznicama: a) natrijev klorid; b) ugljikov oksid (II); c) jod; d) kalij nitrata. |
|
Samo ionske komunikacije podržavaju strukturu tvari: a) natrijev peroksid; b) Haretirani vapno; c) bakreni sipop; d) sylvinit. |
|
Navedite atoma koji element može sudjelovati u formiranju metalne i ionske komunikacije: a) kao; b) br; c) k; d) SE. |
|
Najizraženiji karakter ionske komunikacije u spoju: a) kalcijev klorid; b) kalijev fluorid; c) aluminij fluorid; d) natrijev klorid. |
|
Navedite tvari koje agregatno stanje u kojem se pod normalnim uvjetima određuje vodikovim vezama između molekula: a) vodik; b) klorid; c) tekući vrt fluor; d) voda. |
|
Navedite najtrajniju vodikovu vezu: a) -N .... H-; b) -o .... h-; c) -cl ... h-; d) -S .... H-. |
|
Koji je kemijski odnos najmanje jak? a) metal; b) ionski; c) vodik; d) kovalentni. |
|
Navedite vrstu komunikacije u NF molekuli 3 : a) ionski; b) ne-polarni kovalent; c) polarni kovalent d) vodik. |
|
Kemijska veza između atoma elemenata s brojevima sekvence 8 i 16: a) ionski; b) kovalentni polarni; c) kovalentna ne-polarna; d) vodik. |
|
Periodični zakon.
Atom za izgradnju
Članak prikazuje testne zadatke na temu testnih zadataka sastavljenih od strane autora za tematsku kontrolu u 8. razredu. (Kapacitet banaka - 80 zadataka za svaku od šest tema proučavanih u 8. razredu, a 120 zadataka na temu "Osnovna klasa anorganskih spojeva".) Trenutno se obuka kemije u 8. razredu provodi na devet udžbenika. Stoga je na kraju članka naveden popis kontroliranih elemenata znanja koji ukazuje na brojeve zadataka. To će omogućiti učiteljima da rade u različitim programima da odaberu odgovarajuću sekvencu zadataka iz jedne teme i skup kombinacija testnih zadataka iz različitih tema, uključujući za konačnu kontrolu.
Predloženi 80 test zadataka grupiran je za 20 pitanja u četiri opcije, u kojima se ponavljaju slični zadaci. Da biste sastavljali više opcija s popisa elemenata znanja, odaberite (nasumično) brojeve zadataka za svaku proučavanu stavku u skladu s vašim tematskim planiranjem. Takvo prezentacija zadataka za svaku temu omogućuje vam da provedete analizu brzih elemenata pogrešaka i njihovog pravovremenog korekcije. Upotreba sličnih zadataka u jednoj izvedbi, izmjena jednog ili dva točna odgovora smanjuje vjerojatnost nagađanja odgovora. Složenost pitanja, u pravilu, povećava se od 1. i 2. opcije na 3. i 4. opcije.
Postoji mišljenje da su testovi "nagađanje". Predlažemo da provjerite je li to. Nakon testiranja usporedite rezultate s oznakama. Ako su rezultati ispitivanja u nastavku, može se objasniti sljedećim razlozima.
Prvo, takav (test) je neobičan za studente. Drugo, nastavnik stavlja naglasak u proučavanje teme (određivanje glavnog sadržaja obrazovanja i metodologije poučavanja).
opcija 1
Zadatke.
1. U 4. razdoblju, putem grupe je element s brojem slijeda:
1) 25; 2) 22; 3) 24; 4) 34.
2. Element s naplatom jezgre atoma +12 ima broj redoslijeda:
1) 3; 2) 12; 3) 2; 4) 24.
3. Redni broj elementa odgovara ovim karakteristikama:
1) optužba za atomske jezgre;
2) broj protona;
3) broj neutrona;
4. Šest elektrona na vanjskoj razini energije na atomima elemenata s brojem grupe:
1) II; 2) iii; 3) VI; 4) IV.
5. Formula viših oksidnih klora:
1) Sl20; 2) Cl2O3;
3) Cl2O5; 4) Cl2 o 7.
6. Valencija aloma aluminija je:
1) 1; 2) 2; 3) 3; 4) 4.
7. Ukupna formula hlapivih vodikovih spojeva elemenata skupine VI:
1) EN 4; 2) hr 3;
3) NE; 4) H2 E.
8. Broj vanjskog elektroničkog sloja u atomu kalcija:
1) 1; 2) 2; 3) 3; 4) 4.
9.
1) li; 2) na; 3) k; 4) Cs.
10. Navedite elemente metala:
1) k; 2) Cu; 3) o; 4) N.
11. Gdje su u tablici D.I. Imeleeva, elementi se nalaze, čiji atomi u kemijskim reakcijama daju samo elektrone?
1) u skupini II;
2) na početku drugog razdoblja;
3) sredinom drugog razdoblja;
4) u preko grupe.
12.
2) ve, mg; Al;
3) mg, ca, SR;
13. Navedite elemente koji nisu metaalnih:
1) Cl; 2) s; 3) mn; 4) mg.
14. Nemetalna svojstva povećavaju se za redom:
15. Koje su obilježja atomske promjene periodično?
1) puniti nukleus atom;
2) broj razina energije u atomu;
3) broj elektrona u vanjskoj razini energije;
4) Broj neutrona.
16.
1 do; 2) al; 3) p; 4) Cl.
17. U razdoblju s povećanjem naplate kernela, radijusi atoma elemenata:
1) smanjenje;
2) ne mijenjaju se;
3) povećanje;
4) Promjena povremeno.
18. Izotopi atoma jednog elementa razlikuju se po:
1) broj neutrona;
2) broj protona;
3) broj elektrona valencija;
4) Odredba u tablici D.I. Imendeeva.
19. Broj neutrona u kernelu atoma 12 s:
1) 12; 2) 4; 3) 6; 4) 2.
20. Distribucija elektrona energetskim razinama u atomu fluora:
1) 2, 8, 4; 2) 2,6;
3) 2, 7; 4) 2, 8, 5.
Opcija 2.
Zadatke. Odaberite jedan ili dva točna odgovora.
21. Element s redoslijedom broj 35 je u:
1) 7. razdoblje, IVA Group;
2) 4. razdoblje, Viia Group;
3) 4. period, viib grupa;
4) 7. razdoblje, IVb grupa.
22. Element s naplatom jezgre atoma +9 ima broj redoslijeda:
1) 19; 2) 10; 3) 4; 4) 9.
23. Broj protona u neutralnom atomu podudara se s:
1) broj neutrona;
2) atomska masa;
3) broj sekvence;
4) broj elektrona.
24. Pet elektrona na vanjskoj razini energije na atomima elemenata s brojem grupe:
1) i; 2) iii; 3) v; 4) VII.
25. Formula viših dušikovog oksida:
1) N20; 2) n2O3;
3) N205; 4) ne;
26. Valencija kalcijevog atoma u svom najvišoj hidroksidu jednaka je:
1) 1; 2) 2; 3) 3; 4) 4.
27. Valencija atoma arsena u svom hidrogenskom spoju je:
1) 1; 2) 2; 3) 3; 4) 4.
28. Broj vanjskog elektroničkog sloja u kalijem atomu:
1) 1; 2) 2; 3) 3; 4) 4.
29. Najveći radijus atoma od elementa:
1) b; 2) o; 3) c; 4) N.
30. Navedite elemente metala:
1 do; 2) h; 3) f; 4) Cu.
31. Atomi elemenata koji su sposobni uzimanje i daju elektrone, nalaze se:
1) u skupini IA;
2) u preko grupe;
3) na početku drugog razdoblja;
4) na kraju trećeg razdoblja.
32.
1) Na, K, Li; 2) Al, mg, Na;
3) p, s, SL; 4) Na, mg, al.
33. Navedite elemente koji nisu metaalnih:
1) Na; 2) mg; 3) si; 4) P.
34.
35. Glavna karakteristika kemijskog elementa:
1) atomska masa;
2) optužba za jezgru;
3) broj razina energije;
4) Broj neutrona.
36. Simbol elementa čiji atomi čine amfoterični oksid:
1) n; 2) k; 3) s; 4) Zn.
37. U glavnim podskupinama (a) periodičnog sustava kemijskih elemenata s povećanjem naplate jezgre, radijus atoma:
1) se povećava;
2) smanjuje se;
3) ne mijenja;
4) Povremeno se razlikuje.
38. Broj neutrona u jezgri atoma je:
1) broj elektrona;
2) broj protona;
3) razlika između relativne atomske mase i broja protona;
4) atomska masa.
39. Izotopi vodika razlikuju se u broju:
1) elektroni;
2) neutronima;
3) protoni;
4) položaj u tablici.
40. Distribucija elektrona energetskim razinama u natrijevom atomu:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5.
Opcija 3.
Zadatke. Odaberite jedan ili dva točna odgovora.
41. Navedite broj slijeda elementa, koji se nalazi u IVa grupi, četvrtom razdoblju tablice D.I. Iveleeva:
1) 24; 2) 34; 3) 32; 4) 82.
42. Naknada jezgre atoma elementa broj 13 je:
1) +27; 2) +14; 3) +13; 4) +3.
43. Broj elektrona u atomu je:
1) broj neutrona;
2) broj protona;
3) atomska masa;
4) broj sekvence.
44. Atomi IVa elemenata grupe, broj valentnih elektrona je:
1) 5; 2) 6; 3) 3; 4) 4.
45. Oksidi s općim formulom R2O3 Elementi serije:
1) Na, K, Li; 2) mg, ca, biti;
3) b, Al, GA; 4) C, SI, ge.
46. Valencija fosfornog atoma u svom najvišem oksidu je:
1) 1; 2) 3; 3) 5; 4) 4.
47. Vodikovi spojevi elemenata skupine VIIA:
1) HCTO 4; 2) HCl;
3) HBRO; 4) HBR.
48. Broj elektroničkih slojeva u seleni atom je:
1) 1; 2) 2; 3) 3; 4) 4.
49. Najveći radijus atoma od elementa:
1) li; 2) na; 3) mg;
50. Navedite elemente metala:
1) Na; 2) mg; 3) si; 4) P.
51. Atomi od kojih elementi lako daju elektrone?
1) k; 2) Cl; 3) na; 4) S.
52. Broj elemenata u kojima se povećavaju metalna svojstva:
1) C, N, B, f;
2) Al, SI, P, mg;
53. Navedite elemente koji nisu metaalnih:
1) Na; 2) mg; 3) n; 4) S.
54. Brojni elementi u kojima se ne-metalna svojstva povećavaju:
1) Li, Na, K, n;
2) Al, SI, P, mg;
3) C, N, O, f;
4) Na, mg, Al, K.
55. Uz povećanje optužbe za jezgru atoma, nemetalna svojstva elemenata:
1) povremeno se mijenjaju;
2) pojačana;
3) ne mijenjaju se;
4) oslabiti.
56. Simbol elementa čiji atomi čine amfoterični hidroksid:
1) Na; 2) al; 3) n; 4) S.
57. Učestalost mijenjanja svojstava elemenata i njihovih spojeva je objašnjena:
1) ponavljanje strukture vanjskog elektroničkog sloja;
2) povećanje broja elektroničkih slojeva;
3) povećanje broja neutrona;
4) povećanje atomske mase.
58. Broj protona u jezgri natrijevog atoma je:
1) 23; 2) 12; 3) 1; 4) 11.
59. Koja je razlika između atoma izotopa jednog elementa?
1) broj protona;
2) broj neutrona;
3) broj elektrona;
4) optužba za kernel.
60. Distribucija elektrona energetskim razinama u litijevom atomu:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5;
Opcija 4.
Zadatke. Odaberite jedan ili dva točna odgovora.
61. Element s redoslijedom broja 29 je u:
1) 4. razdoblje, IA Group;
2) 4. razdoblje, IB grupa;
3) 1. razdoblje, IA grupa;
4) 5. razdoblje, IA Group.
62. Naknada jezgre atoma elementa br. 15 je:
1) +31; 2) 5; 3) +3; 4) +15.
63. Naknada atomske jezgre određena je:
1) sekvenca broj elementa;
2) broj grupe;
3) broj razdoblja;
4) atomska masa.
64. Na atomima III elemenata grupe, broj valentnih elektrona je:
1) 1; 2) 2; 3) 3; 4) 5.
65. Najveći sumporni oksid ima formulu:
1) H2S03; 2) H2S04;
3) tako 3; 4) SO 2.
66. Formula višoj fosfornom oksidu:
1) P2O3; 2) H3 PO 4;
3) nru 3; 4) P 2 O 5.
67. Vrednovanje atom dušika u svom hidrogenskom spoju:
1) 1; 2) 2; 3) 3; 4) 4.
68. Broj perioda u tablici D.I. Redeeleeva odgovara sljedećoj karakteristici atoma:
1) broj valentnih elektrona;
2) veću valent u spoju s kisikom;
3) ukupan broj elektrona;
4) broj razina energije.
69. Najveći radijus atoma od elementa:
1) Cl; 2) br; 3) i; 4) F.
70. Navedite elemente metala:
1) mg; 2) li; 3) h; 4) S.
71. Na atomu koji je element lakše dati elektron?
1) natrij; 2) cezij;
3) kalij; 4) litij.
72. Povećanje metalnih svojstava u nizu:
1) Na, mg, al; 2) Na, K, Rb;
3) Rb, K, Na; 4) P, S, Cl.
73. Navedite elemente koji nisu metaalnih:
1) Cu; 2) u; 3) n; 4) cr.
74. N-P-AS-SB nemetalna svojstva:
1) smanjenje;
2) ne mijenjaju se;
3) povećanje;
4) smanjenje, a zatim povećati.
75. Koje karakteristike atoma povremeno mijenjaju?
1) relativna atomska masa;
2) optužba za jezgru;
3) broj razina energije u atomu;
4) Broj elektrona na vanjskoj razini.
76. Atomi od kojih element formira amfoterični oksid?
1 do; 2) ve; 3) c; 4) SA.
77. U razdoblju uz povećanje naknade atomske jezgre povećava privlačnost elektrona u kernel i metalna svojstva:
1) pojačana;
2) povremeno se mijenjaju;
3) oslabiti;
4) Nemojte se mijenjati.
78. Relativna atomska masa elementa je numerički jednaka:
1) broj protona u jezgri;
2) broj neutrona u kernelu;
3) ukupan broj neutrona i protona;
4) broj elektrona u atomu.
79. Broj neutrona u jezgri atoma 16 o je:
1) 1; 2) 0; 3) 8; 4) 32.
80. Distribucija elektrona energetskim razinama u silicijskom atomu:
1) 2, 8, 4; 2) 2, 6;
3) 2, 7; 4) 2, 8, 5.
Popis kontroliranih elemenata znanja o temi
"Periodični zakon. Strukturu atoma
(U zagradama se daju putem brojeva posla)
Broj sekvence elementa (1, 3, 21, 41, 61), naboj jezgre atoma (2, 22, 42, 62, 63), broj protona (23) i broj elektrona (43) u atomu.
Broj grupe, elektroni u vanjskoj razini energije (4, 24, 44, 64), viši oksid formule (5, 25, 45, 65), najviša valencija elementa (6, 26, 46, 66), formule vodikovih spojeva (7, 27, 47, 67).
Broj razdoblja, broj elektroničkih razina (8, 28, 48, 68).
Promijenite radijus atoma (9, 17, 29, 37, 49, 67, 69).
Položaj u tablici D.I. Remefeleeva elementi-metali (10, 30, 50, 70) i \u200b\u200bnemetalni elementi (13, 33, 53, 73).
Sposobnost atoma daju i prihvate elektrone (11, 31, 51, 71).
Promjena svojstava jednostavnih tvari: po skupinama (12, 14, 34, 52, 54, 74) i razdoblja (32, 72, 77).
Periodična promjena u elektroničkoj strukturi atoma i svojstava jednostavnih tvari i njihovih spojeva (15, 35, 55, 57, 75, 77).
Amfoteri oksidi i hidroksidi (16, 36, 56, 76).
Broj mase, broj protona i neutrona u atomu, izotopi (18, 19, 38, 39, 58, 59, 78, 79).
Raspodjela elektrona razinama energije u atomu (20, 40, 60, 80).
Odgovori na test zadatke na temu
"Periodični zakon. Strukturu atoma
| opcija 1 | Opcija 2. | Opcija 3. | Opcija 4. | ||||
|---|---|---|---|---|---|---|---|
| Broj zadataka | Broj odgovora | Broj zadataka | Broj odgovora | Broj zadataka | Broj odgovora | Broj zadataka | Broj odgovora |
| 1 | 4 | 21 | 2 | 41 | 3 | 61 | 2 |
| 2 | 2 | 22 | 4 | 42 | 3 | 62 | 4 |
| 3 | 1, 2 | 23 | 3, 4 | 43 | 2, 4 | 63 | 1 |
| 4 | 3 | 24 | 3 | 44 | 4 | 64 | 3 |
| 5 | 4 | 25 | 3 | 45 | 3 | 65 | 3 |
| 6 | 3 | 26 | 2 | 46 | 3 | 66 | 4 |
| 7 | 4 | 27 | 3 | 47 | 2, 4 | 67 | 3 |
| 8 | 4 | 28 | 4 | 48 | 4 | 68 | 4 |
| 9 | 4 | 29 | 1 | 49 | 5 | 69 | 3 |
| 10 | 1, 2 | 30 | 1, 4 | 50 | 1, 2 | 70 | 1, 2 |
| 11 | 1, 2 | 31 | 2, 4 | 51 | 1, 3 | 71 | 2 |
| 12 | 3 | 32 | 2 | 52 | 3 | 72 | 2 |
| 13 | 1, 2 | 33 | 3, 4 | 53 | 3, 4 | 73 | 2, 3 |
| 14 | 1 | 34 | 4 | 54 | 3 | 74 | 1 |
| 15 | 3 | 35 | 2 | 55 | 1 | 75 | 4 |
| 16 | 2 | 36 | 4 | 56 | 2 | 76 | 2 |
| 17 | 1 | 37 | 1 | 57 | 1 | 77 | 3 |
| 18 | 1 | 38 | 3 | 58 | 4 | 78 | 3 |
| 19 | 3 | 39 | 2 | 59 | 2 | 79 | 3 |
| 20 | 3 | 40 | 2 | 60 | 1 | 80 | 1 |
Književnost
Gorodnichev i.n., Kontrola i provjera kemije. M.: Akvarij, 1997; Sorokin V.V., Zlotnikov npr, Testovi kemije. M.: Obrazovanje, 1991.
Gore spomenuto (str. 172) na periodičnost promjena u najvažnijim svojstvima atoma - valent. Postoje i druga važna svojstva čija je promjena karakterizirana frekvencijom. Takva svojstva uključuju veličinu (radijusa) atoma. AtoM nema površinea granica je nejasna, kao gustoća vanjskih oblaka elektrona kao što se uklanja glatko smanjuje. Podaci o atomu Radii se dobivaju od određivanja udaljenosti između njihovih centara u molekulama i kristalnim strukturama. Izračuni su također provedeni na temelju jednadžbi kvantne mehanike. Na sl. 5.10
Sl. 5.10. Učestalost promjena u atomskim radijusima
krivulja promjena u atomskim radijusima, ovisno o punjenju kernela.
Od vodika do helije, radijus se smanjuje, a zatim se oštro povećava u litiju. To je posljedica pojave elektrona na drugoj razini energije. U drugom razdoblju od litija do Neo, budući da se naplata kernela povećava, radiju se smanjuje.
U isto vrijeme, povećanje broja elektrona u ovoj energetskoj razini dovodi do povećanja njihovog međusobnog odbijanja. Stoga, do kraja razdoblja, smanjenje radijusa usporava.
Kada se krećete od Neon na natrij - prvi element trećeg razdoblja - radijus se ponovno oštro povećava, a zatim se postupno smanjuje na argon. Nakon toga, postoji oštar porast radijusa u kaliju. Ispada karakterističnu periodičnu krivulju. Svaki dio krivulje alkalnog metala do plemenitog plina karakterizira promjenu radijusa u razdoblju: Tijekom prijelaza je smanjenje radijusa s lijeva na desno. Također je zanimljivo saznati prirodu promjene radijusa u skupinama elemenata. Da biste to učinili, morate držati liniju kroz elemente iste skupine. Prema položaju maksimume u alkalnom metalu, izravno se vidi da radijus atoma tijekom prijelaza u skupini od vrha do donja se povećava. To je zbog povećanja broja elektroničkih školjki.
zadatak 5.17. Kako radijusi atoma iz f do ur promjene? Odrediti ovo na sl. 5.10.
Mnoga druga svojstva atoma ovisi o radijuzima, i fizičkoj i kemijskoj. Na primjer, povećanje radijusa atoma može objasniti smanjenje temperatura taljenja alkalijskog metala od litija u cezij:
Veličine atoma povezane su s njihovim energetskim svojstvima. Što je veći radijus vanjskih elektronskih oblaka, lakše je elektron gubi elektron. U isto vrijeme, pretvara se u pozitivno nabijeno i on.
Ion je jedno od mogućih stanja atoma u kojem ima električni naboj zbog gubitka ili dodavanja elektrona.
Sposobnost atoma za preseljenje u pozitivno nabijeni ion je karakteriziran energija ionizacije e I.To je minimalna energija potrebna za odvajanje vanjskog elektrona iz atoma u stanju plina:
![]()
Rezultirajući pozitivni ion također može izgubiti elektrone, postaje dvosmjerni, tri grafikona, itd. Veličina ionizacijskog energije se uvelike povećava.
Ionizacijska energija atoma se povećava u razdoblju kada se kreće s lijeva na desno i smanjuje se u skupinama prilikom prijelaza s vrha do dna.
Mnogi, ali ne i svi atomi mogu pričvrstiti dodatni elektron, pretvarajući se u negativno nabijeni ion. Ova nekretnina je karakterizirana elektronska energija E Energy E usp To je energija koja se razlikuje kada je elektron povezan s atomom koji se nalazi u stanju plina:
![]()
I energija ionizacije i energiju klijanja elektrona je uobičajena 1 mol atomi i izraziti u KJ / molu. Razmotrite ionizaciju atoma natrijeva kao rezultat privrženosti i gubitka elektrona (Sl. 5.11) . S linije je jasno da je za isključenje elektrona iz atoma natrijeva potreban 10 još jednom energijom nego što je dodijeljena kada je spojen elektron. Neobični natrijev ion nestabilan i u složenim tvarima gotovo se nikada ne nalazi.

Sl. 5.11. Ionizacija natrijevog atoma
Ionizacijska energija atoma mijenja se u razdobljima i skupinama u smjeru suprotnom promjeni u radijusu atoma. Promjena energije afiniteta na elektron u tom razdoblju je teže, budući da su elementi IIA- i VIIIA-RPYNN afiniteta odsutni. Možemo približno pretpostaviti da je energija afiniteta elektrona E dopovećava se u razdobljima (u skupinu vii inkluzivno) i smanjuje se u skupinama od vrha do dna (sl. 5.12).
zadatak 5 .osamnaest. Može li magnezij i argonski atomi u plinovitom stanju stvaranja negativno nabijenih iona?
Ioni s pozitivnim i negativnim troškovima privlače među sebe, što dovodi do raznih transformacija. Najjednostavniji slučaj je formiranje ionskih veza, tj. Ujedinjenje iona u tvari pod djelovanjem elektrostatske atrakcije. Tada se javlja ionska kristalna struktura, karakteristična za sol nacl i mnoge druge soli. Ali možda

Sl. 5.12. Priroda promjena u energiji ionizacije i energije afiniteta elektrona u skupinama i razdobljima
dakle, negativni ion nije jako čvrsto drži svoj višak elektrona, a pozitivni ion, naprotiv, nastoji vratiti svoju elektrotektivnost. Zatim interakcija između iona može dovesti do stvaranja molekula. Očito, međusoblje su ioni različitog znaka naboja C1 + i C1 ~. No, zbog činjenice da su to ioni identičnih atoma, oni tvore C12 molekulu s nultim naknadama na atomima.
Pitanja i vježbe
1. Iz koliko protona, neutrona i elektrona se sastoje od atoma broma?
2.
Izračunajte masovne frakcije izotopirajuće prirode. ![]()
3. Koliko energije se oslobađa tijekom formiranja 16 g.kisik reakcijom ![]() teče u dubinama zvijezda?
teče u dubinama zvijezda?
4. Izračunajte elektronsku energiju u uzbuđenom atomu vodika kada n \u003d3.
5. Napišite potpune i skraćene elektroničke formule atom joda.
6. Napišite smanjenu elektroničku formulu iona.
7. Napišite potpunu i skraćenu elektroničku formula Atom i Iona 2.
8. Izgradite dijagrame energije fosfora i arsenskih atoma.
9. Izgradite pune energije dijagrami cinka i galijskih atoma.
10. Stavite sljedeće atome u redoslijed povećanja radijusa: aluminij, bor, dušik.
11. Koji od sljedećih iona međusobno formiraju ionske kristalne strukture: u R + R -, K +, K -, I +, I -, LI +, Li -? Što se može očekivati \u200b\u200bkada interakcija iona u drugim kombinacijama?
12. Pretpostavimo da je moguća priroda radijusa atoma tijekom tranzicije u periodnom sustavu u smjeru dijagonale, na primjer Li - mg - sc.