Výpočty tepelných účinkov reakcií. Spôsoby výpočtu tepelných účinkov chemických reakcií pri rôznych teplotách
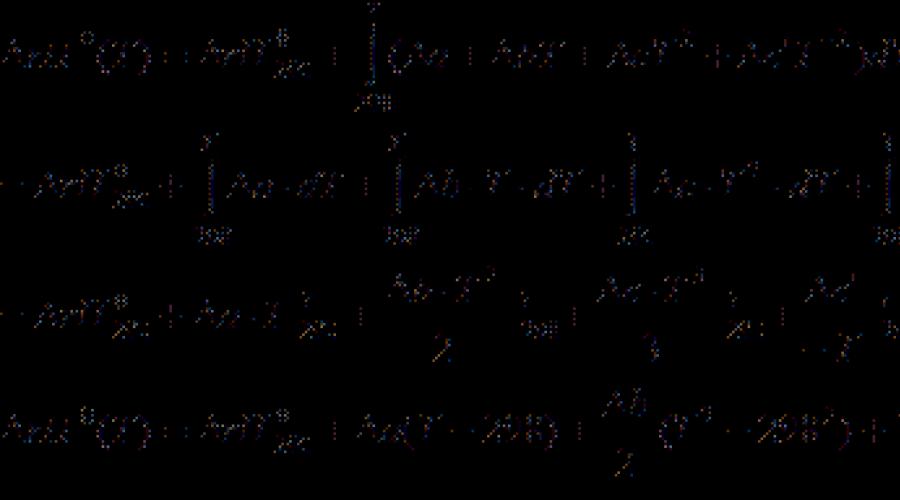
Všetky spôsoby výpočtu tepelných účinkov sú založené na rovnici Kirchoff v integrálnej forme.
Najčastejšie sa ako prvá teplota používa štandardná 298.15K.
Všetky spôsoby výpočtu tepelných účinkov sa redukujú na metódy užívania integrácie pravej časti rovnice.
Integrované metódy:
I. Stredné tepelné čiapky. Táto metóda je najjednoduchšia a najpresnejšia. V tomto prípade je expresia pod integrovaným znakom nahradená zmena v priemernej kapacite tepla, ktorá nezávisí od teploty vo zvolenom rozsahu.
Priemerná teplota tepla je tabuľková a meraná pre väčšinu reakcií. Ľahko sa vypočítavajú na referenčných údajoch.
II. Podľa skutočných tepelných uzáverov. (S pomocou teplôt riadkov)
V tejto metóde je expresia tepelnej kapacity integrandu napísaná ako teplotný rozsah:

III. Podľa vysokoteplotných zložiek entalpie. Táto metóda bola široko distribuovaná s vývojom raketovej technológie pri výpočte tepelných účinkov chemických reakcií pri vysokých teplotách. Je založený na definícii izobarskej tepelnej kapacity:

Vysoká teplotná zložka entalpie. Ukazuje, koľko sa entalpia jednotlivej látky zmení, keď sa zahrieva na určitý počet stupňov.
Pre chemickú reakciu, napíšte:

Touto cestou:
Prednáška číslo 3.
Prednáškový plán:
1. II zákon termodynamiky, definície, matematického záznamu.
2. Analýza II zákona termodynamiky
3. Výpočet zmien entropie v niektorých procesoch
tu a ďalšie indexy i. odkazujú na počiatočné látky alebo činidlá a indexy j.- na konečné látky alebo reakčné produkty; a - stechiometrické koeficienty v reakčnej rovnici pre východiskové látky a reakčné produkty.
Príklad:Vypočítajte tepelný účinok reakcie metanolovej syntézy za štandardných podmienok.
Rozhodnutie: Pre výpočty použijeme referenčné údaje podľa štandardného tepla tvorby, ktoré sa podieľajú na látkových reakciách (pozri tabuľku. 44 na strane 72 referenčnej knihy).
Tepelný účinok reakcie metanolovej syntézy za štandardných podmienok podľa prvého dôsledku zákona o Gesse (rovnica 1.15) je rovnaká:
Pri výpočte tepelných účinkov chemických reakcií je potrebné vziať do úvahy, že tepelný účinok závisí od agregovaného stavu činidiel a na typ záznamu rovnice chemickej reakcie:
Na druhý dôsledkom zákona Gessa sa tepelný účinok môže vypočítať pomocou tepla spaľovania Δ C H.Ako rozdiel v teple tepla spaľovania východiskových materiálov a reakčných produktov (s prihliadnutím na stechiometrické koeficienty):
kde δ. R C P. - charakterizuje zmenu izobarskej kapacity systému systému v dôsledku prúdenia chemickej reakcie a nazýva sa teplotný koeficient tepelného účinku reakcie.
Z diferenciálnej rovnice Kirchhoff z toho vyplýva, že závislosť tepelného účinku na teplotu je určená znakom δ R C P.. Záleží na tom, že viac, celková tepelná kapacita počiatočných látok alebo celkovej tepelnej kapacity reakčných produktov. Analyzujme diferenciálnu rovnicu Kirchhoff.
1. Ak teplotný koeficient δ R C P.\u003e 0, potom derivát  \u003e 0 a funkcia
\u003e 0 a funkcia  zvýšenie. V dôsledku toho sa tepelný účinok reakcie so zvyšujúcim sa zvyšuje teplota.
zvýšenie. V dôsledku toho sa tepelný účinok reakcie so zvyšujúcim sa zvyšuje teplota.
2. Ak teplotný koeficient δ R C P.< 0, то производная  < 0 и функция
< 0 и функция  zostupne. V dôsledku toho klesá tepelný účinok reakcie so zvyšujúcim sa teplotou.
zostupne. V dôsledku toho klesá tepelný účinok reakcie so zvyšujúcim sa teplotou.
3. Ak teplotný koeficient δ R C P. \u003d 0, potom derivát  \u003d 0 I.
\u003d 0 I.  . V dôsledku toho tepelný účinok reakcie nezávisí od teploty. Tento prípad sa nevyskytuje v praxi.
. V dôsledku toho tepelný účinok reakcie nezávisí od teploty. Tento prípad sa nevyskytuje v praxi.
Diferenciálne rovnice sú vhodné na analýzu, ale nepohodlné pre výpočty. Aby sa dosiahla rovnica na výpočet tepelného účinku chemickej reakcie, v krížovej diferenciálnej rovnici Kirchhoff, ktorý oddeľuje premenné:


Tepelná kapacita látok závisí od teploty, a preto  . V regióne teplôt bežne používaných v chemických a technologických procesoch však táto závislosť nie je významná. Na praktické účely sa médium tepelne-kapacitné látky používajú v teplotnom rozsahu od 298 do zadanej teploty.
. V regióne teplôt bežne používaných v chemických a technologických procesoch však táto závislosť nie je významná. Na praktické účely sa médium tepelne-kapacitné látky používajú v teplotnom rozsahu od 298 do zadanej teploty.  ktoré sú uvedené v referenčných knihách. Teplotný koeficient tepelného účinku, vypočítaný s použitím strednej tepelnej kapacity:
ktoré sú uvedené v referenčných knihách. Teplotný koeficient tepelného účinku, vypočítaný s použitím strednej tepelnej kapacity:
Príklad:Vypočítajte tepelný účinok reakcie metanolovej syntézy pri teplote 1000 až a štandardného tlaku.
Rozhodnutie: Pre výpočty použijeme referenčné údaje o priemernej tepelnej kapacite látok zapojených do reakcie v teplotnom rozsahu od 298 do 1000 K (pozri tabuľku 40 na strane 56 adresára):
Zmeny v priemernej kapacite tepla systému v dôsledku prúdenia chemickej reakcie:
Druhý začiatok termodynamiky
Jednou z najdôležitejších úloh chemickej termodynamiky je objasniť hlavnú možnosť (alebo neschopnosť) spontánneho prietoku chemickej reakcie v posudzovacom smere. V prípadoch, keď sa zistí, že táto chemická interakcia sa môže vyskytnúť, je potrebné určiť stupeň transformácie zdrojových látok a výťažok reakčných produktov, to znamená plnosť reakcie
Smerom priebehu spontánneho procesu sa môže určiť na základe druhého zákona alebo nástupu termodynamiky formulovanej, napríklad vo forme Clausius postulátu:
Samotné teplo sa nemôže pohybovať z chladného tela na horúce, to znamená, že takýto spôsob nie je nemožný, ktorý je jediným výsledkom, ktorým bol prechod tepla z tela s nižšou teplotou do tela s vyššou teplotou.
Navrhujú sa rôzne formulácie druhého začiatku termodynamiky. Thomsonova formulácia - Planck:
Večný motor druhého druhu je nemožné, t.j. takýto periodicky aktívny stroj je nemožný, čo by umožnilo získať prevádzku len ochladením zdroja tepla.
Matematická formulácia druhého začiatku termodynamiky sa vyskytuje pri analýze prevádzky termálnych strojov v dielach N. Carno a R. Clausius.
Clausius bol zavedený štátnu funkciu S., pomenovaná entropia, zmena, v ktorej sa rovná teplotu reverzibilného procesu, ktorý sa vzťahuje na teplotu
Pre akýkoľvek proces
 | (1.22) |
Výsledný výraz je matematická expresia druhého začiatku termodynamiky.
Štandardné teplo vzdelania (entalpia of Education) Látky Nazýva sa entalpia o tvorbe tvorby 1 modlitby tejto látky z prvkov (jednoduché látky, ktoré sú pozostávajúce z atómov jedného druhu) v najstabilnejšom štandardnom stave. Štandardné environmentálne enthals (CJ / MOL) sú uvedené v referenčných knihách. Pri použití referenčných hodnôt je potrebné venovať pozornosť fázovému stavu látok zapojených do reakcie. Enthalpy z tvorby najstabilnejších jednoduchých látok je 0.
Korolárny z zákona o výpočte tepelných účinkov chemických reakcií na teplo vzdelávania : štandardný tepelný účinok chemickej reakcie sa rovná teplu tepla tvorby reakčných produktov a tepla tvorby zdrojových látok s prihliadnutím na stechiometrické koeficienty (množstvá mólov) reagencií:
Chvenie 4 + 2 CO \u003d 3 C ( grafit ) + 2 H. 2 O.
televízia plynových plynov. plyn
Teplo tvorby látok v týchto štátoch fázy je uvedené v tabuľke. 1.2.
Tabuľka 1.2.
Teplá tvorba látok
Rozhodnutie
Pretože reakcia prechádza, keď P. \\ t\u003d CONST, potom štandardný termálny efekt sa nachádza ako zmena entalpie podľa známeho tepla vzdelávania podľa následku zákona Gessa (vzorec (1.17):
ΔН. o 298 \u003d (2 · (-241,81) + 3 · 0) - (-74,85 + 2 · (-110,53)) \u003d -187,71 kJ \u003d -187710 J.
ΔН. o 298 < 0, реакция является экзотермической, протекает с выделением теплоты.
Zmena vnútornej energie nájdeme na základe rovnice (1.16):
Δu. o 298 = Δh. o 298 – Δ ν · RT..
Pre túto reakciu zmien v počte mólov plynných látok v dôsledku prechodu chemickej reakcie Δν = 2 – (1 + 2) = –1; T.\u003d 298 K, potom
Δ U. o 298 \u003d -187710 - (-1) · 8,314 · 298 \u003d -185232 J.
Výpočet štandardných tepelných účinkov chemických reakcií podľa štandardného tepla spaľovania látok zapojených do reakcie
Štandardná tepelná spaľovacia látka (Enthalpy Enthalpy)
nazýva sa tepelný účinok úplnej oxidácie 1 modlitby danej látky (až do vyšších oxidov alebo špeciálne indikovaných zlúčenín) s kyslíkom za predpokladu, že počiatočné a konečné látky majú štandardnú teplotu. Štandardné Látky ENTHALPIA  (KJ / MOL) sú uvedené v referenčných knihách. Pri použití referenčných hodnôt je potrebné venovať pozornosť znameniu slona spaľovacej reakcie, ktorá je vždy exotermická ( Δ
H.
<0), а в таблицах указаны величины
(KJ / MOL) sú uvedené v referenčných knihách. Pri použití referenčných hodnôt je potrebné venovať pozornosť znameniu slona spaľovacej reakcie, ktorá je vždy exotermická ( Δ
H.
<0), а в таблицах указаны величины
 .
. Enthalpy spaľovanie vyššieho oxidov (napríklad voda a oxid uhličitý) sa rovná 0.
Enthalpy spaľovanie vyššieho oxidov (napríklad voda a oxid uhličitý) sa rovná 0.
Korolárny z zákona o výpočte tepelných účinkov chemických reakcií na teplo spaľovania : Štandardný tepelný účinok chemickej reakcie sa rovná teplu tepla spaľovania počiatočných látok a tepla spaľovania reakčných produktov s prihliadnutím na stechiometrické koeficienty (množstvo mólov) činidiel:
C. 2 H. 4 + H. 2 O. \u003d S. 2 N. 5 Je on.
Rovnako ako jedna z fyzických charakteristík osoby je fyzická sila, najdôležitejšou charakteristikou akejkoľvek chemickej komunikácie je sila komunikácie, t.j. Energie.
Pripomeňme, že energetika chemickej väzby - táto energia, ktorá je pridelená pri tvorbe chemickej väzby alebo energie, ktorá je potrebné stráviť na zničenie tejto súvislosti.
Chemická reakcia všeobecne je konverzia jednej látky do iných. V dôsledku toho, počas chemickej reakcie, existuje lámanie niektorých spojení a tvorby druhých, t.j. Energie.
Základným zákonom fyziky uvádza, že energia nevyskytuje z ničoho a nezmizne bez stopy, ale prechádza len z jedného druhu do druhého. Na základe jeho univerzálnosti je tento princíp zjavne aplikovateľný na chemickú reakciu.
Tepelný účinok chemickej reakcie nazýva množstvo tepla,
pridelené (alebo absorbované) počas reakcie a vzhľadom na 1 mol reagoval (alebo výslednú) látku.
Termálny účinok je označený písmenom Q a spravidla sa meria v KJ / mol alebo kcal / mol.
Ak sa reakcia vyskytuje s uvoľňovaním tepla (Q\u003e 0), nazýva sa exotermická, a ak s absorpciou tepla (Q< 0) – эндотермической.
Ak je schematicky znázornený energetický profil reakcie, potom pre endotermické reakcie sú produkty nad energiu ako reagencie, a na exotermické - naopak, reakčné produkty sú umiestnené pod energiu (stabilnejšie) ako činidlá.
Je jasné, že čím väčšia látka reaguje, tým väčšie je množstvo energie oddelené (alebo absorbované), t.j. Tepelný účinok je priamo úmerný množstvu látky. Preto je postoj tepelného efektu na 1 mol látky spôsobený našou túžbou porovnať tepelné účinky rôznych reakcií.
Prednáška 6. Termochémia. Tepelný účinok chemického reakčného príkladu 1. S obnovením 8,0 g oxidu vodíka z medi (ii) sa vytvorili kovové medené a vodné páry a 7,9 kJ tepla von. Vypočítajte tepelný účinok reakcie redukcie oxidu meďnatého (II).
Rozhodnutie. CUO reakčná rovnica (TV.) + H2 (G.) \u003d Cu (TV) + H20 (G.) + Q (*)
Urobte si podiel počas obnovenia 0,1 mol - 7,9 KJ je pridelený počas reštaurovania 1 mol - X KJ
Kde X \u003d + 79 KJ / Mole. Rovnica (*)
CUO (TV.) + H2 (G.) \u003d CU (TV.) + H2 O (G.) +79 KJ
Termochemická rovnica- Jedná sa o rovnicu chemickej reakcie, ktorá indikuje agregovaný stav zložiek reakčnej zmesi (činidiel a produktov) a tepelný účinok reakcie.
Aby sa roztavil ľad alebo odparil vodu, je potrebné stráviť určité množstvo tepla, zatiaľ čo pri zmrazení kvapalnej vody alebo kondenzácie vodnej pary sú pridelené rovnaké množstvá. To je dôvod, prečo je zima, keď vyjdeme z vody (odparovanie vody z povrchu tela vyžaduje náklady na energiu) a potenie je biologický ochranný mechanizmus od prehriatia tela. Naopak, mraznička zamrzne vodu a ohrieva okolitú miestnosť, čo mu dáva nadmerné teplo.
Tento príklad ukazuje tepelné účinky zmien v súhrnnom stave vody. Teplo topenia (pri 0 ° C) λ \u003d 3,34 × 105 J / kg (fyzika) alebo QL. \u003d - 6.02 KJ / MOL (chémia), tepelné odparovanie (odparovanie) (pri 100 ° C) q \u003d 2,26 × 106 J / kg (fyzika) alebo QISP. \u003d - 40,68 KJ / MOL (chémia).
roztavenie
odparovanie |
|||||
obr, 298.
Prednáška 6. Termochémia. Tepelný účinok chemickej reakcie je samozrejme, sú možné sublimačné procesy, keď pevná látka
ide do plynnej fázy, obchádzanie kvapalného stavu a inverzných procesov depozície (kryštalizácia) z plynnej fázy, je tiež možné vypočítať alebo merať tepelný účinok.
Je zrejmé, že v každej látke existujú chemické väzby, preto každá látka má určitú energetickú rezervu. Nie všetky látky však môžu byť navzájom prepojené s jednou chemickou reakciou. Preto sa dohodli na zavedení štandardného stavu.
Štandardný stav látky- Toto je agregovaný stav látky pri teplote 298 K, tlaku 1 atmosféry v najstabilnejšom alotropnej modifikácii v týchto podmienkach.
Štandardné podmienky- Toto je teplota 298 K a tlaku 1 atmosféra. Štandardné podmienky (štandardný stav) je indikovaný indexom.
Štandardné pripojenie tvorby tepla nazýva sa tepelný účinok chemickej reakcie tvorby tejto zlúčeniny z jednoduchých látok prijatých v ich štandardnom stave. Teplo tvorby zlúčeniny je indikované symbolom Q.0 Pre rôzne zlúčeniny sa štandardné tepelné vzdelávanie uvádza v referenčných knihách fyzikálno-chemických hodnôt.
Štandardné teplo tvorby jednoduchých látok sa rovná 0,0 ° C. napríklad Q0 Ar., 298 (O2, plyn) \u003d 0, Q0 ARR., 298 (C, TV, Grafit) \u003d 0.
Napríklad . Zaznamenajte termochemickú rovnicu na vytvorenie síranu meďnatého (II). Z referenčnej knihy Q0 ARR, 298 (CUSO4) \u003d 770 KJ / MOL.
Cu (TV.) + S (TV.) + 2O2 (G.) \u003d CUSO4 (TV) + 770 KJ.
Poznámka: Termochemická rovnica môže byť zaznamenaná pre akúkoľvek látku, je však potrebné pochopiť, že v reálnom živote sa reakcia vyskytuje úplne iným spôsobom: z uvedených činidiel sú vytvorené pri zahrievaní oxidu medi (II) a síry (IV ), ale síran meďnatý (II) sa nevytvorí. DÔLEŽITÉ ZÁVER: Termochemická rovnica je model, ktorý umožňuje výpočty, je dobre v súlade s inými termochemickými údajmi, ale nevydrží overeniu praxe (to znamená, že nie je schopný správne predpovedať možnosť alebo neschopnosť reakcie).
(B j) - σ a i × Q Ar 0, 298 I
Prednáška 6. Termochémia. Tepelný účinok chemickej reakcie
Objasnenie. Aby ste vás zavádzali, okamžite pridajte túto chemickú termodynamiku môže predpovedať možnosť / nemožnosť reakcieTo si však vyžaduje serióznejšie "nástroje", ktoré idú nad rámec školského priebehu chémie. Termochemická rovnica v porovnaní s týmito technikami je prvým krokom na pozadí Heopse Pyramída - bez toho, aby to nemohlo robiť, ale nie vysoké.
Príklad 2. Vypočítajte tepelný účinok kondenzácie vody vážiacich 5,8 g. Proces kondenzácie je opísaný termochemickou rovnicou H20 (G.) \u003d H20 (g.) + Q - Kondenzácia zvyčajne exotermická kondenzačná kondenzácia pri 25 ° C 37 kJ / mol (adresár).
V dôsledku toho Q \u003d 37 × 0,32 \u003d 11,84 kJ.
V 19. storočí sa ruský chemik, ktorý študoval tepelné účinky reakcií, experimentálne vytvorila zákon o ochrane energie vo vzťahu k chemickým reakciám - zákonom HESS.
Tepelný účinok chemickej reakcie nezávisí od procesnej dráhy a je určený len rozdielom v konečnom a počiatočných štátoch.
Z hľadiska chémie a matematiky tento zákon znamená, že môžeme slobodne vypočítať proces vybrať si akúkoľvek "trajektóriu výpočtu", pretože výsledok na ňom nezávisí. Z tohto dôvodu má veľmi dôležité právo HESS neuveriteľne dôležité koreolárny zákon.
Tepelný účinok chemickej reakcie sa rovná súčtu tepla tvorby reakčných produktov siete tepla tvorby činidiel (s prihliadnutím na stechiometrické koeficienty).
Z hľadiska zdravého rozumu toto vyšetrovanie zodpovedá procesu, v ktorom všetky reagencie sa najprv zmenili na jednoduché látky, ktoré sa potom zhromaždili novým spôsobom, takže sa získali reakčné produkty.
Vo forme rovnice, dôsledkom Gesse zákon vyzerá ako reakčná rovnica: A 1 A 1 + A 2 A 2 + ... + A N A \u003d B 1 B 1 + B 2 B 2 + ... b
Súčasne, i i ib j sú stechiometrické koeficienty, I - reagencie, B J - Reakčné produkty.
Potom má dôsledok zákona Gessa formu Q \u003d σ b j × Q Arr. 0, 298
k BK + Q
(A i)
Prednáška 6. Termochémia. Tepelný účinok chemickej reakcie od štandardného tepla tvorby mnohých látok
a) Odhodnotené špeciálne tabuľky alebo b) možno určiť experimentálne, je možné predpovedať (vypočítať) tepelný účinok veľmi veľkého počtu reakcií s dostatočne vysokou presnosťou.
Príklad 3. (Dôsledok zákona o Gesse). Vypočítajte tepelný účinok konverzie pary metánu, ktorý sa vyskytuje v plynnej fáze za štandardných podmienok:
CH4 (G.) + H20 (G.) \u003d CO (G.) + 3 H2 ()
Zistite, či je táto reakcia exotermická alebo endotermická?
Riešenie: dôsledok zákona o Gesse
Q \u003d 3 Q0 | D) + q 0 | (CO, D) -Q 0 | D) -Q 0 | O, d) - Vo všeobecnosti. |
|||||
obr, 298. | obr, 298. | obr, 298. | obr, 298. | ||||||
Q OB0. | 298 (H 2, D) \u003d 0 | Jednoduchá látka v štandardnom stave |
|||||||
Z referenčnej knihy nájdeme teplo tvorby zostávajúcich zložiek zmesi.
O, d) \u003d 241,8 | (CO, D) \u003d 110,5 | D) \u003d 74,6 | |||||||||
obr, 298. | obr, 298. | obr, 298. | |||||||||
Hodnoty nahrádzame rovnicou
Q \u003d 0 + 110,5 - 74,6 - 241,8 \u003d -205,9 KJ / MOL, reakcia je vysoko endotermich.
Odpoveď: Q \u003d -205.9 KJ / MOL, Endotermické
Príklad 4. (Uplatňovanie Gessa). Teplé reakcie sú známe
C (TV.) + ½ O (g) \u003d CO (g) + 110,5 kJ
C (TV.) + O2 (G.) \u003d CO2 (G.) + 393,5 KJ Nájdite tepelný účinok reakcie 2CO (G.) + O2 (G.) \u003d 2CO2 (g). Rozhodnutie vynásobené prvé a druhé rovnica na 2
2c (TV.) + O2 (g) \u003d 2CO (g) + 221 KJ 2C (TV.) + 2O2 (G.) \u003d 2CO2 (G.) + 787 KJ
Od druhej rovnice
O2 (G.) \u003d 2CO2 (G.) + 787 KJ - 2CO (G.) - 221 KJ, \\ t
2CO (G.) + O2 (G.) \u003d 2CO2 (G.) + 566 KJ Odpoveď: 566 KJ / MOL.
Poznámka: Pri štúdiu termochémie považujeme chemickú reakciu zvonku (vonku). Naopak, chemická termodynamika - veda správania chemických systémov - domnieva sa, že systém zvnútra a pôsobí s koncepciou "entalpie" H ako tepelná energia systému. ENTALPY, TAKÉ
Prednáška 6. Termochémia. Tepelný účinok chemickej reakcie je rovnaký význam ako množstvo tepla, ale má opačný znak: ak sa energia rozlišuje od systému, jeho prostredie sa dostane a vyhrieva sa a systém stráca energiu.
Literatúra:
1. Návod, V.V. Eremin, N.E. Kuzmenko et al., Chemický stupeň 9, bod 19,
2. Vzdelávacia a metodická príručka "Základy všeobecnej chémie" Časť 1.
Kompilátory - S.G. Baram, I.N. Mironova. - Vezmite si s tebou! Pre budúce zamestnanie seminára
3. A.V. Výrobné. Základy chémie. http://hemi.nsu.ru/index.htm.
§9.1 Tepelný účinok chemickej reakcie. Hlavné zákony termochémie.
§ 9.2 ** Termochémia (pokračovanie). Tepla tvorby látky z prvkov.
Štandardná entrálna výchova.
Pozor!
Ideme preto vyriešiť úlohy vysporiadania, preto je kalkulačka žiaduca aj pre semináre v chémii.
Termochemické štúdie tepelné účinky chemických reakcií. V mnohých prípadoch sa tieto reakcie vyskytujú pri konštantnom objeme alebo konštantnom tlaku. Z prvého zákona termodynamiky vyplýva, že za týchto podmienok tepla je funkčná funkcia. S konštantným objemom tepla rovného k zmene vnútornej energie:
a pri konštantnom tlaku, zmena entalpie:
Tieto rovnosti v aplikácii na chemické reakcie sú nevyhnutné gessa zákon:
Tepelný účinok chemickej reakcie prúdiacej v konštantnom tlaku alebo konštantnom objeme nezávisí od reakčnej dráhy a je určená len stavom činidiel a reakčných produktov.
Inými slovami, tepelný účinok chemickej reakcie je zmena stavovej funkcie.
V termochémii, na rozdiel od iných termodynamických aplikácií, sa teplo považuje za pozitívne, ak je zvýraznené v prostredí, t.j. Ak H. < 0 или U.
< 0. Под тепловым эффектом химической реакции
понимают значение H. (ktorý sa nazýva jednoducho "entalpia reakcia") alebo U. reakcie.
Ak reakcia prebieha v roztoku alebo pevnej fáze, kde je zmena objemu mierne,
H. = U. + (pv) U.. (3.3)
Ak sa do reakcie podieľajú perfektné plyny, potom pri konštantnej teplote
H. = U. + (pv) = U. + n. RT., (3.4)
kde n je zmena počtu mólov plynov v reakcii.
S cieľom uľahčiť porovnanie entalpium rôznych reakcií používajte koncepciu "štandardného stavu". Štandardný stav je stav čistej látky pri tlaku 1 bar (\u003d 105 Pa) a danú teplotu. Pre plyny je to hypotetický stav pri tlaku 1 bar, ktorý má vlastnosti nekonečne riedko plynu. Entalpia reakcie medzi látkami v štandardných podmienkach pri teplotách T., označujú ( r. Znamená "reakciu"). V termochemických rovníc, nielen vzorcov látok, ale aj ich agregované stavy alebo kryštalické modifikácie sú uvedené.
Zo zákona HESS, Dôležité následky toku, ktoré umožňujú vypočítať entalpiu chemických reakcií.
Corollary 1.
![]()
rovnaký rozdiel v štandardnej tvorbe reakčných produktov a reagencií štandardnej entalpy (s prihliadnutím na stechiometrické koeficienty):
Štandardná entalpia (teplo) tvorby látok (f. znamená "formáciu") pri danej teplote nazývanej entalpia tvorby tvorby jednej modlitby tejto látky z prvkovsa nachádza v najmodernejšom štandardnom stave. Podľa tejto definície je entalpia tvorby najstabilnejších jednoduchých látok v štandardnom stave 0 pri akejkoľvek teplote. Štandardné enthalpy tvorby látok pri teplote 298 K sú uvedené v referenčných knihách.
Pojem "entalpie vzdelávania" sa používajú nielen pre konvenčné látky, ale aj pre ióny v riešení. Súčasne je H + ion prijatý na referenčnú plochu, pre ktorú má byť štandardná entalpia formácie vo vodnom roztoku, ktorá má byť nula: ![]()
Corollary 2. Štandardná entalpia chemickej reakcie
![]()
rovná rozdielu entalpie spaľovania činidiel a reakčných produktov (s prihliadnutím na stechiometrické koeficienty):
(c. Znamená "obruba"). Štandardná entalpia (teplo) spaľovania látky sa nazýva entalpia reakcie z celkovej oxidácie jednej modlitby látky. Tento dôsledok sa zvyčajne používa na výpočet tepelných účinkov organických reakcií.
Corollary 3. Enthalska chemickej reakcie sa rovná rozdielu energie roztrhaných a výsledných chemických väzieb.
Komunikačná energia A- B sa nazýva energia potrebná na prerušenie väzby a riedenie výsledných častíc do nekonečnej vzdialenosti:
Ab (g) a (g) + b (g).
Komunikačná energia je vždy pozitívna.
Väčšina termochemických údajov v referenčných knihách sú uvedené pri teplote 298 K. Na výpočet tepelných účinkov pri iných teplotách kirchhoffová rovnica:
(Diferenciálna forma) (3.7)
 (integrálna forma) (3.8)
(integrálna forma) (3.8)
kde C P. - Rozdiel izobarskej tepelnej kapacity reakčných produktov a východiskových materiálov. Rozdiel T. 2 - T. 1 je malý, potom si môžete vziať C P. \u003d const. S veľkým rozdielom teploty je potrebné použiť teplotnú závislosť C P.(T.) Typ:
kde sú koeficienty a., b., c. atď. Pre jednotlivé látky, prijímajú z adresára a označenie označuje rozdiel medzi výrobkami a činidlami (s prihliadnutím na koeficienty).
Príklady
Príklad 3-1. Štandardné enthalpy tvorby kvapalnej a plynnej vody pri 298 K sa rovnajú -285,8 a -241,8 kJ / mol. Vypočítajte entalpiu odparovania vody pri tejto teplote.
Rozhodnutie. Vzdelávanie Enthalpia zodpovedá nasledujúcim reakciám:
H2 (g) + ѕo2 (g) \u003d H20 (g), H. 1 0 = -285.8;
H2 (g) + ѕo2 (g) \u003d H20 (g), H. 2 0 = -241.8.
Druhá reakcia sa môže uskutočniť v dvoch stupňoch: prvá horieť vodík, aby sa vytvorila kvapalná voda prvou reakciou a potom sa odparí vodou:
H20 (g) \u003d H20 (g), H. 0 je \u003d?
Potom podľa zákona Hessa,
H. 1 0 + H. 0 je \u003d. H. 2 0 ,
z H. 0 ISP \u003d -241,8 - (-285,8) \u003d 44,0 kJ / mol.
Odpoveď. 44.0 KJ / MOL.
Príklad 3-2. Vypočítajte entrálnu reakciu
6c (g) + 6H (g) \u003d C6H6 (g)
a) o enthalpies vzdelávania; b) na komunikačné energie za predpokladu, že dvojité väzby v molekule C6H6 sú fixované.
Rozhodnutie. A) Vzdelávanie Enthalpy (v KJ / Mole) Nájdeme v adresári (napríklad P.W.atkins, Fyzická chémia, 5. vydanie, str. C9-C15): F H. 0 (C6H6 (g)) \u003d 82,93, \\ t F H. 0 (c (g)) \u003d 716,68, \\ t F H. 0 (H (d)) \u003d 217,97. Reakcia entalpie je:
R H. 0 \u003d 82,93 - 6 716,68 - 6 217,97 \u003d -5525 KJ / MOL.
b) V tejto reakcii nie sú chemické väzby rozbité, ale len tvoria. V aproximácii pevných dvojitých väzieb, C6H6 molekula obsahuje 6 väzieb C-H, 3 komunikácie C - C a 3 komunikácie C \u003d C. Energetické prepojenia (v KJ / MOL) (P.W..atkins, Fyzická chémia, 5. vydanie, str. C7): E.(C-H) \u003d 412, E.(C-C) \u003d 348, \\ t E.(C \u003d c) \u003d 612. Reakcia Enthalpy sa rovná:
R H. 0 \u003d - (6 412 + 3 348 + 3 612) \u003d -5352 KJ / MOL.
Rozdiel s presným výsledkom je -5525 kJ / mol je spôsobený tým, že v benzenovej molekule nie sú žiadne jednoduché väzby C - C a dvojité väzby C \u003d C a existuje 6 aromatických väzieb s C C.
Odpoveď. a) -5525 kJ / mol; b) -5352 kJ / mol.
Príklad 3-3. Používanie referenčných údajov vypočítajte entalpiu reakcie
3CU (TV) + 8HNO 3 (aq) \u003d 3CU (NO 3) 2 (aq) + 2NO (g) + 4H20 (g)
Rozhodnutie. Skrátená rovnica iónovej reakcie má formulár:
3CU (TV) + 8H + (aq) + 2NO 3 - (aq) \u003d 3CU2 + (aq) + 2NO (g) + 4H20 (g).
Podľa zákona o Gesse sa enthalská reakcia rovná:
R H. 0 = 4 F H. 0 (H20 (g)) + 2 F H. 0 (nie (g)) + 3 F H. 0 (CU 2+ (AQ)) - 2 F H. 0 (č. 3 - (aq))
(Enhaulpia formovania medi a iónov H + sú rovnaké, podľa definície, 0). SUBTTHANTIZOVANIE Vzdelávanie Vzdelávanie (P.W.atkins, Fyzická chémia, 5. vydanie, str. C9-C15), nájdeme:
R H. 0 \u003d 4 (-285,8) + 2 90,25 + 3 64,77 - 2 (-205,0) \u003d -358.4 KJ
(za tri modlitby medi).
Odpoveď. -358.4 KJ.
Príklad 3-4. Vypočítajte entalpiu spaľovania metánu pri 1000 K, ak je entalpia formácie podávaná pri 298 na: F H. 0 (CH 4) \u003d -17,9 kcal / mol F H. 0 (CO 2) \u003d -94,1 kcal / mol F H. 0 (H20 (g)) \u003d -57,8 kcal / mol. Teplovú kapacitu plynov (v CAL / (MOH K)) v rozsahu od 298 do 1000 K je rovnaká:
C p (CH 4) \u003d 3,422 + 0,0178. T., C P.(O 2) \u003d 6,095 + 0,0033. T.,
C p (CO 2) \u003d 6,396 + 0,0102. T., C P.(H20 (d)) \u003d 7,188 + 0,0024. T..
Rozhodnutie. Enhaulpia metánová spaľovacia reakcia
CH4 (g) + 2O2 (g) \u003d C02 (g) + 2H20 (g)
pri 298 na rovnaké:
94,1 + 2 (-57,8) - (-17,9) \u003d -191,8 kcal / mol.
Nájdite rozdiel tepelného kapacity ako funkciu teploty:
C P. = C P.(CO 2) + 2 C P.(H 2 O (d)) - C P.(CH 4) - 2 C P.(O 2) \u003d
= 5.16 - 0.0094T. (Cal / (Moth. K)).
Entalpia reakcie na 1000 na výpočet podľa rovnice Kirchhoff:
= +  = -191800 + 5.16
= -191800 + 5.16
(1000-298) - 0,0094 (1000 2 -298 2) / 2 \u003d -192500 Cal / mol.
Odpoveď. -192,5 kcal / mol.
Úlohy
3-1. Koľko tepla bude potrebných na preklad 500 g al (t.pl. 658 ° C, H. 0 pl \u003d 92,4 kal / g), odobraté pri teplote miestnosti, v roztavenom stave, ak C P.(AL TV) \u003d 0,183 + 1,096 10 -4 T. Cal / (g k)?
3-2. Štandardná entrálna reakcia CAko 3 (TV) \u003d CaO (TV) + CO 2 (g) vyskytujúca sa v otvorenej nádobe pri teplote 1000 K, rovná 169 kJ / mol. Čo sa rovná teplotu tejto reakcie prúdiacej pri rovnakej teplote, ale v uzavretej nádobe?
3-3. Vypočítajte štandardnú vnútornú energiu tvorby kvapalného benzénu pri 298 K, ak je štandardná entalpia jej tvorby 49,0 kJ / mol.
3-4. Vypočítať entalpiu tvorby n2 o 5 (d) na T. \u003d 298 K na základe nasledujúcich údajov:
2NO (g) + 02 (g) \u003d 2NO 2 (g), H. 1 0 \u003d -114.2 KJ / MOL,
4NO 2 (g) + 02 (g) \u003d 2N205 (g), H. 2 0 \u003d -110,2 KJ / MOL,
N2 (g) + 02 (g) \u003d 2NO (g), H. 3 0 \u003d 182,6 kJ / mol.
3-5. Enhaulpia spaľovacia glukóza, -fruktóza a sacharóza pri 25 ° C sa rovná -2802,
-2810 a -5644 kJ / mol, resp. Vypočítajte teplo hydrolýzy sacharózy.
3-6. Určiť entalpiu tvorby tvorby B2H6 (g) s T. \u003d 298 z nasledujúcich údajov:
B2H6 (g) + 3O 2 (g) \u003d B2O3 (TV) + 3H20 (g), H. 1 0 \u003d -2035.6 KJ / MOL
2b (TV) + 3/2 O 2 (g) \u003d B 2O 3 (TV), H. 2 0 \u003d -1273.5 KJ / MOL,
H2 (g) + 1/2 02 (g) \u003d H20 (g), H. 3 0 \u003d -2241,8 kJ / mol.
3-7. Vypočítajte teplo tvorby sulfátu zinočnatého z jednoduchých látok, keď T. \u003d 298 K založené na nasledujúcich údajoch.