Reakcijų šiluminio poveikio skaičiavimai. Cheminių reakcijų šiluminio poveikio apskaičiavimo metodai skirtingose \u200b\u200btemperatūrose
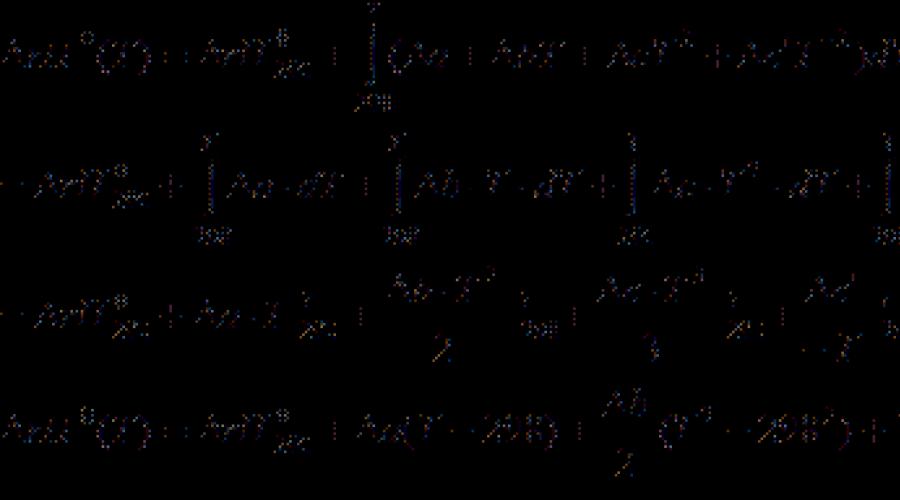
Visi terminio poveikio apskaičiavimo metodai yra pagrįsti Kirchoff lygtimi integruotoje formoje.
Dažniausiai standartinis standartas 298.15K naudojamas kaip pirmoji temperatūra.
Visi šiluminio poveikio apskaičiavimo metodai sumažinami iki tinkamos lygties dalies integrumo metodų.
Neatskiriama metodų:
I. vidurinės šilumos kepurės. Šis metodas yra paprasčiausias ir tiksliausias. Šiuo atveju išraiška pagal integruotą ženklą pakeičiamas vidutinis šilumos pajėgumas, kuris nepriklauso nuo pasirinkto diapazono temperatūros.
Vidutinis šilumos pajėgumas yra lentelės ir matuojamas daugumai reakcijų. Juos lengva apskaičiuoti pagal atskaitos duomenis.
Ii. Pagal tikros šilumos dangtelius. (Su temperatūros eilučių pagalba)
Šiame metode šilumos pajėgumų integrandas yra parašytas kaip temperatūros diapazonas:

III. Pagal aukštos temperatūros komponentus. Šis metodas buvo plačiai paplitęs su raketų technologija, apskaičiuojant cheminių reakcijų šiluminį poveikį aukštoje temperatūroje. Jis grindžiamas ISOBAR šilumos pajėgumų apibrėžimu:

Aukštos temperatūros komponentas. Tai rodo, kiek individualios medžiagos entalpija pasikeis, kai jis šildomas iki tam tikro laipsnio skaičiaus.
Cheminės reakcijos rašymas:

Šiuo būdu:
Paskaitos numeris 3.
Paskaitos planas:
1. II termodinamikos įstatymas, apibrėžimas, matematinis įrašas.
2. termodinamikos įstatymo II analizė
3. Apskaičiavimas entropijos pokyčių kai kuriuose procesuose
čia ir kiti indeksai i. kreipkitės į pradines medžiagas ar reagentus ir indeksus j.- baigtinėms medžiagoms ar reakcijos produktams; ir - stechiometriniai koeficientai reakcijos lygtys pradinių medžiagų ir reakcijos produktų, atitinkamai.
Pavyzdys:Apskaičiuokite metanolio sintezės reakcijos šiluminį poveikį standartinėmis sąlygomis.
Sprendimas: Skaičiavimams naudosime atskaitos duomenis pagal standartinę medžiagų reakcijos formavimo šilumą (žr. 44 lentelę.
Metanolio sintezės reakcijos šiluminis poveikis pagal standartines sąlygas pagal pirmąją GESS įstatymo pasekmę (1.15 lygtis) yra lygi:
Apskaičiuojant cheminių reakcijų šiluminį poveikį, būtina atsižvelgti į tai, kad šiluminis poveikis priklauso nuo bendrosios reagentų būsenos ir cheminės reakcijos lygties įrašymo tipo:
Antrajai GESSA įstatymo pasekmė, šiluminis poveikis gali būti apskaičiuojamas naudojant degimo šilumą Δ C H.Kaip į pradinės medžiagos degimo ir reakcijos produktų degimo šilumos skirtumą (atsižvelgiant į stechiometrinius koeficientus):
kur δ. R C P. - apibūdina sistemos izobariškos šilumos pajėgumo pokyčius dėl cheminės reakcijos srauto ir vadinama reakcijos šiluminio poveikio temperatūros koeficientu.
Nuo diferencinio "Kirchhoff" lygties matyti, kad šiluminio poveikio temperatūrai priklausomybė nustatoma pagal ženklą Δ R C P.. Tai priklauso nuo to, kad daugiau, bendras pradinių medžiagų šilumos pajėgumas arba bendras reakcijos produktų šilumos pajėgumas. Analizuojame diferencialinę "Kirchhoff" lygybę.
1. Jei temperatūros koeficientas Δ R C P.\u003e 0, tada išvestinė priemonė  \u003e 0 ir funkcija
\u003e 0 ir funkcija  didėja. Todėl reakcijos šiluminis poveikis didėjant temperatūrai.
didėja. Todėl reakcijos šiluminis poveikis didėjant temperatūrai.
2. Jei temperatūros koeficientas Δ R C P.< 0, то производная  < 0 и функция
< 0 и функция  mažėjantis. Todėl sumažėja reakcijos šiluminis poveikis didėjančiam temperatūrai.
mažėjantis. Todėl sumažėja reakcijos šiluminis poveikis didėjančiam temperatūrai.
3. Jei temperatūros koeficientas Δ R C P. \u003d 0, tada išvestinė priemonė  \u003d 0 I.
\u003d 0 I.  . Todėl terminis poveikis reakcijos nepriklauso nuo temperatūros. Šis atvejis nėra praktiškai.
. Todėl terminis poveikis reakcijos nepriklauso nuo temperatūros. Šis atvejis nėra praktiškai.
Diferencialinės lygtys yra patogios analizei, bet nepatogiai skaičiavimams. Norint gauti lygtį, skirtą apskaičiuoti cheminės reakcijos šiluminio poveikio lygtį, kirsti diferencialinę "Kirchhoff" lygtį, atskiriant kintamuosius:


Šilumos pajėgumas medžiagų priklauso nuo temperatūros, todėl ir  . Tačiau cheminių ir technologinių procesų dažniausiai naudojamų temperatūrų regione ši priklausomybė nėra reikšminga. Praktiniais tikslais vidutinio šilumos talpos medžiagos naudojamos temperatūros intervale nuo 298 iki nurodytos temperatūros.
. Tačiau cheminių ir technologinių procesų dažniausiai naudojamų temperatūrų regione ši priklausomybė nėra reikšminga. Praktiniais tikslais vidutinio šilumos talpos medžiagos naudojamos temperatūros intervale nuo 298 iki nurodytos temperatūros.  kurios pateiktos informacinėse knygose. Temperatūros koeficientas šiluminio poveikio, apskaičiuotas naudojant vidutinio šilumos talpos:
kurios pateiktos informacinėse knygose. Temperatūros koeficientas šiluminio poveikio, apskaičiuotas naudojant vidutinio šilumos talpos:
Pavyzdys:Apskaičiuokite metanolio sintezės reakcijos šiluminį poveikį 1000 iki standartinio slėgio.
Sprendimas: Apskaičiavimams naudosime orientacinius duomenis apie vidutinį šilumos pajėgumus, susijusius su temperatūros reakcija nuo 298 iki 1000 K (žr. 40 lentelę):
Vidutinio sistemos šilumos pajėgumų pokyčiai dėl cheminės reakcijos srauto:
Antrasis termodinamikos pradžia
Viena iš svarbiausių cheminių termodinamikos uždavinių yra paaiškinti pagrindinę cheminės reakcijos spontaniško srauto galimybę nagrinėjamoje kryptimi. Tais atvejais, kai tampa aišku, kad ši cheminė sąveika gali atsirasti, būtina nustatyti šaltinių medžiagų transformacijos laipsnį ir reakcijos produktų derlingumą, ty reakcijos pilnatvę
Spontaniško proceso metu kryptis gali būti nustatoma remiantis antrojo įstatymo ar termodinamikos pradžia, pavyzdžiui, Clausius Postulate forma:
Pats šiluma negali judėti nuo šalto kūno iki karšto, ty toks procesas yra neįmanomas, vienintelis rezultatas buvo šilumos perėjimas nuo kūno su žemesne temperatūra su aukštesne temperatūra.
Siūlomi įvairūs antrojo termodinamikos pradžios įvairovė. Thomson formuluotė - Plankkas:
Amžinasis antrosios rūšies variklis yra neįmanomas, t. Y., toks periodiškai aktyvus mašina yra neįmanoma, o tai leistų gauti operaciją tik aušinant šilumos šaltinį.
Antrojo termodinamikos pradžios matematinė formulavimas analizuojant šiluminių mašinų veikimą N. Carno ir R. Clausius darbuose.
Clausius buvo įvesta valstybės funkcija S., pavadintas entropija, kai pakeitimas yra lygus grįžtamo proceso šilumui, nurodyta temperatūrai
Bet kokiam procesui
 | (1.22) |
Gauta išraiška yra antrojo termodinamikos pradžios matematinė išraiška.
Standartinė švietimo šiluma (švietimo entuzija) Medžiagos Tai vadinama už šio cheminės medžiagos meldimo formavimo formavimo iš elementų (paprastų medžiagų, kurios sudaro vienos rūšies atomų) steigimas labiausiai stabilioje standartinėje būsenoje. Standartiniai aplinkos entalspijos (CJ / MOL) pateikiami informacinėse knygose. Naudojant referencines vertes, būtina atkreipti dėmesį į etapo būklę, susijusią su reakcija. Stabiliausių paprastų medžiagų susidarymo entalpija yra 0.
Corollary nuo GESS įstatymo dėl cheminių reakcijų šilumos poveikio skaičiavimo į švietimo šilumą : standartas. \\ T cheminės reakcijos šiluminis poveikis yra lygus reakcijos produktų susidarymo šilumos ir šaltinių formavimo šilumos šilumai, atsižvelgiant į stechiometrinius koeficientus (kiekius molių):
CH. 4 + 2 CO \u003d 3 c ( grafitas ) + 2 H. 2 O.
dujų dujų televizija. Dujos
Šių etapų valstybių medžiagų susidarymo šiluma parodyta lentelėje. 1.2.
1.2 lentelė.
Šiltas medžiagų susidarymas
Sprendimas Šis sprendimas
Kadangi reakcija praeina, kai P.\u003d Const, tada standartinis šiluminis poveikis randamas kaip entalpijos pokytis pagal žinomą švietimo šilumą pagal GESS įstatymą (Formulė (1.17): \\ t
ΔН. apie tai 298 \u003d (2 · (-241,81) + 3 · 0) - (-74,85 + 2 · (-110,53)) \u003d -187,71 kJ \u003d -187710 J.
ΔН. apie tai 298 < 0, реакция является экзотермической, протекает с выделением теплоты.
Vidaus energijos pasikeitimas Mes randame pagal lygtį (1.16):
ΔU. apie tai 298 = Δh. apie tai 298 – Δ ν ν · Rt..
Dėl šios reakcijos iš cheminės reakcijos į cheminės reakcijos persikėlimo pokyčių reakciją Δν = 2 – (1 + 2) = –1; T.\u003d 298 K, tada
Δ U. apie tai 298 \u003d -187710 - (-1) · 8,314 · 298 \u003d -185232 J.
Cheminių reakcijų standartinio šiluminio poveikio apskaičiavimas pagal standartinę reakcijoje dalyvaujančių medžiagų degimo šilumą
Standartinė šilumos degimo (degimo entalpija) medžiaga
jis vadinamas šilumu pilno oksidacijos 1 maldos tam tikros medžiagos (iki aukštojo oksidų arba specialiai nurodytų junginių) su deguonimi, su sąlyga, kad pradinės ir baigtinės medžiagos turi standartinę temperatūrą. Standartiniai degimo entalpia medžiagos  (KJ / mol) pateikiami informacinėse knygose. Naudojant pamatines vertes, būtina atkreipti dėmesį į degimo reakcijos dramblio ženklą, kuris visada egzotermiškai ( Δ
H.
<0), а в таблицах указаны величины
(KJ / mol) pateikiami informacinėse knygose. Naudojant pamatines vertes, būtina atkreipti dėmesį į degimo reakcijos dramblio ženklą, kuris visada egzotermiškai ( Δ
H.
<0), а в таблицах указаны величины
 .
. Didesnių oksidų entalpių degimas (pvz., Vandens ir anglies dioksidas) yra lygūs 0.
Didesnių oksidų entalpių degimas (pvz., Vandens ir anglies dioksidas) yra lygūs 0.
Įstatymas nuo GESS įstatymo dėl cheminių reakcijų šilumos poveikio degimo šilumui apskaičiuoti : standartinis cheminės reakcijos šiluminis poveikis yra lygus pradinių medžiagų degimo šilumos ir reakcijos produktų degimo šilumos šilumos, atsižvelgiant į stechiometrinius koeficientus (sumų kiekį) reagentų:
C. 2 H. 4 + H. 2 O. \u003d S. 2 N. 5 AR JIS.
Lygiai taip pat viena iš fizinių asmenų savybių yra fizinė jėga, svarbiausia bet kokio cheminio ryšio ypatybė yra bendravimo galia, t.y. Jos energija.
Prisiminkite, kad cheminės obligacijų energija - ši energija, skirta formuojant cheminę jungtį arba energiją, kurią reikia panaudoti šiam ryšiui sunaikinti.
Cheminė reakcija apskritai yra vienos medžiagos konvertavimas į kitus. Todėl cheminės reakcijos metu yra kai kurių ryšių sujungimas ir kitų formavimas, t. Y. Energijos tekinimas.
Pagrindinis fizikos įstatymas nurodo, kad energija nėra kyla iš nieko ir neišnyksta be pėdsakų, bet tik eina iš vienos rūšies į kitą. Pagal savo universalumą šis principas yra akivaizdžiai taikomas cheminės reakcijos.
Cheminės reakcijos šiluminis poveikis vadinamas šilumos kiekiu,
reakcijos metu skiriama (arba absorbuojama), o santykinis iki 1 molio reagavo (arba gauta) medžiaga.
Šiluminis poveikis nurodomas raide Q ir, kaip taisyklė, matuojamas KJ / MOL arba kcal / mol.
Jei reakcija atsiranda su šilumos atlaisvinimu (Q\u003e 0), jis vadinamas ExotherMic, ir jei su šilumu absorbcija (Q< 0) – эндотермической.
Jei ji yra schematiškai pavaizduoti reakcijos energijos profilį, tada endoterminės reakcijos, produktai yra didesni nei reagentai, ir exothermic - priešingai, reakcijos produktai yra žemiau energijos (stabilios) nei reagentai.
Akivaizdu, kad kuo didesnė medžiaga reaguoja, tuo didesnė energijos kiekis yra atskirtas (arba absorbuojamas), t.y. Šiluminis poveikis yra tiesiogiai proporcingas medžiagos kiekiui. Todėl terminio poveikio požiūris į 1 mol medžiagos yra dėl mūsų noro palyginti šilumos poveikį įvairių reakcijų.
Paskaita 6. Thermochemija. Cheminės reakcijos 1 pavyzdys šiluminis poveikis. Su 8,0 g vario (ii) vandenilio oksido, metalo vario ir vandens poros buvo suformuotos ir 7,9 kJ šilumos. Apskaičiuokite vario oksido (II) sumažinimo reakcijos šiluminį poveikį.
Sprendimas. CUO reakcijos lygtis (televizija.) + H2 (G.) \u003d Cu (televizija) + H2 O (G.) + Q (*)
Padarykite proporciją 0,1 mol - 7,9 kJ atkūrimo metu 1 mol - X KJ atkūrimo metu
Kur x \u003d + 79 kJ / mol. Lygtis (*)
CUO (TV.) + H2 (G.) \u003d Cu (TV.) + H2 O (G.) +79 kJ
Termocheminės lygtis. \\ T- Tai cheminės reakcijos lygtis, rodanti bendrą reakcijos mišinio (reagentų ir produktų) komponentų būklę ir reakcijos šiluminį poveikį.
Taigi, kad išlydytų ledą arba išgaruotų vandenį, būtina išleisti tam tikrus šilumos kiekius, o skysto vandens užšalimo ar vandens garų kondensacija yra paskirstytos tos pačios sumos. Štai kodėl šalta, kai išeiname iš vandens (vandens išgaravimas iš kūno paviršiaus reikia energijos sąnaudų), o prakaitavimas yra biologinis apsauginis mechanizmas nuo kūno perkaitimo. Priešingai, šaldiklis užšaldo vandenį ir šildo aplinkinį kambarį, suteikiant jai pernelyg didelę šilumą.
Šis pavyzdys rodo šiluminį poveikį pokyčių į bendrą vandens būklę. Lydymosi šiluma (0o c) λ \u003d 3,34 × 105 j / kg (fizika) arba ql. \u003d - 6.02 KJ / MOL (chemija), šilumos garavimas (garinimas) (100O c) Q \u003d 2,26 × 106 j / kg (fizika) arba QISP. \u003d - 40,68 kJ / mol (chemija).
lydymas
garavimas |
|||||
oBR, 298.
Paskaita 6. Thermochemija. Žinoma, cheminės reakcijos šiluminis poveikis yra sublimacijos procesai yra įmanomi, kai kietas
jis eina į dujų fazę, apeinant skystą būseną ir atvirkštinius nusodinimo procesus (kristalizaciją) nuo dujų fazės, taip pat galima apskaičiuoti arba matuoti šiluminį poveikį.
Akivaizdu, kad kiekvienoje medžiagoje yra cheminių obligacijų, kiekviena medžiaga turi tam tikrą energijos rezervą. Tačiau ne visos medžiagos gali būti paverstos viena kitai su viena chemine reakcija. Todėl sutiko įvesti standartinę būseną.
Standartinė medžiagos būklė- Tai yra bendra medžiagos būklė, esant 298 K temperatūrai, 1 atmosferos slėgis yra stabiliausia deflato deficia šiomis sąlygomis.
Standartinės sąlygos- tai yra 298 K ir slėgio temperatūra 1 atmosfera. Standartinės sąlygos (standartinis būsena) nurodomas indeksas0.
Standartinis šilumos formavimo ryšys jis vadinamas šiluminiu poveikiu cheminės reakcijos šio junginio formavimo iš paprastų medžiagų, kurių buvo imtasi standartinėje būsenoje. Sudėtinės formavimo šilumą nurodo Q simbolis.0 Dėl įvairių junginių, standartinis šiluminis švietimas pateikiamas referencinėse knygose fizikinių ir cheminių vertybių.
Standartinė paprastų medžiagų susidarymo šiluma yra lygi 0. Pavyzdžiui, Q0R, 298 (O2, dujos) \u003d 0, Q0R, 298 (C, TV, grafitas) \u003d \u200b\u200b0.
Pavyzdžiui . Įrašykite termocheminę lygtį, skirtą vario sulfato formavimui (II). Nuo orientacinės knygos Q0R, 298 (CUSO4) \u003d 770 KJ / MOL.
Cu (TV.) + S (TV.) + 2O2 (G.) \u003d CUSO4 (TV) + 770 kJ.
Pastaba: termocheminė lygtis gali būti užregistruota bet kuriai medžiagai, tačiau būtina suprasti, kad realiame gyvenime reakcija atsiranda visiškai kitokiu būdu: nuo išvardytų reagentų yra suformuoti, kai šildomas vario (II) oksidas ir siera (IV ), bet vario sulfatas (ii) nėra suformuota. Svarbi išvada: termocheminė lygtis yra modelis, leidžiantis skaičiavimams, jis yra gerai suderinamas su kitais termocheminiais duomenimis, tačiau nepadaro praktikos patikrinimo (ty negali teisingai numatyti galimybės ar nesugebėjimo reakcijos).
(B J) - σ a i × q Ar 0, 298 I
Paskaita 6. Thermochemija. Cheminės reakcijos šiluminis poveikis
Paaiškinimas. Kad nebūtų suklaidinti, aš nedelsiu pridėti tą cheminį termodinamiką gali numatyti galimybę arba neįmanoma reakcijosTačiau tai reikalauja rimtesnių "įrankių", kurie viršija mokyklos chemijos kursą. Termocheminė lygtis, palyginti su šiais metodais, yra pirmasis žingsnis ant heopse piramidės fone - be jo negali daryti, bet ne didelė.
2 pavyzdys. Apskaičiuokite vandens kondensacijos šiluminį poveikį 5,8 g. Kondensacijos procesą apibūdina H2 O (G.) \u003d H2 O (g.) + Q - kondensacija Paprastai egzoterminis šilumos kondensacijos procesas ne 25O C 37 kJ / mol (kataloge).
Todėl Q \u003d 37 × 0,32 \u003d 11,84 kJ.
XIX a. Rusijos chemikas, kuris studijavo reakcijų šiluminį poveikį, eksperimentiškai nustatė energijos taupymo įstatymą, susijusį su cheminėmis reakcijomis - HESS įstatymu.
Cheminės reakcijos šiluminis poveikis nepriklauso nuo proceso kelio ir nustato tik baigtinių ir pradinių valstybių skirtumą.
Chemijos ir matematikos požiūriu šis įstatymas reiškia, kad mes galime laisvai apskaičiuoti procesą pasirinkti bet kokią "skaičiavimo trajektoriją", nes rezultatas nepriklauso nuo jo. Dėl šios priežasties labai svarbus HESS įstatymas turi neįtikėtinai svarbų gESS įstatymo pasekmė.
Cheminės reakcijos šiluminis poveikis yra lygus reakcijos produktų, atėmus reagentų susidarymo šilumą (atsižvelgiant į stechiometrinius koeficientus).
Atsižvelgiant į sveiko proto požiūriu, šis tyrimas atitinka procesą, kuriame visi reagentai pirmą kartą tapo paprastomis medžiagomis, kurios buvo surinktos nauju būdu, kad būtų gauti reakcijos produktai.
Lygčių forma, GESS įstatymo pasekmė atrodo kaip reakcijos lygtis: 1 a 1 + a 2 a 2 + ... + a n an \u003d b 1 b 1 + b 2 b 2 + ... B.
Tuo pačiu metu, aš i i ib j yra stechiometriniai koeficientai, I-reagentai, B J - reakcijos produktai.
Tada GESSA įstatymo pasekmė turi formą Q \u003d σ B J × QR. 0, 298
k bk + q
(A i)
Paskaita 6. Thermochemija. Cheminės reakcijos šiluminis poveikis nuo standartinės daugelio medžiagų susidarymo šilumos
a) Įsipareigojusi specialias stalus arba b) gali būti nustatomas eksperimentiškai, jis tampa įmanoma numatyti (apskaičiuoti) šiluminį poveikį labai daug reakcijų su pakankamai dideliu tikslumu.
3 pavyzdys. (GESS teisės pasekmė). Apskaičiuokite šiluminį metano konversijos šiluminį poveikį dujų etape standartinėmis sąlygomis:
CH4 (G.) + H2 O (G.) \u003d CO (G.) + 3 h2 ()
Nustatykite, ar ši reakcija yra egzoterminė ar endoterminė?
Sprendimas: GESS įstatymo pasekmė
Q \u003d 3 Q0 | D) + q 0 | (CO, D) -Q 0 | D) -Q 0 | O, d) - apskritai. |
|||||
oBR, 298. | oBR, 298. | oBR, 298. | oBR, 298. | ||||||
Q OB0. | 298 (H 2, D) \u003d 0 | Paprasta medžiaga standartinėje būklėje |
|||||||
Nuo referencinės knygos mes randame likusių mišinio sudedamųjų dalių formavimo šilumą.
O, d) \u003d 241,8 | (CO, D) \u003d 110,5 | D) \u003d 74,6 | |||||||||
oBR, 298. | oBR, 298. | oBR, 298. | |||||||||
Mes pakeisime vertybes į lygtį
Q \u003d 0 + 110,5 - 74,6 - 241,8 \u003d -205,9 kJ / mol, reakcija yra labai enderinga.
Atsakymas: Q \u003d -205,9 kJ / mol, endoterminis
4. pavyzdys (GESSA taikymas). Žinomos reakcijos šiluma
C (TV.) + ½ o (g.) \u003d CO (g.) + 110,5 kJ
C (TV.) + O2 (G.) \u003d CO2 (G.) + 393.5 KJ Rasti reakcijos 2co (G.) + O2 (G.) \u003d 2CO2 (g.). Sprendimas dauginant pirmąjį ir sekundę 2 lygtis
2C (TV.) + O2 (g.) \u003d 2CO (g.) + 221 kJ 2c (TV.) + 2O2 (G.) \u003d 2CO2 (G.) + 787 kJ
Subitount iš antrosios lygties pirmosios
O2 (G.) \u003d 2CO2 (G.) + 787 KJ - 2CO (G.) - 221 kJ,
2CO (G.) + O2 (G.) \u003d 2CO2 (G.) + 566 KJ Atsakymas: 566 kJ / mol.
Pastaba: studijuojant termochemiją, mes manome, kad cheminė reakcija iš išorės (išorės). Priešingai, cheminis termodinamika - cheminių sistemų elgesio mokslas - mano, kad sistema nuo vidaus ir veikia su "entalpijos" h, kaip sistemos šiluminė energija. Entalpy
Paskaita 6. Thermochemija. Cheminės reakcijos šiluminis poveikis yra ta pati reikšmė kaip šilumos kiekis, bet turi priešingą ženklą: jei energija skiriasi nuo sistemos, jos aplinka gauna ir šildomas, o sistema praranda energiją.
Literatūra:
1. Tutorial, V.V. Eemin, N.E. Kuzmenko ir kt., Chemistry 9 laipsnis, 19 punktas,
2. Švietimo ir metodinis vadovas "Bendrosios chemijos pagrindai" 1 dalis.
Kompiliatoriai - s.G. Baramas, i.n. Mironova. - Paimkite su jumis! Už kitą seminarų profesiją
3. A.V. Manutulles. Chemijos pagrindai. http://hemi.nsu.ru/index.htm.
§9.1 Cheminės reakcijos šiluminis poveikis. Pagrindiniai termochemijos įstatymai.
§9.2 ** Thermochemistry (tęsinys). Medžiagos susidarymo šiluma nuo elementų.
Standartinis entalpių mokymas.
DĖMESIO!
Mes einame išspręsti atsiskaitymo užduotis, todėl skaičiuoklė taip pat pageidautina seminaruose chemijoje.
Thermochemija studijuoja cheminių reakcijų šiluminę poveikį. Daugeliu atvejų šios reakcijos atsiranda pastoviu garsumu arba pastoviu slėgiu. Nuo pirmojo termodinamikos įstatymo matyti, kad pagal šias šilumos sąlygas yra funkcijos funkcija. Su pastoviu šilumos kiekiu lygus vidaus energijos pokyčiams:
ir pastoviu spaudimu, entalpių pokyčiai:
Šie lygiai taikant chemines reakcijas yra labai svarbūs gESSA įstatymas:
Cheminės reakcijos šiluminis poveikis pastoviam slėgiui arba pastoviam tūrybai nepriklauso nuo reakcijos kelio ir nustato tik reagentų ir reakcijos produktų būklę.
Kitaip tariant, cheminės reakcijos šiluminis poveikis yra pakeisti būsenos funkciją.
Thermochemistry, priešingai nei kitos termodinaminės programos, šiluma laikoma teigiama, jei ji yra pabrėžta aplinkoje, t.y. jeigu H. < 0 или U.
< 0. Под тепловым эффектом химической реакции
понимают значение H. (kuris yra vadinamas tiesiog "entalpių reakcija") arba U. reakcijos.
Jei reakcija vyksta tirpalu arba kieta faze, kai tūrio pokytis yra šiek tiek,
H. = U. + (pV.) U.. (3.3)
Jei reakcijoje dalyvauja tobulos dujos, tada pastovi temperatūra
H. = U. + (pV.) = U. + n. Rt., (3.4)
kur n yra reakcijos reakcijos molių skaičius.
Siekiant palengvinti įvairių reakcijų entalipijos palyginimą, naudokite "standartinės valstybės" sąvoką. Standartinė būklė yra grynos medžiagos būklė 1 barų slėgiui (\u003d 10 5 PA) ir tam tikra temperatūra. Dujoms tai yra hipotetinė būklė, esant 1 baro slėgiui, kuris turi be galo retų dujų savybes. Tarp medžiagų reakcijos į standartines sąlygas esant temperatūrai T., žymi ( r. Reiškia "reakcija"). Termocheminėse lygtyse nurodomos ne tik medžiagų formulės, bet ir jų bendrosios būsenos arba kristalinės modifikacijos.
Nuo HESS įstatymo, svarbių pasekmių srautas, leidžiantis apskaičiuoti cheminių reakcijų entalpiją.
Corollary 1.
![]()
lygus standartinio entalpijos formavimo reagavimo produktų ir reagentų skirtumui (atsižvelgiant į stechiometrinius koeficientus):
Standartinis medžiagos formavimo standartinis entalpija (šiluma) (f. reiškia "formavimąsi") tam tikra temperatūra, vadinama vieno šios medžiagos maldos formavimo formavimu nuo elementųĮsikūręs labiausiai tvarioje standartinėje būsenoje. Remiantis šiuo apibrėžimu, stabiliausių paprastų medžiagų susidarymo intefypy standartinėje būsenoje yra 0 bet kurioje temperatūroje. Standartiniai cheminių medžiagų susidarymo davinimas 298 K temperatūroje pateiktos informacinėse knygose.
"Švietimo edalpy" sąvokos naudojamos ne tik įprastinėms medžiagoms, bet ir tirpalams. Tuo pačiu metu, H + jonas gaunamas per atskaitos tašką, už kurį standartinis entalpija formavimo vandeninio tirpalo turėtų būti nulis: ![]()
Corollary 2. Standartinis cheminės reakcijos entalpija
![]()
lygus reagentų ir reakcijos produktų degimo skirtumui (atsižvelgiant į stechiometrinius koeficientus):
(c. Reiškia "deginatą"). Standartinis cheminės medžiagos degimo (šilumos) dengimas vadinamas iš viso oksidacijos vienos maldos medžiagos reakcijos entalpija. Ši pasekmė paprastai naudojama apskaičiuoti organinių reakcijų šiluminį poveikį.
Corollary 3. Cheminės reakcijos entalpija yra lygi suplėšytų ir gautų cheminių obligacijų energijos skirtumai.
Komunikacijos energija A-B yra vadinama energija, reikalinga susigriebti obligacijai ir sukeliant susidarančiųjų dalelių į begalinį atstumą:
AB (g) a (g) + b (g).
Ryšių energija visada yra teigiama.
Dauguma termocheminių duomenų apie referencines knygas pateikiama 298 K. temperatūroje, kad būtų galima apskaičiuoti šiluminį poveikį kitose temperatūrose kirchhoff lygtis:
(Diferencinė forma) (3.7)
 (neatskiriama forma) (3.8)
(neatskiriama forma) (3.8)
kur C P. - reakcijos produktų ir pradinių medžiagų izobariško šiluminio pajėgumo skirtumas. Jei skirtumas. \\ T T. 2 - T. 1 yra mažas, tada galite imtis C P. \u003d Const. Su dideliu temperatūros skirtumu, būtina naudoti priklausomybę nuo temperatūros C P.(T.) Tipas:
kur koeficientai yra a., b., c. ir tt Dėl atskirų medžiagų, jie paima iš katalogo, ir ženklas rodo skirtumą tarp produktų ir reagentų (atsižvelgiant į koeficientus).
Pavyzdžiai. \\ T
3-1 pavyzdys. Standartiniai liudijimo ir dujinio vandens susidarymo davinimas 298 k yra lygus -285,8 ir -241,8 kJ / mol, atitinkamai. Apskaičiuokite vandens garavimo entalpiją šioje temperatūroje.
Sprendimas Šis sprendimas. Švietimo entalpija atitinka šias reakcijas:
H2 (g) + ѕ ѕo 2 (g) \u003d h 2 o (g), H. 1 0 = -285.8;
H2 (g) + ѕ ѕo 2 (g) \u003d h 2 o (g), H. 2 0 = -241.8.
Antroji reakcija gali būti atliekama dviem etapais: pirmiausia dega vandenilis, kad susidarytų skystas vanduo pirmuoju reakcija ir išgaruoja vandenį:
H 2 O (g) \u003d h 2 o (g), H. 0 yra \u003d?
Tada, atsižvelgiant į HESS įstatymą,
H. 1 0 + H. 0 yra \u003d. H. 2 0 ,
nuo. H. 0 ISP \u003d -241,8 - (-285,8) \u003d 44,0 kJ / mol.
Atsakymas. 44,0 kJ / mol.
3-2 pavyzdys. Apskaičiuokite entalpių reakciją
6C (g) + 6H (g) \u003d C6 h 6 (g)
a) dėl švietimo entalpų; b) ryšio energijoje, pagal prielaidą, kad dvigubos obligacijos molekulėje C 6 H 6 yra fiksuoti.
Sprendimas Šis sprendimas. a) Švietimas entalpija (KJ / Mole) Mes rasti kataloge (pavyzdžiui, P.W.atkins, fizinė chemija, 5 leidimas, PP. C9-C15): F H. 0 (C 6 h 6 (g)) \u003d 82,93, F H. 0 (c (g)) \u003d 716.68, F H. 0 (h (g)) \u003d 217.97. Entalpijos reakcija yra:
R H. 0 \u003d 82,93 - 6 716,68 - 6 217,97 \u003d -5525 KJ / mol.
b) Šioje reakcijoje cheminės obligacijos nėra pažeistos, bet tik suformuotos. Į fiksuoto dvigubų obligacijų apytiksliai C6 H 6 molekulės sudėtyje yra 6 obligacijos C-H, 3 ryšio C - C ir 3 ryšio C \u003d C. Energijos nuorodos (KJ / Mol) (P.W.atkins, fizinė chemija, 5 leidimas, p. C7): E.(C- h) \u003d 412, E.(C- c) \u003d 348, E.(C \u003d c) \u003d 612. Reakcijos entalpija yra lygi:
R H. 0 \u003d - (6 412 + 3 348 + 3 612) \u003d -5352 kJ / mol.
Skirtumas su tiksliu rezultatu yra -5525 KJ / MOL yra dėl to, kad benzeno molekulėje nėra vieno C - C ir dvigubų obligacijų obligacijų C \u003d C, ir yra 6 aromatinės obligacijos su C C C.
Atsakymas. a) -5525 kJ / mol; b) -5352 kj / mol.
3-3 pavyzdys. Naudojant atskaitos duomenis, apskaičiuoti reakcijos entalpiją
3CU (TV) + 8HNO 3 (AQ) \u003d 3CU (NO 3) 2 (AQ) + 2NO (G) + 4H 2 O (G)
Sprendimas Šis sprendimas. Sutrumpinta jonų reakcijos lygtis turi formą:
3CU (TV) + 8H + (AQ) + 2NO 3 - (AQ) \u003d 3CU 2+ (AQ) + 2NO (G) + 4H 2 O (G).
Pagal GESS įstatymą entalpių reakcija yra lygi:
R H. 0 = 4 F H. 0 (H 2 O (g)) + 2 F H. 0 (ne (g)) + 3 F H. 0 (Cu 2+ (AQ)) - 2 F H. 0 (Nr. 3 - (AQ))
("Copper" ir "Ion H +" formavimo "Enhaupia" yra lygūs, pagal apibrėžimą, 0). Švietimo ugdymo ugdymas (P.W.atkins, fizinė chemija, 5 leidimas, PP. C9-C15), mes randame:
R H. 0 \u003d 4 (-285,8) + 2 90,25 + 3 64,77 - 2 (-205,0) \u003d -358,4 kJ
(už tris maldos varis).
Atsakymas. -358,4 kJ.
3-4 pavyzdys. Apskaičiuokite metano degimo už 1000 k dygsnio dygsnį, jei formavimo entalpija pateikiama 298: F H. 0 (CH4) \u003d -17,9 kcal / mol F H. 0 (CO 2) \u003d -94,1 kcal / mol F H. 0 (H 2 O (g)) \u003d -57,8 kcal / mol. Dujų šilumos talpa (CAL / (CAL / (K)) diapazone nuo 298 iki 1000 k yra lygi:
C P (CH4) \u003d 3,422 + 0,0178. T., C P.(O 2) \u003d 6.095 + 0,0033. T.,
C P (CO 2) \u003d 6.396 + 0,0102. T., C P.(H2 O (d)) \u003d 7,188 + 0,0024. T..
Sprendimas Šis sprendimas. Enhaupia metano degimo reakcija
CH4 (g) + 2O 2 (g) \u003d CO 2 (g) + 2H2 2 (g)
298 iki lygios:
94,1 + 2 (-57,8) - (-17,9) \u003d -191,8 kcal / mol.
Raskite šilumos talpos skirtumą kaip temperatūros funkciją:
C P. = C P.(CO 2) + 2 C P.(H 2 O (g)) - C P.(CH 4) - 2 C P.(O 2) \u003d
= 5.16 - 0.0094T. (Cal / (Cal. K)).
Reakcijos entalpija 1000 iki skaičiavimo pagal "Kirchhoff" lygtį:
= +  = -191800 + 5.16
= -191800 + 5.16
(1000-298) - 0,0094 (1000 2 -298 2) / 2 \u003d -192500 CAL / MOL.
Atsakymas. -192,5 kcal / molis.
UŽDUOTYS
3-1. Kiek šilumos bus reikalinga 500 g al vertimui (T.pl. 658 ° C, H. 0 PL \u003d 92.4 CAL / G), paimta kambario temperatūroje, išlydytoje būsenoje, jei C P.(Al TV) \u003d 0,183 + 1,096 10 -4 T. CAL / (G K)?
3-2. Standartinė entalpy reakcija CACO 3 (TV) \u003d CAO (TV) + CO 2 (G), atsirandantis atvirame laive esant 1000 K temperatūrai, lygus 169 kJ / mol. Kas yra lygi šios reakcijos šilumai, tekančia toje pačioje temperatūroje, bet uždarame laive?
3-3. Apskaičiuokite standartinę vidinę skysto benzeno susidarymo vidinę energiją 298 k, jei standartinis jo formavimo entalpija yra 49,0 kJ / mol.
3-4. Apskaičiuokite N 2 O 5 (d) formavimo entalpiją T. \u003d 298 K, remiantis šiais duomenimis:
2NO (g) + o 2 (g) \u003d 2NO 2 (g), H. 1 0 \u003d -114,2 kJ / mol,
4NO 2 (g) + o 2 (g) \u003d 2n 2 O 5 (g), H. 2 0 \u003d -110,2 kJ / mol,
N 2 (g) + o 2 (g) \u003d 2NO (g), H. 3 0 \u003d 182,6 kJ / mol.
3-5. Enhaupia Degimo-gliukozės, skirtos ir sacharozės esant 25 ° C temperatūrai yra lygūs -2802,
-2810 ir -5644 KJ / mol, atitinkamai. Apskaičiuokite sacharozės hidrolizės šilumą.
3-6. Nustatykite B 2 H 6 (g) formavimo formavimo entalpiją T. \u003d 298 į šiuos duomenis:
B 2 H 6 (G) + 3O 2 (G) \u003d B 2 O 3 (TV) + 3H 2 O (G), H. 1 0 \u003d -2035,6 kJ / mol
2b (TV) + 3/2 o 2 (G) \u003d B 2 O 3 (TV), H. 2 0 \u003d -1273,5 kJ / mol,
H2 (g) + 1/2 o 2 (g) \u003d h 2 o (g), H. 3 0 \u003d -2241,8 kJ / mol.
3-7. Apskaičiuokite cinko sulfato formavimo šilumą nuo paprastų medžiagų T. \u003d 298 K, remiantis šiais duomenimis.