Toliau išvardytų elementų atomų charakteristikas. Chemija
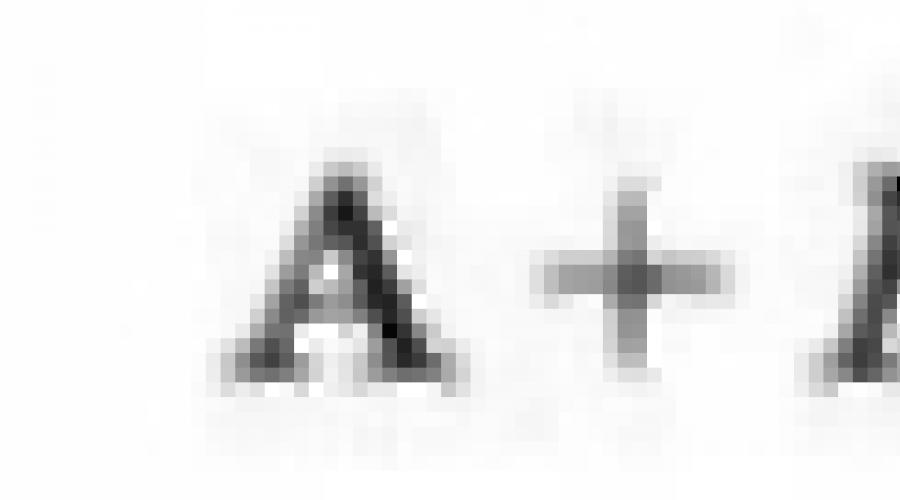
Egzaminas Nr. 2 apima užduotis šiomis temomis:
- Periodinė sistema
- Elementų ir jų junginių savybių keitimo dažnis.
- Cheminė jungtis. Metodas Saulė.
- Cheminė jungtis. MO metodas.
- Cheminė jungtis. Jonų ryšys.
- Cheminė jungtis sudėtinguose junginiuose.
Žinių patikrinimo bandymas:
1. Periodiškai pakeistų elementų atomų charakteristikas
(1) ATOM branduolio mokestis;
(2) santykinė atominė masė;
(3) atomo energijos lygių skaičius;
(4) elektronų skaičius išorės energijos lygiu.
2. Viduje laikotarpiu elemento sekos numeris paprastai yra lydimas
(1) su atominiu spinduliu sumažėjimu ir atomo elektroninės reguliatoriaus padidėjimu;
(2) atominio spindulio padidėjimas ir atomo elektroninio reguliavimo reguliavimo sumažėjimas;
(3) su atominiu spinduliu sumažėjimu ir atomo elektroninės reguliavimo režimo sumažėjimas;
(4) atominio spindulio padidėjimas ir atomo elektroninės reguliavimo reguliavimo padidėjimas.
3. Atomas, kurio elementas yra paprasčiausias būdas suteikti vieną elektroną (numeriai reiškia elemento sekos numerį):
(1) natrio, 11; (2) Magnis, 12; (3) aliuminio, 13; (4) silicis, 14?
4. Periodinės elementų sistemos elementų atomai turi tą patį numerį
(1) elektronai išoriniu elektroniniu lygmeniu;
(2) neutronai;
(3) Visi elektronai.
5. Elementai yra įsikūrusi didėjant elektronifikavimo eilės eilėje
(1) kaip, SE, Cl, F; (2) C, I, B, si; (3) BR, P, H, SB; (4) O, SE, BR, TE.
6. Antrajame ir trečiuoju periodinės sistemos laikotarpiais, nes sumažėja elementų dydis atomai
(1) jų jonų dydis taip pat sumažinamas;
(2) sumažėja elektros energija;
(3) elementų metalo savybės silpnina;
(4) elementų metalo savybės yra sustiprintos.
7. Kuris skaičius apima tik pereinamojo laikotarpio elementus:
(1) elementai 11, 14, 22, 42; (2) 13, 33, 54, 83 elementai;
(3) elementai 24, 39, 74, 80; (4) elementai 19, 32, 51, 101?
8. Kuris iš toliau pateiktų elementų turi chemines savybes, leidžiančias kalbėti apie jo panašumą su kalcio elementu:
(1) Anglies. Nuo; (2) natrio, na; (3) Kalis. Į; (4) Stroncis, SR?
9. Nemetalinės savybės, esančios pagrindiniame periodinės sistemos D. I. MENDELEV pogrupiuose yra labiausiai ryški tų, kurie yra
(1) pogrupio viršuje;
(2) pogrupio apačioje;
(3) pogrupio viduryje;
(4) Visuose elementuose pogrupis išreiškiamas maždaug tuo pačiu laipsniu.
10. Kuris elementų skaičius yra atstovaujamas didėjančia tvarka atominio spindulio:
(1) O, S, SE, tie; (2) C, N, O, F; (3) na, mg, al, si; (4) i, br, cl, f?
11. Metalo pobūdis elementų savybių mg-ca-sr-ba serijoje
(1) mažėja;
(2) didėja;
(3) nesikeičia;
12. Nemetalinis elementų savybių pobūdis daugelyje N-P-AS-SB-BI
(1) mažėja;
(2) didėja;
(3) nesikeičia;
(4) mažėja, o tada padidėja.
13. Kuris garas nurodytame elementų rinkinyje - CA, P, SI, AG, NI, kaip - turi panašias chemines savybes:
(1) SA, si; (2) AG, Ni; (3) P, kaip; (4) ni, r?
14. Pagal savo chemines savybes radioaktyvus radioaktyvusis elementas yra arčiausiai
(1) Cesium; (2) bario; (3) Lantanas; (4) Actinia.
15. Remiantis lantano elemento pozicija periodinėje sistemoje, saugu tvirtinti, kad lanthanidai bus labiausiai būdingas oksidacijos laipsnis
(1) +1; (2) +2; (3) +3; (4) +4.
16. Pagrindinės 1 grupės elementų hidroksidų savybės, kai padidėja eilės numeris
(1) sumažėjimas;
(2) padidėjimas;
(3) lieka nepakitusi;
(4) Sumažinimas ir tada padidėja.
17. Remiantis periodinėje sistemoje elementų padėtį, greičiausiai Vokietijos sąnario su seleniu gali būti pavaizduota formulėje.
18. Hipotetinis elementas Z formos ZCL 5 chlorido. Kas yra labiausiai tikėtina jo oksido formulė:
(1) ZO 2; (2) ZO 5; (3) Z2 O 5; (4) Z 5 o 2?
19. Paprastos medžiagos, kurių elementai turi didžiausią fizinių ir cheminių savybių panašumą:
(1) Li, S; (2) būti, Cl; (3) F, Cl; (4) li, f?
20. Toliau nurodyto trečiojo laikotarpio elementų yra ryškiausios ne metalinės savybės
(1) aliuminio; (2) silicio; (3) sieros; (4) chloras.
21. Iš pirmiau minėtų elementų IIIa grupei ryškios ne metalinės savybės
(1) bor; (2) aliuminio; (3) Gallium; (4) Indija.
22. Kuris iš pirmiau minėtų periodinės sistemos ketvirto laikotarpio elementų pasireiškia tomis pačiomis valentinėmis vertėmis jų vandenilio junginyje ir didžiausiame okside:
(1) bromo; (2) germanio; (3) Arseno; (4) Selenas?
23. oksidų pobūdis P2 O 5 -SIO 2 -L 2 O Z -MGO pakeičiamas taip:
(1) nuo pagrindinio iki rūgšto;
(2) nuo rūgšties iki pagrindinio;
(3) nuo pagrindinio iki amfotererio;
(4) iš amfoteriko iki rūgšto.
24. Parašykite didesnių elementų ir atitinkamų rūgščių oksidų formules; Pavadinkite šias rūgštis:
25. Remiantis periodinės sistemos elemento pozicija, parašykite toliau išvardytus junginius:
26. Nuo pirmiau pateikto elementų sąrašo: BE, B, C, N, AL, SI, P, S, GA, GE, AS, BR - EO 2 Tipo oksidų forma, ir 4 tipo hidridai - 4 -.
27. Remiantis periodinės sistemos elemento pozicija, išimkite savo aukščiausio oksido ir hidroksido formules ir nurodykite savo pobūdį:
28. Elementas su eilės numeriu sudaro vandenilio junginį, didesnį oksidą ir hidroksidą. Pastarasis pasireiškia
(1) rūgšties savybės;
(2) pagrindinės savybės;
(3) Amfoterinės savybės.
29. Didžiausias cheminių elementų skaičius, kuris gali užpildyti šeštą periodinę periodinę sistemą, turėtų būti lygi
(1) 8; (2) 18; (3) 32; (4) 50.
30. Turi būti didžiausias septintojoeriodų skaičius
(1) 18; (2) 32; (3) 50; (4) 72.
31. Septintą laikotarpį pastaroji turi būti elementas pagal sekos numerį
(1) 118; (2) 114; (3) 112; (4) 110.
32. Šarkalių metalų savybės turėtų būti tikimasi iš elementų su sekos numeriais
(1) 111 ir 190; (2) 119 ir 169; (3) 137 ir 187; (4) 155 ir 211.
33. Valento elektronų bismuth orbitalų konfigūracija sutampa su
(1) selenas ir teluriumas;
(2) azoto ir fosforo;
(3) silicio ir germanio;
(4) niobiumas ir tanthal.
34. Elementas su sekos numeriu 117 turėtų būti priskirtas
(1) šarminės metalo lamas; (3) halogenai;
(2) šarminės žemės metalai; (4) Pereinamieji elementai.
35. Didžiausias švino valenumas deguonies junginyje yra:
(1) II; (2) IV; (3) VI; (4) VIII.
36. Valentų elektronų orbitalų tipas Indijoje sutampa su
(1) AM ir FR; (2) PB ir SN; (3) al ir ga; (4) Cu ir AG.
37. Titanas nurodo
(1) s.-; (2) p.-; (3) d.-; (4) f.- elementai.
38. Didžiausia Bromo valencija deguonies junginyje
(1) I; (2) III; (3) V; (4) VII.
39. Septintasis elementų sistemos laikotarpis turi baigtis elementą su sekos numeriu
(1) 108; (2) 110; (3) 118; (4) 128.
40. Tarp H-E nuorodų kampas yra didžiausias ryšio molekulėje
(1) H 2, (2) H 2 se; (3) h 2 s; (4) H 2 O.
41. K-CA-SC-TI eilutėje, atomų spindulys (mažėja, didėja).
42. Energija, nurodyta SL ° (G.) → Cl + lygtis (G.) + E - 1254 kJ, yra chloro atomui
(1) cheminės obligacijų energija;
(2) jonizacijos energija;
(3) Elektroninė registracija;
(4) Affinity į elektroną.
43. Elektroninio ryšio afinitetas vadinamas
(1) energija, reikalinga elektronų atskyrimui nuo nepaaiškinto atomo;
(2) šio elemento atomo gebėjimas atidėti elektronų tankį;
(3) elektronų perėjimas prie didesnio energijos lygio;
(4) energijos izoliacija, kai elektronai yra pritvirtintas prie atomo ar jonų.
44. Kuris iš elementų yra didžiausia jonizacijos energijos vertė:
(1) Li; (2) F; (3) FE; (4) I?
45. Energija, išleista pašalinant vieną elektroną nuo elemento atomo dujinėje būsenoje, magniui
(1) mažiau nei natrio ir daugiau nei aliuminio;
(2) daugiau nei natrio ir mažiau nei aliuminio;
(3) mažiau nei natrio ir aliuminio;
(4) daugiau nei natrio ir aliuminio.
46. \u200b\u200bRemiantis elektroninių konstrukcijų atomų ir pozicijų elementų periodinėje sistemoje analizės, nurodykite, kuris iš šių dviejų atomų žemiau yra didesnis afinitavimo į elektroną:
(1) Kalis arba kalcis;
(2) sieros arba chloro;
(3) Vandenilis arba ličio?
47. Cheminiai elementai yra norint padidinti elektroninę elektroninę įrangą eilėje
(1) SI, P, SE, RR, SL, O; (2) SI, P, R, SE, C1, O;
(3) P, SI, FRA, SE, C1, O; (4) SE, SI, P, R, C1, O.
48. Koks yra elementų skaičius, kai jie padidina savo atominius spindulius:
(1) na, mg, al, si; (3) O, S, SE, tie;
(2) C, O, N, F; (4) I, BR, C1, F?
49. Daugelyje šarminių metalų (nuo Li į CS), Cesium yra mažiausiai elektronifikacija. Tai paaiškina tuo, ką jis turi
(1) didžiausias skaičius neutronų branduolyje;
(2) didesnis valentų elektronų skaičius, palyginti su kitais elementais;
(3) didelė atominė masė;
(4) Valented elektroniniai, į didžiausią laipsnį iš atomo branduolio.
50. Izoelektroniniai vadinami jonai, turintys tą patį elektronų skaičių ir tą pačią išorinio elektronų lygio struktūrą. Jonai apie 2-, F -, Na +, MG 2+, A1 3+ turi elektroninę konfigūraciją Noon NoO dujų ir yra išdėstyti didėjančia tvarka atominių masių elementų. Tuo pačiu metu jų jonų spinduliai
(1) Praktiškai nekeičia;
(2) sumažėjimas;
(3) padidėjimas;
(4) Sumažinimas, tada padidinti.
51. bus poliarinės molekulės, turinčios poliarinę kovalentinę ryšį, pavyzdys bus
(1) n 2; (2) h 2 o; (3) NH3; (4) CCL 4.
52. Iš pirmiau minėtų molekulių: H2, O 2, H 2 O, CO2, CH4, H 2 S - POLAR.
53. Kuriuose iš junginių tarp atomų yra suformuota donoro priėmimo mechanizmo kovalentinė obligacija:
(1) KSL; (2) NH 4 Cl; (3) CCL 4; (4) CO 2?
54. Berilio atomo denitaliniai orbitalės hidrido molekulėje berilio hibridizuoti pagal tipą
(1) sp.; (2) sP2.; (3) sP 3.;(4) d 2 SP 3,
ir molekulė turi struktūrą:
55. Boro atomo denitaliniai orbitalai TF 3 molekulėje yra hibridizuoti pagal tipą
(1) sp.; (2) sP2.; (3) sP 3.;(4) d 2 SP 3,
ir molekulė turi struktūrą:
a) linijinis; c) tetraedral;
b) butas; d) oktaedralinis.
56. Keturių lygiaverčių C - H obligacijų buvimas metano molekulėje paaiškinamas tuo, kad
(1) atsiranda keturių elektroninių porų abipusis atbaidymas;
(2) Anglies atominis hibridizuotas keturis sP 3.orbitos;
(3) Anglies atomas turi vieną s.- ir trys r.- Valence Electron;
(4) Anglies atomas turi du s- ir du r.- Valence Electron.
Atsakymai:
1. (4) elektronų skaičius išoriniame energijos lygiu.
2. (1) su atominio spindulio sumažėjimu ir atomo elektroninės reguliatoriaus padidėjimu.
3. (1) Natris, 11.
4. (1) elektronai išoriniame elektroniniame lygyje.
5. (1) AS, SE, CL, F.
6. (3) Elementų metalo savybės silpnina.
7. (3) elementai 24, 39, 74, 80.
8. (4) Strontsia, Sr.
9. (1) pogrupio viršuje.
10. (1) O, S, SE, tie.
11. (2) didėja.
12. (1) sumažėja.
14. (2) Bariumas.
16. (2) Padidėjimas.
18. (3) Z 2 O 5.
20. (4) Chloras.
22. (2) Vokietija.
23. (2) nuo rūgšties iki pagrindinio.
26. EO 2 Tipo oksidai yra C, SI, GE, ir 4 - C tipo hidridai, SI, GE.
28. H 2 S, SEO 3 ir H 2 SEO 4. (1) Rūgštinės savybės.
32. (2) 119 ir 169.
33. (2) azoto ir fosforo.
34. (3) halogenai.
36. (3) AL ir GA.
37. (3) d.- elementai.
41. Sumažėja.
42) Ionizacijos energija.
43. (4) energijos izoliacija, kai elektronas yra prijungtas prie atomo ar jonų.
45. (4) Daugiau nei natrio ir aliuminio.
46. \u200b\u200b(1) Kalis; (2) chloras; (3) Vandenilis.
47. (1) SI, P, SE, WR, SL, O.
48. (3) O, S, SE, tie.
49. (4) Valence Electrons, į didžiausią laipsnį nuo atomo branduolio.
50. (2) Sumažinimas.
52. H 2 O, H 2 S.
53. (2) NH 4 Cl.
54. (1) sp., a) linijinis.
55. (2) sP2., b) butas.
56. (2) Anglies atomas yra hibridizuotas su keturiais formavimu sP 3.orbitos.
Užduotys individualiam numatomam grafikos darbui:
Už elementą, kurio sekos numeris yra lygus galimybių atlikti šiuos skaičiavimus:
1. Parašykite elektroninę elemento formulę ir rodyti grafiškai užpildydami visų atominių orbitų elektronus.
3. Nustatykite vieno elemento atomo ir jo tūrio masę.
4. Nustatykite vienos paprastos medžiagos molekulės masę.
5. Remiantis elemento padėtį PS, išvardijami galimi elemento atomo oksidacijos laipsniai jungtys su kitais elementais.
6. Parašykite oksido formulę, chloridą, hidridą, sulfidą.
8. Apskaičiuokite vandenilio ir deguonies jungties dipolio ilgį.
9. Pail į ryšį paprastos medžiagos molekulėje, naudojant saulės metodą.
10. Pail į elemento molekulę paprasta medžiaga, naudojant MO metodo energijos schemą, nurodykite bendravimo įvairovę ir rašykite formulę.
11. Nurodykite visų galimų oksidų molekulių elemento atomo tipą (deguonies atveju - vandenilio jungčių molekulės).
12. Nurodykite visų tipų obligacijas (σ, π, δ) oksido molekulių (deguonies atveju - vandenilio junginių).
13. Nurodykite valentinės kampų vertes oksido molekulių (deguonies atveju - vandenilio junginių molekulės).
14. Nurodykite oksido molekulių formą (deguonies atveju - vandenilio junginių molekulės).
15. Apskaičiuokite AV IONO junginio energiją ir IONS A + ir B energijos energiją.
1, 5, 6, 7, 8, 9, 14, 15, 16, 17: a - kalio, b yra elementas, kurio sekos numeris yra lygus elemento numeriui.
3, 4, 11, 12, 13, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28: B - chloro, elementas, kurio sekos numeris yra lygus elemento numeriui.
2, 10, 18 variantų: a - elementas, kurio sekos numeris yra lygus (+1 versija), B yra elementas, kurio sekos elementas yra lygus (-1 variantas).
Literatūra.
1. Kulman A.G. Bendrosios chemijos užduočių rinkimas, ED. 2, poilsis ir pridėti. - m.: Didesnis. shk. 1975 m.
2. Maslovas E.I. , Holboray Z.E. Chemijos užduočių ir pratybų rinkimas, 5-asis Ed., Pererab. ir pridėkite m.: didesnis. shk. 1997 m.
Atominis elemento numeris rodo:
a) pradinių dalelių skaičius atomo; b) atomo branduolių skaičius;
c) atomo neutronų skaičius; d) protonų atomo skaičius.
Labiausiai teisinga yra teiginys, kad cheminiai elementai PSE yra išdėstyti didėjančia tvarka:
a) absoliuti jų atomų masė; b) santykinė atominė masė;
c) atominės branduolio branduolių skaičius; d) atominio branduolio mokestis.
Cheminių elementų savybių keitimo dažnis yra rezultatas:
a) padidinti atomų elektronų skaičių;
b) atominių branduolių mokesčių didinimas;
c) padidinti atominę masę;
d) periodiškumas į elektronines atomų struktūras.
Žemiau išvardytų savybių, elementų atomai periodiškai pasikeitė, nes elemento sekos numeris yra auginami:
a) atomo energijos lygių skaičius;
b) santykinė atominė masė;
c) elektronų skaičius išorės energijos lygiu;
d) atomo branduolio mokestis.
Pasirinkite poras, kurioje kiekvienas atomo charakteristikas periodiškai skiriasi su protonų skaičiumi elemento padidėjimu:
a) elektronų afiniteto jonizacijos ir energijos energija;
b) spindulys ir masė;
c) Elektronegation ir visiški elektronai;
d) metalo savybės ir valentų elektronų skaičius.
Pasirinkite tinkamą elementų patvirtinimąV.Grupė:
a) visi atomai turi tą patį elektronų skaičių;
b) visi atomai turi tą patį spindulį;
c) visi atomai turi tą patį elektronų skaičių išoriniame sluoksnyje;
d) Visi atomai turi maksimalų valdiklį, lygų grupės numeriui.
Kai kurie elementai turi šiuos elektronų konfigūraciją:ns. 2 (n.-1) d. 10 np. 4 . Kokioje periodinės sistemos grupėje yra šis elementas?
a) IVT grupė; b) VIV grupė; c) IVA grupė; d) per grupę.
PSE laikotarpiais su didėjančiais atominių branduolių mokesčiaisne Pakeitimai: a) atomų masė; b) elektroninių sluoksnių skaičius; c) elektronų, esančių išoriniame elektroniniame sluoksnyje, skaičius; d) atomų spindulys. |
|
Kokiais eilutėmis cheminiai elementai yra norint padidinti jų atominį spindulį? a) li, B, C; b) būti, mg, ca, sr; c) n, o, f, ne; d) na, mg, al, si. |
|
Mažiausia jonizacijos energija tarp stabilių atomų yra: a) ličio; b) Barry; c) ceziumas; d) natrio. |
|
Elementų elektra padidėja eilėje: a) p, si, s, o; b) Cl, F, s, o; c) te, se, s, o; d) o, s, se, te. |
|
Elementų eilėjeNa. Mg. Al. Si P. S. Cl. Iš kairės į dešinę: a) didina elektroninį reguliavimą; b) jonizacijos energija mažėja; c) padidėja valentų elektronų skaičius; d) mažėja metalinės savybės. |
|
Nurodykite aktyviausią ketvirtojo laikotarpio metalą: a) kalcis; b) kalio; c) chromas; d) cinkas. |
|
Nurodykite aktyviausią metalo IIA grupę: a) berilio; b) Barry; c) magnio; d) kalcis. |
|
Nurodykite aktyviausią neetall VIIA grupę: a) jodas; b) bromo; c) fluoras; d) chloras. |
|
Pasirinkite teisingus pareiškimus: a) IA-VIII, tik elementai s- ir b) IV-VIIIV grupėse yra tik D elementai; c) visi D elementai yra metalai; d) Bendras S elementų skaičius PSE yra 13. |
|
Didėjant VA grupės elemento atominiam skaičiui: a) metalinės savybės; b) energijos lygių skaičius; c) bendras elektronų skaičius; d) Valencijos elektronų skaičius. |
|
P elementai reiškia: a) kalis; b) natrio; c) magnio; d) arsenas. |
|
Kokia elementų šeima yra aliuminis? a) S elementai; b) P elementai; c) D elementai; d) F elementai. |
|
Nurodykite seriją, kurioje yra tikd.- elementai: a) al, se, la; b) ti, ge, sn; c) ti, v, cr; d) LA, CE, HF. |
Kokia eilutė rodo elementų S, P ir D-šeimų simbolius? a) h, jis, li; b) h, ba, al; c) BE, C, F; d) mg, p, cu. |
|
Atom, kurio IV laikotarpio elementas yra didžiausias elektronų skaičius? a) cinkas; b) chromas; c) bromo; d) krypton. |
|
Atomu, kurio elementas, išorinio energijos lygio elektronai yra tvirtai prijungti prie branduolio? a) kalis; b) anglies; c) fluoras; d) Prancūzija. |
|
Valento elektronų pritraukimo jėga į atomo branduolį sumažėja į keletą elementų: a) na, mg, al, si; b) rb, k, na, li; c) SR, Ca, mg, būti; d) li, na, k, rb. |
|
Elementas su eilės numeris 31 yra: a) III grupėje; b) mažas laikotarpis; c) didelis laikotarpis; d) A grupėje |
|
Iš šių elektroninių formulių pasirinkite tuos, kurie atitinka P elementusV. Laikotarpis: a) 1s 2 2S 2 2P 6 3S 2 3P 6 3D 1 4S 2 4P 6 4D 1 5S 2 5P 1; b) 1s 2 2S 2 2P 6 3S 2 3P 6 3D 1 4S 2 4P 6 5S 2; c) 1s 2 2s 2 2 2. 2 3S 2 3P 6 3D 1 4S 2 4P 2; d) 1s 2 2s 2 2P 6 3S 2 3P 6 3D 1 4S 2 4P 6 4D 1 5S 2 5P 6. |
|
Iš pirmiau minėtų elektroninių formulių pasirinkite tuos, kurie atitinka cheminius elementus, sudarančius aukščiausią kompozicijos oksidą 2 Apie tai 3 : a) 1s 2 22 2 2P 6 3S 2 3P 1; b) 1s 2 2s 2 2P 6 3S 2 3P 6 3D 1 4S 2 4P3; c) 1s 2 2s 2 2P 6 3S 2 3P 6 3D 1 4S 2; d) 1s 2 2S 2 2P 6 3S 2 3P 6 3D 3 4S 2. |
|
Nustatykite elementą, kurio atomas yra ant 4p-pylon 4 elektronų. Koks laikotarpis ir grupė? a) arseno, IV laikotarpis, VA grupė; b) "Tellur", V laikotarpis per grupę; c) selenas, IV laikotarpis per grupę; d) volframas, VI laikotarpis, Vib grupė. |
Kalcio ir skandų atomai vieni kitiems skiriasi: a) energijos lygių skaičius; b) spindulys; c) valentų elektronų skaičius; d) aukštesnio oksido formulė. |
|
Sieros ir chromo atomai taip pat: a) Valencijos elektronų skaičius; b) energijos lygių skaičius; c) aukščiausias valentas; d) aukštesnio oksido formulė. |
|
Azoto ir fosforo atomai turi: a) tas pats elektroninių sluoksnių skaičius; b) tas pats protonų skaičius branduolyje; c) tas pats valentų elektronų skaičius; d) identiški spinduliai. |
|
Elemento III laikotarpio aukštojo oksido formulė, kurios atomu iš esmės yra trims nesusijusiems elektronams: a) e 2 o 3; b) EO 2; c) e 2 o 5; d) e 2 o 7. |
|
Didesnio oksido elemento EO 3 formulė. Nurodykite jo vandenilio junginio formulę: a) lt 2; Benas; c) lt 3; d) LT 4. |
|
Oksidų pobūdis nuo pagrindinio iki rūgšties svyruoja gretas: a) NA 2 O, MgO, SiO 2; b) cl 2 o, taip 2, P2 O 5, Nr. 2; c) beo, MgO, B 2 O 3, AL 2 O 3; d) CO2, B 2 O 3, AL2 O 3, LI 2 O; e) SAO, FE 2 O 3, AL 2 O 3, SO 2. |
|
Pasirinkite eilutes, kurioje formulės yra išdėstytos didėjančia tvarka rūgšties savybių junginių: a) N 2 O 5, P2 O 5, kaip 2 O 5; c) H 2 SEO 3, H 2 SO 3, H 2 SO 4; b) hf, hbras, hi; D) AL 2 O 3, P2 O 5, CL 2 O 7. |
|
Nurodykite seriją, kurioje hidroksidai yra išdėstyti siekiant padidinti pagrindines savybes: a) LIOH, KOH, NaOH; c) LIOH, CA (OH) 2, al (OH) 3; b) lioh, naoh, mg (oh) 2; d) LIOH, Naoh, Koh. |
Užduotys
Fosforo mėginyje yra du nuklidai: fosforo-31 ir fosforo-33. Fosforo-33 molinė frakcija yra 10%. Apskaičiuokite santykinę atominę fosforo masę šiame mėginyje.
Natūralus varis susideda iš Cu 63 ir Cu 65 nuklidų. CU 63 atomų skaičiaus santykis su CU 65 atomų skaičiumi mišinyje yra 2,45: 1.05. Apskaičiuoti santykinę atominę vario masę.
Vidutinė santykinė atominė natūralaus chloro masė yra 35,45. Apskaičiuokite dviejų izotopų molines frakcijas, jei žinoma, kad jų masės skaičiai yra lygūs 35 ir 37.
Deguonies mėginyje yra du nuklidai: 16 O ir 18 O, kurių masės yra atitinkamai 4,0 g ir 9,0 g. Nustatykite santykinę atominę deguonies masę šiame mėginyje.
Cheminis elementas susideda iš dviejų nuklidų. Pirmosios nuklido šerdis yra 10 protonų ir 10 neutronų. Antrojo neutronų branduolyje 2 daugiau. 9 atomai iš lengvesnių nuklidų sąskaitų už vieną atomą sunkiau nuklido. Apskaičiuoti vidutinį atominį elemento svorį.
Kokia santykinė atominė masė turėtų deguonies, jei natūraliame mišinyje kiekvienam 4 deguonies atomo-16 sudarė 3 deguonies-17 atomų ir 1 deguonies atomas-18?
Atsakymai:1. 31,2. 2. 63,6. 3. 35 Cl: 77,5% ir 37 Cl: 22,5%. 4. 17,3. 5. 20,2. 6. 16,6.
Cheminiai ryšiai
Pagrindinis tūris švietimo medžiagos:
Cheminių obligacijų pobūdis ir rūšys. Pagrindiniai cheminės jungties parametrai: energija, ilgis.
Kovalentinis ryšys. Keilentės komunikacijos formavimo keitimosi ir donorų priėmimo mechanizmai. Kovolinio ryšio kryptis ir prisotinimas. Kovalentinės obligacijos poliškumas ir poliarizavimas. Oksidacijos vertinimas ir laipsnis. A grupių elementų atomų dantinumo galimybės ir valentų sąlygos. Vienos ir kelios nuorodos. Atominės kristalinės grotelės. Atominių orbitalų hibridizacijos sąvoka. Pagrindiniai hibridizacijos rūšys. Ryšių kampai. Molekulių erdvinė struktūra. Molekulių empirinis, molekulinė ir struktūrinė (grafinė) formulė.
Jonų komunikacija. Joninės kristalinės grotelės. Cheminės medžiagos, turinčios molekulinę, atominę ir jonų struktūrą.
Metalo komunikacija. "Crystal Metals" grotelės.
Tarpinis sąveika. Molekulinės kristalų grotelės. Tarpolekulinės sąveikos ir bendrosios medžiagos būklės energija.
Vandenilio jungtis.Vandenilio obligacijų vertė natūraliuose objektuose.
Kaip tyrimo rezultatas, studentai turėtų žinoti:
kas yra cheminiai santykiai;
pagrindinės cheminės obligacijos rūšys;
kovalentiniai komunikacijos švietimo mechanizmai (mainų ir donorų-acceptor);
pagrindinės kovalentinės obligacijos charakteristikos (prisotinimas, kryptis, poliškumas, įvairovė, S ir P-ryšiai);
pagrindinės jonų, metalo ir vandenilio obligacijų savybės;
pagrindinės kristalų grotelės;
kaip energijos tiekimas keičiamas ir molekulių pobūdis pereinant nuo vienos bendros valstybės į kitą;
kas išsiskiria medžiagomis, turinčiomis kristalinę struktūrą iš amorfinės struktūros medžiagų.
Studijuodamas temą, studentai turėtų įgyti įgūdžių:
cheminės jungties tipo apibrėžimai tarp atomų įvairiuose junginiuose;
cheminių obligacijų stiprumo palyginimas pagal jų energiją;
nustatant oksidacijos laipsnių pagal įvairių medžiagų formules;
kai kurių molekulių geometrinės formos sukūrimas, pagrįstas atominių orbitalių hibridizacijos teorija;
prognozavimas ir lyginant savybes medžiagų, priklausomai nuo santykių pobūdžio ir kristalų grotelių rūšį.
Baigęs mokytis temą, studentai turėtų turėti pristatymą:
- ant molekulių erdvinės struktūros (kovarinis obligacijų kryptis, valence kampas);
- dėl atominių orbitalių hibridizacijos teorijos (SP 3 -, SP 2 -, SP-hibridizacija)
Išnagrinėjęs temą, studentai turėtų prisiminti:
elementai, kuriuose yra nuolatinis oksidacijos laipsnis;
vandenilio ir deguonies junginiai, kuriuose šie elementai jiems nėra būdingi oksidacijos laipsnį;
kampas tarp jungčių vandens molekulėje.
1 skirsnis. Cheminės medžiagos gamta ir rūšys
Medžiagų formulės: NA 2 O, SO 3, KCL, PCL 3, HCl, H2, Cl2, NaCl, CO2, (NH 4) 2 SO 4, H2 O 2, CO, H 2 S, NH 4 Cl, SO 2, HI, HI, RB 2 SO 4, SR (OH) 2, H 2 SEO 4, jis, SCCL 3, N 2, Alb 3, HBR, H 2 SE, H 2 O, O 2, CH 4, NH 3, Ki, CABR 2, BAO, NO, FCL, SIC. Pasirinkite jungtis:
molekulinė ir ne elastinga struktūra;
tik su kovalentinėmis poliarinėmis obligacijomis;
tik su kovalentinėmis ne poliarinėmis obligacijomis;
tik su joninėmis jungtimis;
derinant jonų ir kovalentinių obligacijų struktūrą;
derinant kovalentines poliarines ir kovalentines ne polilines jungtis;
gali formuoti vandenilio jungtis;
turintys ryšio struktūrą, kurią sudarytų donoro-acceptoriaus mechanizmas;
Kaip veikia ryšių poliškumas?
a) h 2 o; H 2 s; H 2 SE; H 2 TE b) pH 3; H 2 s; HCl.
Kokioje valstybėje yra pagrindinis ar susijaudinęs - yra atskirų elementų atomų šiose jungtyse:
B.Cl 3; P.Cl 3; SiO 2; Būti.F 2; H 2. S.; C.H 4; H. Cl.O 4?
Kokia šių elementų pora cheminėje sąveikoje turi maksimalią tendenciją formuoti jonų komunikaciją:
Ca, c, k, o, aš, cl, f?
Kurioje iš toliau pateiktų cheminių medžiagų obligacijų plyšimas bus labiau linkę tęsti jonų formavimąsi, ir kurioje būtų suformuoti laisvuosius radikalus: NaCl, CS2, CS2, CH 4, K 2 O, H2, 4, KOH, Cl 2?
Dana halogeninės veislės: HF, HCl, HBR, HI. Pasirinkite halogeninį sodą:
vandeninis tirpalas yra stipriausia rūgštis (silpniausia rūgštis);
su labiausiai poliariniu ryšiu (mažiausiai poliarinių ryšių);
su didžiausiu ryšio ilgiu (su mažiausiu ryšio ilgiu);
su didžiausia virimo temperatūra (su mažiausia virimo temperatūra).
Formuojant vieną cheminę jungtį, fluoro fluoras yra išleistas 2.64 "
10-19 J energija. Apskaičiuokite, koks cheminis fluoro molekulių skaičius turėtų būti sudarytas siekiant atskirti 1,00 kJ energijos.
6 bandymas.
Kai molekulė susidaro iš dviejų izoliuotų atomų, energijos sistemoje: a) didėja; b) mažėja; c) nesikeičia; d) Galima mažėti ir padidinti energiją. |
|
Nurodykite, kokia medžiagų pora, bendros elektroninės poros yra perkeltos į deguonies atomą: a) iš 2 ir CO; b) Cl 2 O ir ne; c) H2 O ir n 2 o 3; d) H2 o 2 ir o 2 f 2. |
|
Nurodykite ryšius su kovalentiniu ne poliariniu ryšiu: a) o 2; b) n 2; c) Cl 2; d) PCL 5. |
|
Nurodykite ryšius su kovalentiniu poliariniu ryšiu: a) h 2 o; b) BR 2; c) cl 2 o; d) taip 2. |
|
Pasirinkite keletą molekulių, visų nuorodų, kuriose yra kovalentinis: a) NaCl, HCl; b) CO 2, NA 2 O; c) CH3 CL, CH3 na; d) SO 2, NO 2. |
|
Ryšiai su kovalentiniu poliariniu ir kovalentiniu ne poliariniu ryšiu yra atitinkamai: a) vandens ir vandenilio sulfidas; b) bromido kalio ir azoto; c) amoniako ir vandenilio; d) deguonis ir metanas. |
|
Nė viena iš kovalentinių obligacijų nesudaro donoro priimtojo mechanizmo dalelėje: a) CO 2; b) CO; c) bf 4 -; d) NH 4 +. |
|
Kadangi susietos atomų elektrinio negatyvumo skirtumas: a) komunikacijos poliškumo mažinimas; b) komunikacijos poliškumo stiprinimas; c) padidinti jonų komunikacijos laipsnį; d) sumažinti jonų komunikacijos laipsnį. |
|
Kurioje molekulių eilutėje yra komunikacijos poliškumo didinimo tvarka? a) HF, HCl, HBR; b) NH3, pH 3, pelenai 3; c) h 2 se, h 2 s, h 2 o; d) CO2, CS 2, CSE 2. |
|
Didžiausia rišamoji energija molekulėje: a) H 2 te; b) h 2 se; c) h 2 s; d) H 2 O. |
|
Cheminė jungtis yra mažiausiai patvarus molekulėje: a) bromomodorodas; b) chloridas; c) iododorodoras; d) fluoroodorodas. |
|
Komunikacijos trukmė didėja medžiagų, turinčių formules: a) CCL 4, CBR 4, CF 4; b) SO 2, SEO 2, TEO 2; c) h 2 s, h 2 o, h 2 se; d) HBR, HCl, HF. |
|
Maksimalus skaičiuss.- ryšiai, kurie gali egzistuoti tarp dviejų atomų molekulėje: a) 1; b) 2; 3; d) 4. |
|
Trivietis ryšys tarp dviejų atomų apima: a) 2 s-obligacijos ir 1 π obligacijos; b) 3 s komunikacija; c) 3 π obligacijos; d) 1S komunikacija ir 2π obligacijos. |
|
Molekulė S. 2 Sudėtyje yra cheminių nuorodų: a) 1s ir 1π; b) 2s ir 2π; c) 3s ir 1π; d) 4s. |
|
Sumas.- I.π- jungtys (s. + π) molekulėjeTaigi. 2 Cl. 2 lygus: a) 3 + 3; b) 3 + 2; c) 4 + 2; d) 4 + 3. |
|
Nurodykite ryšius su jonų ryšiu: a) natrio chloridas; b) anglies oksidas (II); c) jodas; d) kalio nitratas. |
|
Tik joninės komunikacijos palaiko medžiagos struktūrą: a) natrio peroksidas; b) pakenkti kalkėms; c) vario sipop; d) sylvinit. |
|
Nurodykite, kurio elementas gali dalyvauti formuojant metalo ir jonų ryšį: a) kaip; b) BR; c) k; d) se. |
|
Labiausiai ryškiausias Joninės komunikacijos simbolis junginyje: a) kalcio chloridas; b) kalio fluoridas; c) aliuminio fluoridas; d) natrio chloridas. |
|
Nurodykite medžiagas, kurias bendroji būsena yra normaliomis sąlygomis nustatoma vandenilio jungtimis tarp molekulių: \\ t a) vandenilis; b) chloridas; c) skystas fluoro sodas; d) vanduo. |
|
Nurodykite patvarus vandenilio jungtis: a) -n .... h-; b) -o .... h-; c) -cl .... h-; d) - .... h-. |
|
Kokie cheminiai santykiai yra mažiausiai stiprūs? a) metalas; b) joninis; c) vandenilis; d) kovalentinis. |
|
Nurodykite bendravimo tipą NF molekulėje 3 : a) joninis; b) ne poliariniai kovalentiniai; c) poliariniai kovalentiniai d) vandenilis. |
|
Cheminė jungtis tarp elementų su seka numeriais 8 ir 16: a) joninis; b) kovalentinis poliaras; c) kovalentinis ne poliaras; d) vandenilis. |
|
Periodinė teisė.
Pastato atomo
Straipsnyje pateikiami bandymų užduotys bandymų užduotims, kurias autoriai parengė 8-ojoje klasėje. (Banko pajėgumai - 80 užduočių kiekvienai iš šešių temų, mokomų 8-ojoje klasėje, ir 120 užduočių tema "Pagrindinė neorganinių junginių klasė".) Šiuo metu chemijos mokymas 8-ojoje klasėje atliekamas devyniuose vadovėliuose. Todėl straipsnio pabaigoje pateikiamas kontroliuojamų žinių elementų sąrašas nurodant užduočių numerius. Tai leis mokytojams, dirbantiems skirtingose \u200b\u200bprogramose, pasirinkti tiek tinkamą užduočių seką iš vienos temos ir bandymų užduočių derinių iš skirtingų temų, įskaitant galutinę kontrolę.
Siūlomos 80 bandymų užduotys yra sugrupuotos iš 20 klausimų keturiose parinktyse, kuriose pakartojamos panašios užduotys. Jei norite kompiliuoti daugiau parinkčių iš žinių elementų sąrašo, pasirinkite (atsitiktinai) užduočių numerius kiekvienam mokytam elementui pagal jūsų teminį planavimą. Toks užduočių pristatymas kiekvienai temai leidžia jums praleisti greitą elementų analizę klaidų ir jų laiku korekcijos. Panašių užduočių naudojimas viename įgyvendinimo variante, vieno ar dviejų teisingų atsakymų pakaitomis mažina atsakymo atspėti tikimybę. Problemų sudėtingumas, kaip taisyklė, padidėja nuo pirmojo ir 2 variantų iki 3 ir 4 variantų.
Yra nuomonė, kad bandymai yra "atspėti". Siūlome patikrinti, ar tai yra. Po bandymų palyginkite rezultatus su ženklais. Jei bandymų rezultatai yra žemiau, jį galima paaiškinti šiomis priežastimis.
Pirma, toks (testas) yra neįprasta studentams. Antra, mokytojas atkreipia dėmesį į temos tyrimą (nustatant pagrindinį švietimo ir mokymo metodikos turinį).
1 variantas
Užduotys.
1. Per ketvirtąjį laikotarpį per grupę yra elementas su sekos numeriu:
1) 25; 2) 22; 3) 24; 4) 34.
2. Elementas su atomo +12 branduoliu turi sekos numerį:
1) 3; 2) 12; 3) 2; 4) 24.
3. Elemento sekos numeris atitinka šias charakteristikas:
1) atomo branduolių mokestis;
2) protonų skaičius;
3) neutronų skaičius;
4. Šeši elektronai prie išorinio energijos lygio esant elementų su grupės numeriu atomais:
1) ii; 2) III; 3) VI; 4) IV.
5. Didesnio oksido chloro formulė:
1) SL 2 O; 2) Cl 2 o 3;
3) Cl 2 O 5; 4) Cl 2 o 7.
6. Aliuminio atomo valencija yra:
1) 1; 2) 2; 3) 3; 4) 4.
7. Bendra VI elementų lakiųjų vandenilio junginių formulė:
1) LT 4; 2) lt 3;
3) ne; 4) H 2 E.
8. Išorinis elektroninio sluoksnio skaičius kalcio atome:
1) 1; 2) 2; 3) 3; 4) 4.
9.
1) Li; 2) na; 3) k; 4) CS.
10. Nurodykite elementų metalus:
1) k; 2) Cu; 3) o; 4) N.
11. Kur yra lentelėje D.I. Imeleeva, elementai yra, kurių atomai cheminėse reakcijose tik suteikia elektronų?
1) II grupėje;
2) 2-ojo laikotarpio pradžioje;
3) 2-ojo laikotarpio viduryje;
4) per grupę.
12.
2) VE, mg; Al;
3) mg, ca, sr;
13. Nurodykite ne metallyLe elementus:
1) Cl; 2) s; 3) mn; 4) mg.
14. Nemetalinės savybės padidėja eilėje:
15. Kokia yra periodiškai atomo charakteristikos?
1) įkraukite branduolį atomą;
2) atomo energijos lygių skaičius;
3) elektronų skaičius išorės energijos lygiu;
4) neutronų skaičius.
16.
1 į; 2) al; 3) P; 4) Cl.
17. Per laikotarpį, didėjant branduoliui, elementų atomų spinduliuotė:
1) sumažėjimas;
2) nesikeičia;
3) padidėjimas;
4) periodiškai keisti.
18. Vieno elemento atomų izotopai skiriasi:
1) neutronų skaičius;
2) protonų skaičius;
3) Valencijos elektronų skaičius;
4) Nuostata D.I. IMENDEVA.
19. Neutronų skaičius atomo 12 s branduolyje:
1) 12; 2) 4; 3) 6; 4) 2.
20. Elektronų pasiskirstymas naudojant fluoro atomo energijos lygį:
1) 2, 8, 4; 2) 2,6;
3) 2, 7; 4) 2, 8, 5.
2 variantas.
Užduotys. Pasirinkite vieną ar du teisingus atsakymus.
21. Elementas su eilės numeriu 35 yra:
1) 7-oji laikotarpio IVA grupė;
2) 4-asis laikotarpis, VIIA grupė;
3) 4-asis laikotarpis, VIIB grupė;
4) 7-oji laikotarpis, IVB grupė.
22. Elementas su atomo +9 branduoliu turi sekos numerį:
1) 19; 2) 10; 3) 4; 4) 9.
23. Neutralaus atomo protonų skaičius sutampa su:
1) neutronų skaičius;
2) atominės masės;
3) sekos numeris;
4) elektronų skaičius.
24. Penki elektronai prie išorinio energijos lygio esant elementų su grupės numeriu atomais:
1) i; 2) III; 3) v; 4) VII.
25. Aukštojo azoto oksido formulė:
1) n 2 o; 2) n 2 o 3;
3) n 2 o 5; 4) Ne;
26. Kalcio atomo valencija savo didžiausiu hidroksidu yra lygus:
1) 1; 2) 2; 3) 3; 4) 4.
27. Arseno atomo valencija vandenilio junginyje yra:
1) 1; 2) 2; 3) 3; 4) 4.
28. Išorinis elektroninio sluoksnio skaičius kalio atome:
1) 1; 2) 2; 3) 3; 4) 4.
29. Didžiausias atomo spindulys iš elemento:
1) b; 2) o; 3) C; 4) N.
30. Nurodykite elementų metalus:
1 į; 2) h; 3) F; 4) Cu.
31. Elementų, galinčių tiekti ir suteikti elektronus, atomai yra:
1) IA grupėje;
2) per grupę;
3) antrojo laikotarpio pradžioje;
4) 3-ojo laikotarpio pabaigoje.
32.
1) na, k, li; 2) al, mg, na;
3) p, s, сl; 4) NA, mg, al.
33. Nurodykite ne metallyLe elementus:
1) na; 2) mg; 3) si; 4) P.
34.
35. Pagrindinė cheminio elemento ypatybė:
1) atominė masė;
2) branduolio mokestis;
3) energijos lygių skaičius;
4) neutronų skaičius.
36. Elemento simbolis, kurio atomai sudaro amfoterinį oksidą:
1) n; 2) k; 3) s; 4) Zn.
37. Pagrindiniame cheminių elementų periodinės sistemos pogrupiuose, didėjant branduoliui, atomo spinduliu:
1) didėja;
2) sumažėja;
3) nesikeičia;
4) periodiškai skiriasi.
38. Atomo branduolio neutronų skaičius yra:
1) elektronų skaičius;
2) protonų skaičius;
3) skirtumas tarp santykinės atominės masės ir protonų skaičiaus;
4) atominės masės.
39. Vandenilio izotopai skiriasi numeriu:
1) elektronai;
2) neutronai;
3) protonai;
4) Pozicija lentelėje.
40. Elektronų pasiskirstymas pagal natrio atomo energijos lygius:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5.
3 variantas.
Užduotys. Pasirinkite vieną ar du teisingus atsakymus.
41. Nurodykite elemento sekos numerį, kuris yra IVa grupėje, 4 lentelės d. Iveleava:
1) 24; 2) 34; 3) 32; 4) 82.
42. Už elemento Nr. 13 atomo branduolį yra:
1) +27; 2) +14; 3) +13; 4) +3.
43. Atominės elektronų skaičius yra:
1) neutronų skaičius;
2) protonų skaičius;
3) atominės masės;
4) sekos numeris.
44. Grupės IVa elementų atomai, Valencijos elektronų skaičius yra:
1) 5; 2) 6; 3) 3; 4) 4.
45. Oksidai su bendrąja formulė R2 O 3 formos elementai serijos:
1) na, k, li; 2) mg, ca, būti;
3) b, al, ga; 4) c, si, ge.
46. Fosforo atomo valencija aukščiausiu oksidu yra:
1) 1; 2) 3; 3) 5; 4) 4.
47. VIIA grupės elementų vandenilio junginiai:
1) HClo 4; 2) HCl;
3) hbro; 4) HBR.
48. Elektroninių sluoksnių skaičius SELENA ATOM yra:
1) 1; 2) 2; 3) 3; 4) 4.
49. Didžiausias atomo spindulys iš elemento:
1) Li; 2) na; 3) mg;
50. Nurodykite elementų metalus:
1) na; 2) mg; 3) si; 4) P.
51. Atomai, kurių elementai lengvai suteikia elektronams?
1) k; 2) Cl; 3) na; 4) S.
52. Keletas elementų, kuriuose padidėja metalo savybės:
1) C, N, B, F;
2) al, si, p, mg;
53. Nurodykite ne metallyLe elementus:
1) na; 2) mg; 3) n; 4) S.
54. Keletas elementų, kuriuose didėja nemetalinės savybės:
1) Li, Na, K, N;
2) al, si, p, mg;
3) C, N, O, F;
4) NA, mg, al, K.
55. Didėjant atomo branduoliui, ne metalinės elementų savybės:
1) periodiškai pakeisti;
2) stiprinamas;
3) nesikeičia;
4) Silpnen.
56. Elemento, kurio atomai sudaro amfoterinį hidroksidą, simbolis:
1) na; 2) al; 3) n; 4) S.
57. Paaiškinami elementų ir jų junginių savybių keitimo dažnis:
1) išorinio elektroninio sluoksnio struktūros pakartojimas;
2) elektroninių sluoksnių skaičiaus padidėjimas;
3) neutronų skaičiaus padidėjimas;
4) atominės masės padidėjimas.
58. Natrio atomo branduolio skaičius yra:
1) 23; 2) 12; 3) 1; 4) 11.
59. Koks skirtumas tarp vieno elemento izotopų atomų?
1) protonų skaičius;
2) neutronų skaičius;
3) elektronų skaičius;
4) branduolio mokestis.
60. Elektronų pasiskirstymas pagal energijos lygį ličio atome:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5;
4 variantas.
Užduotys. Pasirinkite vieną ar du teisingus atsakymus.
61. Elementas su eilės numeriu yra:
1) 4 laikotarpis, IA grupė;
2) 4-asis laikotarpis, IB grupė;
3) 1 laikotarpis, IA grupė;
4) 5 laikotarpis, IA grupė.
62. Elemento Nr. 15 atomo mokestis yra toks:
1) +31; 2) 5; 3) +3; 4) +15.
63. Atom branduolio mokestį nustatoma:
1) elemento sekos numeris;
2) grupės numeris;
3) laikotarpio numeris;
4) atominės masės.
64. III grupės elementų atomuose "Valence Electrons" skaičius yra:
1) 1; 2) 2; 3) 3; 4) 5.
65. Didžiausias sieros oksidas turi formulę:
1) H 2 taip 3; 2) H 2 SO 4;
3) taip 3; 4) taip 2.
66. Didesnės fosforo oksido formulė:
1) P 2 o 3; 2) H 3 PO 4;
3) NRU 3; 4) P 2 O 5.
67. Azoto atomo vertinimas vandenilio junginyje:
1) 1; 2) 2; 3) 3; 4) 4.
68. Laikotarpio numeris D.I. Remeeleeva atitinka šias atomo charakteristikas:
1) Valence elektronų skaičius;
2) aukštesnis valentas junginiu su deguonimi;
3) bendras elektronų skaičius;
4) energijos lygių skaičius.
69. Didžiausias atomo spindulys iš elemento:
1) Cl; 2) BR; 3) I; 4) F.
70. Nurodykite elementų metalus:
1) mg; 2) Li; 3) h; 4) S.
71. Atomu, kurio elementas yra lengviau suteikti elektroną?
1) natrio; 2) Cesium;
3) kalio; 4) ličio.
72. Metalo savybės padidėja eilėje:
1) NA, mg, al; 2) na, k, rb;
3) rb, k, na; 4) p, s, cl.
73. Nurodykite ne metallyLe elementus:
1) Cu; 2) į; 3) n; 4) CR.
74. N-P-AS-SB nemetalinės savybės:
1) sumažėjimas;
2) nesikeičia;
3) padidėjimas;
4) Sumažinimas ir tada padidėja.
75. Kokios atomo charakteristikos periodiškai keičiasi?
1) santykinė atominė masė;
2) branduolio mokestis;
3) atomo energijos lygių skaičius;
4) elektronų skaičius išoriniame lygyje.
76. Atomai, kurių elementas sudaro amfoterinį oksidą?
1 į; 2) ve; 3) C; 4) SA.
77. Per laikotarpį, kai atomo branduolio padidėjimas padidina elektronų pritraukimą į branduolio ir metalo savybes:
1) sustiprintas;
2) periodiškai pakeisti;
3) silpnėja;
4) nekeiskite.
78. Santykinė atominė dalis elemento yra skaitmeniniu lygi:
1) prošų skaičius į šerdį;
2) branduolio neutronų skaičius;
3) bendras neutronų ir protonų skaičius;
4) atomo elektronų skaičius.
79. ATOM 16 o neutronų skaičius yra:
1) 1; 2) 0; 3) 8; 4) 32.
80. Elektronų pasiskirstymas energijos lygiu silicio atome:
1) 2, 8, 4; 2) 2, 6;
3) 2, 7; 4) 2, 8, 5.
Kontroliuojamų žinių apie temą sąrašas
"Periodinis įstatymas. Atomo struktūra
(Skliausteliuose pateikiami per darbo numerius)
Elemento sekos numeris (1, 3, 21, 41, 61), atomo branduolio (2, 22, 42, 62, 63), protonų (23) ir elektronų skaičiaus mokestis (43) Atom.
Grupės numeris, elektronai išoriniame energijos lygiu (4, 24, 44, 64), didesnės oksido formulės (5, 25, 45, 65), aukščiausias elemento valdymas (6, 26, 46, 66), formulės vandenilio junginių (7, 27, 47, 67).
Laikotarpio numeris, elektroninių lygių skaičius (8, 28, 48, 68).
Pakeiskite atomo spindulį (9, 17, 29, 37, 49, 67, 67).
Padėtis D.I. Remefeleyvų elementų metalai (10, 30, 50, 70) ir ne metalinių elementų (13, 33, 53, 73).
Atomų gebėjimas duoti ir priimti elektronus (11, 31, 51, 71).
Paprastų medžiagų savybių keitimas: pagal grupes (12, 14, 34, 52, 54, 74) ir laikotarpius (32, 72, 77).
Periodiniai pokyčiai elektroninės struktūros atomų ir savybių paprastų medžiagų ir jų junginių (15, 35, 55, 57, 75, 77).
Amphoteri oksidai ir hidroksidai (16, 36, 56, 76).
Mišių skaičius, protonų skaičius ir neutronų atomo, izotopų (18, 19, 38, 39, 58, 59, 78, 79).
Elektronų pasiskirstymas pagal energijos lygį atomo (20, 40, 60, 80).
Atsakymai į tos temos užduočių atlikimą
"Periodinis įstatymas. Atomo struktūra
| 1 variantas | 2 variantas. | 3 variantas. | 4 variantas. | ||||
|---|---|---|---|---|---|---|---|
| QUEST NUMBER | Atsakymo numeris | QUEST NUMBER | Atsakymo numeris | QUEST NUMBER | Atsakymo numeris | QUEST NUMBER | Atsakymo numeris |
| 1 | 4 | 21 | 2 | 41 | 3 | 61 | 2 |
| 2 | 2 | 22 | 4 | 42 | 3 | 62 | 4 |
| 3 | 1, 2 | 23 | 3, 4 | 43 | 2, 4 | 63 | 1 |
| 4 | 3 | 24 | 3 | 44 | 4 | 64 | 3 |
| 5 | 4 | 25 | 3 | 45 | 3 | 65 | 3 |
| 6 | 3 | 26 | 2 | 46 | 3 | 66 | 4 |
| 7 | 4 | 27 | 3 | 47 | 2, 4 | 67 | 3 |
| 8 | 4 | 28 | 4 | 48 | 4 | 68 | 4 |
| 9 | 4 | 29 | 1 | 49 | 5 | 69 | 3 |
| 10 | 1, 2 | 30 | 1, 4 | 50 | 1, 2 | 70 | 1, 2 |
| 11 | 1, 2 | 31 | 2, 4 | 51 | 1, 3 | 71 | 2 |
| 12 | 3 | 32 | 2 | 52 | 3 | 72 | 2 |
| 13 | 1, 2 | 33 | 3, 4 | 53 | 3, 4 | 73 | 2, 3 |
| 14 | 1 | 34 | 4 | 54 | 3 | 74 | 1 |
| 15 | 3 | 35 | 2 | 55 | 1 | 75 | 4 |
| 16 | 2 | 36 | 4 | 56 | 2 | 76 | 2 |
| 17 | 1 | 37 | 1 | 57 | 1 | 77 | 3 |
| 18 | 1 | 38 | 3 | 58 | 4 | 78 | 3 |
| 19 | 3 | 39 | 2 | 59 | 2 | 79 | 3 |
| 20 | 3 | 40 | 2 | 60 | 1 | 80 | 1 |
Literatūra
Gorodnichev I.N.. Chemijos kontrolė ir tikrinimas. M.: Akvariumas, 1997 m.; Sorokin V.V., Zlotnikov E.G. Chemijos testai. M.: Švietimas, 1991 m.
Tai buvo paminėta pirmiau (172 psl.) Dėl svarbiausių atomų savybių periodiškumo. Yra ir kitų svarbių savybių, kurių pakeitimai pasižymi dažniu. Tokios savybės apima atomo dydį (spindulį). Atomas turi ne paviršiaiir siena yra neaiški, kaip išorinių elektronų debesų tankis, nes jis pašalina jį sklandžiai mažėja. Duomenys apie atomo spinduliuotę gaunamas nuo jų centrų molekulių ir kristalinių konstrukcijų nustatymo. Skaičiavimai taip pat buvo atlikti remiantis kvantinės mechanikos lygtimis. Fig. 5.10.
Fig. 5.10. Atominės spindulių pokyčių dažnis
atominės spindulių pokyčių kreivė, priklausomai nuo branduolio mokesčio.
Nuo vandenilio iki helio spindulio mažėja, o tada smarkiai padidėja ličio. Taip yra dėl elektronų atsiradimo antrajame energijos lygmenyje. Per antrąjį laikotarpį nuo ličio iki Neo, kaip branduolio mokestis didėja, spinduliavimas sumažėja.
Tuo pačiu metu didėja elektronų skaičius šiame energijos lygiu, padidina jų abipusį atbaidymą. Todėl iki laikotarpio pabaigos spindulio sumažėjimas sulėtėja.
Perkeliant nuo neono iki natrio - pirmasis trečiojo laikotarpio elementas - spindulys vėl padidėja, o tada palaipsniui mažėja argono. Po to kalio spinduliu padidėja. Pasirodo būdinga periodinė pjovimo kreivė. Kiekviena šarminio metalo kreivės dalis į kilnią dujas apibūdina spindulio pasikeitimą per laikotarpį: yra spindulio sumažėjimas perėjimo iš kairės į dešinę. Taip pat įdomu išsiaiškinti spindulių pokyčių pobūdį elementų grupėse. Norėdami tai padaryti, turite turėti eilutę per tos pačios grupės elementus. Pagal "Maxima" padėtį šarminiuose metaluose yra tiesiogiai matomas, kad atomų spinduliai pereinant prie grupės iš viršaus į apačią didėja. Taip yra dėl to, kad padidėja elektroninių korpusų skaičius.
5.17 užduotis. Kaip atomų spindulys nuo F iki ur keitimo? Nustatykite tai Fig. 5.10.
Daugelis kitų atomų savybių priklauso nuo radii, tiek fizinės ir cheminės medžiagos. Pavyzdžiui, atomų spindulių spindulių padidėjimas gali paaiškinti šarminio metalo lydymosi temperatūros sumažėjimą nuo ličio iki cezio:
Atomų dydžiai yra susiję su jų energijos savybėmis. Kuo didesnis išorinių elektronų debesų spindulys, tuo lengviau jis yra elektronas praranda elektroną. Tuo pačiu metu ji virsta teigiamai įkrauta ir jis.
Ion yra viena iš galimų atomo, kurioje jis turi elektros krūvį dėl elektronų praradimo ar pridėjimo.
Apibūdinamas atomo gebėjimas pereiti į teigiamai įkrautą joną jonizacijos energija E I.Tai yra minimali energija, reikalinga išorinio elektrono atskyrimui nuo atomo dujų būsenoje:
![]()
Gautas teigiamas jonas taip pat gali prarasti elektronų, tampa dviem grandinėmis, trijų diagrama ir kt. Ionizacijos energijos dydis labai didėja.
Atomų jonizacijos energija didėja per laikotarpį, kai juda iš kairės į dešinę ir mažėja grupėse, kai perėjimas nuo viršaus į apačią.
Daugelis, bet ne visi atomai sugeba pridėti papildomą elektroną, paverčiant neigiamai įkrautą joną ~. Šis turtas yra apibūdinamas electron Energy E energija E plg. Tai yra išskirtinė energija, kai elektronas yra prijungtas prie dujų būsenos atomo:
![]()
Tiek jonizacijos energija, tiek elektronų daigumo energija yra įprasta 1 mole atomai ir išreikšti KJ / mol. Apsvarstykite natrio atomo jonizaciją dėl elektrono tvirtinimo ir praradimo (5.11 pav.) . Iš figūros yra aišku, kad reikalingas natrio atomo elektronų pašalinimui 10 dar kartą energijos nei jis skiriamas, kai yra prijungtas elektronas. Neigiamas natrio jonų nestabilus ir sudėtingose \u200b\u200bmedžiagose beveik niekada nerastas.

Fig. 5.11. Natrio atomo jonizacija
Atomų jonizacijos energija pokyčiai periodais ir grupėmis, priešinga atomų spindulio pokyčiais. Afiniteto energijos pokyčiai į elektroną yra sunkiau, nes nėra IIA- ir VIIia-Rypnn afinybės elementų. Mes galime apytiksliai manyti, kad elektronų afiniteto energija yra panaši E ikipadidėja laikotarpiais (VII grupei imtinai) ir sumažėja grupėse nuo viršaus iki apačios (5.12 pav.).
užduotis 5 .veiki. Ar magnio ir argono atomai gali dėti neigiamai įkrautus jonus?
Tarpusavyje pritraukiami teigiami ir neigiami mokesčiai, kurie veda į įvairias transformacijas. Paprasčiausias atvejis yra jonų jungčių formavimas, t.y., jonų suvienijimas medžiagoje esant elektrostatiniam traukos priemonei. Tada atsiranda jonų kristalų struktūra, būdinga NaCl maisto druskos ir daug kitų druskų. Bet gal

Fig. 5.12. Jonizacijos ir elektrono giminingumo energijos pokyčių pobūdis grupėse ir laikotarpiuose
taigi, neigiamas jonas nėra labai tvirtai laikantis jo perteklių, o teigiamas jonas, priešingai, siekia atkurti jo elektronikabumą. Tada tarp jonų sąveika gali sukelti molekulių susidarymą. Akivaizdu, kad tarpusavyje pritraukiami skirtingo įkrovimo C1 + ir C1 ~ ženklo jonai. Tačiau dėl to, kad tai yra identiškų atomų jonai, sudaro C1 2 molekulę su nuliniu mokesčiais ant atomų.
Klausimai ir pratybos
1. Iš kiek protonų, neutronų ir elektronų susideda iš bromo atomų?
2.
Apskaičiuokite izotopo gamtos masines frakcijas. ![]()
3. Kiek energijos išleidžiama nuo 16 formavimo metu g.deguonis pagal reakciją ![]() teka žvaigždžių gylyje?
teka žvaigždžių gylyje?
4. Apskaičiuokite elektronų energiją sužadintu vandenilio atomu n \u003d.3.
5. Parašykite visapusiškus ir sutrumpintus jodo atomo formules.
6. Parašykite sumažintą elektroninę jonų formulę.
7. Rašykite išsamią ir sutrumpintą elektroninę formulę atomą ir IONA 2.
8. Sukurkite fosforo ir arseno atomų energijos diagramas.
9. Sukurkite pilnas cinko ir galio atomų energijos diagramas.
10. Padidinkite šiuos atomus į didinant spindulį: aliuminio, boro, azoto.
11. Kuris iš šių jonų formuoja jonų kristalines struktūras tarpusavyje: R + R -, K +, K -, I +, I -, Li +, Li -? Ką galima tikėtis, kai jonų sąveika kitose deriniuose?
12. Tarkime, galimas atomų spindulio pobūdis pereinant periodinėje sistemoje įstrižinėje kryptimi, pavyzdžiui, Li - mg - SC.