Περιγραφή ενός στοιχείου ανά θέση στον περιοδικό πίνακα. Χαρακτηριστικά ενός στοιχείου από τη θέση του στην παρουσίαση psche για ένα μάθημα χημείας (τάξη 9) σχετικά με το θέμα
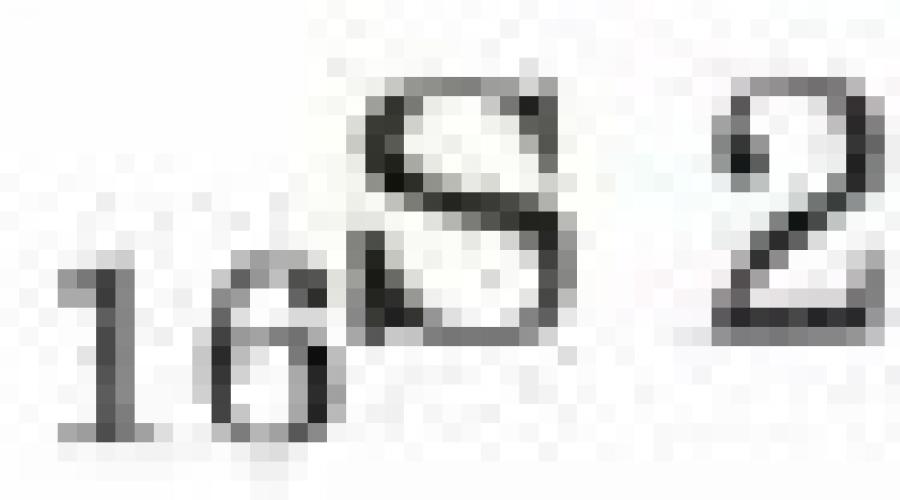
Διαβάστε επίσης
Όπως οι λογοτεχνικοί ήρωες, τα χημικά στοιχεία -οι «ήρωες» των χημικών διεργασιών- έχουν χαρακτηριστικά. Μόνο εάν για το πρώτο χρησιμοποιείται ένα λογοτεχνικό έργο ως κύρια πηγή, τότε για το δεύτερο - ο Περιοδικός Πίνακας Χημικών Στοιχείων του D.I. Mendeleev. Ωστόσο, τόσο στην πρώτη όσο και στη δεύτερη περίπτωση χρειάζεται σχέδιο.
Όταν χαρακτηρίζουμε ένα χημικό στοιχείο, θα τηρήσουμε το παρακάτω σχέδιο.
- Η θέση του στοιχείου στον Περιοδικό Πίνακα του D.I. Mendeleev και η δομή των ατόμων του.
- Η φύση μιας απλής ουσίας (μέταλλο, αμέταλλο).
- Σύγκριση των ιδιοτήτων μιας απλής ουσίας με τις ιδιότητες απλών ουσιών που σχηματίζονται από στοιχεία που γειτονεύουν στην υποομάδα.
- Σύγκριση των ιδιοτήτων μιας απλής ουσίας με τις ιδιότητες απλών ουσιών που σχηματίζονται από γειτονικά στοιχεία της περιόδου.
- Σύνθεση του ανώτερου οξειδίου, ο χαρακτήρας του (βασικό, όξινο, αμφοτερικό).
- Σύνθεση ανώτερου υδροξειδίου, η φύση του (οξυγονούχο οξύ, βάση, αμφοτερικό υδροξείδιο).
- Σύνθεση πτητικής ένωσης υδρογόνου (για μη μέταλλα).
Στο παραπάνω σχέδιο, οι ακόλουθες χημικές έννοιες είναι άγνωστες σε εσάς: μέταλλα μεταπτώσεως, αμφοτερικά οξείδια και υδροξείδια. Το νόημά τους θα αποκαλυφθεί στην επόμενη παράγραφο. Προς το παρόν, ας δούμε τα χαρακτηριστικά του μετάλλου και του μη μετάλλου.
Σε αυτή την περίπτωση, θα καθοδηγηθούμε από τα βασικά μοτίβα αλλαγών στις ιδιότητες των ατόμων, απλών ουσιών και ενώσεων που σχηματίζονται από τα χημικά στοιχεία των κύριων υποομάδων (ομάδες Α) και τις περιόδους του Περιοδικού Συστήματος του D. I. Mendeleev, που είναι ήδη γνωστό εσείς από το μάθημα της 8ης τάξης (Πίνακας 1).
Τραπέζι 1
Μοτίβα μεταβολών στις ιδιότητες των ατόμων, απλών ουσιών και ενώσεων που σχηματίζονται από χημικά στοιχεία στις κύριες υποομάδες και περιόδους του Περιοδικού Πίνακα του D. I. Mendeleev
|
Μορφές ύπαρξης χημικού στοιχείου και οι ιδιότητές τους |
Αλλαγές ιδιοκτησίας |
||
|
στις κύριες υποομάδες ↓ |
σε περιόδους → |
||
|
Βασική χρέωση |
Αυξάνει |
Αυξάνει |
|
|
Αριθμός γεμισμένων ενεργειακών επιπέδων |
Αυξάνει |
Δεν αλλάζει και ισούται με τον αριθμό περιόδου |
|
|
Αριθμός ηλεκτρονίων στο εξωτερικό επίπεδο |
Δεν αλλάζει και ισούται με τον αριθμό της ομάδας |
Το U μεγεθύνεται |
|
|
Ατομική ακτίνα |
Αυξάνει |
Μειώνεται |
|
|
Επαναφέρω |
Εντατικοποίηση |
Αποδυναμώνω |
|
|
Οξειδωτικό |
Αποδυναμώνω |
Εντατικοποίηση |
|
|
Υψηλότερη κατάσταση οξείδωσης |
Σταθερά και ίσα με τον αριθμό της ομάδας (N) |
Το Y αυξάνεται από +1 σε +7 (+8) |
|
|
Χαμηλότερη κατάσταση οξείδωσης |
Δεν αλλάζει και ισούται με (8-N) |
Αυξάνεται από -4 σε -1 |
|
|
Απλός |
Μέταλλο |
Εντατικοποίηση |
Αποδυναμώνω |
|
Μη μεταλλικές ιδιότητες |
Αποδυναμώνω |
Εντατικοποίηση |
|
|
Συνδέω-συωδεομαι |
Χαρακτήρας |
Κέρδος |
Κύρια -> Ενίσχυση όξινων ιδιοτήτων και αποδυνάμωση των βασικών Αλκάλια -> Αδιάλυτη βάση -> |
Χαρακτηριστικά του μετάλλου χρησιμοποιώντας ως παράδειγμα μαγνήσιο.
1. Το μαγνήσιο έχει αύξοντα αριθμό στο Περιοδικό Σύστημα Z - 12 και μαζικό αριθμό A - 24. Αντίστοιχα, το φορτίο του πυρήνα του ατόμου του είναι +12 (αριθμός πρωτονίων). Επομένως, ο αριθμός των νετρονίων στον πυρήνα είναι N = A - Z = 12. Δεδομένου ότι το άτομο είναι ηλεκτρικά ουδέτερο, ο αριθμός των ηλεκτρονίων που περιέχονται σε ένα άτομο μαγνησίου είναι επίσης 12.
Το στοιχείο μαγνήσιο βρίσκεται στην 3η περίοδο του Περιοδικού Πίνακα, που σημαίνει ότι όλα τα ηλεκτρόνια του ατόμου βρίσκονται σε τρία ενεργειακά επίπεδα. Η δομή του κελύφους ηλεκτρονίων ενός ατόμου μαγνησίου μπορεί να ανακλαστεί χρησιμοποιώντας το ακόλουθο διάγραμμα:
Με βάση τη δομή του ατόμου, είναι δυνατό να προβλεφθεί η κατάσταση οξείδωσης του μαγνησίου στις ενώσεις του. Στις χημικές αντιδράσεις, ένα άτομο μαγνησίου δίνει δύο εξωτερικά ηλεκτρόνια, παρουσιάζοντας αναγωγικές ιδιότητες, επομένως, λαμβάνει μια κατάσταση οξείδωσης +2.
Οι αναγωγικές ιδιότητες του μαγνησίου είναι πιο έντονες από αυτές του βηρυλλίου, αλλά πιο αδύναμες από αυτές του ασβεστίου (στοιχεία της ομάδας IIA), το οποίο σχετίζεται με αύξηση των ατομικών ακτίνων κατά τη μετάβαση από το Be στο Mg και το Ca. Αντίστοιχα, στη σειρά Be - Mg - Ca, τα δύο εξωτερικά ηλεκτρόνια μετακινούνται όλο και πιο μακριά από τον πυρήνα, η σύνδεσή τους με τον πυρήνα εξασθενεί και εγκαταλείπουν το άτομο όλο και πιο εύκολα, το οποίο ταυτόχρονα γίνεται το M 2+ ιόν (Μ - μέταλλο).
2. Το μαγνήσιο, μια απλή ουσία, χαρακτηρίζεται από ένα μεταλλικό κρυσταλλικό πλέγμα και έναν μεταλλικό χημικό δεσμό, και ως εκ τούτου όλες τις τυπικές ιδιότητες των μετάλλων (θυμηθείτε ποιες).
3. Οι μεταλλικές ιδιότητες του μαγνησίου είναι ισχυρότερες από αυτές του βηρυλλίου, αλλά πιο αδύναμες από αυτές του ασβεστίου (εξηγήστε γιατί, δεδομένου ότι οι μεταλλικές ιδιότητες καθορίζονται κυρίως από την ικανότητα των ατόμων να εγκαταλείπουν ηλεκτρόνια).
4. Οι μεταλλικές ιδιότητες του μαγνησίου είναι λιγότερο έντονες από αυτές του νατρίου, αλλά ισχυρότερες από αυτές του αλουμινίου (γειτονικά στοιχεία της 3ης περιόδου) (εξηγήστε γιατί).
5. Το οξείδιο του μαγνησίου MgO είναι ένα βασικό οξείδιο και εμφανίζει όλες τις τυπικές ιδιότητες των βασικών οξειδίων (θυμηθείτε ποια).
6. Η βάση Mg(OH) 2 αντιστοιχεί στο υδροξείδιο του μαγνησίου, το οποίο εμφανίζει όλες τις χαρακτηριστικές ιδιότητες των βάσεων (θυμηθείτε ποιες).
7. Το μαγνήσιο δεν σχηματίζει πτητική ένωση υδρογόνου.
Χαρακτηριστικά ενός μη μετάλλου που χρησιμοποιεί θείο ως παράδειγμα.
1. Το θείο είναι στοιχείο της ομάδας VIA και της 3ης περιόδου, Z = 16, A = 32. Αντίστοιχα, το άτομο θείου περιέχει 16 πρωτόνια και 16 νετρόνια στον πυρήνα και 16 ηλεκτρόνια στο κέλυφος των ηλεκτρονίων. Η δομή του ηλεκτρονικού του κελύφους μπορεί να αντικατοπτριστεί χρησιμοποιώντας το ακόλουθο διάγραμμα:
![]()
Τα άτομα θείου εμφανίζουν και τις δύο οξειδωτικές ιδιότητες (δέχονται τα δύο ηλεκτρόνια που λείπουν για να ολοκληρώσουν το εξωτερικό επίπεδο, αποκτώντας έτσι μια κατάσταση οξείδωσης -2, για παράδειγμα, σε ενώσεις με μέταλλα ή λιγότερο ηλεκτραρνητικά μη μεταλλικά στοιχεία - υδρογόνο, άνθρακας κ.λπ.) , και αναγωγικές ιδιότητες (δώστε 2, 4 ή και τα 6 εξωτερικά ηλεκτρόνια σε περισσότερα ηλεκτραρνητικά στοιχεία, για παράδειγμα οξυγόνο, αλογόνα, αποκτώντας έτσι καταστάσεις οξείδωσης +2, +4, +6).
Το θείο είναι λιγότερο ισχυρός οξειδωτικός παράγοντας από το οξυγόνο, αλλά ισχυρότερος από το σελήνιο, το οποίο σχετίζεται με την αύξηση των ατομικών ακτίνων από το οξυγόνο στο σελήνιο. Για τον ίδιο λόγο, οι αναγωγικές ιδιότητες των στοιχείων της κύριας υποομάδας της ομάδας VI (ομάδα VIA) αυξάνονται όταν μετακινούνται από το οξυγόνο στο σελήνιο. (Δώστε εξηγήσεις για αυτές τις αλλαγές στις οξειδωτικές και αναγωγικές ιδιότητες.)
2. Το θείο είναι μια απλή ουσία, ένα τυπικό αμέταλλο. Το θείο χαρακτηρίζεται από το φαινόμενο της αλλοτροπίας. Διαφορετικές απλές ουσίες που σχηματίζονται από το χημικό στοιχείο θείο έχουν διαφορετικές ιδιότητες, αφού η κρυσταλλική τους δομή είναι διαφορετική. Για παράδειγμα, στο ρομβικό θείο το μοριακό κρυσταλλικό πλέγμα αποτελείται από κυκλικά μόρια της σύνθεσης S 8 και στο πλαστικό θείο τα μόρια είναι μακριές ανοιχτές αλυσίδες ατόμων:

3. Οι μη μεταλλικές ιδιότητες του θείου είναι λιγότερο έντονες από αυτές του οξυγόνου, αλλά ισχυρότερες από αυτές του σεληνίου.
4. Οι μη μεταλλικές ιδιότητες του θείου είναι πιο έντονες από αυτές του φωσφόρου, αλλά πιο αδύναμες από αυτές του χλωρίου (γειτονικά στοιχεία στην 3η περίοδο).
5. Το ανώτερο οξείδιο του θείου έχει τον τύπο SO 2. Αυτό είναι ένα όξινο οξείδιο. Παρουσιάζει όλες τις τυπικές ιδιότητες των όξινων οξειδίων (ποιες;).
6. Ανώτερο υδροξείδιο του θείου είναι το γνωστό θειικό οξύ H 2 SO 4, το διάλυμα του οποίου εμφανίζει όλες τις τυπικές ιδιότητες των οξέων (ποιων;).
7. Το θείο σχηματίζει μια πτητική ένωση υδρογόνου - υδρόθειο H 2 S.
Παρόμοια χαρακτηριστικά μπορούν να δοθούν για τα περισσότερα μεταλλικά στοιχεία και τα μη μεταλλικά στοιχεία των κύριων υποομάδων. Στη βάση τους, είναι δυνατή η σύνταξη γενετικών σειρών από μέταλλο και μη μέταλλο.
Γενετική σειρά του μετάλλου:
Γενετική σειρά μη μετάλλων:
Νέες λέξεις και έννοιες
- Σχέδιο χαρακτηριστικών ενός χημικού στοιχείου.
- Χαρακτηριστικά του μεταλλικού στοιχείου.
- Χαρακτηριστικά ενός μη μεταλλικού στοιχείου.
- Γενετική σειρά από μέταλλο και αμέταλλο.
Εργασίες για ανεξάρτητη εργασία
- Δώστε χαρακτηριστικά των στοιχείων: α) φώσφορος. β) κάλιο.
- Να γράψετε τις εξισώσεις των χημικών αντιδράσεων που χαρακτηρίζουν τις ιδιότητες: α) MgO και SO 3 ; β) Mg(OH) 2 και H 2 SO 4. Γράψτε τις εξισώσεις για τις αντιδράσεις που περιλαμβάνουν ηλεκτρολύτες και σε ιοντική μορφή.
- Δώστε χαρακτηριστικά μαγνησίου - μια απλή ουσία. Τι είδους σύνδεση παρατηρείται σε αυτό; Ποιες φυσικές ιδιότητες έχει το μέταλλο μαγνήσιο; Να γράψετε τις εξισώσεις για τις αντιδράσεις του μαγνησίου με τις ακόλουθες ουσίες: α) οξυγόνο; β) χλώριο Cl 2; γ) θείο. δ) άζωτο N2; δ) υδροχλωρικό οξύ. Εξετάστε τα από τη σκοπιά των διεργασιών οξείδωσης-αναγωγής.
- Τι είναι η αλλοτροπία; Ποιος τύπος χημικού δεσμού πραγματοποιείται στα μόρια της σύνθεσης: α) S 8 ; β) H 2 S; Ποιες φυσικές ιδιότητες έχει η πιο σταθερή τροποποίηση του θείου - το ορθορομβικό θείο -; Να γράψετε τις εξισώσεις για τις αντιδράσεις του θείου με τις ακόλουθες ουσίες: α) νάτριο; β) ασβέστιο; γ) αλουμίνιο? δ) οξυγόνο. ε) υδρογόνο; ε) φθόριο F 2. Εξετάστε τα από τη σκοπιά των διεργασιών οξείδωσης-αναγωγής.
- Συγκρίνετε τις ιδιότητες της απλής ουσίας πυριτίου με τις ιδιότητες απλών ουσιών που σχηματίζονται από χημικά στοιχεία που είναι γειτονικά του πυριτίου κατά την περίοδο.
- Το υψηλότερο οξείδιο του οποίου χημικό στοιχείο έχει τις πιο έντονες όξινες ιδιότητες: α) άζωτο ή φώσφορος. β) φώσφορο ή θείο;
- Υπολογίστε τον όγκο του αέρα (υποθέτοντας ότι το κλάσμα όγκου του οξυγόνου σε αυτόν είναι 0,2) που θα απαιτηθεί για την καύση ενός δείγματος μαγνησίου 120 mg που περιέχει 2% άκαυστες ακαθαρσίες.
- Υπολογίστε τον όγκο του οξειδίου του θείου (IV) (αρ.) που μπορεί να ληφθεί με την καύση 1,6 kg θείου εάν η απόδοση προϊόντος είναι 80% της θεωρητικά δυνατής.
Σημείωση. Αρχικά, χρησιμοποιώντας την εξίσωση αντίδρασης, υπολογίστε τον όγκο του οξειδίου του θείου (IV) - αυτός είναι ο θεωρητικός όγκος V και, στη συνέχεια, βρείτε τον πρακτικό όγκο V πρακτικό, με βάση τη γνωστή απόδοση του προϊόντος W:
W = V πρακτική: V θεωρητική, επομένως V πρακτική = W V θεωρητική.
Ομοίως, μπορείτε να βρείτε τη μάζα του προϊόντος αντίδρασης χρησιμοποιώντας τον τύπο:
W = m πρακτική: m θεωρητική, επομένως m πρακτική = W m θεωρητική.
- Είναι δυνατόν να πούμε ότι το υψηλότερο οξείδιο του θείου SO 3 αντιστοιχεί στο θειικό οξύ H 2 SO 3; Γιατί;
- Χρησιμοποιώντας τη μέθοδο ηλεκτρονικού ισοζυγίου, προσδιορίστε τους συντελεστές στα σχήματα χημικών αντιδράσεων:
α) Mg + CO 2 -> MgO + C;
β) S + KClO 3 -> KCl + SO 2.
Μοτίβα αλλαγών σε ορισμένες ιδιότητες χημικών στοιχείων στο PS. Χαρακτηριστικά Εντός περιόδου Εντός μιας ομάδας (για στοιχεία των κύριων υποομάδων) Φορτίο του ατομικού πυρήνα Αυξάνεται Αριθμός ενεργειακών επιπέδων Δεν αλλάζει Αυξάνει Αριθμός ηλεκτρονίων στο εξωτερικό επίπεδο ενέργειας Αυξάνεται Δεν αλλάζει Ατομική ακτίνα Μειώνεται Αυξάνει Ηλεκτραρνητικότητα Αυξάνει Μειώνει ιδιότητες Μειώνει Αύξηση Μεταλλικές ιδιότητες Μειώνει Αύξηση

Χλώριο νατρίου Πυρηνικό φορτίο Αριθμός νουκλεονίωνsp=11, n=12p=17,n=18 Αριθμός ηλεκτρονίων=11E=17 Αριθμός ενεργειακών επιπέδων 33 Ηλεκτρονικός τύπος 1s 2 2s 2 2p 6 3s 1 1s 2 2s 2 2p 23 p s 5 Υψηλότερος βαθμός οξείδωσης+1+7 Οξειδοαναγωγικές ιδιότητες Αναγωγικό Οξειδωτικό μέσο 1. Θέση του στοιχείου στο PS και η δομή του ατόμου του




Χλώριο νατρίου Το οξείδιο του νατρίου Na2O παρουσιάζει βασικές ιδιότητες. Η αντίστοιχη βάση του είναι το NaOH. Na 2 O + H 2 O = 2NaOH Na 2 O + 2HCl = 2NaCl + H 2 O Na 2 O + SO 3 = Na 2 SO 4 Το ανώτερο οξείδιο του χλωρίου Cl2O7 είναι ένα όξινο οξείδιο. Αντιστοιχεί στο οξύ HClO4. Cl 2 O 7 + H 2 O = 2HClO 4 Cl 2 O 7 + Na 2 O = 2NaClO 4 Cl 2 O 7 + 2NaOH = 2NaClO 4 + H 2 O
Χλώριο νατρίου Το υδροξείδιο του νατρίου NaOH είναι μια ισχυρή βάση και παρουσιάζει ιδιότητες χαρακτηριστικές μιας βάσης. NaOH + HCl = NaCl + H2O 2NaOH + CO2 = Na2CO3 + H2O 2NaOH + CuCl2 = Cu(OH)2 + 2NaCl Το υπερχλωρικό οξύ HClO4 εμφανίζει τις ιδιότητες ενός ισχυρού οξέος. HClO2 + KOH = KClO4 + H2O


(από τα αρχαία ελληνικά αλλος «άλλος», τροπος «στροφή, ιδιότητα») η ύπαρξη του ίδιου χημικού στοιχείου με τη μορφή δύο ή περισσότερων απλών ουσιών, διαφορετικών σε δομή και ιδιότητες, λεγόμενες αλλοτροπικές τροποποιήσεις ή αλλοτροπικές μορφές. άλλα - Ελληνικό χημικό στοιχείο απλών ουσιών

Ερώτηση 1.
Α) Χαρακτηριστικά του φωσφόρου.
1. Φώσφορος - στοιχείο της πέμπτης ομάδας και της τρίτης περιόδου, Z = 15,
Αντίστοιχα, το άτομο φωσφόρου περιέχει 15 πρωτόνια στον πυρήνα, 16
Νετρόνια και 15 ηλεκτρόνια. Η δομή του ηλεκτρονικού του κελύφους
Μπορεί να απεικονιστεί χρησιμοποιώντας το ακόλουθο διάγραμμα:
15Р 2е; 8е; 5ε.
Τα άτομα φωσφόρου παρουσιάζουν τόσο οξειδωτικές ιδιότητες (δεχτείτε τα τρία ηλεκτρόνια που λείπουν για να ολοκληρώσετε το εξωτερικό επίπεδο, λαμβάνοντας μια κατάσταση οξείδωσης -3, για παράδειγμα, σε ενώσεις με λιγότερα ηλεκτραρνητικά στοιχεία - μέταλλα, υδρογόνο κ.λπ.) όσο και αναγωγικές ιδιότητες (δώστε 3 ή 5 ηλεκτρόνια σε περισσότερα ηλεκτραρνητικά στοιχεία - οξυγόνο, αλογόνα κ.λπ., αποκτώντας καταστάσεις οξείδωσης +3 και +5.)
Ο φώσφορος είναι λιγότερο ισχυρός οξειδωτικός παράγοντας από το άζωτο, αλλά ισχυρότερος από το αρσενικό, το οποίο σχετίζεται με την αύξηση των ατομικών ακτίνων από άζωτο σε αρσενικό. Για τον ίδιο λόγο, αντίθετα, ενισχύονται οι αποκαταστατικές ιδιότητες.
2. Ο φώσφορος είναι μια απλή ουσία, ένα τυπικό αμέταλλο. Ο φώσφορος χαρακτηρίζεται από το φαινόμενο της αλλοτροπίας. Για παράδειγμα, υπάρχουν αλλοτροπικές τροποποιήσεις του φωσφόρου όπως ο λευκός, ο κόκκινος και ο μαύρος φώσφορος, που έχουν διαφορετικές χημικές και φυσικές ιδιότητες. 3. Οι μη μεταλλικές ιδιότητες του φωσφόρου είναι λιγότερο έντονες από αυτές του αζώτου, αλλά ισχυρότερες από αυτές του αρσενικού (γειτονικά στοιχεία της ομάδας).
4. Οι μη μεταλλικές ιδιότητες του φωσφόρου είναι πιο έντονες από αυτές του πυριτίου, αλλά πιο αδύναμες από αυτές του θείου (γειτονικά στοιχεία της περιόδου). 5. Το ανώτερο οξείδιο του φωσφόρου έχει τον τύπο P205. Αυτό είναι ένα όξινο οξείδιο. Παρουσιάζει όλες τις τυπικές ιδιότητες των όξινων οξειδίων. Για παράδειγμα, όταν αντιδρά με νερό, λαμβάνεται φωσφορικό οξύ.
P205 + ZN20 =*2N3P04.
Όταν αλληλεπιδρά με βασικά οξείδια και βάσεις, παράγει άλατα.
P205 + 3MgO = Mg3(P04)2; P205 + 6KON = 2K3P04+ ZN20.
6. Υψηλότερο υδροξείδιο του φωσφόρου - φωσφορικό οξύ H3P04,
Το διάλυμα του οποίου εμφανίζει όλες τις τυπικές ιδιότητες των οξέων:
Αλληλεπίδραση με βάσεις και βασικά οξείδια:
Н3Р04 + 3NaOH = Na3P04 + ЗН20. 2Н3Р04 + ЗСаО = Ca3(P04)2i + ЗН20.
7. Ο φώσφορος σχηματίζει μια πτητική ένωση H3P - φωσφίνη.
Β) Χαρακτηριστικά του καλίου.
1. Το κάλιο έχει τακτικό αριθμό 19, Ζ = 19 και συγγενή
Ατομική μάζα Α, (Κ) = 39. Αντίστοιχα, το φορτίο του πυρήνα του ατόμου του είναι +19
(ίσο με τον αριθμό των πρωτονίων). Επομένως, ο αριθμός των νετρονίων στον πυρήνα
Ίσο με 20. Δεδομένου ότι το άτομο είναι ηλεκτρικά ουδέτερο, ο αριθμός των ηλεκτρονίων
Το στοιχείο κάλιο βρίσκεται στην τέταρτη περίοδο του περιοδικού πίνακα, που σημαίνει ότι όλα τα ηλεκτρόνια βρίσκονται σε τέσσερα ενεργειακά επίπεδα. Έτσι, η δομή του ατόμου του καλίου γράφεται ως εξής:
19K: 2е; 8е; 8е; 1ε.
Με βάση τη δομή του ατόμου, είναι δυνατό να προβλεφθεί η κατάσταση οξείδωσης του καλίου στις ενώσεις του. Δεδομένου ότι στις χημικές αντιδράσεις το άτομο καλίου δίνει ένα εξωτερικό ηλεκτρόνιο, παρουσιάζοντας αναγωγικές ιδιότητες, επομένως, αποκτά κατάσταση οξείδωσης +1.
Οι αναγωγικές ιδιότητες του καλίου είναι πιο έντονες από αυτές του νατρίου, αλλά πιο αδύναμες από αυτές του ρουβιδίου, το οποίο σχετίζεται με αύξηση των ακτίνων από Na σε Rb.
2. Το κάλιο είναι μια απλή ουσία, χαρακτηρίζεται από μεταλλικό
Κρυσταλλικό πλέγμα και χημικός δεσμός μετάλλων και
Εξ ου και όλες οι τυπικές ιδιότητες των μετάλλων.
3. Οι μεταλλικές ιδιότητες του καλίου είναι πιο έντονες από αυτές του νατρίου, αλλά πιο αδύναμες από αυτές του ρουβιδίου, αφού το άτομο καλίου δίνει ένα ηλεκτρόνιο πιο εύκολα από το άτομο νατρίου, αλλά πιο δύσκολο από το άτομο του ρουβιδίου.
4. Οι μεταλλικές ιδιότητες του καλίου είναι πιο έντονες από εκείνες του ασβεστίου, αφού ένα ηλεκτρόνιο ενός ατόμου καλίου αποκόπτεται ευκολότερα από δύο ηλεκτρόνια ενός ατόμου ασβεστίου.
5. Το οξείδιο του καλίου KgO είναι βασικό οξείδιο και παρουσιάζει όλες τις τυπικές ιδιότητες των βασικών οξειδίων. Αλληλεπίδραση με οξέα και οξείδια οξέος.
K20 + 2NS1 = 2KS1+N20; K20 + S03 = K2S04.
6. Η βάση (αλκάλι) ΚΟΗ αντιστοιχεί στο υδροξείδιο του καλίου, το οποίο εμφανίζει όλες τις χαρακτηριστικές ιδιότητες των βάσεων: αλληλεπίδραση με οξέα και οξείδια οξέος.
KOH+HNO3 = KN03+H20; 2KOH+N205 = 2KN03+H20.
7. Το κάλιο δεν σχηματίζει πτητική ένωση υδρογόνου, αλλά σχηματίζει υδρίδιο του καλίου KH.
Ερώτηση 2.
Α) Το MgO είναι βασικό οξείδιο, το S03 είναι όξινο οξείδιο.
1) MgO + S03 = MgS04;
2) MgO + 2HNO3 = Mg(N03)2 + H20;
3) MgO + 2H+ = Mg + + H20; 2RbOH + S03 = Rb2S04 + H20; S03 + 20RG = S04 ~ + H20.
Β) Το Mg(OH)2 είναι βασικό υδροξείδιο, το H2S04 είναι όξινο υδροξείδιο.
1) Mg(OH)2 + H2S04 = MgS04 + 2H20; ΟΗ~ + Η+ = Η20;
2) Mg(OH)2 + S03 = MgS04 + H20; S03 + 20RG = H20 + S04"; ΕΓΩ) H2b04 + Na20 = Na2b04 + H20; Na20 + 2H = 2Na + H20.
Ερώτηση 3.
Το μαγνήσιο είναι μια απλή ουσία, που χαρακτηρίζεται από ένα μεταλλικό κρυσταλλικό πλέγμα. έχει μεταλλική λάμψη και ηλεκτρική αγωγιμότητα.
Α) 2Mg + 02 = 2MgO
6) Mg + Cl2 = MgCl2 Mg°-2e = Mg2+ 1
Ερώτηση 4.
Αλλοτροπία είναι το φαινόμενο της ύπαρξης ενός χημικού στοιχείου σε
Με τη μορφή πολλών απλών ουσιών, διαφορετικών στη δομή και
Ιδιότητες (οι λεγόμενες αλλοτροπικές μορφές).
Α) Σε μόρια σύνθεσης S8 πραγματοποιείται ο ομοιοπολικός-μηπολικός τύπος
Δεσμοί (δηλαδή, δεν υπάρχει μετατόπιση του σχηματισμού ζεύγους ηλεκτρονίων
Β) Σε μόρια της σύνθεσης H2S πραγματοποιείται ομοιοπολικός-πολικός τύπος δεσμού, αφού το ζεύγος ηλεκτρονίων μετατοπίζεται σε ένα πιο ηλεκτραρνητικό άτομο - θείο (S).
H->S<- Н
Φυσικές ιδιότητες του ρομβικού θείου (S8):
Μια ουσία κίτρινη ως λεμόνι, σταθερή έως τους t = 95,6°C, διαλύεται σε δισουλφίδιο του άνθρακα (CS2), ανιλίνη, βενζόλιο και φαινόλη. Εξισώσεις αντίδρασης:
Α) 2Na + S = Na2S
Αναγωγικό μέσο
Ca°-2" =eCa2+
Β)S2Al + 3l=Al2S3 А1°-Зе=А12
Ε) S + 3F2 = SF6 6
1 - αναγωγικός παράγοντας 1 - οξειδωτικός παράγοντας
Αναγωγικός παράγοντας 1 - οξειδωτικός παράγοντας
1 - αναγωγικός παράγοντας 3 - οξειδωτικός παράγοντας
Ερώτηση 5.
Οι μη μεταλλικές ιδιότητες του πυριτίου είναι λιγότερο έντονες από αυτές του φωσφόρου, αλλά ισχυρότερες από αυτές του αλουμινίου .
Ερώτηση 6.
Α) Το άζωτο έχει περισσότερες όξινες ιδιότητες από τον φώσφορο,
Διότι σε ομάδες από πάνω προς τα κάτω υπάρχει ενίσχυση της κύριας και
Ιδιότητες εξασθένησης οξέος.
Β) Το θείο έχει περισσότερες όξινες ιδιότητες από τον φώσφορο,
Διότι σε περιόδους από αριστερά προς τα δεξιά παρατηρείται αύξηση των όξινων και
Εξασθένηση βασικών ιδιοτήτων.
Ερώτηση 7.Δεδομένος: Ti(0 2) = 0,2; m(Mg) = 0,12 g; Yum8 (ακαθαρσίες) = 2%. Εύρημα: V (αέρας)
R^nie: 1. Βρείτε τη μάζα του μαγνησίου χωρίς ακαθαρσίες: pure(Me) = t(Me) - t(Me)-Yum0 (ακαθαρσίες); καθαρό (Mg) = 0,121-0,12 g-0,02 = 0,1176 g.
2. Ας γράψουμε την εξίσωση για την αντίδραση καύσης του μαγνησίου. ΟΔ 176
2Mg + 02 = 2MgO,
Υ=2 mol; y=1 mol;
Μ = 24 g/mol; Vv = 22,4 l/mol;
Ας κάνουμε μια αναλογία για την εξίσωση αντίδρασης: 48 g -22,4 l 0,1176 g -chl
X = °"1176"22"4 = 0,05488 l. 48
Επομένως, απαιτούνται 0,05488 λίτρα καθαρού οξυγόνου για την καύση
0,1176 γρ μαγνήσιο.
3. Ας βρούμε τον όγκο του αέρα που απαιτείται για την καύση του μαγνησίου:
Υ(αέρας) = X(°ll = 0,05488 = 0,2744 l.
Απάντηση: U(αέρας) = 0,2744 l.
Ερώτηση 8.
Δεδομένος: m(S) = 1,6 kg -1600 g.
Εύρημα: V(S02)
Λύση: 1. Να γράψετε την εξίσωση για την αντίδραση της καύσης του θείου σε οξυγόνο.
1 £(\(\ Г VTT
1. Δώστε χαρακτηριστικά των στοιχείων: α) φώσφορος. β) κάλιο.

2. Να γράψετε τις εξισώσεις των χημικών αντιδράσεων και τις χαρακτηριστικές ιδιότητες: Να γράψετε τις εξισώσεις των αντιδράσεων που περιλαμβάνουν ηλεκτρολύτες και σε ιοντική μορφή.

3. Δώστε τα χαρακτηριστικά του μαγνησίου - μιας απλής ουσίας. Τι είδους σύνδεση παρατηρείται σε αυτό; Ποιες φυσικές ιδιότητες έχει το μέταλλο μαγνήσιο; Να γράψετε τις εξισώσεις για την αντίδραση του μαγνησίου με τις ακόλουθες ουσίες: α) οξυγόνο; β) χλώριο Cl2; γ) θείο. δ) άζωτο N2; ε) υδροχλωρικό οξύ. Εξετάστε τα από τη σκοπιά των διεργασιών οξείδωσης-αναγωγής.
Το μαγνήσιο είναι μια απλή ουσία, που χαρακτηρίζεται από ένα μεταλλικό κρυσταλλικό πλέγμα. έχει μεταλλική λάμψη και ηλεκτρική αγωγιμότητα.

4. Τι είναι η αλλοτροπία; Τι τύπος χημικού δεσμού πραγματοποιείται στα μόρια της σύνθεσης: α) S8; β) H2S; Ποιες φυσικές ιδιότητες έχει η πιο σταθερή τροποποίηση του θείου - το ορθορομβικό θείο -; Να γράψετε τις εξισώσεις για τις αντιδράσεις του θείου με τις ακόλουθες ουσίες: α) νάτριο; β) ασβέστιο; γ) αλουμίνιο? δ) οξυγόνο. ε) υδρογόνο; ε) φθόριο F2. Εξετάστε τα από τη σκοπιά των διεργασιών οξείδωσης-αναγωγής.
Αλλοτροπία είναι το φαινόμενο της ύπαρξης ενός χημικού στοιχείου με τη μορφή πολλών απλών ουσιών, διαφορετικών σε δομή και ιδιότητες (οι λεγόμενες αλλοτροπικές μορφές).

5. Συγκρίνετε τις ιδιότητες της απλής ουσίας πυρίτιο με τις ιδιότητες απλών ουσιών που σχηματίζονται από χημικά στοιχεία - γειτονικά του πυριτίου σε περίοδο.
Οι μη μεταλλικές ιδιότητες του πυριτίου είναι λιγότερο έντονες από αυτές του φωσφόρου, αλλά ισχυρότερες από αυτές του αλουμινίου.
6. Ποιο χημικό στοιχείο έχει το υψηλότερο οξείδιο τις πιο έντονες όξινες ιδιότητες: α) άζωτο ή φώσφορος, β) φώσφορος ή θείο;
α) Το άζωτο έχει περισσότερες όξινες ιδιότητες από τον φώσφορο, αφού σε ομάδες από πάνω προς τα κάτω ενισχύονται οι βασικές ιδιότητες και εξασθενούν οι όξινες ιδιότητες.
β) Οι όξινες ιδιότητες του θείου είναι πιο έντονες από αυτές του φωσφόρου, γιατί σε περιόδους από αριστερά προς τα δεξιά, οι όξινες ιδιότητες ενισχύονται και οι βασικές ιδιότητες εξασθενούν.
7. Υπολογίστε τον όγκο του αέρα (υποθέστε ότι το κλάσμα όγκου του οξυγόνου σε αυτόν είναι 0,2) που θα χρειαστεί για την καύση ενός δείγματος μαγνησίου 120 mg που περιέχει 2% άκαυστες ακαθαρσίες.

8. Υπολογίστε τον όγκο του οξειδίου του θείου (IV) (αρ.) που μπορεί να ληφθεί με την καύση 1,6 kg θείου εάν η απόδοση προϊόντος είναι 80% της θεωρητικά δυνατής.


9. Είναι δυνατόν να πούμε ότι το υψηλότερο οξείδιο του θείου SO3 αντιστοιχεί στο θειικό οξύ H2SO3; Γιατί;
