Ανταλλαγή ιόντων. Ionites και την ταξινόμησή τους
Ικανότητα ανταλλαγής
Για τα ποσοτικά χαρακτηριστικά των ιδιότητες ανταλλαγής ιόντων και προσρόφησης του Ionovis, χρησιμοποιούνται οι ακόλουθες τιμές: Πλήρης, δυναμική και εργατική δεξαμενή ανταλλαγής.
Πλήρης δεξαμενή ανταλλαγής(ΤΑΧΥΔΡΟΜΕΙΟ) Που καθορίζεται από τον αριθμό των λειτουργικών ομάδων ικανών από την ανταλλαγή ιόντων, σε μια μονάδα μάζας αέρα-ξηρού ή πρησμένου ιοντικού και εκφράζεται σε mm-eq / g ή me-eq / l. Είναι μια σταθερή τιμή που αναφέρεται στο ιονικό διαβατήριο και δεν εξαρτάται από τη συγκέντρωση ή τη φύση της ανταλλαγής ιόντων. Αυτό μπορεί να ποικίλει (μείωση) λόγω θερμικής, χημικής ή ακτινοβολίας. Σε πραγματικές συνθήκες, μειώνεται με το χρόνο λόγω της γήρανσης της ιονικής μήτρας, η μη αναστρέψιμη απορρόφηση ιόντων δηλητηρίου (οργανικά, σίδηρο κ.λπ.), η οποία μπλοκάρει λειτουργικές ομάδες.
Η ισορροπία (στατική) ικανότητα ανταλλαγής εξαρτάται από τη συγκέντρωση ιόντων σε νερό, pH και αναλογία ιονικών όγκων και του διαλύματος στις μετρήσεις. Πρέπει να πραγματοποιήσουν τους υπολογισμούς των τεχνολογικών διεργασιών.
Δυναμική δεξαμενή ανταλλαγής(Καθημερινά) - τον σημαντικότερο δείκτη στις διαδικασίες επεξεργασίας νερού. Σε πραγματικές συνθήκες, η πολλαπλή χρήση του Iodet στον κύκλο της αναγέννησης της απορρόφησης, η ικανότητα ανταλλαγής δεν χρησιμοποιείται πλήρως, αλλά μόνο εν μέρει.
Ο βαθμός χρήσης προσδιορίζεται με την αναγέννηση και τον ρυθμό ροής του παράγοντα αναγέννησης, τον χρόνο επαφής ιονικού με νερό και με έναν παράγοντα αναγεννητικής, τη συγκέντρωση αλάτων, ρΗ, σχεδιασμού και υδροδυναμικής της χρησιμοποιούμενης συσκευής. Το σχήμα δείχνει ότι η διαδικασία του καθαρισμού του νερού διακόπτεται σε μια ορισμένη συγκέντρωση του περιοριστικού ιόντος, κατά κανόνα, πολύ πριν από τον πλήρη κορεσμό του Ionet. Ο αριθμός των ιόντων απορροφάται σε αυτή την περίπτωση, που αντιστοιχεί στην περιοχή του ορθογωνίου Α, που αντιστοιχεί στον όγκο του Ionet και θα είναι καθημερινά.
Ο αριθμός των απορροφούμενων ιόντων που αντιστοιχούν στον πλήρη κορεσμό, όταν ο κύκλος είναι 1, που αντιστοιχεί στην ποσότητα της ποσότητας και η περιοχή του σκιασμένου σχήματος πάνω από την καμπύλη τύπου S, ονομάζεται ολική δυναμική ικανότητα ανταλλαγής (PD) . Σε διαδικασίες επεξεργασίας νερού τύπου τύπου, συνήθως δεν υπερβαίνει τα 0,4-0,7 in.
Σύκο. ένας
πειραματικό μέρος
Αντιδραστήρια και λύσεις:mgCl2 * 6H2O άλατα σε αποσταγμένο νερό σε μια φιάλη μέτρησης με χωρητικότητα 250 cm
Το διάλυμα νιτρικού ασβεστίου (0,02 Μ) παρασκευάστηκε με διάλυση του δείγματος (1,18 g) Sali Ca (ΝΟ3) 2 · 4N20. Μετά τη διάλυση του δείγματος, το διάλυμα αραιώθηκε σε απεσταγμένο νερό σε μια φιάλη μέτρησης με χωρητικότητα 250 cm.
Διάλυμα 2 νιτρικό ασβέστιο (0,1 m) παρασκευάστηκε με διάλυση του δείγματος (5,09 g) άλατα Ca (ΝΟ3) 2 · 4n20. Μετά τη διάλυση του δείγματος, το διάλυμα αραιώθηκε σε απεσταγμένο νερό σε μια φιάλη μέτρησης με χωρητικότητα 250 cm.
Αρχική λύση του συμπλοκούς ΙΙΙπου παρασκευάζεται από το Fixanal. Η τυποποίηση πραγματοποιήθηκε σύμφωνα με το θειικό μαγνήσιο.
Διαλύματα ρυθμιστικού διαλύματος που παρασκευάζονται από NH4Cl "Ch.D.A." και NH4OH.
Η υπολειμματική συγκέντρωση ιόντων Mg2 + προσδιορίστηκε με συμπλοκοποιητικά με τον δείκτη ερυκολχρωμάτων Τ.
Η υπολειμματική συγκέντρωση των ιόντων Ca2 + προσδιορίστηκε με συμπλοκοποιητικά με την ένδειξη MIRCEXIDE.
Η συγκεντρωτική συγκέντρωση βρέθηκε από την άποψη του αρχικού και υπολειμματικού.
Ως προσροφητής χρησιμοποιήθηκε από τη φυλή που περιέχει ζεόλιθμες της εκδήλωσης Artyhevsky.
Μαγειρεύοντας το ροφητήριο.
CSP Atheshevsky εκδήλωση θραύσης, κοσκινισμένο, συλλεγέντων κλάσων κοκκίων με μέγεθος 1 - 2 mm και ξηραίνεται σε ένα ντουλάπι ξήρανσης.
Δοχείο ανταλλαγής ιόντων σε στατική λειτουργία. Κατά 20 cm με ένα διάλυμα που περιέχει ιόντα Ca2 +, σε άλλη περίπτωση, mg2 +, με γνωστή συγκέντρωση και
Μία ορισμένη τιμή ρΗ προστέθηκε 5,0 g του απορροφητήρα, αναταράσσεται για έναν καθορισμένο χρόνο και διαχωρίστηκε η στερεά φάση με διήθηση. ΣΕ
Η επιλεκτικότητα της χρωματομετρικής τιτλοδότησης σε σχέση με το ασβέστιο μπορεί να βελτιωθεί με τον προσδιορισμό του προσδιορισμού σε ένα ισχυρά μέσο αλκοόλης (το διήθημα μαγνησίου προσδιορίστηκε με την υπολειμματική συγκέντρωση των ιόντων Ca2 +, στην άλλη περίπτωση, Mg2 +. Βρέθηκε η συγκέντρωση επιφάνειας Όσον αφορά την πηγή και την υπολειμματική.
Μεταλλικός χρωματικός δείκτης - Muriesid.
EDTA, διάλυμα 0,05m. Μείγμα ρυθμιστικού αμμωνίου ρΗ \u003d 9; ΝθΟΗ, 2Μ λύση. Δείκτες - Eryoichrom Black T και Muriesid - στερεό (μείγμα με NaCl σε σχέση με 1: 100).
Ορισμός μεθοδολογίας
1. Το δείγμα του αναλυμένου διαλύματος μεταφέρθηκε στη φιάλη τιτλοδότησης, προστέθηκε 10cm3 ρυθμιστικό διάλυμα αμμωνίου (ρΗ 9), 25 cm3 απεσταγμένου νερού, στην άκρη μιας σπάτουλα 30 - 40 mg eriohrom του μαύρου t και Εξασφαλίστε το σύστημα για να διαλύσετε εντελώς τον δείκτη. Η λύση απέκτησε κρασί-κόκκινο. Η τιτλοδότηση του διαλύματος EDTA διεξήχθη στάγδην από μια στροφέα με συνεχή ανάδευση στο χρώμα του χρώματος σε σαφώς μπλε.
2. Το δείγμα του αναλυθέντος διαλύματος μεταφέρθηκε στη φιάλη για τιτλοδότηση, προστίθεται διάλυμα NaOH 5 cm3 m, 30 cm3 απεσταγμένου νερού και στην άκρη μιας σπάτουλα 30 mgexide. Η λύση απέκτησε ένα κόκκινο χρώμα. Η τιτλοδότηση πραγματοποιήθηκε με ένα διάλυμα EDTA πριν από τη μετάβαση του χρώματος σε μοβ.
Υπολογισμός των στατιστικών συνθηκών σε σχέση με τα ιόντα ασβεστίου και μαγνησίου.
Προσδιορισμός της ικανότητας ανταλλαγής μαγνησίου
Κατά 20 cm 3 διάλυμα χλωριούχου μαγνησίου με μοριακή συγκέντρωση ισοδύναμου 0,02 mol / l προστίθεται και 5,0 δευτερόλεπτο προ-ξηράνθηκε στους 1050 ° C για 1 ώρα και ανακινάται για έναν καθορισμένο χρόνο (0,5 ώρες). Σε μια άλλη περίπτωση, 1 ώρα και ούτω καθεξής. Μετά τη λήξη του χρόνου, το διάλυμα διηθήθηκε. Λαμβάνοντας υπόψη για την ανάλυση 5 cm3 του διηθήματος και η υπολειμματική συγκέντρωση ιόντων Mg2 + προσδιορίστηκε με την σερμαζομετρική μέθοδο.
2. Μέχρι 20 cm3 του διαλύματος χλωριούχου ασβεστίου με γραμμομοριακή συγκέντρωση ισοδύναμου 0, L Mole / L πρόσθεσε 5,0 g του προσροφητικού προ-ξηράνθηκε στους 1050 ° C για 1 ώρα και ανακινάται για έναν καθορισμένο χρόνο (0,5 ώρες). Σε μια άλλη περίπτωση, 1 ώρα και ούτω καθεξής. Μετά τη λήξη του χρόνου, το διάλυμα διηθήθηκε. Ελήφθησε η ανάλυση 5 cm3 του διηθήματος και η υπολειμματική συγκέντρωση των ιόντων CA2 προσδιορίστηκε με την σεπμερομιονομετρική μέθοδο.
Η επιρροή του χρόνου επαφής του CSP και του διαλύματος CACL2 * 4N2O στη δεξαμενή ανταλλαγής του CSP σε στατικές συνθήκες.
(C (Ca2 +) ex \u003d 0,1 mol / l, mcsp \u003d 5,0)
Με αύξηση του χρόνου επαφής των φάσεων, παρατηρείται αύξηση της συγκέντρωσης ισορροπίας. Και μετά από 3 ώρες, τοποθετείται μια δυναμική ισορροπία κύλισης.
6. Περιορισμός της εγκυρότητας του διακεκομμένου πρωτοκόλλου αριθ. 5-94 του διακρατικού συμβουλίου για την τυποποίηση, τη μετρολογία και την πιστοποίηση (IUS 11-12-94)
7. Έκδοση (Ιανουάριος 2002) με την τροπολογία (IUS 3-91)
Αυτό το πρότυπο ισχύει για τους Ionites και καθιερώνει μεθόδους για τον προσδιορισμό της δεξαμενής δυναμικής ανταλλαγής με πλήρη ιοντική αναγέννηση και με μια δεδομένη κατανάλωση παράγοντα αναζωογόνησης.
Οι μέθοδοι συνίστανται στον προσδιορισμό του αριθμού των ιόντων απορροφώνται από το διάλυμα εργασίας από μια μονάδα όγκου διογκωμένου ιονίου με συνεχή ροή του διαλύματος μέσω του στρώματος ιονίου.
1. Μέθοδος δειγματοληψίας
1. Μέθοδος δειγματοληψίας
1.1. Η μέθοδος δειγματοληψίας υποδεικνύει την κανονιστική και τεχνική τεκμηρίωση για συγκεκριμένα προϊόντα.
1.2. Για τους Ιονίους, στις οποίες το κλάσμα μάζας της υγρασίας είναι μικρότερο από 30%, το δείγμα λαμβάνεται (100 ± 10). Για πρήξιμο, το δείγμα τοποθετείται σε ένα ποτήρι με χωρητικότητα 600 cm και χύνεται με κορεσμένο διάλυμα χλωριούχο νάτριο, το οποίο πρέπει να επικαλυφθεί με μια περίσσεια για να καλύψει το στρώμα ιονίου με το πρήξιμο. Μετά από 5 ώρες, το IONIS πλένεται με αποσταγμένο νερό.
1.3. Για τους Ιονίους με ένα μάζα κλάσμα υγρασίας, περισσότερο από 30% λαμβάνεται από ένα δείγμα (150 ± 10) g σε ένα ποτήρι 600 cm με χωρητικότητα και προσκολλάται 200 \u200b\u200bcm απεσταγμένου νερού.
2. Αντιδραστήρια, λύσεις, πιάτα, συσκευές
Το νερό αποστάχθηκε σύμφωνα με το GOST 6709 ή απομεταλλεύτηκε, πληροί τις απαιτήσεις του GOST 6709.
Χλωριούχο βαρίου σύμφωνα με το GOST 742, H.CH., διάλυμα με ένα κλάσμα μάζας 10%.
Χλωρίδιο 2-νερού ασβεστίου, H.Ch., διαλύματα συγκέντρωσης (SASL \u003d 0.01 mol / dm (0.01 n.) Και (SASL) \u003d 0.0035 mol / dm (0.0035 n.).
Σαλονικό οξύ σύμφωνα με τους GOST 3118, H.CH., διαλύματα με κλάσμα μάζας 5% και συγκεντρώσεις (ΗΟΙ) \u003d 0,5 mol / dm (0,5 n.), (HCl) \u003d 0,1 mol / dm (0, 1 Ν. ) Και (NSL) \u003d 0.0035 mol / dm (0.0035 n.).
Το θειικό οξύ σύμφωνα με το GOST 4204, H.CH., διαλύματα με ένα κλάσμα μάζας 1%, συγκέντρωση (HSO) \u003d 0,5 mol / dm (0,5 n.).
Υδροξείδιο του νατρίου σύμφωνα με τους GOST 4328, H.CH., διαλύματα με κλάσμα μάζας 2, 4, 5%, συγκεντρώσεις (ΝθΟΗ) \u003d 0,5 mol / DM (0,5 Ν.), (ΝθΟΗ) \u003d 0,1 mol / dm (0,1 n.), (ΝθΟΗ) \u003d 0.0035 mol / dm (0.0035 n.).
Χλωριούχο νάτριο σύμφωνα με το GOST 4233, H.C., κορεσμένο διάλυμα και ένα διάλυμα συγκέντρωσης (NaCI) \u003d 0,01 mol / dm (0,01 n.).
Η μεικτή ένδειξη που αποτελείται από μεθύλιο κόκκινο και μεθυλενικό μπλε ή μεθύλιο κόκκινο και το πράσινο βρωμόν πράσινο παρασκευάζεται σύμφωνα με το GOST 4919.1.
Μεθυλο πορτοκαλί ή μεθυλο κόκκινη ένδειξη, ένα διάλυμα με ένα κλάσμα μάζας 0,1% παρασκευάζεται σύμφωνα με το GOST 4919.1.
Δείκτης φαινολφθαλίνης, διάλυμα αλκοόλης με κλάσμα μάζας 1%, παρασκευάζεται σύμφωνα με το GOST 4919.1.
Το απορροφητικό χημικό ασβέστη CPI-1 σύμφωνα με το GOST 6755 ή το ασβέστη είναι το NATRON.
Σωλήνα (Hlekalcum) σύμφωνα με το GOST 25336.
Menzur 1000 σύμφωνα με το GOST 1770.
Κύλινδροι σύμφωνα με τις παραλλαγές GOST 1770 1-4 με χωρητικότητα 100 και 250 cm και παραστάσεις 1, 2 με χωρητικότητα 500 και 1000 cm.
Γυαλιά σε ή n σύμφωνα με το GOST 25336 σε οποιαδήποτε απόδοση χωρητικότητας 600 και 1000 cm.
Φιάλες KN-1-250 σύμφωνα με το GOST 25336.
Pipettes 2-2-100, 2-2-25, 2-2-20 και 2-2-10 μέσω NTD.
BURETTRES σε τύπους NTD 1, 2, παραστάσεις 1-5, κατηγορίες ακρίβειας 1, 2, με χωρητικότητα 25 ή 50 cm, με τιμή διαίρεσης που δεν υπερβαίνει τα 0,1 cm και τα τεμάχια τύπων 1, 2, εκτέλεση 6, ακρίβεια Μαθήματα 1, 2, με χωρητικότητα 2 ή 5 cm, με τιμή διαίρεσης που δεν υπερβαίνει τα 0,02 cm.
Οι φιάλες μέτρησης 1, 2 σύμφωνα με τους GOST 1770, κατηγορίες ακρίβειας 1, 2, με χωρητικότητα 10, 25 και 100 cm.
Κόσκινο με ένα πλέγμα ελέγχου 0315K σύμφωνα με το GOST 6613 με ένα κέλυφος με διάμετρο 200 mm.
Το CCC-5000 κύπελλο σύμφωνα με το GOST 25336 ή από ένα πολυμερισμό υλικό επαρκή για να τοποθετήσει το κόσκινο σε αυτό.
Εργαστήριο εγκατάστασης (βλέπε σχέδιο) αποτελείται από μια φιάλη 1 και μια γυάλινη στήλη με 6 εσωτερική διάμετρο (25,0 ± 1,0) mm και ύψος τουλάχιστον 600 mm για να προσδιοριστεί η δυναμική ικανότητα ανταλλαγής υπό συνθήκες πλήρους ιονικής αναγέννησης και εσωτερικής διαμέτρου (16,0 ± 0,5) mm και ύψος τουλάχιστον 850 mm για να προσδιοριστεί υπό συνθήκες καθορισμένης ροής αναγεννητικού παράγοντα. Στο κατώτερο τμήμα της στήλης του φίλτρου WPIAN 7 του POR 250 POR 250 χκη σύμφωνα με το GOST 25336 ή η άλλη διάταξη φιλτραρίσματος, ανθεκτικά σε οξέα και αλκάλια, χωρίς μεταδίδοντας κόκκους IONIS μεγαλύτερη από 0,25 mm και έχει μικρή αντίσταση φιλτραρίσματος . Η στήλη συνδέεται με μια φιάλη με γυάλινο σωλήνα 3 και ένας ελαστικός εύκαμπτος σωλήνας 4 με ένα κοχλιοφόρο κλιπ 5. Για να αποφευχθεί το διοξείδιο του άνθρακα από τον αέρα από τον αέρα σε διάλυμα υδροξειδίου του νατρίου σε ένα σωλήνα φιάλης, ένας σωλήνας χλωριούχου 2 είναι εγκατεστημένος με το Απορροφητής HPP-1.
Εργαστηριακή εγκατάσταση
Επιτρέπεται η χρήση άλλων οργάνων μέτρησης με μετρολογικά χαρακτηριστικά που δεν είναι χειρότερα από αυτά που αναφέρονται, καθώς και τα αντιδραστήρια ποιότητας που δεν είναι χαμηλότερα από τα καθορισμένα.
3. Μέθοδος για τον προσδιορισμό της δυναμικής ικανότητας ανταλλαγής με πλήρη ιοντική αναγέννηση
3.1. Προετοιμασία για τη δοκιμή
3.1.1. Η προετοιμασία για τη δοκιμή διεξάγεται σύμφωνα με το GOST 10896 και μετά την αποθηκεύεται το ιόν κατάρτισης σε κλειστή φιάλη κάτω από το στρώμα αποσταγμένου νερού.
Η μάρκα KAOTOTITIS KU-2-8 HP και το ανιόν της μάρκας AB-17-8CS στη δοκιμή σύμφωνα με το GOST 10896 δεν παρασκευάζονται.
3.1.2. Το ιονικό δείγμα από τη φιάλη υπό τη μορφή ενός υδατικού εναιωρήματος μεταφέρεται σε έναν κύλινδρο με χωρητικότητα 100 cm και σφράγισε ένα στρώμα ιονικού δακτυλίου πατώντας γύρω από τη στερεή επιφάνεια του πυθμένα του κυλίνδρου στην παύση της συρρίκνωσης. Ο όγκος του ιόντος ρυθμίζεται σε 100 cm και με τη βοήθεια αποσταγμένου νερού ανέχρων ιόντων στη στήλη, ακολουθώντας τις φυσαλίδες αέρα μεταξύ των ιοντικών κόκκων. Η περίσσεια νερού από τη στήλη αποστραγγίζεται, αφήνοντας 1-2 cm στρώμα πάνω από το επίπεδο ιονίου.
3.1.3. Τα ιόντα στη στήλη πλένεται με απεσταγμένο νερό, περνώντας από το πάνω προς τα κάτω με ταχύτητα 1,0 DM / h. Ταυτόχρονα, η ανιονίτιδα πλένεται από αλκάλιο (σύμφωνα με φαινολφθαλίνιο) και το όξινο κατιόν (σύμφωνα με μεθυλεστέρα).
3.1.4. Τα υψηλής δέσμευσης ανιόντων σε μορφή υδροξυλίου φορτώνονται γρήγορα και πλένονται με νερό που δεν περιέχει διοξείδιο του άνθρακα.
3.2. Δοκιμασία
3.2.1. Ο προσδιορισμός της δυναμικής ικανότητας ανταλλαγής των ιωνών αποτελείται από διάφορους κύκλους, καθένα από τα οποία περιλαμβάνει τρεις διαδοχικές πράξεις - κορεσμός, αναγέννηση, πλύσιμο, οι συνθήκες των οποίων παρουσιάζονται στον Πίνακα 1.
Τραπέζι 1
Προϋποθέσεις για τον προσδιορισμό της δυναμικής ικανότητας ανταλλαγής με την πλήρη ιωνική αναγέννηση
Δείκτης | Ionit τάξη | Λύση για κορεσμό των ιονίων | Έλεγχος κορεσμού | Αναγέννηση | |||
ικανοποιητικός | πλυντήριο | αναγέννηση |
|||||
Δυναμική ικανότητα ανταλλαγής σε ολίσθηση () | Ισχυρός- | Χλωριούχο ασβέστιο (CaCl) \u003d 0,01 mol / dm (0,01 n.) | Πριν από τη συγκέντρωση ιόντων ασβεστίου στο διήθημα (CA) \u003d 0,05 mmol / dm (0,05 mg · eq / dm) προσδιορίζονται από το GOST 4151 | Υδροχλωρικό οξύ, διάλυμα με ένα μάζα κλάσμα 5% | |||
Ισχυρός- | Χλωριούχο νάτριο (NaCl) \u003d 0,01 mol / dm (0,01 n.) | Πριν από τη μείωση της συγκέντρωσης αλκαλίων κατά 0,5 mmol / DM (0,5 mg · Eq / DM) σε σύγκριση με τη μέγιστη σταθερή τιμή στο διήθημα [Μικτή ένδειξη, διάλυμα τίτλου, υδροχλωρικό οξύ συγκέντρωσης (HCl) \u003d 0,01 mol / dm (0,01 n.)] Και πριν από την αύξηση της περιεκτικότητας σε ιόντα χλωρίου σε σύγκριση με το βιώσιμο περιεχόμενο του στο διήθημα (που ορίζεται σύμφωνα με το GOST 15615) | Υδροξείδιο του νατρίου, διάλυμα με κλάσμα μάζας 5% | ||||
Ασθενώς | Πριν από την εμφάνιση στο διήθημα των οξέων (με μεθυλεστέρα) | ||||||
Πλήρης δυναμική ικανότητα ανταλλαγής () | Ασθενώς | Σαλονικό οξύ (HCl) \u003d 0,1 mol / dm (0,1 n.) | Πριν από την εξίσωση της συγκέντρωσης διηθήματος με τη συγκέντρωση της λύσης εργασίας | Υδροξείδιο του νατρίου, διάλυμα με μάζα κλάσμα 2% | |||
Σημειώσεις:
1. Κατά τον προσδιορισμό της συγκέντρωσης των ιόντων CA σύμφωνα με το GOST 4151
2. Το συγκεκριμένο φορτίο είναι ο όγκος του διαλύματος που διέρχεται από τον όγκο του ιονέτ ανά 1 ώρα. Για παράδειγμα, 5 DM / DMS αντιστοιχεί στον ρυθμό διήθησης στο οποίο είναι 100 cm διαλύματος (8,3 cm / min) μετά από 100 cm του ionite.
3. Ο ρυθμός φιλτραρίσματος έχει ρυθμιστεί ώστε να μέτρησε σε έναν κύλινδρο μέτρησης του όγκου διηθήματος που λαμβάνεται κατά τη διάρκεια ενός συγκεκριμένου χρονικού διαστήματος.
Λύσεις και νερό τροφοδοτούνται από πάνω προς τα κάτω. Όταν απολαμβάνετε τις μάρκες Anonita της AN-1 και οι λύσεις AN-2FN μειώνεται από κάτω.
3.2.2 Πριν από τη διεξαγωγή δραστηριοτήτων κορεσμού, αναγέννησης και πλυσίματος, η στήλη γεμίζεται με κατάλληλη λύση. Το στρώμα διαλύματος πάνω από το ιόν θα πρέπει να είναι (15 ± 3) cm.
3.2.3. Μετά τον κορεσμό, την αναγέννηση και το πλύσιμο στη στήλη πάνω από το ιόν, αφήνουν ένα στρώμα υγρού με ύψος 1-2 cm.
3.2.4. Η ιοντική στήλη γεμίζεται με το διάλυμα εργασίας για μια συγκεκριμένη κατηγορία ιονίου (βλ. Πίνακα 1) έτσι ώστε το στρώμα διαλύματος πάνω από ιόν να είναι (15 ± 3) cm και να επιλέξει την αντίστοιχη ταχύτητα διήθησης.
Όταν η συγκέντρωση 0,1 mol / dm διέρχεται μέσω στήλης με ιόν (0,1 Ν.), Το διήθημα συλλέγεται σε κυλίνδρους χωρητικότητας 250 cm, σε συγκέντρωση 0,01 mol / dm (0,01 n.) - in Κύλινδροι με χωρητικότητα 1000 cm. Στον δεύτερο και επόμενους κύκλους κορεσμού πριν από την εμφάνιση των ιόντων εργασίας στο διήθημα (προσδιορίζεται μετά τον πρώτο κύκλο), το διήθημα συλλέγεται με τμήματα των 100 και 250 cm σύμφωνα με τις συγκεντρώσεις του Λύση εργασίας.
3.2.5. Από κάθε τμήμα του διηθήματος, το δείγμα λαμβάνεται και ελέγχει τον κορεσμό σύμφωνα με τον πίνακα 1.
3.2.6. Μετά την εμφάνισή του στο τμήμα του διηθήματος, τα ιόντα του διαλύματος εργασίας υπολογίζουν τον συνολικό όγκο διηθήματος.
3.2.7. Για να προσδιορίσετε την πλήρη δυναμική ικανότητα ανταλλαγής, το διάλυμα συνεχίζεται να ευθυγραμμίζεται τη συγκέντρωση διηθήματος με τη συγκέντρωση της διαλύματος εργασίας. Ο έλεγχος κορεσμού σε αυτή την περίπτωση διεξάγεται με την τιτλοδότηση του δείγματος με ένα διάλυμα ενός οξέος (υδροξείδιο του νατρίου) με μια μικτή ένδειξη πριν αλλάξει το χρώμα.
3.2.8. Πριν από την εκτέλεση της αναγέννησης, οι Ιονίοι στη στήλη εκραγούν το ρεύμα απεσταγμένου νερού από το κάτω μέρος επάνω ώστε όλα τα φύλλα IONTH να είναι σε κίνηση. Έκρηξη της μάρκας KU-1 Catticia και οι ανιόντες των εμπορικών σημάτων του AN-1 και AN-2FN πραγματοποιούνται πριν από τη λειτουργία κορεσμού.
3.2.9. Η ιονική αναγέννηση διεξάγεται με ένα διάλυμα οξέος (υδροξείδιο του νατρίου) με την τιμή που καθορίζεται στον Πίνακα 1. Το διήθημα συναρμολογείται συνεχώς από έναν κύλινδρο με έναν κύλινδρο με όγκο 250-1000 cm, προσθέτοντας 3-4 σταγόνες της ένδειξης. Όταν εμφανιστεί ένα οξύ (υδροξείδιο του νατρίου), η συγκέντρωσή του προσδιορίζεται στο διήθημα στα επόμενα τμήματα. Για τον έλεγχο του διηθήματος, το δείγμα λαμβάνεται με μια πιπέτα ή μετρήσιμη φιάλη και τιτλοδοτήρα με ένα διάλυμα οξέος (υδροξειδίου του νατρίου) (HSL, HSO) \u003d 0,5 mol / dm (0,5 n.), (NaOH) \u003d 0,5 mol / DM (0, 5 Ν.) παρουσία του δείκτη
3.2.10. Το όξινο διάλυμα (υδροξείδιο του νατρίου) διαβιβάζεται για την εξίσωση της συγκέντρωσης του διηθήματος με τη συγκέντρωση του αναγεννητικού διαλύματος.
3.2.11. Το IONIS μετά την αναγέννηση πλένεται με αποσταγμένο νερό σε ουδέτερη αντίδραση σύμφωνα με το πορτοκαλί μεθυλεστέρα (φαινολφθαλίνιο) με ταχύτητα που καθορίζεται στον Πίνακα 1. Στη συνέχεια, το ιόν διατηρείται σε αποσταγμένο νερό για 1 ώρα και το έλεγχο του διήθησης ξανά. Εάν το διήθημα δεν έχει ουδέτερη αντίδραση, το ιόν πλένεται και πάλι.
3.2.12. Ο ορισμός της δυναμικής ικανότητας ανταλλαγής είναι πλήρης εάν οι τελευταίοι κύκλοι που έχουν ληφθεί αποτελέσματα, η ασυμφωνία μεταξύ των οποίων δεν υπερβαίνει το 5% του μέσου αποτελέσματος.
3.2.13. Η δυναμική ικανότητα ανταλλαγής του ανιόντος του ΑΒ-17-8cc καθορίζεται από δύο παράλληλα δείγματα στον πρώτο κύκλο κορεσμού, πριν από την εμφάνιση των ιόντων εργασίας στο διήθημα. Το διήθημα συλλέγεται με τμήματα 250 cm. Για το αποτέλεσμα, τα μέσα αριθμητικά αποτελέσματα δύο ορισμών, η επιτρεπόμενη ασυμφωνία μεταξύ των οποίων δεν υπερβαίνει το 5% του μέσου αποτελέσματος.
(Τροποποίηση, IUS 3-91).
4. Μέθοδος για τον προσδιορισμό των δυναμικών εμπορευματοκιβωτίων με μια δεδομένη αναγεννητική κατανάλωση
4.1. Προετοιμασία για τη δοκιμή
4.1.1. Οι Ιόνις, που επιλέγονται σύμφωνα με τις αξιώσεις 1.2 και 1.3, διαχωρίζονται από μικρά κλάσματα με τη μέθοδο υγρής επανασύνδεσης σύμφωνα με το GOST 10900, χρησιμοποιώντας ένα κόσκινο με ένα πλέγμα n 0315k.
4.1.2. Ο διαχωρισμένος ανιονίτης τοποθετείται σε ένα γυαλί, 500 cm διάλυμα υδροξειδίου του νατρίου με ένα κλάσμα μάζας 4% αναδεύεται και αναδεύεται. Μετά από 4 ώρες, το διάλυμα υδροξειδίου αποστραγγίζεται και το ανιόν πλένεται με νερό σε ελαφρώς αλκαλική αντίδραση σύμφωνα με φαινολφθαλένιο και μεταφέρεται στη στήλη, όπως υποδεικνύεται στην παράγραφο 3.1.2.
4.1.3. Το διαχωρισμένο κατιόν πλένεται από εναιώρημα και σκαρφαλώνει με αποσταγμένο νερό με απόχυση πριν από την εμφάνιση του νερού πλύσης και μεταφέρεται στη στήλη σύμφωνα με την παράγραφο 3.1.2.
4.2. Δοκιμασία
4.2.1. Προσδιορισμός της δυναμικής δεξαμενής ανταλλαγής των ιονίων πριν από την εμφάνιση των ιόντων εργασίας στο διήθημα () αποτελείται από διάφορους κύκλους, καθένα από τα οποία περιλαμβάνει τρεις διαδοχικές λειτουργίες - κορεσμός, αναγέννηση, πλύσιμο, των οποίων οι συνθήκες παρουσιάζονται στον Πίνακα 2. Λύσεις και νερό τροφοδοτούνται από πάνω προς τα κάτω. Το ύψος του υγρού στρώματος πάνω από το επίπεδο Iodet ρυθμίζεται όπως ορίζεται σε σελ.3.2.2 και 3.2.3.
Πίνακας 2
Προϋποθέσεις για τον προσδιορισμό της δυναμικής ικανότητας ανταλλαγής των ιωνών σε μια δεδομένη αναγεννητική κατανάλωση
Ionit τάξη | Αναγέννηση | Ειδική τιμή τιμής αναγεννημένη | Έλεγχος πλύσης | Λύση Saturation Ionite | Έλεγχος κορεσμού | Ταχύτητα διήθησης |
||
νάσα | Γαμημένος | καταχωρητές |
||||||
Ισχυρός | Στην υπολειμματική συγκέντρωση οξέος στο διήθημα όχι περισσότερο | Χλωριούχο ασβέστιο (SASL \u003d 0.0035 mol / dm (0.0035 n.) | Πριν από τη συγκέντρωση ιόντων ασβεστίου στο διήθημα περισσότερο (CA) \u003d 0,05 mmol / dm | |||||
Ασθενώς | Θειικό οξύ, διάλυμα με ένα κλάσμα μάζας 1% | Μέχρι την απουσία στο διήθημα θεσμιξης (δείγμα με Bacll παρουσία HCl) | Υδροξείδιο του νατρίου (ΝαΟΗ) \u003d 0.0035 mol / dm (0.0035 n.) | Μέχρι συγκέντρωση στο διήθημα υδροξειδίου του νατρίου (ΝθΟΗ) \u003d 0,1 mmol / dm | ||||
Ισχυρός- | Υδροξείδιο του νατρίου με ένα κλάσμα μάζας 4% | Στην υπολειμματική συγκέντρωση υδροξειδίου του νατρίου στο διήθημα όχι περισσότερο (ΝθΟΗ) \u003d 0,2 mmol / dm | Χλωριούχο νάτριο (NaCI) \u003d 0,01 mol / dm (0,01 n.) | Πριν από τη μείωση της συγκέντρωσης αλκαλίων σε (ΝθΟΗ) \u003d 0,7 mmol / dm | ||||
Ασθενώς | Υδροξείδιο του νατρίου, διάλυμα με κλάσμα μάζας 4% | Στην υπολειμματική συγκέντρωση υδροξειδίου του νατρίου στο διήθημα όχι περισσότερο (ΝθΟΗ) \u003d 0,2 mmol / dm (0,2 mg · Eq / dm) μέσω φαινολφθαλίνης | Άλατος (θειικό) οξύ (HSL, HSO) \u003d 0,0035 mol / dm (0,0035 n.) | Μέχρι την υπολειμματική συγκέντρωση οξέος στο διήθημα δεν είναι περισσότερο (η) \u003d 0,1 mmol / dm (0,1 mg · Eq / dm), η ένδειξη αναμειγνύεται, το διάλυμα του τίτλου - συγκέντρωση υδροξειδίου του νατρίου (NaOH) \u003d 0,01 mol / dm (0, 01 η.) | ||||
Σημειώσεις:
1. Όταν εκφράζεται ο κανόνας του συγκεκριμένου ρυθμού ροής του παράγοντα αναγέννησης () σε γραμμάρια στο mole υπό τη λέξη "mole" σημαίνει τη μοριακή μάζα του ισοδύναμου ιόντων (Na, K, CA, MG, CL, NO, NSO, MG, CL, NO, NSO HSO, CO, έτσι
Και τα λοιπά.).
2. Ο πραγματικός ρυθμός ροής του παράγοντα αναγέννησης δεν πρέπει να διαφέρει από τον καθορισμένο κανόνα κατά περισσότερο από 5%.
3. Κατά τον προσδιορισμό της συγκέντρωσης ιόντων Α.Ε., σύμφωνα με το GOST 4151, τη χρήση 2-3 σταγόνων της ένδειξης του χρωμίου-σκούρου μπλε και τιτλοδότηση της συγκέντρωσης Trilone-B (NaHCon · 2ho) \u003d 0,01 mol / DM (0,01
4. Το συγκεκριμένο φορτίο είναι ο όγκος του διαλύματος που διέρχεται από τον όγκο του IONIS ανά 1 ώρα. Για παράδειγμα, 5 DM / DM1.Η αντιστοιχεί στον ρυθμό διήθησης στο οποίο είναι 100 cm διαλύματος (8,3 cm / min) μετά 100 cm ιονίτης.
5. Το ποσοστό διήθησης έχει ρυθμιστεί ώστε να μέτρησε σε έναν κύλινδρο μέτρησης του όγκου διηθήματος που λαμβάνεται κατά τη διάρκεια ενός συγκεκριμένου χρονικού διαστήματος.
Προκειμένου να αποφευχθεί η βλάβη της κατιτιστικής, η αναγέννηση οξέος και πλύσης από τα προϊόντα αναγέννησης πραγματοποιείται χωρίς διακοπή, επιτρέποντας το κενό μεταξύ των εργασιών.
Πριν από την εκτέλεση κάθε επόμενου κύκλου, το ιόν σφίγγει τη ροή του νερού από κάτω προς τα πάνω, έτσι ώστε όλα τα σπόρια Ionship να κινούνται.
4.2.2. Μέσα από ιόντα στη στήλη, το διάλυμα αναγεννητικής διαβιβάζεται, ο όγκος του οποίου () σε κυβικά εκατοστά υπολογίζεται από τον τύπο
όπου είναι μια δεδομένη τιμή του συγκεκριμένου ρυθμού ροής του παράγοντα αναγέννησης, g / mol (g / g · eq).
- Δυναμική δεξαμενή ανταλλαγής. Επιλέξτε σύμφωνα με την κανονιστική και τεχνική τεκμηρίωση σε συγκεκριμένο IONIS, MOL / M (R · EQ / M). Για τους Ionites, Ab-17-8, AN-31 και EDE-10P βαθμοί επιτρέπονται για την πρώτη αναγέννηση αυξημένη αξία της δυναμικής ικανότητας ανταλλαγής σε 3,
- Δείγματα Ionita, cm;
- Συγκέντρωση αναγεννητικού κονιάματος, g / dm.
Η ποσότητα του αναγεννητικού διαλύματος μετράται στην έξοδο της στήλης με έναν κύλινδρο ή βενζούρ. Στη συνέχεια, η στήλη αποσυνδέεται, το επίπεδο του διαλύματος πάνω από το ιόν στη στήλη μειώνεται σε 1-2 cm και κλείνει το χαμηλότερο
4.2.3. Οι ιονίτες μετά την αναγέννηση πλένονται με αποσταγμένο νερό από μια περίσσεια οξέος (υδροξείδιο του νατρίου) με την ταχύτητα που υποδεικνύεται στον Πίνακα 2.
Περιοδικά επιλέξτε το δείγμα διηθήματος και τους τιτλοποιημένους διαλύματα υδροξειδίου του νατρίου (NaOH, HCl, HSO) \u003d 0,1 mol / dm (0,1 n.) Παρουσία μεθυλεστέρα πορτοκαλιού (φαινολφθαλίνης).
Η πλύση ελέγχεται από τον Πίνακα 2.
4.2.4. Μετά το πλύσιμο, η στήλη γεμίζεται με την πτερωτή και ρυθμίζεται το ποσοστό κορεσμού από τον Πίνακα 2.
Κατά τη διάρκεια της εργασίας σε μια στήλη εργασίας διαλύσεων συγκεντρώσεων 0,01 mol / dm (0,01 n.) Το διήθημα συλλέγεται σε ένα κύλινδρο με χωρητικότητα 250 cm, σε συγκέντρωση 0,0035 mol / dm (0,0035 n.) Χρησιμοποιήστε τον κύλινδρο με ένα Χωρητικότητα 1000 cm. Οι δεύτεροι και οι επόμενοι κύκλοι κορεσμού πριν από την εμφάνιση των ιόντων κονιάματος εργασίας στο διήθημα (προσδιορίζονται μετά τον πρώτο κύκλο), το διήθημα συλλέγεται κατά 100 και 250 cm, αντίστοιχα, συγκεντρώσεις του διαλύματος εργασίας.
4.2.5. Για τον έλεγχο του κορεσμού από το τμήμα του διηθήματος, το δείγμα λαμβάνεται και αναλύεται σύμφωνα με τον πίνακα 2. Εάν το αποτέλεσμα ανάλυσης δείχνει ότι το επίπεδο κορεσμού δεν επανέφερε τις τιμές που καθορίζονται στον Πίνακα 2, όλα τα προηγούμενα δείγματα διηθήματος μπορούν να αναλυθούν.
4.2.6. Μετά την εμφάνισή του στο τμήμα του διηθήματος των ιόντων εργασίας των ιόντων εργασίας στις ποσότητες που αναφέρονται στον Πίνακα 2, ο κορεσμός ολοκληρώνεται και υπολογίζεται το συνολικό διήθημα () και το δυναμικό δοχείο ανταλλαγής.
4.2.7. Το ιόν υποβάλλεται σε δεύτερη αναγέννηση και πλύθηκε σύμφωνα με τις παραγράφους 4.4.2.2 και 4.2.3.
Κατά τον υπολογισμό του αναγεννητικού παράγοντα που απαιτείται για τον δεύτερο κύκλο, η τιμή του δυναμικού δοχείου ανταλλαγής που λαμβάνεται στον πρώτο κύκλο σύμφωνα με την παράγραφο 4.2.6 χρησιμοποιείται σύμφωνα με την παράγραφο 4.2.6.
Πριν από την πραγματοποίηση μεταγενέστερων κύκλων κορεσμού, η κατανάλωση αναγεννητικής κατανάλωσης υπολογίζεται από το μέγεθος της δυναμικής ικανότητας ανταλλαγής που λαμβάνεται στον προηγούμενο κύκλο.
4.2.8. Το τέλος του ορισμού Εάν οι τελευταίοι κύκλοι που έλαβαν τα αποτελέσματα που επιτρέπονται από τις αποκλίσεις μεταξύ των οποίων δεν υπερβαίνουν το 5% του μέσου αποτελέσματος, με τον πραγματικό ειδικό ρυθμό ροής του παράγοντα αναγέννησης, διαφορετικό από τον καθορισμένο κανόνα κατά το 5%.
5. Αποτελέσματα επεξεργασίας
5.1. Δυναμική ικανότητα ανταλλαγής () σε κυβικό μέτρο (R · EQ / m) έως ότου τα ιόντα του λειτουργικού διαλύματος εμφανίζονται στο διήθημα υπολογίζονται από τον τύπο
όπου - ο συνολικός όγκος του διηθήματος πέρασε από τα ιόντα πριν από την εμφάνιση των ιόντων της εργασίας εργασίας, βλέπε.
- ο όγκος του Ionet, βλέπε
5.2. Ο πραγματικός ρυθμός ροής του παράγοντα αναγέννησης () σε γραμμάρια ανά mol (g / g ισομερούς) των απορροφούμενων ιόντων υπολογίζεται από τον τύπο
όπου υπάρχει ο όγκος του αναγεννητικού κονιάματος, βλέπε.
- Συγκέντρωση της αναγέννησης, G / DM.
- η συνολική ποσότητα διηθήματος πέρασε μέσω των ιωνών μέχρις ότου εμφανιστούν τα ιόντα της λύσης εργασίας, βλέπε.
- Συγκέντρωση διαλύματος εργασίας, mol / dm (n.
5.3. Πλήρης δυναμική ικανότητα ανταλλαγής () σε moles ανά κυβικό μέτρο (R · EQ / m) υπολογίζεται από τον τύπο
Όπου - η συνολική ποσότητα διηθήματος πέρασε μέσω των ιωνών για την εξίσωση των συγκεντρώσεων του διηθήματος και του διαλύματος εργασίας, cm.
- Συγκέντρωση διαλύματος εργασίας, mol / dm (n.);
- ο όγκος του τμήματος του διηθήματος μετά την εμφάνιση των ιόντων του διαλύματος εργασίας (Skip), cm;
- Συγκέντρωση του διαλύματος σε τμήματα του διηθήματος μετά την εμφάνιση των ιόντων του διαλύματος εργασίας (Skip), mol / dm (n.);
- όγκος Iodet,
5.4. Για το αποτέλεσμα του ορισμού, λαμβάνονται τα μέσα αριθμητικά αποτελέσματα των δύο τελευταίων κύκλων, οι αποκλίσεις μεταξύ των οποίων δεν υπερβαίνουν ± 5%, με αξιόπιστη πιθανότητα \u003d 0,95.
Σημείωση. Όταν εκφράζει τη δυναμική ικανότητα ανταλλαγής των ιονίων σε ένα κυβικό μέτρο κάτω από τη λέξη "mole", υπάρχει μια γραμμομοριακή μάζα ισοδύναμου ιόντων (Na, K, CA, MG, CL, NO, NSO, HSO, CO, κλπ. ).
Το κείμενο του εγγράφου διατρέπει:
Επίσημη έκδοση
Ionites. Μέθοδοι προσδιορισμού
Χωρητικότητα ανταλλαγής: Σάββατο Γωστόφ. -
M.: Πρότυπα δημοσίευσης IPK, 2002
Γενικές έννοιες
Σε γενικές λέξεις, υπό την ικανότητα της ρητίνης ανταλλαγής ιόντων κατανοείται ως ο αριθμός των ιόντων, οι οποίοι μπορούν να απορροφηθούν από μια ορισμένη ποσότητα ρητίνης. Επιπλέον, η μονάδα μέτρησης της χωρητικότητας ρητίνης μπορεί να είναι διαφορετική. Για παράδειγμα, mm-eq / ml (meq / ml), κύριε (eq / l) ή kilogran σε κυβικό πόδι (KGR / FT3). Γνωρίζοντας μια ισοδύναμη μάζα της ύλης, μπορείτε να υπολογίσετε τη δεξαμενή της ρητίνης. Η ισοδύναμη μάζα της ουσίας ορίζεται ως ο λόγος της γραμμομοριακής μάζας της ουσίας προς σθένος (αυστηρά μιλώντας, στον αριθμό της ισοδυναμίας της ουσίας). Για παράδειγμα, το μοριακό βάρος ασβέστιο είναι 40 g. / Mol, και valence 2, τότε η ισοδύναμη μάζα είναι ίση με 20 g. / Mol (40/2 \u003d 20). Η ρητίνη ανταλλαγής ιόντων με την ικανότητα ανταλλαγής 1,95 g - eq / L είναι ικανή να απομακρυνθεί 1,95 Η20 \u003d 39 γραμμάρια από το διάλυμα ανά 1 λίτρο ρητίνης.
Στην πράξη, η ικανότητα ανταλλαγής της ρητίνης καθορίζεται στα εργαστήρια τιτλοδότησης. Μέσω της στήλης στην οποία τοποθετείται η σόδα σε μορφή υδρογόνου (μορφή Η), διαλύεται διάλυμα υδροξειδίου του νατρίου (ΝθΟΗ). Μέρος των ιόντων Na + ανταλλάσσεται για ιόντα υδρογόνου. Το υδροξείδιο του νατρίου, το οποίο δεν εισήλθε σε αντίδραση με μια ιοντική ομάδα ρητίνης, καθαρίζεται με οξύ. Το Sut από την αρχική συγκέντρωση του υδροξειδίου του νατρίου, η υπολειμματική συγκέντρωση μπορεί να προσδιοριστεί από το δοχείο κατιόντων. Ένας άλλος τρόπος για τον προσδιορισμό της ικανότητας συναλλαγματικής ικανότητας του ιόντος διέρχεται από το στρώμα ρητίνης του διαλύματος χλωριούχου ασβεστίου. Παρομοίως, προσδιορίζεται η δεξαμενή μιας ρητίνης ανταλλαγής ανιόντων (σε ΟΗ-μορφή), μέσω του οποίου διέρχεται το όξινο διάλυμα.
Η χωρητικότητα ρητίνης μπορεί να μετρηθεί σε mm-Eq / ml (όγκο) ή mg-eq / g (βάρος). Εάν ορίζεται ένα δοχείο που εκφράζεται σε mM-EQ / g (και η μάζα ξηρού ιόντος εννοείται), στη συνέχεια, γνωρίζοντας την υγρασία της ρητίνης, είναι εύκολο να πάτε στο MM-EQ / ml.
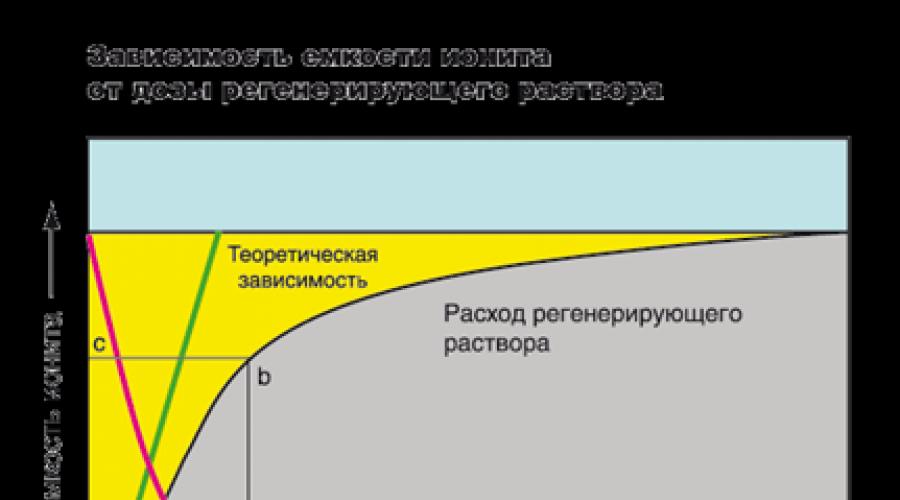
Στο σχήμα, η ικανότητα ανταλλαγής της ρητίνης απεικονίζεται γραφικά από μια περιοχή κίτρινου χρώματος που βρίσκεται μεταξύ κατακόρυφης ευθείας και CL. Η περιοχή του γκρι, που βρίσκεται κάτω από την καμπύλη, είναι η συγκέντρωση ιόντων σε καθαρό νερό. Στην αρχή του κύκλου, η συγκέντρωση ιόντων στο διήθημα είναι πολύ μικρός και παραμένει σταθερή καθ 'όλη τη διάρκεια του φίλτρου, τη στιγμή που το εμπρόσθιο φιλτραρίσματος φτάσει στο άκρο του στρώματος Ione, τα ιόντα που εμφανίζονται στο διήθημα (στο Εικόνα - Σημείο Ρ). Αυτό είναι ένα σήμα για την αναγέννηση ρητίνης. Συνήθως, η αναγέννηση του φίλτρου πραγματοποιείται στο Slippath. Για παράδειγμα, στη βιομηχανία, η συγκέντρωση ιόντων ακαμψίας στις οποίες το φίλτρο προέρχεται στην αναγέννηση μπορεί να φτάσει σε τιμή μικρότερη από 0,05 03 και σε οικιακά συστήματα μαλακώματος - λιγότερο από 0,5 0. Το μήκος τμήματος X - Υ αντιστοιχεί στον όγκο του καθαρισμένου νερού σε λίτρα ή γαλόνια. Η περιοχή του σχήματος anlb είναι μια πλήρης απορρόφηση των ιόντων της ρητίνης και η περιοχή του σχήματος ANMB είναι ο αριθμός των απορροφούμενων ιόντων μέχρι την εμφάνιση της ολίσθησης.
Μιλώντας για τη δεξαμενή, συχνά εννοούμε την εργασία με ακρίβεια και όχι ένα πλήρες δοχείο ανταλλαγής. Η ικανότητα εργασίας δεν αποτελεί μόνιμη αξία, εξαρτάται από το σύνολο των παραγόντων: το εμπορικό σήμα του Ionite, τη συγκέντρωση και τον τύπο των απορροφούμενων ιόντων, το ρΗ του διαλύματος, στις απαιτήσεις του καθαρισμένου νερού, του ρυθμού ροής, το ύψος του ύψους του στρώματος ιονίου και άλλων απαιτήσεων.

Η επίτευξη υψηλού βαθμού εκχύλισης ιόντων από ένα υδατικό διάλυμα απαιτεί αύξηση της δόσης του αναγεννητικού διαλύματος (κόκκινη γραμμή). Ωστόσο, η αύξηση της συγκέντρωσης του διαλύματος αναγέννησης είναι απείρως αδύνατη (η πράσινη γραμμή είναι η θεωρητική εξάρτηση μεταξύ του βαθμού μείωσης της χωρητικότητας ρητίνης και του ρυθμού ροής του ρυθμιστικού διαλύματος). Στην πράξη, για την επίτευξη υψηλής χωρητικότητας, είναι απαραίτητο να αυξηθεί ο αριθμός των ρητινών. Με το πρώτο φίλτρο, ο βαθμός μείωσης των ιδιοτήτων ανταλλαγής ιόντων μπορεί να φθάσει το 100%, αλλά με την πάροδο του χρόνου αυτή η τιμή θα μειωθεί. Για παράδειγμα. Οι περισσότεροι από τους κατασκευαστές συστημάτων μαλακώματος νερού συνιστώνται να χρησιμοποιούν ένα διάλυμα NaCl με συγκέντρωση 100-125 g. / L για να αποκαταστήσει την ικανότητα του κατιόντος έως και 50-55% του συνολικού δοχείου ανταλλαγής.
Κατά τον προσδιορισμό του δοχείου, είναι απαραίτητο να γνωρίζουμε την ιοντική μορφή της ρητίνης (αλάτι, οξύ, κύριος). Με αναγέννηση ή στη διαδικασία λειτουργίας, ο όγκος της αντλημένης ρητίνης αλλάζει, η διαδικασία που ονομάζεται ρητίνη που ονομάζεται "αναπνοή". Ο πίνακας δείχνει πώς οι ρητίνες συμπεριφέρονται σε διάφορες διαδικασίες.
Διακρίνονται κατιόν και ανιονικά. Αντιδράσεις στις οποίες συμμετέχουν IONES στον πίνακα.
τιτλοποίηση αντίδρασης ρητίνης ιόντων

Επιπλέον, στην αγγλική γλώσσα, το σύμβολο SAC υποδεικνύει το έντονα όξινο κατιόν, η SBA είναι ένα εξαιρετικά χρήσιμο ανιόν, το WAC είναι ένα ασθενώς όξινο κατιόν και το WBA είναι ένα ασθενώς φιλικό ανιόν. Η ικανότητα ανταλλαγής ιόντων καθορίζεται από την παρουσία μιας λειτουργικής ομάδας, τα έντονα όξινα κατιόντα περιέχουν μια σουλφ-ομάδα - SO3H και το ασθενώς όξινο όξινο κατιόν της καρβοξυλικής ομάδας - COOH. Τα έντονα όξινα κατιόντα ανταλλάσσονται με κατιόντα σε οποιεσδήποτε τιμές ρΗ, δηλαδή, συμπεριφέρονται σαν ισχυρά οξέα σε διάλυμα. Ένα ασθενώς όξινο όξινο κατιόν είναι παρόμοιο με τα ασθενικά οξέα και αντιδρά με αντιδράσει ανταλλαγή ιόντων μόνο σε τιμές ρΗ παραπάνω 7. Οι ανιονικές περιέχουν λειτουργικές ομάδες πέντε τύπων: (-NH2, ΝΗ \u003d, ΝΔ, - - Ν (CH3) 3OH, - Ν (CH3) 2OH4OH). Οι τρεις πρώτες ομάδες δίνουν το ανιόν των κατώτερων φιλικών ιδιοτήτων και των ομάδων - Ν (CH3) 3OH, - Ν (CH3) 2C2H4OH - έντονα εξόρυξη. Τα ασθενώς φιλικά ανιόντα αντιδρούν με ανιόντα ισχυρών οξέων (έτσι, Cl-, όχι) και ιδιαίτερα δεσμευτικό με ανιόντα ισχυρών και αδύναμων (HCO, HSIO) στο εύρος ρΗ από 1 έως 14. Μιλώντας για τη δεξαμενή εξαιρετικά δεσμευτικής Ανιόν, θα πρέπει να δώσετε προσοχή σε αυτό στη ρητίνη υπάρχουν λειτουργικές ομάδες εγγενείς και κακώς φιλικές ανιονικές. Κατά τη γήρανση υψηλής δέσμευσης ανιόντων ή υπό τη δράση υψηλών θερμοκρασιών, υπάρχει μείωση της γραμμής βάσης και μερικής καταστροφής των λειτουργικών ομάδων.
Σκεφτείτε περισσότερες αντιδράσεις που διαρρέουν με τη συμμετοχή ρητινών ανταλλαγής ιόντων. Αντίδραση 1 - Μαλακοποίηση νερού στην έντονη όξινη κατιόν του σχήματος άλατος (Na), 2 - απομάκρυνση ιόντων νιτρικού σε εξαιρετικά δεσμευτικό ανιόν σε μορφή CL. Η εφαρμογή ως αναγεννητικό διάλυμα χλωριούχου νατρίου και χλωριούχου καλίου συμβάλλει στην ευρεία χρήση αυτού του τύπου ρητίνης στην καθημερινή ζωή, τη βιομηχανία και τη θεραπεία των λυμάτων. Οι κατιονιές μπορούν επίσης να αποκατασταθούν από όξινα διαλύματα (για παράδειγμα, υδροχλωρικό οξύ) και ανιόντα - ένα διάλυμα καυστικής σόδα (ΝαΟΗ). Οι Ιονίοι σε Η και ΟΗ-Μορφή χρησιμοποιούνται στα σχήματα για την παρασκευή αφαλατωμένου νερού (αντίδραση 3 και 4). Το ασθενώς όξινο κατιόν υποδεικνύεται με ιδιότητες ανταλλαγής ιόντων σε υψηλές τιμές ρΗ (αντίδραση 5) και ένας ασθενώς-άξονας ανιονίτης - σε χαμηλές τιμές ρΗ (αντίδραση 6). Η αντίδραση 5 είναι ταυτόχρονη μαλακτική και μειωμένη με αλκαλικότητα του νερού. Θα πρέπει να σημειωθεί ότι η ρητίνη WBA ως αποτέλεσμα της αναγέννησης με ένα αλκαλικό διάλυμα δεν μεταδίδεται σε μορφή ΟΗ, αλλά η λεγόμενη μορφή FB (ελεύθερη βάση).
Αδυνατίως όξινο κατιονί σε σύγκριση με τα ισχυρά οξέα έχουν μεγαλύτερη ικανότητα ανταλλαγής, χαρακτηρίζονται από μεγάλη συγγένεια για ιόντα υδρογόνου, οπότε η αναγέννηση προχωράει ευκολότερη και ταχύτερη. Είναι σημαντικό ότι για την αναγέννηση του WAC, καθώς και το WBA, δεν χρησιμοποιούνται τα διαλύματα χλωριούχου νατρίου ή καλίου. Η επιλογή μιας ή άλλης μάρκας ανταλλαγής ιόντων ανταλλαγής εξαρτάται από πολλές συνθήκες. Για παράδειγμα, διακρίνονται δύο τύποι ανιονίας υψηλής εξόρυξης: τύπου Ι (λειτουργική ομάδα - Ν (CH3) 3OH) και τύπου II (-Ν (CH3) 2C2H4OH). Τα ανιόντα του τύπου Ι είναι καλύτερα να απορροφούν τα ιόντα HSIO, σε αντίθεση με τους ανιονικούς τύπου ΙΙ, αλλά οι τελευταίες χαρακτηρίζονται από υψηλότερη ικανότητα ανταλλαγής και καλύτερα αναγεννημένα.
Συμπερασματικά, σημειώνουμε ότι στη βιβλιογραφία, καθώς και στο διαβατήριο στα προϊόντα, υποδεικνύεται η συνολική δεξαμενή βάρους και ανταλλαγής της ρητίνης, οι οποίες ορίζονται στο εργαστήριο. Η χωρητικότητα εργασίας της ρητίνης είναι χαμηλότερη από τον κατασκευαστή που δηλώνεται και εξαρτάται από πολλούς παράγοντες που δεν μπορούν να ληφθούν υπόψη στις εργαστηριακές συνθήκες (γεωμετρικά χαρακτηριστικά του στρώματος ρητίνης, ειδικές συνθήκες διεργασίας: ταχύτητες ροής, συγκέντρωση διαλυμένων ουσιών, βαθμός αναγέννησης , και τα λοιπά.).
Τα υλικά του Vion χρησιμοποιούνται για τον καθαρισμό των εκπομπών αερίων εξαερισμού από τα διαλυτά συστατικά, τα αεροζόλ των οξέων και των αλάτων των βαρέων μετάλλων, όπου χρησιμοποιούνται κυρίως με τη μορφή μη υφασμένων καμβάδων αναρρίχησης βελόνας.
Πρόοδος:
Ζύγιζε 2 gr. Kationita Vion Kn-1 (ξηρό). Ρίξτε στο πλέγμα. Μετακινήστε το αρχικό CUCL 2 (3,6 mmol / L) διαμέσου της στήλης γεμάτο κατιονισμένο. Στη συνέχεια, αλέθουμε το δείγμα για τιτλοποίηση 50 ml. Με βάση τη μεθοδολογία (παράγραφος 3.1), καθορίζουμε την οπτική πυκνότητα του δείγματος και να βρούμε τη συγκέντρωση του χαλκού. Τα αποτελέσματα παρουσιάζονται στον Πίνακα 3.5.
Πίνακας 3.5
|
C, mmol / l |
||||
Δημιούργησαν ένα γράφημα της εξάρτησης της συγκέντρωσης του χαλκού στο διήθημα από τον όγκο του διαλύματος πέρασε μέσω του ιονέτ.
Σύκο. 3.4.
Η διαδικασία απορρόφησης είναι να απορροφάται πλήρως τα πρώτα τμήματα κατιόντων με κατιόν και η περιοχή απορρόφησης κινείται σταδιακά κατά μήκος της στήλης στην έξοδο. Μετά από αυτό, η στιγμή συμβαίνει όταν, λόγω της εξάντλησης του δοχείου κατιόντων, τα κατιόντα αρχίζουν να βγαίνουν από τη στήλη. Από το γράφημα, μπορεί να φανεί ότι η συγκέντρωση του χαλκού στην πρίζα της στήλης αυξάνεται σταδιακά και έχει τη μορφή της καμπύλης σχήματος S, που κυμαίνεται από μηδενικές συγκεντρώσεις στο μέγιστο. Αυτή η καμπύλη τεντώνεται με μικρές συγκεντρώσεις αλάτων.
Υπολογίστηκε η ποσότητα του χαλκού, η οποία απορροφάται στήλη στον συνολικό κορεσμό του κατιόντος, ως περιοχή του σχήματος, μια περιορισμένη καμπύλη σχήματος S και μια άμεση μέγιστη συγκέντρωση:
h \u003d? VI * (Cmax - CI) (3)
όπου vi \u003d 50 ml,
Cmax \u003d 3,6mmmol
h1 \u003d 2,20 mmol.
Υπολογίστηκε το ογκομετρικό δοχείο του κατιόντος:
z1 \u003d h1 / m k \u003d 2,20 / 2 \u003d 1,10 mmol / gr. Kationata.
Τη συζήτηση των αποτελεσμάτων
Κατά τη διάρκεια της πειραματικής εργασίας, προσδιορίστηκε η συνολική ισοτιμία τριών διαφορετικών κατιόντων (KU-2-8, KU-1, Vion kn-1). Τα αποτελέσματα παρουσιάζονται στο Σχήμα 3.5.

Η συνολική δεξαμενή ανταλλαγής του κατιόντος είναι ανάλογη με την περιοχή του σχήματος, μια περιορισμένη καμπύλη σχήματος S και μια άμεση μέγιστη συγκέντρωση. Όπως φαίνεται από το σχήμα 3.5. Τα δοχεία διαφόρων ιωνιτών είναι διαφορετικά και λιγότερο από την πλήρη ικανότητα ανταλλαγής των κατιόντων των δηλωμένων στο διαβατήριο. Έτσι, η πλήρης ισοτιμία της KU-2-8 κατιόν βρίσκεται πειραματικά κάτω από την τιμή του διαβατηρίου κατά 28%, η πλήρης ικανότητα ανταλλαγής του KU-1 είναι χαμηλότερη από την τιμή διαβατηρίου κατά 57% και την κατιόν του Vion Kn-1 είναι 39%. Αυτά τα δεδομένα πρέπει να λαμβάνονται υπόψη κατά τον υπολογισμό και τον σχεδιασμό συσκευών ανταλλαγής ιόντων και φίλτρων.
Το Ion Exchange προχωρά σε εκείνους τους προσροφώρους που είναι πολυηλεκτρολύτες (ανταλλάκτες ιόντων, ιονίοι, ρητίνες ανταλλαγής ιόντων).
Ανταλλαγή ιόντωνΗ ισοδύναμη διαδικασία ανταλλαγής ιονισμού στον εναλλάκτη ιόντων ονομάζεται άλλα ιόντα του ίδιου σημείου διαλύματος. Η διαδικασία της ανταλλαγής ιόντων είναι αναστρέψιμη.
Οι Ιωνοί χωρίζονται σε κατιόντα, ανιόντες και αμφοτερικούς ιονίους.
ΚΑΤΑΡΑΙΤΕΣ- Οι ουσίες που περιέχουν σταθερές αρνητικά φορτισμένες ομάδες στη δομή τους (σταθερά ιόντα), τα οποία κινούνται κινούμενα κατιόντα (αντίθετα), τα οποία μπορούν να ανταλλάξουν με κατιόντα στο διάλυμα (Εικ. 81).
Σύκο. 81. Μοντέλο μήτρας πολυηλεκτρολύτων (κατιόν) με σταθερά ανιόντα και κινούμενα αντίθετα, όπου - τα σταθερά ιόντα.
- Coiones, - Συμβουλές
Φυσικά κατιόντα: ζεόλιθοι, διαπεριτίτιδα, σιλικαζέλ, κυτταρίνη, καθώς και τεχνητό: στερεά αδιάλυτα ιοντικά πολυμερή υψηλού μοριακού βάρους που περιέχουν πιο συχνά σουλφοφοομάδες, καρβοξυλ, φωσφίνιο, οξέα αρσενικού οξέος ή σεληνίου. Συνθετικά ανόργανα κατιόντα, τα οποία χρησιμοποιούνται συχνότερα από αργιλοπυριτικά.
Σύμφωνα με τον βαθμό ιονισμού των ιονικών ομάδων, τα κατιόντα χωρίζονται σε σοβαρό οξύ και αδυναμία. Τα έντονα όξινα κατιόντα είναι ικανά να ανταλλάξουν τα κινητά τους κατιόντα σε εξωτερικά κατιόντα σε αλκαλικά, ουδέτερα και όξινα περιβάλλοντα. Αδυναμικά όξινο κατιόν ανταλλάσσει αντίσταση ανταλλαγής σε άλλα κατιόντα μόνο σε ένα αλκαλικό περιβάλλον. Το έντονα όξινο είναι κατιόν με έντονα διαχωρισμένες ομάδες οξέος - σουλφονικό οξύ. Το ασθενώς οξύ περιλαμβάνει κατιόν που περιέχει ασθενώς όξινες ομάδες οξέος - φωσφορώδες οξύ, καρβοξύλιο, οξυφαινύλιο.
Ανιώνοι- Εναλλάκτες ιόντων που περιέχουν θετικά φορτισμένες ιονικές ομάδες στη δομή τους (σταθερά ιόντα), τα οποία κινούνται ανιόντα (αντίθετα), τα οποία μπορούν να ανταλλάξουν με ανιόντα που είναι σε διάλυμα (Εικ. 82). Διακρίνει φυσικά και συνθετικά ανιονικά.

Σύκο. 82. Μοντέλο της μήτρας πολυηλεκτρολύτων (ανιόν) με σταθερά κατιόντα και κινούμενα αντίθετα, όπου + είναι σταθερά ιόντα.
- Coiones, - Συμβουλές
Οι συνθετικοί ανιονικοί περιέχουν θετικά φορτισμένες ιονικές ομάδες σε μακρομόρια. Οι ασθενώς-σπιτικά ανιονικοί είναι στη σύνθεσή τους πρωτογενείς, δευτερογενείς και τριτοταγείς αμινομάδες, τα υψηλά δεσμευτικά ανιόντα περιέχουν ομάδες αμμωνίας κρεμμυδιού και βάσης (αμμώνιο, πυριδινίου, σουλφονίου, φωσφονίου). Υψηλά δεσμευτικά ανιόντα που μετακινούνται ανιόντα σε όξινα, ουδέτερα και αλκαλικά μέσα, ασθενώς άξονα - μόνο σε ένα όξινο περιβάλλον.
Αμφοτερικοί ιονίτεςΠεριέχουν τόσο κατιονικές και ανιονικές ιοντικές ομάδες. Αυτά τα ιόντα μπορούν να σορβίτε τόσο κατιόντα όσο και τα ανιόντα.
Το ποσοτικό χαρακτηριστικό του ιόντος είναι Πλήρης δεξαμενή ανταλλαγής(ΤΑΧΥΔΡΟΜΕΙΟ). Ο προσδιορισμός μπορεί να διεξαχθεί με μια στατική ή δυναμική μέθοδο που βασίζεται σε αντιδράσεις που ρέουν στο σύστημα IONBIT - Λύση:
RSO 3 - H + + NaOH → RSO 3 - Na + + H2O
RNH 3 + ΟΗ - + ΗΟΙ → RnH3 + Cl - + Η2Ο
Η χωρητικότητα προσδιορίζεται από τον αριθμό των ιοντικών ομάδων σε ιονικό και συνεπώς θεωρητικά πρέπει να υπάρχει σταθερή τιμή. Ωστόσο, εξαρτάται πρακτικά από μια σειρά συνθηκών. Υπάρχουν στατικές δεξαμενές ανταλλαγής (SEO) και δυναμική ικανότητα ανταλλαγής (Dee). Η στατική ικανότητα ανταλλαγής είναι ένα πλήρες δοχείο που χαρακτηρίζει τον συνολικό αριθμό ιονικών ομάδων (σε milliecqualents) ανά μονάδα μάζας αέρα-ξηρού ιόντος ιόντων ή NA της ποσότητας πρησμένων ιωνών. Οι φυσικοί ιονίοι έχουν μικρή στατική μεταβολική χωρητικότητα, που δεν υπερβαίνει το 0,2-0,3 mekv / g. Για συνθετικές ρητίνες ανταλλαγής ιόντων, είναι εντός 3-5 mekv / g, και μερικές φορές φτάνει τα 10,0 meq / g.
Η δυναμική ή η εργασία, η ανταλλαγή χωρητικότητας ισχύει μόνο με το μέρος των ιονέπτων, οι οποίες εμπλέκονται στην ανταλλαγή ιόντων που συμβαίνει σε τεχνολογικές συνθήκες, για παράδειγμα, σε στήλη ανταλλαγής ιόντων σε μια ορισμένη σχετική ταχύτητα του ιονίου και του διαλύματος. Η δυναμική ικανότητα εξαρτάται από την ταχύτητα κίνησης, το μέγεθος της στήλης και άλλων παραγόντων και είναι πάντα μικρότερη από τη στατική μεταβολική χωρητικότητα.
Για να προσδιοριστεί η στατική δεξαμενή ανταλλαγής των Ionites, χρησιμοποιούνται διάφορες μέθοδοι. Όλες αυτές οι μέθοδοι μειώνεται στον κορεσμό του IONET από οποιοδήποτε ιόν, στη συνέχεια μετατοπίζοντας το με ένα άλλο ιόν και την ανάλυση του πρώτου διαλύματος. Για παράδειγμα, ο κατιονίτης μεταφράζεται εύκολα σε Η + -Form (τα αντίθετα είναι τα ιόντα υδρογόνου), στη συνέχεια ξεπλύνετε με διάλυμα χλωριούχου νατρίου και το προκύπτον ξινό διάλυμα απομακρύνεται με αλκαλικό διάλυμα. Η χωρητικότητα είναι ίση με την αναλογία της ποσότητας οξέος που έχει περάσει σε ένα διάλυμα οξέος στη διάθεση του Ionon.
Με μια στατική μέθοδο, το οξύ ή το αλκάλιο τιτλοποιείται, ο οποίος ως αποτέλεσμα της προσρόφησης της ανταλλαγής ιόντων εμφανίζεται σε διάλυμα.
Σε μια δυναμική μέθοδο, αυτό προσδιορίζεται με χρωματογραφικές στήλες. Μέσα από μια στήλη που γεμίζεται με ρητίνη ανταλλαγής ιόντων, το διάλυμα ηλεκτρολύτη διέρχεται και η εξάρτηση της συγκέντρωσης του απορροφούμενου ιόντος στο παρωχημένο διάλυμα (έκλουσμα) καταγράφεται από τον όγκο του παρελθόντος διαλύματος (καμπύλη εξόδου). Θέτουν υπολογιζόμενη από τον τύπο
 , ,
| (337) |
Οπου V. Σύνολο - ο συνολικός όγκος που περιλαμβάνει ένα οξύ που παρέχεται από ρητίνη. από - συγκέντρωση οξέος σε αυτή τη λύση. Μ. - Μάζα της ρητίνης ανταλλαγής ιόντων στη στήλη.
Η σταθερά ανταλλαγής ισορροπίας μπορεί να προσδιοριστεί από δεδομένα σχετικά με την κατανομή ισορροπίας των ιόντων σε στατικές συνθήκες (μια κατάσταση ισορροπίας της ανταλλαγής ιόντων περιγράφεται από το νόμο της μάζας), καθώς και τη δυναμική μέθοδο για τη μετακίνηση της ζώνης του ουσία κατά μήκος του στρώματος ρητίνης (χρωματογραφία διαλύματος).
Για την αντίδραση της ανταλλαγής ιόντων
![]()
Η σταθερά ισορροπίας είναι ίση
 , ,
| (338) |
όπου, - η συγκέντρωση ιόντων στο IONET. - τη συγκέντρωση ιόντων σε διάλυμα.
Εφαρμόζοντας ιονικά, μπορείτε να μαλακώσετε το νερό ή αφαλινάστε το αλατούχο νερό και να είστε κατάλληλοι για φαρμακευτικούς σκοπούς. Μια άλλη χρήση της προσρόφησης της ανταλλαγής ιόντων στο φαρμακείο είναι η χρήση του για αναλυτικούς σκοπούς ως μέθοδος εξαγωγής από τα μίγματα ενός ή άλλου συστατικού που αναλύεται.
Παραδείγματα προβλημάτων επίλυσης
1. Σε 60 ml ενός διαλύματος με συγκέντρωση οποιασδήποτε ουσίας, 0,440 mol / L τοποθετημένο ενεργό άνθρακα ζυγίζει 3 g. Το διάλυμα με ένα προσροφητικό αναδεύτηκε για να καθορίσει μια ισορροπία προσρόφησης, ως αποτέλεσμα της οποίας η συγκέντρωση της ουσίας μειώθηκε σε 0,350 mol / l. Υπολογίστε την τιμή προσρόφησης και τον βαθμό προσρόφησης.
Απόφαση:
Η προσρόφηση υπολογίζεται από τον τύπο (325):

Με τον τύπο (326), καθορίζει τον βαθμό προσρόφησης
2. Σύμφωνα με τα δεδομένα, για την προσρόφηση του Dimedrol στην επιφάνεια του άνθρακα, υπολογίστε τις γραφικές σταθερές της εξίσωσης Langmur:
Υπολογίστε την προσρόφηση του Dimedrol σε συγκέντρωση 3,8 mol / l.
Απόφαση:
Για να καθορίσετε γραφικά τις σταθερές της εξίσωσης Langmuir, χρησιμοποιούμε το γραμμικό σχήμα αυτής της εξίσωσης (327):
Υπολογίστε το 1 / αλλά και 1 / από:
Δημιουργήστε ένα πρόγραμμα στις συντεταγμένες 1 / αλλά – 1/από(Εικ. 83).
Σύκο. 83. Γραφικός ορισμός των σταθερών της εξίσωσης Langmur
Στην περίπτωση που το σημείο Η.\u003d 0 βρίσκεται έξω από το σχέδιο, χρησιμοποιήστε Δεύτερος τρόπος y \u003d ax + b. Πρώτον, επιλέξτε δύο σημεία που βρίσκονται στην ευθεία (Εικ. 83) και καθορίζουν τις συντεταγμένες τους:
(·) 1 (0,15, 1,11). (·) 2 (0,30 · 1,25).

b \u003d y 1 - Αξιοθέατο 1 \u003d0,11 - 0,93 · 0,15 \u003d 0,029.
Το παίρνουμε ΣΙ. = 1/αλλά ¥ \u003d 0,029 μmol / m 2, επομένως αλλά ¥ \u003d 34.48 μmol / m 2.
Σταθερή ισορροπία προσρόφησης Κ.Καθορίζεται ως εξής:
Υπολογίστε την προσρόφηση της διφρολόλης σε συγκέντρωση 3,8 mol / L από την εξίσωση Langmuir (327):
3. Κατά τη μελέτη της προσρόφησης του βενζοϊκού οξέος σε ένα στερεό προσροφητικό, τα ακόλουθα δεδομένα που ελήφθησαν:
Απόφαση:
Για τον υπολογισμό των σταθερών της εξίσωσης Freundlich, είναι απαραίτητο να χρησιμοποιηθεί η γραμμική μορφή της εξίσωσης (332), στις συντεταγμένες του LG ( x / t.) – lg. από Ισοθερμικό έχει το είδος της άμεσης.
Βρείτε τιμές LG ΝΤΟ. και LG. x / m.που περιλαμβάνεται στη γραμμικοποιημένη εξίσωση Freundlich.

| Lg. ΝΤΟ. | –2,22 | –1,6 | –1,275 | –0,928 |
| Lg. x / m. | –0,356 | –0,11 | 0,017 | 0,158 |
Δημιουργήστε ένα πρόγραμμα στις συντεταγμένες του LG ( x / t.) – lg. από(Εικ. 84) .
Σύκο. 84. Γραφικός ορισμός των σταθερών της εξίσωσης Freundlich
Από το σημείο Η.\u003d 0 που βρίσκεται έξω από την εικόνα (84), χρησιμοποιούμε Δεύτερος τρόπος Ορισμός των συντελεστών y \u003d ax + b(Βλ. "Εισαγωγικό μπλοκ. Βασικές αρχές της μαθηματικής επεξεργασίας πειραματικών δεδομένων»). Πρώτον, επιλέξτε δύο σημεία που βρίσκονται σε ευθεία γραμμή (για παράδειγμα, σημεία 1 και 2) και καθορίζουν τις συντεταγμένες τους:
(·) 1 (-2,0, -0,28). (·) 2 (-1,0 · 0,14).
Στη συνέχεια, υπολογίζουμε τον γωνιακό συντελεστή από τον τύπο:

b \u003d y. 1 - τσεκούρι. 1 = -0.28 - 0,42 · (-2,0) \u003d 0,56.
Οι σταθερές της εξίσωσης Freundlich είναι ίσες:
lg. K \u003d b \u003d0,56; Κ.= 10 0,56 = 3,63;
1/n \u003d a \u003d0,42.
Υπολογίστε την προσρόφηση του βενζοϊκού οξέος σε συγκέντρωση 0,028 mol / l χρησιμοποιώντας την εξίσωση Freundlich (330):
4. Χρησιμοποιώντας την εξίσωση στοιχημάτων, υπολογίστε την ειδική επιφάνεια του προσροφητικού σύμφωνα με τα δεδομένα σχετικά με την προσρόφηση του αέριου αζώτου:
Η περιοχή που καταλαμβάνεται από ένα μόριο αζώτου σε μια πυκνή μονοστιβάδα είναι 0,08 ηΜ2, η πυκνότητα αζώτου είναι 1,25 kg / m 3.
Απόφαση:
Η εξίσωση της πολυμερλανδικής προσρόφησης του στοιχήματος σε γραμμική μορφή έχει τη μορφή (333)
Για να δημιουργήσετε ένα γράφημα, καθορίστε τις τιμές:
Δημιουργήστε ένα πρόγραμμα σε συντεταγμένες - P / P S (Εικ. 85).
Χρησιμοποιώντας Πρώτη μέθοδος (Βλ. "Εισαγωγικό μπλοκ. Βασικά στοιχεία της μαθηματικής επεξεργασίας πειραματικών δεδομένων") Ορισμός των άμεσων συντελεστών y \u003d ax + b. Ορίζουμε την αξία του συντελεστή ΣΙ.ως ο τεταγμένος του σημείου που βρίσκεται σε άμεση, η οποία είναι η τετμημένη ίση με 0 ( Η.= 0): ΣΙ. \u003d 5. Επιλέξτε το σημείο στην ευθεία και καθορίστε τις συντεταγμένες του:
(·) 1 (0.2, 309).
Στη συνέχεια, υπολογίζουμε τον γωνιακό συντελεστή:


Σύκο. 85. Γραφικός ορισμός των σταθερών της πολυμερλανδικής προσρόφησης του στοιχήματος ισοθερμίας
Η εξίσωση σταθερών ισοθερμών του στοιχήματος πολυμερολικής προσρόφησης είναι ίση:
 ; .
; .
Επίλυση του συστήματος των εξισώσεων, πάρτε αλλά ∞ \u003d 6,6,10 -8 m 3 / kg.
Για να υπολογίσετε την οριακή τιμή της προσρόφησης, θα πάμε αλλά ∞ έως 1 mol:
 .
.
Η τιμή της συγκεκριμένης επιφάνειας του προσροφητή εντάχθηκε από τον τύπο (329):
5. Πολυστερένιο σουλφοκθειαιοϊνίτιδα σε Ν + -form Βάρος 1 g εισήχθησαν σε ένα διάλυμα KCl με μια συγκέντρωση εκκίνησης από 0 \u003d 100 EQ / M 3 Όγκος V.\u003d 50 ml και το μίγμα διατηρήθηκαν σε κατάσταση ισορροπίας. Υπολογίστε τη συγκέντρωση ισορροπίας καλίου σε ιονικό, εάν η σταθερά της ισορροπίας ανταλλαγής ιόντων \u003d 2,5 και η συνολική δεξαμενή ανταλλαγής του κατιόντος είναι pO \u003d 5 mol-eq / kg.
Απόφαση:
Για να προσδιορίσετε τη σταθερά της ανταλλαγής ιόντων, να χρησιμοποιήσετε την εξίσωση (338). Σε ρητίνη, H + ιόντα ανταλλαγή στον ισοδύναμο αριθμό ιόντων Κ.
Η μάζα της σουλφοκθιονίτιδας σε Η + -form καθορίζεται από τον τύπο (337):


Ο συνολικός αριθμός ανιόντων σε πληροφορική είναι ίση με:
Η μάζα του ανιόντος καθορίζεται επίσης από τον τύπο (337):
