Αντίδραση αλληλεπίδρασης αλουμινίου. Αλουμίνιο: χημικές ιδιότητες και ικανότητα αντίδρασης με άλλες ουσίες
Διαβάστε επίσης
Το αλουμίνιο και οι ενώσεις του
Η κύρια υποομάδα της ομάδας III του περιοδικού πίνακα αποτελείται από το βόριο (B), το αλουμίνιο (Al), το γάλλιο (Ga), το ίνδιο (In) και το θάλλιο (Tl).
Όπως φαίνεται από τα παραπάνω στοιχεία, όλα αυτά τα στοιχεία ανακαλύφθηκαν τον 19ο αιώνα.
Το βόριο είναι ένα αμέταλλο. Το αλουμίνιο είναι μέταλλο μετάπτωσης, ενώ το γάλλιο, το ίνδιο και το θάλλιο είναι μέταλλα πλήρους εμβέλειας. Έτσι, με την αύξηση των ακτίνων των ατόμων των στοιχείων κάθε ομάδας του περιοδικού πίνακα, αυξάνονται οι μεταλλικές ιδιότητες των απλών ουσιών.
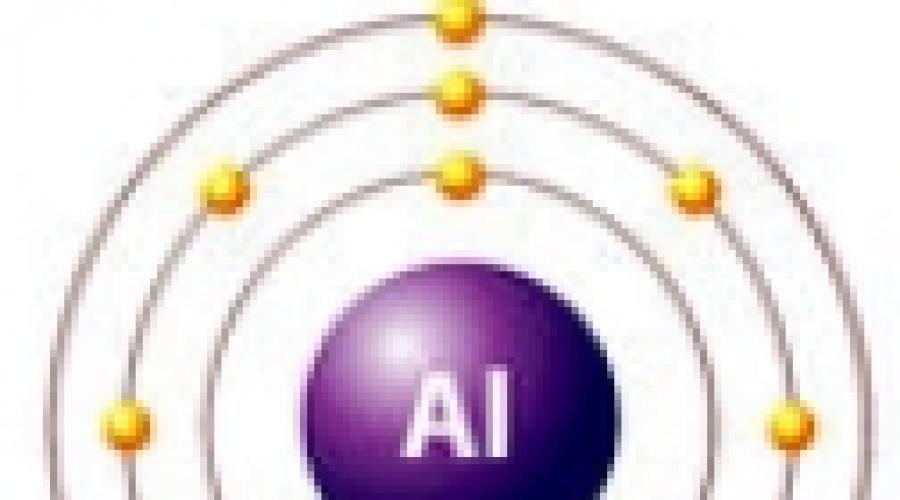
Η θέση του αλουμινίου στον πίνακα του D. I. Mendeleev. Ατομική δομή, καταστάσεις οξείδωσης
Το στοιχείο αλουμίνιο βρίσκεται στην ομάδα III, η κύρια υποομάδα «Α», περίοδος 3 του περιοδικού συστήματος, αριθμός σειράς Νο. 13, σχετική ατομική μάζα Ar(Al) = 27. Ο γείτονάς του στα αριστερά στον πίνακα είναι το μαγνήσιο - ένα τυπικό μέταλλο, και στα δεξιά - πυρίτιο - ήδη μη μέταλλο. Κατά συνέπεια, το αλουμίνιο πρέπει να παρουσιάζει ιδιότητες κάποιας ενδιάμεσης φύσης και οι ενώσεις του είναι αμφοτερικές.
Al +13) 2) 8) 3, p – στοιχείο,
| Επίγεια κατάσταση 1s 2 2s 2 2p 6 3s 2 3p 1 |
| Ενθουσιασμένη κατάσταση 1s 2 2s 2 2p 6 3s 1 3p 2 |
Το αλουμίνιο εμφανίζει κατάσταση οξείδωσης +3 σε ενώσεις:
Al 0 – 3 e - → Al +3
Φυσικές ιδιότητες
Το αλουμίνιο στην ελεύθερη του μορφή είναι ένα ασημί-λευκό μέταλλο με υψηλή θερμική και ηλεκτρική αγωγιμότητα. Το σημείο τήξης είναι 650 o C. Το αλουμίνιο έχει χαμηλή πυκνότητα (2,7 g/cm 3) - περίπου τρεις φορές μικρότερη από αυτή του σιδήρου ή του χαλκού, και ταυτόχρονα είναι ένα ανθεκτικό μέταλλο.
Όντας στη φύση
Ως προς τον επιπολασμό στη φύση, κατατάσσεται 1ος μεταξύ μετάλλων και 3ος μεταξύ στοιχείων, δεύτερο μόνο μετά το οξυγόνο και το πυρίτιο. Το ποσοστό περιεκτικότητας σε αλουμίνιο στον φλοιό της γης, σύμφωνα με διάφορους ερευνητές, κυμαίνεται από 7,45 έως 8,14% της μάζας του φλοιού της γης.
Στη φύση, το αλουμίνιο εμφανίζεται μόνο σε ενώσεις(μεταλλικά στοιχεία).
Μερικοί από αυτούς:
· Βωξίτης - Al 2 O 3 H 2 O (με προσμίξεις SiO 2, Fe 2 O 3, CaCO 3)
· Νεφελίνες - KNa 3 4
Αλουνίτες - KAl(SO 4) 2 2Al(OH) 3
· Αλουμίνα (μείγματα καολίνων με άμμο SiO 2, ασβεστόλιθος CaCO 3, μαγνησίτης MgCO 3)
Κορούνδιο - Al 2 O 3 (ρουμπίνι, ζαφείρι)
· Άστριος (ορθόκλος) - K 2 O×Al 2 O 3 × 6SiO 2
Καολινίτης - Al 2 O 3 × 2SiO 2 × 2H 2 O
Αλουνίτης - (Na,K) 2 SO 4 ×Al 2 (SO 4) 3 × 4Al(OH) 3
· Βηρύλιο - 3BeO Al 2 O 3 6SiO 2
Χημικές ιδιότητες του αλουμινίου και των ενώσεων του
Το αλουμίνιο αντιδρά εύκολα με το οξυγόνο υπό κανονικές συνθήκες και είναι επικαλυμμένο με μια μεμβράνη οξειδίου (που του δίνει μια ματ εμφάνιση).
Το πάχος του είναι 0,00001 mm, αλλά χάρη σε αυτό, το αλουμίνιο δεν διαβρώνεται. Για να μελετηθούν οι χημικές ιδιότητες του αλουμινίου, αφαιρείται το φιλμ οξειδίου. (Χρησιμοποιώντας γυαλόχαρτο ή χημικά: πρώτα βυθίστε το σε αλκαλικό διάλυμα για να αφαιρέσετε το φιλμ οξειδίου και μετά σε διάλυμα αλάτων υδραργύρου για να σχηματίσετε ένα κράμα αλουμινίου με υδράργυρο - αμάλγαμα).
ΟΡΙΣΜΟΣ
Αλουμίνιο– χημικό στοιχείο της 3ης περιόδου της ομάδας ΙΙΙΑ. Αύξων αριθμός – 13. Μεταλλ. Το αλουμίνιο ανήκει στα στοιχεία της οικογένειας p. Σύμβολο – Αλ.
Ατομική μάζα - 27 amu. Η ηλεκτρονική διαμόρφωση του εξωτερικού επιπέδου ενέργειας είναι 3s 2 3p 1. Στις ενώσεις του, το αλουμίνιο εμφανίζει κατάσταση οξείδωσης «+3».
Χημικές ιδιότητες του αλουμινίου
Το αλουμίνιο παρουσιάζει αναγωγικές ιδιότητες στις αντιδράσεις. Δεδομένου ότι ένα φιλμ οξειδίου σχηματίζεται στην επιφάνειά του όταν εκτίθεται στον αέρα, είναι ανθεκτικό στην αλληλεπίδραση με άλλες ουσίες. Για παράδειγμα, το αλουμίνιο παθητικοποιείται σε νερό, πυκνό νιτρικό οξύ και διάλυμα διχρωμικού καλίου. Ωστόσο, μετά την αφαίρεση του φιλμ οξειδίου από την επιφάνειά του, είναι σε θέση να αλληλεπιδράσει με απλές ουσίες. Οι περισσότερες αντιδράσεις συμβαίνουν όταν θερμαίνονται:
2Al σκόνη +3/2O 2 = Al 2 O 3;
2Al + 3F 2 = 2AlF 3 (t);
2Al σκόνη + 3Hal 2 = 2AlHal 3 (t = 25C);
2Al + N2 = 2AlN (t);
2Al +3S = Al 2 S 3 (t);
4Al + 3C γραφίτης = Al 4 C 3 (t);
4Al + P 4 = 4AlP (t, σε ατμόσφαιρα Η 2).
Επίσης, μετά την αφαίρεση του φιλμ οξειδίου από την επιφάνειά του, το αλουμίνιο μπορεί να αλληλεπιδράσει με το νερό για να σχηματίσει υδροξείδιο:
2Al + 6H 2 O = 2Al(OH) 3 + 3H2.
Το αλουμίνιο παρουσιάζει επαμφοτερίζουσες ιδιότητες, επομένως είναι σε θέση να διαλύεται σε αραιά διαλύματα οξέων και αλκαλίων:
2Al + 3H 2 SO 4 (αραιό) = Al 2 (SO 4) 3 + 3H 2;
2Al + 6HCl αραιό = 2AlCl 3 + 3 H 2 ;
8Al + 30HNO3 (αραιό) = 8Al(NO 3) 3 + 3N 2 O + 15H 2 O;
2Al +2NaOH +3H2O = 2Na + 3H2;
2Al + 2(NaOH×H 2 O) = 2NaAlO 2 + 3 H 2.
Η αλουμινοθερμία είναι μια μέθοδος παραγωγής μετάλλων από τα οξείδια τους, που βασίζεται στην αναγωγή αυτών των μετάλλων με αλουμίνιο:
8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe;
2Al + Cr 2 O 3 = Al 2 O 3 + 2Cr.
Φυσικές ιδιότητες του αλουμινίου
Το αλουμίνιο είναι ένα ασημί-λευκό χρώμα. Οι κύριες φυσικές ιδιότητες του αλουμινίου είναι η ελαφρότητα, η υψηλή θερμική και ηλεκτρική αγωγιμότητα. Στην ελεύθερη κατάσταση, όταν εκτίθεται στον αέρα, το αλουμίνιο καλύπτεται με ένα ανθεκτικό φιλμ οξειδίου Al 2 O 3, το οποίο το καθιστά ανθεκτικό στη δράση των συμπυκνωμένων οξέων. Σημείο τήξεως – 660,37 C, σημείο βρασμού – 2500 C.
Παραγωγή και χρήση αλουμινίου
Το αλουμίνιο παράγεται με ηλεκτρόλυση του τηγμένου οξειδίου αυτού του στοιχείου:
2Al 2 O 3 = 4Al + 3O 2
Ωστόσο, λόγω της χαμηλής απόδοσης του προϊόντος, χρησιμοποιείται συχνότερα η μέθοδος παραγωγής αλουμινίου με ηλεκτρόλυση μείγματος Na 3 και Al 2 O 3. Η αντίδραση γίνεται όταν θερμανθεί στους 960C και παρουσία καταλυτών - φθοριδίων (AlF 3, CaF 2, κ.λπ.), ενώ η απελευθέρωση αλουμινίου συμβαίνει στην κάθοδο, και απελευθερώνεται οξυγόνο στην άνοδο.
Το αλουμίνιο έχει βρει ευρεία εφαρμογή στη βιομηχανία Τα κράματα με βάση το αλουμίνιο είναι τα κύρια δομικά υλικά στα αεροσκάφη και τη ναυπηγική.
Παραδείγματα επίλυσης προβλημάτων
ΠΑΡΑΔΕΙΓΜΑ 1
| Ασκηση | Όταν το αλουμίνιο αντέδρασε με το θειικό οξύ, σχηματίστηκε θειικό αργίλιο βάρους 3,42 g. Προσδιορίστε τη μάζα και την ποσότητα της ουσίας αλουμινίου που αντέδρασε. |
| Λύση | Ας γράψουμε την εξίσωση αντίδρασης: 2Al + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2. Μοριακές μάζες αλουμινίου και θειικού αλουμινίου, υπολογισμένες με βάση τον πίνακα χημικών στοιχείων του D.I. Mendeleev – 27 και 342 g/mol, αντίστοιχα. Τότε, η ποσότητα της ουσίας του σχηματιζόμενου θειικού αργιλίου θα είναι ίση με: n(Al2 (SO4) 3) = m(Al2 (SO4) 3) / M(Al2 (SO4) 3); n(Al 2 (SO 4) 3) = 3,42 / 342 = 0,01 mol. Σύμφωνα με την εξίσωση αντίδρασης n(Al 2 (SO 4) 3): n(Al) = 1:2, επομένως n(Al) = 2×n(Al 2 (SO 4) 3) = 0,02 mol. Τότε, η μάζα του αλουμινίου θα είναι ίση με: m(Al) = n(Al)×M(Al); m(Al) = 0,02×27 = 0,54 g. |
| Απάντηση | Η ποσότητα της ουσίας αλουμινίου είναι 0,02 mol. μάζα αλουμινίου – 0,54 g. |
- Ονομασία - Al (Αλουμίνιο);
- Περίοδος - III;
- Ομάδα - 13 (IIIa);
- Ατομική μάζα - 26,981538;
- Ατομικός αριθμός - 13;
- Ατομική ακτίνα = 143 μ.μ.
- Ομοιοπολική ακτίνα = 121 μ.μ.
- Κατανομή ηλεκτρονίων - 1s 2 2s 2 2p 6 3s 2 3p 1 ;
- θερμοκρασία τήξης = 660°C;
- σημείο βρασμού = 2518°C;
- Ηλεκτραρνητικότητα (σύμφωνα με τον Pauling/σύμφωνα με τους Alpred και Rochow) = 1,61/1,47;
- Κατάσταση οξείδωσης: +3,0;
- Πυκνότητα (αρ.) = 2,7 g/cm3;
- Μοριακός όγκος = 10,0 cm 3 /mol.
Το αλουμίνιο (στυπτηρία) αποκτήθηκε για πρώτη φορά το 1825 από τον Δανό G. K. Oersted. Αρχικά, πριν την ανακάλυψη μιας βιομηχανικής μεθόδου παραγωγής, το αλουμίνιο ήταν πιο ακριβό από τον χρυσό.
Το αλουμίνιο είναι το πιο άφθονο μέταλλο στον φλοιό της γης (το κλάσμα μάζας είναι 7-8%) και το τρίτο πιο άφθονο από όλα τα στοιχεία μετά το οξυγόνο και το πυρίτιο. Το αλουμίνιο δεν βρίσκεται σε ελεύθερη μορφή στο proirod.
Οι πιο σημαντικές φυσικές ενώσεις αλουμινίου:
- αργιλοπυριτικά - Na 2 O Al 2 O 3 2SiO 2 ; K 2 O Al 2 O 3 2SiO 2
- βωξίτης - Al 2 O 3 · n H2O
- κορούνδιο - Al 2 O 3
- κρυόλιθος - 3NaF AlF 3

Ρύζι. Δομή του ατόμου αλουμινίου.
Το αλουμίνιο είναι ένα χημικά ενεργό μέταλλο - στο εξωτερικό του ηλεκτρονικό επίπεδο υπάρχουν τρία ηλεκτρόνια που συμμετέχουν στο σχηματισμό ομοιοπολικών δεσμών όταν το αλουμίνιο αλληλεπιδρά με άλλα χημικά στοιχεία (βλ. Ομοιοπολικός δεσμός). Το αλουμίνιο είναι ένας ισχυρός αναγωγικός παράγοντας και εμφανίζει κατάσταση οξείδωσης +3 σε όλες τις ενώσεις.
Σε θερμοκρασία δωματίου, το αλουμίνιο αντιδρά με το οξυγόνο που περιέχεται στον ατμοσφαιρικό αέρα για να σχηματίσει ένα ισχυρό φιλμ οξειδίου, το οποίο αποτρέπει αξιόπιστα τη διαδικασία περαιτέρω οξείδωσης (διάβρωσης) του μετάλλου, με αποτέλεσμα να μειώνεται η χημική δραστηριότητα του αλουμινίου.
Χάρη στο φιλμ οξειδίου, το αλουμίνιο δεν αντιδρά με το νιτρικό οξύ σε θερμοκρασία δωματίου, επομένως, τα μαγειρικά σκεύη αλουμινίου είναι ένα αξιόπιστο δοχείο για την αποθήκευση και τη μεταφορά νιτρικού οξέος.
Φυσικές ιδιότητες του αλουμινίου:
- ασημί-λευκό μέταλλο?
- στερεός;
- διαρκής;
- Ανετα;
- πλαστικό (τεντωμένο σε λεπτό σύρμα και φύλλο).
- έχει υψηλή ηλεκτρική και θερμική αγωγιμότητα.
- Σημείο τήξεως 660°C
- το φυσικό αλουμίνιο αποτελείται από ένα ισότοπο 27 13 Al
Χημικές ιδιότητες του αλουμινίου:
- κατά την αφαίρεση του φιλμ οξειδίου, το αλουμίνιο αντιδρά με το νερό:
2Al + 6H2O = 2Al(OH) 3 + 3H2; - σε θερμοκρασία δωματίου αντιδρά με βρώμιο και χλώριο σχηματίζοντας άλατα:
2Al + 3Br 2 = 2AlCl 3; - σε υψηλές θερμοκρασίες, το αλουμίνιο αντιδρά με οξυγόνο και θείο (η αντίδραση συνοδεύεται από την απελευθέρωση μεγάλης ποσότητας θερμότητας):
4Al + 3O 2 = 2Al 2 O 3 + Q;
2Al + 3S = Al 2 S 3 + Q; - σε t=800°C αντιδρά με άζωτο:
2Al + N 2 = 2AlN; - σε t=2000°C αντιδρά με άνθρακα:
2Al + 3C = Al 4 C 3; - μειώνει πολλά μέταλλα από τα οξείδια τους - αλουμινοθερμία(σε θερμοκρασίες έως 3000°C) βολφράμιο, βανάδιο, τιτάνιο, ασβέστιο, χρώμιο, σίδηρος, μαγγάνιο παράγονται βιομηχανικά:
8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe; - αντιδρά με υδροχλωρικό και αραιό θειικό οξύ για να απελευθερώσει υδρογόνο:
2Al + 6HCl = 2AlCl3 + 3H2;
2Al + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2; - αντιδρά με πυκνό θειικό οξύ σε υψηλή θερμοκρασία:
2Al + 6H 2 SO 4 = Al 2 (SO 4) 3 + 3SO 2 + 6H 2 O; - αντιδρά με αλκάλια με την απελευθέρωση υδρογόνου και το σχηματισμό σύνθετων αλάτων - η αντίδραση λαμβάνει χώρα σε διάφορα στάδια: όταν το αλουμίνιο βυθίζεται σε ένα αλκαλικό διάλυμα, το ανθεκτικό προστατευτικό φιλμ οξειδίου που βρίσκεται στην επιφάνεια του μετάλλου διαλύεται. Αφού διαλυθεί η μεμβράνη, το αλουμίνιο, ως ενεργό μέταλλο, αντιδρά με το νερό για να σχηματίσει υδροξείδιο του αργιλίου, το οποίο αντιδρά με το αλκάλιο ως αμφοτερικό υδροξείδιο:
- Al2O3 +2NaOH = 2NaAlO2 +H2O - διάλυση του φιλμ οξειδίου.
- 2Al+6H2O = 2Al(OH) 3 +3H2 - αλληλεπίδραση αλουμινίου με νερό για σχηματισμό υδροξειδίου του αργιλίου.
- NaOH+Al(OH) 3 = NaAlO 2 + 2H 2 O - αλληλεπίδραση υδροξειδίου του αργιλίου με αλκάλια
- 2Al+2NaOH+2H 2 O = 2NaAlO 2 +3H 2 - η συνολική εξίσωση για την αντίδραση του αλουμινίου με το αλκάλιο.
Συνδέσεις αλουμινίου
Al 2 O 3 (αλουμίνα)
Οξείδιο του αλουμινίουΤο Al 2 O 3 είναι μια λευκή, πολύ πυρίμαχη και σκληρή ουσία (στη φύση, μόνο το διαμάντι, το καρβορούνδιο και η βοραζόνη είναι πιο σκληρά).
Ιδιότητες αλουμίνας:
- δεν διαλύεται στο νερό και αντιδρά με αυτό.
- είναι μια αμφοτερική ουσία, που αντιδρά με οξέα και αλκάλια:
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O;
Al 2 O 3 + 6NaOH + 3H 2 O = 2Na 3; - πώς αντιδρά ένα αμφοτερικό οξείδιο όταν συντήκεται με οξείδια μετάλλων και άλατα για να σχηματίσει αργιλικά:
Al 2 O 3 + K 2 O = 2KAlO 2.
Στη βιομηχανία, η αλουμίνα λαμβάνεται από βωξίτη. Σε εργαστηριακές συνθήκες, η αλουμίνα μπορεί να ληφθεί με την καύση αλουμινίου σε οξυγόνο:
4Al + 3O 2 = 2Al 2 O 3.
Εφαρμογές Αλουμίνας:
- για την παραγωγή αλουμινίου και ηλεκτρικών κεραμικών.
- ως λειαντικό και πυρίμαχο υλικό.
- ως καταλύτης σε αντιδράσεις οργανικής σύνθεσης.
Al(OH) 3
Υδροξείδιο αργιλίουΤο Al(OH) 3 είναι ένα λευκό κρυσταλλικό στερεό που λαμβάνεται ως αποτέλεσμα μιας αντίδρασης ανταλλαγής από ένα διάλυμα υδροξειδίου του αργιλίου - καθιζάνει ως λευκό ζελατινώδες ίζημα που κρυσταλλώνεται με την πάροδο του χρόνου. Αυτή η αμφοτερική ένωση είναι σχεδόν αδιάλυτη στο νερό:
Al(OH) 3 + 3NaOH = Na 3;
Al(OH) 3 + 3HCl = AlCl 3 + 3H 2 O.
- αλληλεπίδραση Al(OH) 3 με οξέα:
Al(OH) 3 +3H + Cl = Al 3+ Cl 3 +3H 2 O - αλληλεπίδραση Al(OH) 3 με αλκάλια:
Al(OH) 3 +NaOH - = NaAlO 2 - +2H 2 O
Το υδροξείδιο του αργιλίου λαμβάνεται από τη δράση αλκαλίων σε διαλύματα αλάτων αλουμινίου:
AlCl 3 + 3NaOH = Al(OH) 3 + 3NaCl.
Παραγωγή και χρήση αλουμινίου
Το αλουμίνιο είναι αρκετά δύσκολο να απομονωθεί από φυσικές ενώσεις με χημικά μέσα, γεγονός που εξηγείται από την υψηλή αντοχή των δεσμών στο οξείδιο του αλουμινίου, επομένως, για τη βιομηχανική παραγωγή αλουμινίου, η ηλεκτρόλυση ενός διαλύματος αλουμίνας Al 2 O 3 σε τετηγμένο κρυόλιθο Na 3. Χρησιμοποιείται το AlF 6. Ως αποτέλεσμα της διαδικασίας, το αλουμίνιο απελευθερώνεται στην κάθοδο και το οξυγόνο απελευθερώνεται στην άνοδο:
2Al 2 O 3 → 4Al + 3O 2
Η πρώτη ύλη είναι ο βωξίτης. Η ηλεκτρόλυση λαμβάνει χώρα σε θερμοκρασία 1000°C: το σημείο τήξης του οξειδίου του αλουμινίου είναι 2500°C - δεν είναι δυνατό να πραγματοποιηθεί ηλεκτρόλυση σε αυτή τη θερμοκρασία, επομένως το οξείδιο του αλουμινίου διαλύεται σε λιωμένο κρυόλιθο και μόνο τότε χρησιμοποιείται ο προκύπτων ηλεκτρολύτης στην ηλεκτρόλυση για την παραγωγή αλουμινίου.
Εφαρμογή αλουμινίου:
- Τα κράματα αλουμινίου χρησιμοποιούνται ευρέως ως δομικά υλικά στην αυτοκινητοβιομηχανία, τα αεροσκάφη και τη ναυπηγική βιομηχανία: duralumin, silumin, aluminum bronze.
- στη χημική βιομηχανία ως αναγωγικό μέσο·
- στη βιομηχανία τροφίμων για την παραγωγή φύλλου, επιτραπέζιων σκευών, υλικών συσκευασίας.
- για την κατασκευή συρμάτων κ.λπ.
Αλουμίνιοαπομονώθηκε για πρώτη φορά στην καθαρή του μορφή από τον Friedrich Wöhler. Ένας Γερμανός χημικός θέρμανε το άνυδρο χλωρίδιο του στοιχείου με μέταλλο καλίου. Αυτό συνέβη στο 2ο μισό του 19ου αιώνα. Μέχρι τον 20ο αιώνα κιλά αλουμινίουκοστίζει περισσότερο.
Μόνο οι πλούσιοι και κρατικοί μπορούσαν να αντέξουν οικονομικά το νέο μέταλλο. Ο λόγος για το υψηλό κόστος είναι η δυσκολία διαχωρισμού του αλουμινίου από άλλες ουσίες. Μια μέθοδος για την εξαγωγή του στοιχείου σε βιομηχανική κλίμακα προτάθηκε από τον Charles Hall.
Το 1886, διέλυσε το οξείδιο σε λιωμένο κρυόλιθο. Ο Γερμανός έκλεισε το μείγμα σε ένα γρανιτένιο δοχείο και του συνέδεσε ηλεκτρικό ρεύμα. Πλάκες από καθαρό μέταλλο κατακάθισαν στον πάτο του δοχείου.
Χημικές και φυσικές ιδιότητες του αλουμινίου
Τι αλουμίνιο;Ασημί λευκό, γυαλιστερό. Επομένως, ο Friedrich Wöhler συνέκρινε τους μεταλλικούς κόκκους με τους οποίους έλαβε. Υπήρχε όμως μια προειδοποίηση: το αλουμίνιο είναι πολύ ελαφρύτερο.
Η πλαστικότητα είναι κοντά στο πολύτιμο και. Το αλουμίνιο είναι μια ουσία, τραβιέται εύκολα σε λεπτό σύρμα και φύλλα. Απλά θυμηθείτε το αλουμινόχαρτο. Είναι κατασκευασμένο με βάση το 13ο στοιχείο.
Το αλουμίνιο είναι ελαφρύ λόγω της χαμηλής του πυκνότητας. Είναι τρεις φορές μικρότερο από αυτό του σιδήρου. Ταυτόχρονα, η δύναμη του 13ου στοιχείου είναι σχεδόν εξίσου καλή.
Αυτός ο συνδυασμός έχει καταστήσει το ασήμι απαραίτητο στη βιομηχανία, για παράδειγμα, στην παραγωγή ανταλλακτικών αυτοκινήτων. Μιλάμε και για βιοτεχνική παραγωγή, γιατί συγκόλληση αλουμινίουδυνατό ακόμη και στο σπίτι.

Φόρμουλα αλουμινίουσας επιτρέπει να αντανακλάτε ενεργά το φως, αλλά και τις ακτίνες θερμότητας. Η ηλεκτρική αγωγιμότητα του στοιχείου είναι επίσης υψηλή. Το κύριο πράγμα είναι να μην το ζεστάνετε πολύ. Θα λιώσει στους 660 βαθμούς. Αν η θερμοκρασία ανέβει λίγο παραπάνω, θα καεί.
Το μέταλλο θα εξαφανιστεί, μόνο οξείδιο του αλουμινίου. Σχηματίζεται επίσης υπό τυπικές συνθήκες, αλλά μόνο με τη μορφή επιφανειακής μεμβράνης. Προστατεύει το μέταλλο. Ως εκ τούτου, αντιστέκεται καλά στη διάβρωση, επειδή η πρόσβαση στο οξυγόνο είναι αποκλεισμένη.
Το φιλμ οξειδίου προστατεύει επίσης το μέταλλο από το νερό. Εάν αφαιρέσετε την πλάκα από την επιφάνεια του αλουμινίου, θα ξεκινήσει μια αντίδραση με H 2 O Η απελευθέρωση αερίων υδρογόνου θα συμβεί ακόμη και σε θερμοκρασία δωματίου. Ετσι, σκάφος αλουμινίουδεν μετατρέπεται σε καπνό μόνο λόγω της μεμβράνης οξειδίου και της προστατευτικής βαφής που εφαρμόζεται στο κύτος του πλοίου.
Πιο δραστήρια αλληλεπίδραση αλουμινίουμε αμέταλλα. Αντιδράσεις με βρώμιο και χλώριο λαμβάνουν χώρα ακόμη και υπό κανονικές συνθήκες. Ως αποτέλεσμα, σχηματίζονται άλατα αλουμινίου. Τα άλατα υδρογόνου λαμβάνονται με συνδυασμό του 13ου στοιχείου με όξινα διαλύματα. Η αντίδραση θα γίνει επίσης με αλκάλια, αλλά μόνο μετά την αφαίρεση του φιλμ οξειδίου. Θα απελευθερωθεί καθαρό υδρογόνο.
Εφαρμογή αλουμινίου
Το μέταλλο ψεκάζεται στους καθρέφτες. Οι υψηλές τιμές ανάκλασης φωτός είναι χρήσιμες. Η διαδικασία λαμβάνει χώρα υπό συνθήκες κενού. Κατασκευάζουν όχι μόνο τυπικούς καθρέφτες, αλλά και αντικείμενα με επιφάνειες καθρέφτη. Αυτά περιλαμβάνουν: κεραμικά πλακίδια, οικιακές συσκευές, λάμπες.

Ντουέτο αλουμίνιο-χαλκό– η βάση είναι ντουραλουμίν. Ονομάζεται απλά duralumin. Προσθέστε ως ποιότητα. Η σύνθεση είναι 7 φορές ισχυρότερη από το καθαρό αλουμίνιο, επομένως, είναι κατάλληλο για μηχανολογία και κατασκευή αεροσκαφών.
Ο χαλκός δίνει στο 13ο στοιχείο δύναμη, αλλά όχι βαρύτητα. Το Dural παραμένει 3 φορές ελαφρύτερο από το σίδηρο. Μικρό μάζα αλουμινίου– εγγύηση ελαφρότητας αυτοκινήτων, αεροπλάνων, πλοίων. Αυτό απλοποιεί τη μεταφορά και τη λειτουργία και μειώνει την τιμή των προϊόντων.
Αγοράστε αλουμίνιοΟι αυτοκινητοβιομηχανίες είναι επίσης ενθουσιώδεις επειδή τα κράματά του μπορούν εύκολα να επικαλυφθούν με προστατευτικές και διακοσμητικές ενώσεις. Η βαφή εφαρμόζεται πιο γρήγορα και πιο ομοιόμορφα από ό,τι σε χάλυβα και πλαστικό.
Ταυτόχρονα, τα κράματα είναι ελατά και εύκολα στην επεξεργασία. Αυτό είναι πολύτιμο, δεδομένου του όγκου των στροφών και των σχεδιαστικών μεταβάσεων στα σύγχρονα μοντέλα αυτοκινήτων.
Το 13ο στοιχείο δεν είναι μόνο εύκολο να βαφτεί, αλλά μπορεί επίσης να λειτουργήσει ως βαφή. Αγορά στην κλωστοϋφαντουργία θειικό αλουμίνιο. Είναι επίσης χρήσιμο στην εκτύπωση, όπου απαιτούνται αδιάλυτες χρωστικές.

αναρωτιέμαι τι λύσηθειικό άλας αλουμίνιοΧρησιμοποιούνται επίσης για τον καθαρισμό του νερού. Παρουσία του «παράγοντα», οι επιβλαβείς ακαθαρσίες καθιζάνουν και εξουδετερώνονται.
Εξουδετερώνει το 13ο στοιχείο και τα οξέα. Ιδιαίτερα καλός σε αυτόν τον ρόλο υδροξείδιο αργιλίου. Εκτιμάται στη φαρμακολογία και την ιατρική, προσθέτοντάς το στα φάρμακα για την καούρα.
Το υδροξείδιο συνταγογραφείται επίσης για έλκη και φλεγμονώδεις διεργασίες του εντερικού σωλήνα. Άρα το φάρμακο κυκλοφορεί και στα φαρμακεία αλουμίνιο. Οξύστο στομάχι - ένας λόγος για να μάθετε περισσότερα για τέτοια φάρμακα.
Στην ΕΣΣΔ κόπηκε επίσης μπρούντζος με προσθήκη 11% αλουμινίου. Οι ονομασίες των πινακίδων είναι 1, 2 και 5 καπίκια. Άρχισαν να το παράγουν το 1926 και το τελείωσαν το 1957. Όμως η παραγωγή κονσερβών αλουμινίου για κονσέρβες δεν έχει σταματήσει.
Μαγειρευτά κρέατα, σάουρι και άλλα τουριστικά πρωινά εξακολουθούν να συσκευάζονται σε δοχεία με βάση το 13ο στοιχείο. Τέτοια βάζα δεν αντιδρούν ταυτόχρονα με τα τρόφιμα, είναι ελαφριά και φθηνά.
Η σκόνη αλουμινίου είναι μέρος πολλών εκρηκτικών μειγμάτων, συμπεριλαμβανομένων των πυροτεχνικών. Η βιομηχανία χρησιμοποιεί μηχανισμούς ανατίναξης με βάση το τρινιτροτολουόλιο και το θρυμματισμένο στοιχείο 13. Ένα ισχυρό εκρηκτικό λαμβάνεται επίσης με την προσθήκη νιτρικού αμμωνίου στο αλουμίνιο.

Στη βιομηχανία πετρελαίου είναι απαραίτητο χλωριούχο αργίλιο. Παίζει το ρόλο του καταλύτη στην αποσύνθεση της οργανικής ύλης σε κλάσματα. Το λάδι έχει την ιδιότητα να απελευθερώνει αέριους, ελαφρούς υδρογονάνθρακες τύπου βενζίνης, που αλληλεπιδρούν με το χλωρίδιο του 13ου μετάλλου. Το αντιδραστήριο πρέπει να είναι άνυδρο. Μετά την προσθήκη χλωρίου, το μείγμα θερμαίνεται στους 280 βαθμούς Κελσίου.
Στις κατασκευές ανακατεύω συχνά νάτριοΚαι αλουμίνιο. Αποδεικνύεται ότι είναι πρόσθετο στο σκυρόδεμα. Το αργιλικό νάτριο επιταχύνει τη σκλήρυνσή του επιταχύνοντας την ενυδάτωση.
Ο ρυθμός μικροκρυστάλλωσης αυξάνεται, πράγμα που σημαίνει ότι αυξάνεται η αντοχή και η σκληρότητα του σκυροδέματος. Επιπλέον, το αργιλικό νάτριο εξοικονομεί τον οπλισμό που βρίσκεται στο διάλυμα από τη διάβρωση.
Εξόρυξη αλουμινίου
Το μέταλλο κλείνει τις πρώτες τρεις πιο συνηθισμένες στη γη. Αυτό εξηγεί τη διαθεσιμότητα και την ευρεία χρήση του. Ωστόσο, η φύση δεν δίνει το στοιχείο στον άνθρωπο στην καθαρή του μορφή. Το αλουμίνιο πρέπει να διαχωριστεί από διάφορες ενώσεις. Το 13ο στοιχείο είναι πιο άφθονο στον βωξίτη. Πρόκειται για πετρώματα που μοιάζουν με πηλό, συγκεντρωμένα κυρίως στην τροπική ζώνη.

Ο βωξίτης συνθλίβεται, στη συνέχεια ξηραίνεται, συνθλίβεται ξανά και αλέθεται παρουσία μικρού όγκου νερού. Αποδεικνύεται ότι είναι μια παχιά μάζα. Θερμαίνεται με ατμό. Ταυτόχρονα, το μεγαλύτερο μέρος του, του οποίου ο βωξίτης δεν είναι επίσης φτωχός, εξατμίζεται. Αυτό που μένει είναι το οξείδιο του 13ου μετάλλου.
Τοποθετείται σε βιομηχανικά λουτρά. Περιέχουν ήδη λιωμένο κρυόλιθο. Η θερμοκρασία διατηρείται γύρω στους 950 βαθμούς Κελσίου. Απαιτείται επίσης ηλεκτρικό ρεύμα τουλάχιστον 400 kA. Δηλαδή, χρησιμοποιείται ηλεκτρόλυση, όπως ακριβώς πριν από 200 χρόνια, όταν το στοιχείο απομονώθηκε από τον Τσαρλς Χολ.
Περνώντας μέσα από ένα θερμό διάλυμα, το ρεύμα σπάει τους δεσμούς μεταξύ του μετάλλου και του οξυγόνου. Ως αποτέλεσμα, το κάτω μέρος του μπάνιου παραμένει καθαρό αλουμίνιο. Αντιδράσειςπεπερασμένος. Η διαδικασία ολοκληρώνεται με τη χύτευση από το ίζημα και την αποστολή του στον καταναλωτή ή τη χρήση του για το σχηματισμό διαφόρων κραμάτων.
Η κύρια παραγωγή αλουμινίου βρίσκεται στον ίδιο χώρο με τα κοιτάσματα βωξίτη. Στο προσκήνιο - Γουινέα. Σχεδόν 8.000.000 τόνοι του 13ου στοιχείου είναι κρυμμένοι στα βάθη του. Η Αυστραλία βρίσκεται στη 2η θέση με δείκτη 6.000.000 Στη Βραζιλία, το αλουμίνιο είναι ήδη 2 φορές λιγότερο. Τα παγκόσμια αποθέματα υπολογίζονται σε 29.000.000 τόνους.
Τιμή αλουμινίου
Για έναν τόνο αλουμινίου ζητούν σχεδόν 1.500 δολάρια. Αυτά είναι τα στοιχεία από τα χρηματιστήρια μη σιδηρούχων μετάλλων στις 20 Ιανουαρίου 2016. Το κόστος καθορίζεται κυρίως από βιομήχανους. Πιο συγκεκριμένα, η τιμή του αλουμινίου επηρεάζεται από τη ζήτησή τους για πρώτες ύλες. Επηρεάζει επίσης τις απαιτήσεις των προμηθευτών και το κόστος της ηλεκτρικής ενέργειας, γιατί η παραγωγή του 13ου στοιχείου είναι ενεργοβόρα.
Για το αλουμίνιο ορίζονται διαφορετικές τιμές. Πάει στο χυτήριο. Το κόστος ανακοινώνεται ανά κιλό και έχει σημασία η φύση του υλικού που παραδίδεται.
Έτσι, για ηλεκτρικό μέταλλο δίνουν περίπου 70 ρούβλια. Για αλουμίνιο ποιότητας τροφίμων μπορείτε να πάρετε 5-10 ρούβλια λιγότερα. Το ίδιο πληρώνουν για μέταλλο κινητήρα. Εάν νοικιάσετε μια μικτή ποικιλία, η τιμή της είναι 50-55 ρούβλια ανά κιλό.

Το φθηνότερο είδος σκραπ είναι τα ρινίσματα αλουμινίου. Μπορείτε να πάρετε μόνο 15-20 ρούβλια για αυτό. Θα δώσουν λίγο παραπάνω για το 13ο στοιχείο. Αυτό αναφέρεται σε δοχεία για ποτά και κονσερβοποιημένα τρόφιμα.
Τα θερμαντικά σώματα αλουμινίου δεν εκτιμώνται επίσης ιδιαίτερα. Η τιμή ανά κιλό σκραπ είναι περίπου 30 ρούβλια. Αυτοί είναι μέσοι όροι. Σε διαφορετικές περιοχές, σε διαφορετικά σημεία, το αλουμίνιο γίνεται δεκτό πιο ακριβά ή φθηνότερα. Συχνά το κόστος των υλικών εξαρτάται από τους όγκους που παραδίδονται.
Γύρω στο 1807, ο Davy, ο οποίος προσπαθούσε να πραγματοποιήσει την ηλεκτρόλυση της αλουμίνας, έδωσε το όνομα στο μέταλλο που υποτίθεται ότι την περιείχε, Αλουμίνιο. Το αλουμίνιο λήφθηκε για πρώτη φορά από τον Hans Oersted το 1825 με τη δράση του αμαλγάματος καλίου σε χλωριούχο αλουμίνιο που ακολουθήθηκε από απόσταξη υδραργύρου. Το 1827, ο Wöhler απομόνωσε το μέταλλο αλουμινίου με πιο αποτελεσματικό τρόπο - θερμαίνοντας άνυδρο χλωριούχο αλουμίνιο με μέταλλο κάλιο.
Όντας στη φύση, λαμβάνοντας:
Από την άποψη της επικράτησης στη φύση, κατατάσσεται 1η μεταξύ των μετάλλων και 3η μεταξύ των στοιχείων, δεύτερη μόνο μετά το οξυγόνο και το πυρίτιο. Η περιεκτικότητα σε αλουμίνιο στον φλοιό της γης, σύμφωνα με διάφορους ερευνητές, κυμαίνεται από 7,45% έως 8,14% της μάζας του φλοιού της γης. Στη φύση, το αλουμίνιο βρίσκεται μόνο σε ενώσεις (ορυκτά).
Κορούνδιο: Al 2 O 3 - ανήκει στην κατηγορία των απλών οξειδίων και μερικές φορές σχηματίζει διαφανείς πολύτιμους κρυστάλλους - ζαφείρι και, με την προσθήκη χρωμίου, ρουμπίνι. Συσσωρεύεται σε τοποθετητές.
Βωξίτης: Al 2 O 3 *nH 2 O - ιζηματογενή μεταλλεύματα αλουμινίου. Περιέχουν μια επιβλαβή ακαθαρσία - SiO 2. Ο βωξίτης χρησιμεύει ως σημαντική πρώτη ύλη για την παραγωγή αλουμινίου, καθώς και χρωμάτων και λειαντικών.
Καολινίτης:Το Al 2 O 3 * 2SiO 2 * 2H 2 O είναι ένα ορυκτό της υποκατηγορίας των στρωματοποιημένων πυριτικών, το κύριο συστατικό της λευκής, πυρίμαχης και πορσελάνης αργίλου.
Η σύγχρονη μέθοδος παραγωγής αλουμινίου αναπτύχθηκε ανεξάρτητα από τον Αμερικανό Charles Hall και τον Γάλλο Paul Héroux. Αποτελείται από τη διάλυση του οξειδίου του αργιλίου Al 2 O 3 σε τήγμα κρυόλιθου Na 3 AlF 3 που ακολουθείται από ηλεκτρόλυση με χρήση ηλεκτροδίων γραφίτη. Αυτή η μέθοδος παραγωγής απαιτεί πολλή ηλεκτρική ενέργεια, και ως εκ τούτου έγινε δημοφιλής μόλις τον 20ο αιώνα. Για την παραγωγή 1 τόνου αλουμινίου απαιτούνται 1,9 τόνοι αλουμίνας και 18 χιλιάδες kWh ηλεκτρικής ενέργειας.
Φυσικές ιδιότητες:
Το μέταλλο είναι ασημί-λευκό, ελαφρύ, πυκνότητα 2,7 g/cm 3, σημείο τήξης 660°C, σημείο βρασμού 2500°C. Υψηλή ολκιμότητα, τυλιγμένο σε λεπτά φύλλα και ομοιόμορφο φύλλο. Το αλουμίνιο έχει υψηλή ηλεκτρική και θερμική αγωγιμότητα και είναι εξαιρετικά ανακλαστικό. Το αλουμίνιο σχηματίζει κράματα με όλα σχεδόν τα μέταλλα.
Χημικές ιδιότητες:
Υπό κανονικές συνθήκες, το αλουμίνιο καλύπτεται με ένα λεπτό και ανθεκτικό φιλμ οξειδίου και επομένως δεν αντιδρά με κλασικά οξειδωτικά μέσα: με H 2 O (t°, HNO 3 (χωρίς θέρμανση). Χάρη σε αυτό, το αλουμίνιο πρακτικά δεν υπόκειται σε διάβρωση και επομένως είναι ευρέως σε ζήτηση στη σύγχρονη βιομηχανία. Ωστόσο, όταν το φιλμ οξειδίου καταστρέφεται (για παράδειγμα, κατά την επαφή με διαλύματα αλάτων αμμωνίου NH 4 +, θερμά αλκάλια ή ως αποτέλεσμα συγχώνευσης), το αλουμίνιο δρα ως ενεργό αναγωγικό μέταλλο. Αντιδρά εύκολα με απλές ουσίες: οξυγόνο, αλογόνα: 2Al + 3Br 2 = 2AlBr 3
Το αλουμίνιο αντιδρά με άλλα αμέταλλα όταν θερμαίνεται:
2Al + 3S = Al 2 S 3 2Al + N 2 = 2AlN
Το αλουμίνιο μπορεί να διαλύσει μόνο το υδρογόνο, αλλά δεν αντιδρά με αυτό.
Με σύνθετες ουσίες: το αλουμίνιο αντιδρά με αλκάλια (για να σχηματίσει τετραϋδροξοαργιλικά άλατα):
2Al + 2NaOH + 6H 2 O = 2Na + 3H 2
Διαλύεται εύκολα σε αραιά και πυκνά θειικά οξέα:
2Al + 3H 2 SO 4 (dil) = Al 2 (SO 4) 3 + 3H 2 2Al + 6H 2 SO 4 (conc) = Al 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Το αλουμίνιο μειώνει τα μέταλλα από τα οξείδια τους (αλουμινοθερμία): 8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe
Σημαντικές συνδέσεις:
Οξείδιο του αλουμινίου, Al 2 O 3: στερεή, πυρίμαχη λευκή ουσία. Το κρυσταλλικό Al 2 O 3 είναι χημικά παθητικό, το άμορφο είναι πιο ενεργό. Αντιδρά αργά με οξέα και αλκάλια στο διάλυμα, επιδεικνύοντας αμφοτερικές ιδιότητες:
Al 2 O 3 + 6HCl (συμπ.) = 2AlCl 3 + ZH 2 O Al 2 O 3 + 2NaOH (συμπ.) + 3H 2 O = 2Na
(Στο τήγμα αλκαλίων σχηματίζεται NaAlO 2).
Υδροξείδιο αργιλίου, Al(OH) 3: λευκό άμορφο (όπως γέλη) ή κρυσταλλικό. Πρακτικά αδιάλυτο στο νερό. Όταν θερμαίνεται, αποσυντίθεται βήμα προς βήμα. Παρουσιάζει αμφοτερικές, εξίσου έντονες όξινες και βασικές ιδιότητες. Όταν συντήκεται με NaOH, σχηματίζεται NaAlO 2. Για να ληφθεί το ίζημα Al(OH) 3, το αλκάλιο συνήθως δεν χρησιμοποιείται (λόγω της ευκολίας μετάβασης του ιζήματος σε διάλυμα), αλλά ενεργεί σε άλατα αλουμινίου με διάλυμα αμμωνίας - το Al(OH) 3 σχηματίζεται σε θερμοκρασία δωματίου
Άλατα αλουμινίου. Τα άλατα αλουμινίου και τα ισχυρά οξέα είναι εξαιρετικά διαλυτά στο νερό και υφίστανται σημαντική υδρόλυση κατιόντων, δημιουργώντας ένα έντονα όξινο περιβάλλον στο οποίο διαλύονται μέταλλα όπως το μαγνήσιο και ο ψευδάργυρος: Al 3+ + H 2 O = AlOH 2+ + H +
Το φθόριο AlF 3 και το ορθοφωσφορικό AlPO 4 είναι αδιάλυτα στο νερό και τα άλατα πολύ ασθενών οξέων, για παράδειγμα H 2 CO 3, δεν σχηματίζονται καθόλου με καθίζηση από ένα υδατικό διάλυμα.
Διπλά άλατα αλουμινίου είναι γνωστά - στυπτηρίασύνθεση MAl(SO 4) 2 *12H 2 O (M=Na +, K +, Rb +, Cs +, TI +, NH 4 +), η πιο κοινή από αυτές είναι η στυπτηρία καλίου KAl(SO 4) 2 *12H 2 Ο .
Η διάλυση των αμφοτερικών υδροξειδίων σε αλκαλικά διαλύματα θεωρείται ως διαδικασία σχηματισμού υδρόξο άλατα(υδροξυ σύμπλοκα). Η ύπαρξη υδροσυμπλεγμάτων [Al(OH) 4 (H 2 O) 2] -, [Al(OH) 6] 3-, [Al(OH) 5 (H 2 O)] 2- έχει αποδειχθεί πειραματικά. από αυτά, το πρώτο είναι το πιο ανθεκτικό. Ο αριθμός συντονισμού του αλουμινίου σε αυτά τα συμπλέγματα είναι 6, δηλ. το αλουμίνιο είναι έξι-συντονισμένο.
Δυαδικές ενώσεις αλουμινίουΟι ενώσεις με κυρίως ομοιοπολικούς δεσμούς, για παράδειγμα το σουλφίδιο Al 2 S 3 και το καρβίδιο Al 4 C 3, αποσυντίθενται πλήρως από το νερό:
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 + 3H 2 S Al 4 C 3 + 12H 2 O = 4Al(OH) 3 + 3CH 4
Εφαρμογή:
Χρησιμοποιείται ευρέως ως δομικό υλικό. Τα κύρια πλεονεκτήματα του αλουμινίου σε αυτή την ποιότητα είναι η ελαφρότητα, η ευκαμψία για σφράγιση, η αντοχή στη διάβρωση και η υψηλή θερμική αγωγιμότητα. Το αλουμίνιο είναι σημαντικό συστατικό πολλών κραμάτων (χαλκός - αλουμίνιο μπρούτζος, μαγνήσιο κ.λπ.)
Χρησιμοποιείται στην ηλεκτρική μηχανική για την κατασκευή συρμάτων και τη θωράκισή τους.
Το αλουμίνιο χρησιμοποιείται ευρέως τόσο στον θερμικό εξοπλισμό όσο και στην κρυογονική τεχνολογία.
Η υψηλή ανακλαστικότητα, σε συνδυασμό με το χαμηλό κόστος και την ευκολία εναπόθεσης, καθιστούν το αλουμίνιο ιδανικό υλικό για την κατασκευή καθρεφτών.
Το αλουμίνιο και οι ενώσεις του χρησιμοποιούνται στην τεχνολογία πυραύλων ως καύσιμο πυραύλων. Στην παραγωγή οικοδομικών υλικών ως παράγοντας σχηματισμού αερίων.
Αλαγιάροφ Νταμίρ
HF Tyumen State University, ομάδα 561.