Reaksiyonların termal etkilerinin hesaplanması. Kimyasal reaksiyonların farklı sıcaklıklarda termal etkilerinin hesaplanması için yöntemler
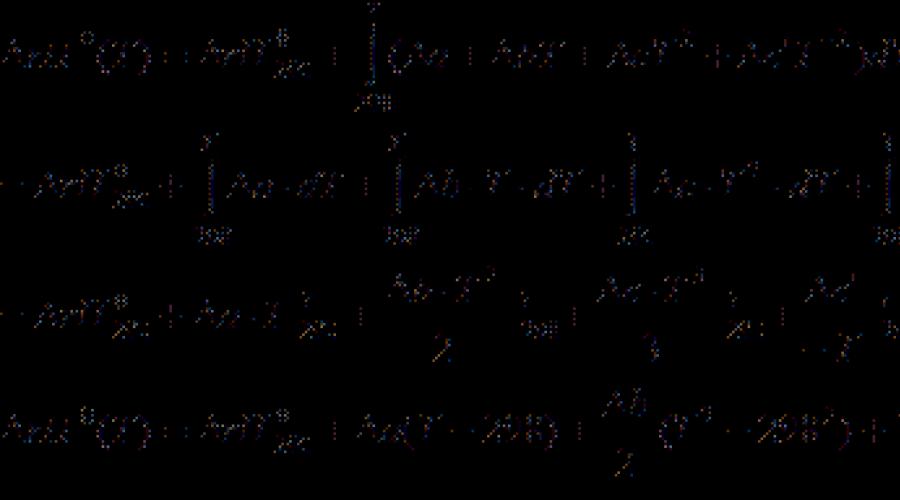
Termal efektleri hesaplamak için tüm yöntemler, integral formdaki Kirchoff denklemine dayanır.
En sık, standart 298.15k, ilk sıcaklık olarak kullanılır.
Termal efektleri hesaplamak için tüm yöntemler, denklemin sağ kısmının entegresini alma yöntemlerine düşürülür.
İntegral alma yöntemleri:
I. Orta ısı kapakları. Bu yöntem en kolay ve en doğru olanıdır. Bu durumda, integral işaretin altındaki ifade, seçilen aralıktaki sıcaklığa bağlı olmayan ortalama ısı kapasitesindeki değişiklik ile değiştirilir.
Ortalama ısı kapasitesi, çoğu reaksiyon için tablo halinde ve ölçülür. Referans verilerini hesaplamak kolaydır.
II. Gerçek ısı kapaklarına göre. (Sıcaklık satırlarının yardımı ile)
Bu yöntemde, ısı kapasitesinin birleşik ekspresyonu bir sıcaklık aralığı olarak yazılır:

III. Entalpinin yüksek sıcaklıktaki bileşenlerine göre. Bu yöntem, kimyasal reaksiyonların yüksek sıcaklıklarda termal etkilerini hesaplarken roket teknolojisinin geliştirilmesi ile yaygın olarak dağıtıldı. Isobar ısı kapasitesinin tanımına dayanır:

Entalpinin yüksek sıcaklık bileşeni. Bireysel maddenin entalpisinin belirli sayıda dereceye kadar ısıtıldığında ne kadar değişeceğini gösterir.
Kimyasal reaksiyon için, yazın:

Böylece:
Ders sayısı 3.
Ders Planı:
1. II Termodinamik Kanunları, Tanım, Matematiksel Kayıt.
2. Termodinamik Kanununun II.
3. Bazı işlemlerde entropi değişikliklerinin hesaplanması
burada ve daha fazla dizinler bEN. İlk maddelere veya reaktiflere ve endekslere bakın. j.- Sonlu maddeleri veya reaksiyon ürünlerini; ve - başlangıç \u200b\u200bmalzemeleri ve reaksiyon ürünleri için reaksiyon denklemindeki stokiyometrik katsayılar.
Misal:Metanol sentezinin reaksiyonunun standart koşullar altında termal etkisini hesaplayın.
Karar: Hesaplamalar için, maddelerin reaksiyonunda bulunan formasyonun standart ısısına göre referans verilerini kullanacağız (bkz. Tablo. 44, referans defterinin sayfa 72).
Metanol sentezi reaksiyonunun, GESS Hukukunun (Denklem 1.15) bunun ilk bunun sonucunda standart koşullar altında termal etkisi eşittir:
Kimyasal reaksiyonların termal etkilerini hesaplarken, termal etkinin reaktiflerin agrega durumuna ve kimyasal reaksiyon denkleminin kaydedilmesine bağlı olduğunu dikkate almak gerekir:
GESSA yasasının ikinci sonucunda, termal etki yanma ısısı kullanılarak hesaplanabilir. Δ C H.Başlangıç \u200b\u200bmalzemelerinin yankının ve reaksiyon ürünlerinin yanmasının ısısının ısısındaki fark olarak (stokiyometrik katsayıları dikkate alınarak):
nerede δ. R c p. - Bir kimyasal reaksiyonun akışının bir sonucu olarak sistemin izobarik ısı kapasitesindeki değişikliği karakterize eder ve reaksiyonun ısıl etkisinin sıcaklık katsayısı olarak adlandırılır.
Diferansiyel Kirchhoff denkleminden, sıcaklık üzerindeki termal etkinin bağımlılığının δ işareti ile belirlendiğini takip eder. R c p.. Bu, ilk maddelerin toplam ısı kapasitesinin veya reaksiyon ürünlerinin toplam ısı kapasitesine sahip olduğuna bağlıdır. Kirchhoff'un diferansiyel denklemini analiz edelim.
1. Sıcaklık katsayısı δ ise R c p.\u003e 0, sonra türev  \u003e 0 ve işlev
\u003e 0 ve işlev  artan. Sonuç olarak, reaksiyonun artan sıcaklıkla termal etkisi artar.
artan. Sonuç olarak, reaksiyonun artan sıcaklıkla termal etkisi artar.
2. Sıcaklık katsayısı δ ise R c p.< 0, то производная  < 0 и функция
< 0 и функция  Azalan. Sonuç olarak, reaksiyonun artan sıcaklıkla termal etkisi azalır.
Azalan. Sonuç olarak, reaksiyonun artan sıcaklıkla termal etkisi azalır.
3. Sıcaklık katsayısı δ ise R c p. \u003d 0, sonra türev  \u003d 0 I.
\u003d 0 I.  . Sonuç olarak, reaksiyonun termal etkisi sıcaklığa bağlı değildir. Bu dava pratikte gerçekleşmez.
. Sonuç olarak, reaksiyonun termal etkisi sıcaklığa bağlı değildir. Bu dava pratikte gerçekleşmez.
Diferansiyel denklemler analiz için uygundur, ancak hesaplamalar için rahatsız edicidir. Kimyasal bir reaksiyonun termal etkisini hesaplamak için bir denklem elde etmek için, değişkenleri ayırarak Kirchhoff'un diferansiyel denklemini aşmak için:


Maddelerin ısı kapasitesi sıcaklığa bağlıdır, bu nedenle ve  . Bununla birlikte, kimyasal ve teknolojik süreçlerde yaygın olarak kullanılan sıcaklıklar bölgesinde, bu bağımlılık anlamlı değildir. Pratik amaçlar için, sıcaklık aralığında 298'den belirtilen sıcaklığa orta ısı kapasitesi maddeleri kullanılır.
. Bununla birlikte, kimyasal ve teknolojik süreçlerde yaygın olarak kullanılan sıcaklıklar bölgesinde, bu bağımlılık anlamlı değildir. Pratik amaçlar için, sıcaklık aralığında 298'den belirtilen sıcaklığa orta ısı kapasitesi maddeleri kullanılır.  referans kitaplarında verilenler. Orta ısı kapasitesi kullanılarak hesaplanan termal etkinin sıcaklık katsayısı:
referans kitaplarında verilenler. Orta ısı kapasitesi kullanılarak hesaplanan termal etkinin sıcaklık katsayısı:
Misal:Metanol sentezinin reaksiyonunun 1000 ila ve standart basınç sıcaklığında termal etkisini hesaplayın.
Karar: Hesaplamalar için, reaksiyonda yer alan maddelerin ortalama ısı kapasitesi üzerindeki referans verilerini 298 ila 1000 K arasında (bkz. Tablo 40, Sayfa 56, Sayfa 56):
Kimyasal reaksiyonun akışının bir sonucu olarak sistemin ortalama ısı kapasitesindeki değişiklikler:
Termodinamiğin ikinci başlangıcı
Kimyasal termodinamiğin en önemli görevlerinden biri, dikkate alınan yönde kimyasal reaksiyonun spontan akışının temel olasılığını (veya yetersizliğini) netleştirmektir. Bu kimyasal etkileşimin oluşabileceği netleştiği durumlarda, kaynak maddelerinin dönüşüm derecesini ve reaksiyon ürünlerinin verimini belirlemek gerekir, yani reaksiyonun dolgunluğu
Spontan sürecin elimi yönü, ikinci yasa bazında veya örneğin bir Clausius varsayımıyla formüle edilmiş termodinamiğin başlangıcında belirlenebilir:
Isının kendisi soğuk bir vücuttan sıcaklığa geçemez, yani böyle bir işlem imkansızdır, bunun sonucu, vücudun gövdesinden daha yüksek bir sıcaklıkta daha düşük bir sıcaklıkta daha düşük bir sıcaklıkta geçişi olan tek sonuç.
Termodinamiğin ikinci başlangıcındaki çeşitli formülasyonlar önerilmektedir. Thomson'ın ifadesi - Planck:
İkinci türün ebedi motoru imkansızdır, yani, bu kadar periyodik olarak aktif bir makine imkansızdır, bu da sadece ısı kaynağını soğutarak işlem elde etmesine izin verir.
Termodinamiğin ikinci başlangıcının matematiksel formülasyonu, N. Carno ve R. Clausius'un çalışmalarında termal makinelerin çalışmasını analiz eder.
Clausius bir devlet fonksiyonu tanıtıldı S., adlandırılan entropi, geri dönüşümlü sürecin ısısına eşit olan, sıcaklığa yönlendirilen değişim
Herhangi bir işlem için
 | (1.22) |
Elde edilen ifade, termodinamiğin ikinci başlangıcının matematiksel bir ifadesidir.
Standart eğitimin sıcaklığı (eğitimin entalpi) maddeleri Bu maddenin oluşumunun oluşumunun oluşumunun, en istikrarlı standart durumda (bir türün atomlarından oluşan basit maddeler) oluşumunun oluşumunun oluşturulmasının entalpisi olarak adlandırılır. Standart çevre entalpileri (CJ / MOL) referans kitaplarında verilmiştir. Referans değerleri kullanırken, reaksiyonda yer alan maddelerin faz durumuna dikkat etmek gerekir. En istikrarlı basit maddelerin oluşumunun entalpisi 0'dır.
Eğitimin ısısındaki kimyasal reaksiyonların termal etkilerinin hesaplanması konusundaki GESS Hukukundan Corollary : standart kimyasal reaksiyonun termal etkisi, reaksiyon ürünlerinin oluşumunun ısısının ısısına ve kaynak maddelerin oluşumunun ısısını, reaktiflerin stokiyometrik katsayıları (mol miktarları) dikkate alınarak:
Ch 4 + 2 co \u003d 3 c ( grafit ) + 2 H. 2 Ö.
gaz Gaz TV. gaz
Bu faz durumlarındaki maddelerin oluşumunun ısısı tabloda gösterilmektedir. 1.2.
Tablo 1.2.
Maddelerin sıcak oluşumu
Karar
Reaksiyon geçtiğinden beri P.\u003d Const, daha sonra standart termal etki, GESS Yasası'nın sonucunda bilinen eğitim ısısına göre entalpi olan bir değişiklik olarak bulunur (Formül (1.17):
Δн. hakkında 298 \u003d (2 · (-241.81) + 3 · 0) - (-74.85 + 2 · (-110,53)) \u003d -187,71 KJ \u003d -187710 J.
Δн. hakkında 298 < 0, реакция является экзотермической, протекает с выделением теплоты.
Dahili enerjideki değişiklik Denklem temelinde buluruz (1.16):
Δu. hakkında 298 = Δh. hakkında 298 – Δ ν · Rt..
Bu değişikliklerin bu tür bir kimyasal reaksiyonun geçişi nedeniyle gazlık maddelerinin mol sayısındaki reaksiyonu için Δν = 2 – (1 + 2) = –1; T.\u003d 298 k, sonra
Δ U hakkında 298 \u003d -187710 - (-1) · 8,314 · 298 \u003d -185232 J.
Reaksiyona dahil olan maddelerin yanmaşısının standart ısısına göre kimyasal reaksiyonların standart ısıl etkilerinin hesaplanması
Standart ısı yanması (yanma entalpi) madde
İlk ve sonlu maddelerin standart bir sıcaklığa sahip olması şartıyla, belirli bir maddenin 1 duasının (daha yüksek oksitlere kadar veya özel olarak belirtilen bileşiklere kadar) tam oksidasyonunun termal etkisi olarak adlandırılır. Standart yanma entalpi maddeleri  (KJ / MOL) referans kitaplarında verilmiştir. Referans değerlerini kullanırken, her zaman ekzotermik olan yanma reaksiyonunun filinin işaretine dikkat etmek gerekir (). Δ
H.
<0), а в таблицах указаны величины
(KJ / MOL) referans kitaplarında verilmiştir. Referans değerlerini kullanırken, her zaman ekzotermik olan yanma reaksiyonunun filinin işaretine dikkat etmek gerekir (). Δ
H.
<0), а в таблицах указаны величины
 .
. Daha yüksek oksitlerin entalpi yanması (örneğin, su ve karbondioksit) 0'a eşittir.
Daha yüksek oksitlerin entalpi yanması (örneğin, su ve karbondioksit) 0'a eşittir.
Yanma ısısındaki kimyasal reaksiyonların termal etkilerinin hesaplanması konusundaki GESS yasasına göre corollary : kimyasal reaksiyonun standart termal etkisi, ilk maddelerin yanma ısısının ısısına ve reaktiflerin stokiyometrik katsayıları (mol miktarını) dikkate alınarak reaksiyon ürünlerinin yanmasının ısısına eşittir:
C. 2 H. 4 + H. 2 Ö. \u003d S. 2 N. 5 O MU.
Bir kişinin fiziksel özelliklerinden biri fiziksel güçtür, herhangi bir kimyasal iletişimin en önemli özelliği, iletişimin gücüdür, yani Onun enerjisi.
Kimyasal bağ enerjisinin - bu bağlantıyı imha etmek için harcanması gereken enerji oluşumunda tahsis edilen bu enerji.
Genel olarak kimyasal reaksiyon, bir maddenin başkalarına dönüştürülmesidir. Sonuç olarak, kimyasal reaksiyon sırasında, bazı bağlantıların kırılması ve başkalarının oluşumunu, yani Enerji çevirme.
Fiziğin temel hukuku, enerjinin hiçbir şeyden doğmadığını ve izleme olmadan kaybolmadıklarını, ancak bir türden diğerine geçtiğini belirtir. Evrensellik sayesinde bu ilke açıkça kimyasal bir reaksiyona uygulanabilir.
Kimyasal reaksiyonun termal etkisi ısı miktarı olarak adlandırılır,
reaksiyon sırasında (veya emilir) ve 1 mol reaksiyona (veya elde edilen) maddeye göre.
Termal etki Q harfi ile gösterilir ve bir kural olarak, KJ / MOL veya KCAL / MOL cinsinden ölçülür.
Reaksiyon, ısı tahliye (q\u003e 0) ile gerçekleşirse, ekzotermik olarak adlandırılır ve eğer ısı emiliminde (Q< 0) – эндотермической.
Reaksiyonun enerji profilini canlandırması, daha sonra endotermik reaksiyonlar için, ürünler reaktiflerden daha fazla enerji altındadır ve ekzotermik için - aksine, reaksiyon ürünleri, reaktiflerden (daha kararlı), reaktiflerden daha düşük bir konumda bulunur.
Maddenin ne kadar büyük olduğu, enerji miktarı daha büyük olduğu açıktır (veya emilir), yani. Termal etki, madde miktarı ile doğrudan orantılıdır. Bu nedenle, termal etkinin maddenin 1 moline tutumu, çeşitli reaksiyonların termal etkilerini karşılaştırma arzumuzu nedeniyledir.
Ders 6. Termokimya. Kimyasal reaksiyon örneğinin termal etkisi. 8.0 g bakır (II) hidrojenin oksitinin restorasyonu ile, metal bakır ve su çiftleri oluşturuldu ve 7.9 KJ ısıtı. Bakır oksitin (II) azaltılmasının reaksiyonunun termal etkisini hesaplayın.
Karar. CUO Reaksiyon Denklemi (TV.) + H2 (G.) \u003d CU (TV.) + H2 O (G.) + Q (*)
1 Mol - X KJ'nin restorasyonu sırasında 0.1 mol - 7.9 KJ'nin restorasyonu sırasında bir oranda bulunun.
Burada x \u003d + 79 kj / köstebek. Denklem (*) alır
CUO (TV.) + H2 (G.) \u003d CU (TV.) + H2 O (G.) +79 KJ
Termokimyasal denklem- Bu, reaksiyon karışımının bileşenlerinin agrega durumunu (reaktifler ve ürünler) ve reaksiyonun termal etkisini gösteren bir kimyasal reaksiyon denklemidir.
Buzun eritilmesi veya suyu buharlaşacak şekilde, belirli miktarlarda ısı harcamak gerekirken, sıvı suyun donması sırasında veya su buharının yoğunlaşması sırasında aynı miktarda tahsis edilir. Bu yüzden sudan çıktığımızda soğuktur (vücut yüzeyinden su buharlaşması, enerji maliyetleri gerektirir) ve terleme, vücudun aşırı ısınmasından biyolojik bir koruyucu mekanizmadır. Aksine, dondurucu suyu dondurur ve çevresindeki odayı ısıtır, aşırı bir ısı verir.
Bu örnek, agrega su durumundaki değişikliklerin termal etkilerini göstermektedir. Erime ısısı (0O C) λ \u003d 3.34 × 105 j / kg (fizik) veya QL. \u003d - 6.02 KJ / MOL (kimya), ısı buharlaşma (buharlaşma) (100O'da) Q \u003d 2.26 × 106 J / KG (fizik) veya QISP. \u003d - 40.68 KJ / MOL (Kimya).
erime
buharlaşma |
|||||
obR, 298.
Ders 6. Termokimya. Kimyasal reaksiyonun termal etkisi tabii ki, katı olduğunda süblimasyon işlemleri mümkündür
gaz fazına, sıvı durumunu ve biriktirme (kristalleşme) gaz fazından gelen ters işlemlerini atlar, ayrıca termal etkiyi hesaplamak veya ölçmek de mümkündür.
Her bir maddenin kimyasal bağlar olduğu, bu nedenle her bir maddenin bazı enerji rezervine sahip olduğu açıktır. Bununla birlikte, tüm maddeler bir kimyasal reaksiyonla birbirlerine dönüştürülemez. Bu nedenle, standart bir durum getirmeyi kabul etti.
Standart madde durumu- Bu, bu koşullarda en istikrarlı allotropik modicasyonda 1 atmosferin bir basıncı olan 298 K sıcaklığında bir maddenin toplam halidir.
Standart koşullar- Bu 298 K ve basınç 1 atmosferinin sıcaklığıdır. Standart koşullar (standart durum) index0 tarafından gösterilir.
Standart Isı Oluşumu Bağlantısı bu bileşiğin oluşumunun kimyasal reaksiyonunun standart durumlarında alınan basit maddelerden ısıl etkisi denir. Bileşik oluşumun ısısı Q sembolü ile gösterilir.0 Çeşitli bileşikler için, standart termal eğitim, fizikokimyasal değerlerin referans defterlerinde verilmiştir.
Basit maddelerin oluşumunun standart ısısı 0'a eşittir. Örneğin, Q0 arr., 298 (O2, Gaz) \u003d 0, Q0 arr., 298 (C, TV, Grafit) \u003d 0.
Örneğin . Bakır sülfatın (II) oluşumu için termokimyasal denklemi kaydedin. Referans Kitabından Q0 ARR, 298 (CUSO4) \u003d 770 KJ / MOL.
CU (TV.) + S (TV.) + 2O2 (G.) \u003d CUSO4 (TV) + 770 KJ.
NOT: Termokimyasal denklem herhangi bir madde için kaydedilebilir, ancak reaksiyonun tamamen farklı bir şekilde gerçekleştiğini anlamak gerekir: listelenen reaktiflerden, bakır (II) ve kükürt (IV) ısıtılmış oksit olduğunda oluşur. ), ancak bakır sülfat (ii) oluşturulmaz. ÖNEMLİ SONUÇ: Termokimyasal denklem, hesaplamalara izin veren bir modeldir, diğer termokimyasal verilerle iyi bir şekilde tutarlıdır, ancak pratiğin doğruluğuna dayanmaz (yani, olasılığını veya reaksiyonu olasılığını veya yetersizliğini doğru tahmin edemiyor).
(B j) - Σ A i × q arr 0, 298 i
Ders 6. Termokimya. Kimyasal reaksiyonun termal etkisi
Açıklama. Sizi yanlış yönlendirmemek için hemen bu kimyasal termodinamiği ekleyeceğim reaksiyonun olasılığını / imkansızlığını tahmin edebilirBununla birlikte, bu, okul kimya dersinin ötesine geçen daha ciddi "araçlar" gerektirir. Bu tekniklere kıyasla termokimyasal denklem, Heopse Piramidi'nin arka planındaki ilk adımdır - yapamaz, ancak yüksek değil.
Örnek 2. 5,8g ağırlığında su yoğuşmasının termal etkisini hesaplayın. Yoğuşma işlemi, H2 O (G.) \u003d H2 O (g.) + Q - Yoğuşma Genellikle 25O C 37 KJ / MOL (Dizin) Ezotermik Isı Yoğuşma işlemi ile tanımlanır.
Sonuç olarak, Q \u003d 37 × 0.32 \u003d 11.84 KJ.
19. yüzyılda, reaksiyonların termal etkilerini inceleyen Rus kimyacı, deneysel olarak kimyasal reaksiyonlar ile ilgili olarak enerji tasarrufu kanunu oluşturdu - HESS'nin yasası.
Kimyasal reaksiyonun termal etkisi, işlem yoluna bağlı değildir ve yalnızca sonlu ve ilk durumlardaki farkla belirlenir.
Kimya ve matematik açısından bu Kanun, bu yasa, herhangi bir "hesaplama yörüngesini" seçme sürecini hesaplamakta özgür olduğumuz anlamına gelir, çünkü sonuç buna bağlı değildir. Bu nedenle, HESS'nin çok önemli hukuku inanılmaz derecede önemlidir. gESS Hukukunun Corollary.
Kimyasal reaksiyonun termal etkisi, reaktiflerin oluşumunun ısısının netinin (stokiyometrik katsayıları dikkate alınarak) reaksiyon ürünlerinin oluşumunun oluşumunun ısısının toplamına eşittir.
Sağdilgenin açısından bu soruşturma, tüm reaktiflerin ilk önce yeni bir şekilde toplandığı basit maddelere dönüştürüldüğü sürece karşılık gelir, böylece reaksiyon ürünleri elde edildi.
Denklem şeklinde, GESS yasasının sonucu reaksiyon denklemine benziyor: bir 1 A 1 + A 2 A 2 + ... + A N A \u003d B 1 B 1 + B2 B2 + ... B
Aynı zamanda, bir I IB J, bir I - Reaktifler, B J - Reaksiyon Ürünleridir.
Öyleyse, GESSA yasasının sonucu q \u003d σ b j × q arizm formuna sahiptir. 0, 298
k bk + q
(A i)
Ders 6. Termokimya. Bir kimyasal reaksiyonun, birçok maddenin oluşumunun standart ısısından bu yana termal etkisi
a) Özel tablolara veya B'ye bağlı olarak) deneysel olarak belirlenebilir, (hesaplamak) çok sayıda reaksiyonun termal etkisini yeterince yüksek doğrulukla tahmin etmek mümkün olur.
Örnek 3. (GESS yasasının sonucu). Standart koşullar altında gaz fazında meydana gelen metanın buhar dönüşümünün termal etkisini hesaplayın:
CH4 (G.) + H2 O (G.) \u003d CO (G.) + 3 H2 ()
Bu reaksiyonun ekzotermik mi yoksa endotermik olup olmadığını belirleyin?
Çözüm: GESS yasasının sonucu
Q \u003d 3 q0 | D) + q 0 | (CO, D) -Q 0 | D) -q 0 | O, d) - genel olarak. |
|||||
oBR, 298. | oBR, 298. | oBR, 298. | oBR, 298. | ||||||
Q ob0. | 298 (h 2, d) \u003d 0 | Standart durumda basit bir madde |
|||||||
Referans Kitabından, karışımın kalan bileşenlerinin oluşumunun sıcaklığını buluruz.
O, d) \u003d 241.8 | (Co, d) \u003d 110.5 | D) \u003d 74.6 | |||||||||
oBR, 298. | oBR, 298. | oBR, 298. | |||||||||
Değerleri denklem için değiştiriyoruz
Q \u003d 0 + 110.5 - 74.6 - 241.8 \u003d -205.9 KJ / MOL, reaksiyon oldukça endotermich.
Cevap: Q \u003d -205.9 KJ / MOL, endotermal
Örnek 4. (GESA'nın uygulanması). Reaksiyonların sıcaklığı bilinmektedir
C (TV.) + ½ o (g.) \u003d CO (g.) + 110.5 KJ
C (TV.) + O2 (G.) \u003d CO2 (G.) + 393.5 KJ Reaksiyon 2CO (G.) + O2 (G.) \u003d 2C02 (g.) Termal etkisini bulun. Birinci ve ikinci kararı çarpın 2'de denklem
2C (TV.) + O2 (g.) \u003d 2C (g.) + 221 KJ 2C (TV.) + 2O2 (G.) \u003d 2C02 (G.) + 787 KJ
İkinci denklemden ilk kez
O2 (G.) \u003d 2C02 (G.) + 787 KJ - 2CO (G.) - 221 KJ,
2CO (G.) + O2 (G.) \u003d 2C02 (G.) + 566 KJ Cevap: 566 KJ / MOL.
Not: Termokimyayı okurken, kimyasal reaksiyonu dışarıdan (dışarıdan) görüyoruz. Aksine, kimyasal termodinamik - kimyasal sistemlerin davranış bilimi - sistemi içeriden dikkate alır ve sistemin termal enerjisi olarak "entalpi" H konseptiyle çalışır. Entalpy, böyle
Ders 6. Termokimya. Kimyasal reaksiyonun termal etkisi, ısı miktarı ile aynı değildir, ancak zıt işarete sahiptir: Enerji sistemden ayırt edilirse, ortamı alır ve ısıtılır ve sistem enerji kaybeder.
Edebiyat:
1. Öğretici, v.v. Eremin, n.e. Kuzmenko ve ark., Kimya Sınıf 9, paragraf 19,
2. Eğitim ve metodolojik manuel "Genel kimyanın temelleri" bölüm 1.
Derleyiciler - S.G. Baram, i.n. Mironova. - Seninle al! Bir sonraki seminer mesleği için
3. A.V. Manuilles. Kimya temelleri. http://hemi.nsu.ru/index.htm.
§9.1 Kimyasal reaksiyonun termal etkisi. Termokimya'nın ana yasaları.
§9.2 ** Termokimya (devam). Maddenin oluşumunun elemanlardan ısıtılması.
Standart entalpi eğitim.
Dikkat!
Bu nedenle, yerleşim görevlerini çözmeye gidiyoruz, bu nedenle, hesap makinesi kimyadaki seminerler için de arzu edilir.
Termokimya, kimyasal reaksiyonların termal etkilerini çalıştırır. Çoğu durumda, bu reaksiyonlar sabit bir hacimde veya sabit bir basınçta meydana gelir. Termodinamiğin ilk yasasından, bu ısı koşulları altında bir fonksiyon işlevidir. İç enerjideki değişime eşit sabit bir ısı hacminde:
ve sabit basınçta, entalpi değişikliği:
Uygulamadaki bu eşitlikler kimyasal reaksiyonlara yöneliktir. gessa Hukuku:
Sabit basınç veya sabit hacimdeki kimyasal reaksiyonun akışının termal etkisi reaksiyon yoluna bağlı değildir ve yalnızca reaktiflerin ve reaksiyon ürünleri tarafından belirlenir.
Başka bir deyişle, kimyasal reaksiyonun termal etkisi, durum işlevini değiştirmektir.
Termokimyada, diğer termodinamik uygulamaların aksine, ortamda vurgulanırsa, ısı pozitif olarak kabul edilir, yani. Eğer bir H. < 0 или U
< 0. Под тепловым эффектом химической реакции
понимают значение H. (bu sadece "entalpi reaksiyonu" olarak adlandırılır) veya U reaksiyonlar.
Reaksiyon, birimdeki değişikliğin hafif olduğu çözelti veya katı fazda ilerlerse,
H. = U + (pv) U. (3.3)
Mükemmel gazlar reaksiyona karışırsa, sabit bir sıcaklıkta
H. = U + (pv) = U + n. Rt, (3.4)
buradaki n, reaksiyondaki gazların mol sayısındaki bir değişikliktir.
Çeşitli reaksiyonların entalpiyumunun karşılaştırılmasını kolaylaştırmak için "Standart Devlet" kavramını kullanın. Standart Durum, 1 bar basınçta (\u003d 10 5 pa) ve belirli bir sıcaklıkta saf maddenin durumudur.. Gazlar için, bu, sonsuz seyrek gazın özelliklerine sahip olan 1 bar basınçta varsayımsal bir durumdur. Sıcaklıklarda standart koşullardaki maddeler arasındaki reaksiyonun entalpisi T., ifade ( r. "Reaksiyon" anlamına gelir). Termokimyasal denklemlerde, sadece maddelerin formülleri değil, aynı zamanda agrega durumları veya kristalin modifikasyonları da belirtilmiştir.
HESS'nin yasasından, kimyasal reaksiyonların entalpasını hesaplamaya olanak tanıyan önemli sonuçlar akışı.
Corollary 1.
![]()
reaksiyon ürünleri ve reaktiflerin standart entalpi oluşumunda (stokiyometrik katsayıları dikkate alınarak) farkına eşittir:
Madde oluşumunun standart entalpi (ısı) (f. Bu maddenin bir dua edilmesinin oluşumunun oluşumunun oluşturulmasının entalpisi olarak adlandırılan belirli bir sıcaklıkta "oluşum" anlamına gelir. elementlerdenEn sürdürülebilir standart durumda bulunur. Bu tanıma göre, standart durumdaki en stabil basit maddelerin oluşumunun entalpisi herhangi bir sıcaklıkta 0'dır. 298 K sıcaklıktaki maddelerin oluşumunun standart entalpileri referans kitaplarında verilmiştir.
"Eğitimin entalpi" kavramları sadece geleneksel maddeler için değil, aynı zamanda çözeltideki iyonlar için de kullanılır. Aynı zamanda, H + iyonu, sulu çözeltideki formasyonun standart entalpisinin sıfır olması gerektiği için referans noktası başına alınır: ![]()
Corollary 2. Kimyasal reaksiyonun standart entalpi
![]()
reaktiflerin ve reaksiyon ürünlerinin yanmaşması (stokiyometrik katsayılar dikkate alınması) entalpi farkına eşittir:
(c. "Bir mücadele" anlamına gelir). Maddenin yanmasının standart entalpi (ısı), bir dua eden maddenin toplam oksidasyonunun reaksiyonunun entalpisi olarak adlandırılır. Bu sonuç genellikle organik reaksiyonların termal etkilerini hesaplamak için kullanılır.
Corollary 3. Kimyasal reaksiyonun entalpisi, yırtık ve ortaya çıkan kimyasal bağların enerjisinin farkına eşittir.
İletişim enerjisi A- B, elde edilen parçacıkların bağını ve seyreltilmesini sonsuz mesafeye kırmak için gereken enerji denir:
Ab (g) a (g) + b (g).
İletişim Enerjisi her zaman olumludur.
Referans kitaplardaki çoğu termokimyasal veri 298 K sıcaklıkta verilmektedir. Diğer sıcaklıklarda termal efektleri hesaplamak için kirchhoff denklemi:
(Diferansiyel Form) (3.7)
 (Bütünleşik Form) (3.8)
(Bütünleşik Form) (3.8)
nerede C P. - Reaksiyon ürünlerinin izobarik ısı kapasitesinin farkı ve başlangıç \u200b\u200bmalzemeleri. Eğer fark varsa T. 2 - T. 1 küçük, sonra alabilirsin C P. \u003d Const. Büyük bir sıcaklık farkı ile, sıcaklık bağımlılığını kullanmak gerekir. C P.(T.) Tür:
katsayıların nerede olduğu a., b., c. vb. Bireysel maddeler için, dizinden alırlar ve işaret, ürünler ve reaktifler arasındaki farkı gösterir (katsayıları dikkate alarak).
Örnek
Örnek 3-1. Sıvı ve gaz suyunun 298 K'teki oluşumunun standart entalpileri sırasıyla -285.8 ve -241.8 KJ / MOL'a eşittir. Bu sıcaklıkta su buharlaşımının entalpasını hesaplayın.
Karar. Eğitim entalpi aşağıdaki reaksiyonlara karşılık gelir:
H2 (g) + ѕo 2 (g) \u003d H20 (g), H. 1 0 = -285.8;
H2 (g) + ѕo 2 (g) \u003d H20 (g), H. 2 0 = -241.8.
İkinci reaksiyon iki aşamada gerçekleştirilebilir: ilk reaksiyonla sıvı su oluşturmak için ilk önce hidrojen yanması ve ardından suyu buharlaştırın:
H20 (g) \u003d H20 (g), H. 0 \u003d?
Sonra, Hess'in kanununa göre,
H. 1 0 + H. 0 \u003d. H. 2 0 ,
dan H. 0 ISS \u003d -241.8 - (-285.8) \u003d 44.0 KJ / MOL.
Cevap. 44.0 KJ / Mol.
Örnek 3-2. Entalpi reaksiyonu hesaplayın
6c (g) + 6h (g) \u003d C6H6 (g)
a) eğitimin ental paralarında; b) iletişim enerjileri üzerinde, C6H6 molekülündeki çift bağların sabit olduğu varsayımı altında sabittir.
Karar. a) Eğitim entalpi (KJ / Mole'da) Rehber'de buluruz (örneğin, P.W.ATkins, Fiziksel Kimya, 5. Baskı, PP. C9-C15): F H. 0 (C6H6 (g)) \u003d 82.93, F H. 0 (c (g)) \u003d 716.68, F H. 0 (H (g)) \u003d 217.97. Entalpi reaksiyonu:
R H. 0 \u003d 82.93 - 6 716.68 - 6 217.97 \u003d -5525 KJ / MOL.
b) Bu reaksiyonda, kimyasal bağlar bozulmaz, ancak yalnızca oluşturulur. Sabit çift bağların yaklaşımında, C6H6 molekülü, C-H, C-C \u003d C \u003d C iletişiminin C-C ve 3'ün 3 bağını içerir. Enerji bağlantıları (KJ / MO cinsinden) (P.W.ATkins, Fiziksel Kimya, 5. Baskı, s. C7): E.(C- h) \u003d 412, E.(C- c) \u003d 348, E.(C \u003d c) \u003d 612. Reaksiyon entalpisi aşağıdakilere eşittir:
R H. 0 \u003d - (6 412 + 3 348 + 3 612) \u003d -5352 KJ / MOL.
Kesin sonuçla olan fark -5525 KJ / MA'dır, benzen molekülündeki tek bir C - C bağlanması ve çift bağlamalar bulunmadığından ve C \u003d C ile 6 aromatik bağlar vardır.
Cevap. a) -5525 KJ / mol; b) -5352 kj / mol.
Örnek 3-3. Referans verilerini kullanarak, reaksiyonun entalpisini hesaplayın
3CU (TV) + 8HNO 3 (AQ) \u003d 3CU (3) 2 (AQ) + 2NO (G) + 4H20 (G)
Karar. Kısaltılmış iyonik reaksiyon denklemi formu vardır:
3CU (TV) + 8H + (AQ) + 2NO 3 - (AQ) \u003d 3CU 2+ (AQ) + 2NO (G) + 4H20 (G).
GESS yasasına göre, entalpi reaksiyonu eşittir:
R H. 0 = 4 F H. 0 (H20 (G)) + 2 F H. 0 (no (g)) + 3 F H. 0 (Cu 2+ (AQ)) - 2 F H. 0 (No 3 - (AQ))
(Bakır ve iyon H + oluşumunun enhhaulpia, tanımı ile eşittir, 0). Sterlhanting Eğitim Eğitimi (P.W.ATkins, Fiziksel Kimya, 5. Baskı, PP. C9-C15), buluruz:
R H. 0 \u003d 4 (-285.8) + 2 90.25 + 3 64.77 - 2 (-205.0) \u003d -358.4 KJ
(üç dua eden bakır başına).
Cevap. -358.4 kj.
Örnek 3-4. Formasyon entalpisi 298'de verilirse, metandan yanmanın entalpasını 1000 K'ye göre hesaplayın: F H. 0 (ch 4) \u003d -17.9 kcal / mol F H. 0 (C02) \u003d -94.1 Kcal / Mol F H. 0 (h20 (g)) \u003d -57.8 kcal / mol. Gazların ısı kapasitesi (CAL / (güve. K)) 298 ila 1000 K arasındaki aralıkta eşittir:
C P (CH4) \u003d 3.422 + 0.0178. T., C P.(O 2) \u003d 6.095 + 0.0033. T.,
C P (C02) \u003d 6.396 + 0.0102. T., C P.(H20 (d)) \u003d 7.188 + 0.0024. T..
Karar. Enhhaulpia Metan Yanma Reaksiyonu
CH 4 (G) + 2O 2 (G) \u003d CO2 (G) + 2H20 (G)
298'de eşit:
94.1 + 2 (-57.8) - (-17.9) \u003d -191.8 Kcal / Mol.
Sıcaklığın bir fonksiyonu olarak ısı kapasitesinin farkını bulun:
C P. = C P.(CO 2) + 2 C P.(H20 (d)) - C P.(CH 4) - 2 C P.(O 2) \u003d
= 5.16 - 0.0094T. (CAL / (güve. K)).
Kirchhoff denklemine göre 1000'deki reaksiyonun entalpisi:
= +  = -191800 + 5.16
= -191800 + 5.16
(1000-298) - 0.0094 (1000 2 -298 2) / 2 \u003d -192500 cal / mol.
Cevap. -192.5 kcal / mol.
GÖREVLER
3-1. 500 G AL (T.PL. 658 O C, çeviriler için ne kadar ısı gerekecektir? H. 0 pl \u003d 92.4 cal / g), oda sıcaklığında, erimiş halde, C P.(AL TV) \u003d 0.183 + 1.096 10 -4 T. Cal / (g k)?
3-2. Standart entalpi reaksiyonu CACO 3 (TV) \u003d CAO (TV) + C02 (G), 1000 K sıcaklığında, 169 KJ / MOL'a eşit bir sıcaklıkta meydana gelen CAO (TV) + C02 (G). Aynı sıcaklıkta akan bu reaksiyonun ısısına eşittir, ancak kapalı kapta mı?
3-3. Formasyonunun standart entalpisi 49.0 KJ / Mol ise, 298 K'lık sıvı benzen oluşumunun standart iç enerjisini hesaplayın.
3-4. N2 O 5 (D) oluşumunun entalpisini hesaplayın. T. \u003d 298 K Aşağıdaki verilere göre:
2no (g) + o 2 (g) \u003d 2no 2 (g), H. 1 0 \u003d -114.2 KJ / MOL,
4NO 2 (G) + O 2 (G) \u003d 2N 2 O 5 (G), H. 2 0 \u003d -110.2 KJ / MOL,
N2 (g) + o 2 (g) \u003d 2no (g), H. 3 0 \u003d 182.6 KJ / MOL.
3-5. Enhhaulpia Yanma-glukoz, -Rüctoz ve 25 ° C'de sukroz, -2802'ye eşittir,
-2810 ve -5644 KJ / MOL, sırasıyla. Sukrozun hidrolizinin sıcaklığını hesaplayın.
3-6. B2H6 (G) oluşumunun oluşumunun oluşumunu belirlemek T. \u003d 298 Aşağıdaki verilerden:
B2H6 (g) + 3O 2 (G) \u003d B2 O 3 (TV) + 3H20 (G), H. 1 0 \u003d -2035.6 KJ / MOL
2b (TV) + 3/2 02 (G) \u003d B 2 O 3 (TV), H. 2 0 \u003d -1273.5 KJ / MOL,
H2 (g) + 1/2 02 (g) \u003d H20 (g), H. 3 0 \u003d -2241.8 KJ / MOL.
3-7. Çinko sülfat oluşumunun ısısını basit maddelerden hesaplayın. T. \u003d 298 K Aşağıdaki verilere göre.