Iónová výmena. Ionity a ich klasifikácia
Prečítajte si tiež
Výmenná kapacita
Na kvantitatívnu charakterizáciu iónomeničových a sorpčných vlastností iónomeničov sa používajú tieto hodnoty: celková, dynamická a pracovná výmenná kapacita.
Celková výmenná kapacita(POE) je určený počtom funkčných skupín schopných výmeny iónov na jednotku hmotnosti vzduchom vysušeného alebo napučaného iónomeniča a je vyjadrený v mg-ekv. / g alebo m-ekv. / l. Je to konštantná hodnota, ktorá je uvedená v pase výmenníka iónov a nezávisí od koncentrácie alebo povahy vymeneného iónu. OEU sa môže meniť (znižovať) v dôsledku tepelných, chemických alebo radiačných účinkov. V reálnych prevádzkových podmienkach OEC v priebehu času klesá v dôsledku starnutia matrice iónomeniča, nevratnej absorpcie jedovatých iónov (organická hmota, železo atď.), Ktoré blokujú funkčné skupiny.
Rovnovážna (statická) výmenná kapacita závisí od koncentrácie iónov vo vode, pH a pomeru objemov iónomeniča a roztoku počas meraní. Nevyhnutné pre výpočty technologických postupov.
Dynamická výmenná kapacita(laň) - najdôležitejší ukazovateľ v procesoch úpravy vody. V reálnych podmienkach opakovaného používania iónomeniča v sorpčnom-regeneračnom cykle nie je výmenná kapacita využitá úplne, ale iba čiastočne.
Stupeň použitia je určený spôsobom regenerácie a spotrebou regeneračného činidla, dobou kontaktu iónomeniča s vodou a regeneračným činidlom, koncentráciou solí, pH, konštrukciou a hydrodynamikou použitého zariadenia. . Obrázok ukazuje, že proces čistenia vody sa spravidla zastaví pri určitej koncentrácii obmedzujúceho iónu dlho pred úplným nasýtením iónomeniča. Počet iónov absorbovaných v tomto prípade, zodpovedajúci oblasti obdĺžnika A, vzťahujúcej sa na objem iónomeniča, bude DOE.
Počet absorbovaných iónov zodpovedajúci úplnej saturácii, keď je sklz rovný 1, zodpovedajúci súčtu DOE a oblasti tieňovaného obrázku nad krivkou v tvare S, sa nazýva celková dynamická výmenná kapacita (TDC) . V typických procesoch úpravy vody DOE zvyčajne nepresahuje 0,4-0,7 POU.
Ryža. jeden
experimentálna časť
Činidlá a roztoky: soli MgCl2 * 6H2O v destilovanej vode v odmernej banke s objemom 250 cm 3
Roztok 1 dusičnanu vápenatého (0,02 M) sa pripravil rozpustením odváženej časti (1,18 g) soli Ca (NO3) 2,4H20. Po rozpustení vzorky bol roztok nariedený v destilovanej vode v odmernej banke s objemom 250 cm3.
Roztok 2 dusičnanu vápenatého (О.1М) sa pripraví rozpustením odváženej časti (5,09 g) soli Ca (NO3) 2,4,420. Po rozpustení vzorky bol roztok nariedený v destilovanej vode v odmernej banke s objemom 250 cm3.
Komplexónový zásobný roztok III pripravené z ustaľovača. Štandardizácia sa uskutočnila pomocou síranu horečnatého.
Pufrovacie roztoky boli pripravené z analytického stupňa NH4CI a NH40H.
Zostatková koncentrácia iónov Mg 2+ bola stanovená komplexometricky pomocou indikátora eriochrómovej černe T.
Zvyšková koncentrácia iónov Ca2+ sa stanovila komplexometricky pomocou indikátora murexidu.
Adsorbovaná koncentrácia bola zistená rozdielom medzi počiatočnou a zvyškovou.
Ako sorbent bola použitá hornina obsahujúca zeolit Atyashevského prejavu.
Príprava sorbentu.
DSP Atyashevsky manifestácia bola rozdrvená, preosiata, zhromaždené frakcie granúl s veľkosťou 1 - 2 - 3 mm a sušené v sušiarni.
Kapacita iónovej výmeny v statickom režime. Do 20 cm 3 roztoku obsahujúceho ióny Ca 2+, v inom prípade Mg 2+, so známou koncentráciou a
Pridalo sa 5,0 g sorbentu pri určitej hodnote pH, trepalo sa špecifikovaný čas a tuhá fáza sa oddelila filtráciou. IN
Selektivitu chelatometrickej titrácie vo vzťahu k vápniku je možné zvýšiť stanovením v silne zásaditom prostredí (zvyšková koncentrácia iónov Ca 2+ sa stanoví vo filtráte horečnatom, v druhom prípade Mg 2+. Adsorbovaná koncentrácia bola zistené rozdielom medzi počiatočným a zvyškovým.
Metallochromickým indikátorom je murexid.
EDTA, 0,05 M roztok; zmes tlmivého roztoku amoniaku pH = 9; NaOH, 2M roztok; ukazovatele - eriochrómová čierna T a murexid - tuhá látka (zmes s NaCl v pomere 1: 100).
Metóda stanovenia
1. Vzorka analyzovaného roztoku sa preniesla do titračnej banky, pridalo sa 10 cm3 zmesi tlmivého roztoku amoniaku (pH 9), 25 cm3 destilovanej vody a na špičku špachtle 30–40 mg eriochrómovej černe T a systém sa odvážil, kým sa indikátor úplne nerozpustil. Roztok nabral vínovo červenú farbu. Titrácia roztokom EDTA sa uskutočňovala po kvapkách z byrety za stáleho miešania, kým sa farba nezmenila na čistú modrú.
2. Vzorka analyzovaného roztoku sa preniesla do titračnej banky, pridalo sa 5 cm3 2M roztoku NaOH, 30 cm3 destilovanej vody a 30 mg murexidu na špičke špachtle. Roztok zčervenal. Titrácia sa uskutočňovala s roztokom EDTA, kým farba nezafarbila.
Výpočet štatistických podmienok vo vzťahu k iónom vápnika a horčíka.
Stanovenie výmennej kapacity pre horčík
K 20 cm3 roztoku chloridu horečnatého s molárnou koncentráciou ekvivalentu 0,02 mol / l bolo pridaných 5,0 g sorbentu, ktorý bol predtým sušený pri teplote 105 ° C počas 1 hodiny a trepaný počas špecifikovaného času (0,5 hodiny). V opačnom prípade 1 hodinu a tak ďalej. Na konci času bol roztok odfiltrovaný. Na analýzu sme odobrali 5 cm3 filtrátu a stanovili zvyškovú koncentráciu iónov Mg2+ komplexometrickou metódou.
2. K 20 cm3 roztoku chloridu vápenatého s molárnou koncentráciou ekvivalentnou 0, l mol / l sa pridalo 5,0 g sorbentu, predtým sušeného 1 hodinu pri 1050 ° C, a trepalo sa špecifikovaný čas (0,5 hodiny). ). V opačnom prípade 1 hodinu a tak ďalej. Na konci času bol roztok odfiltrovaný. Na analýzu sme odobrali 5 cm3 filtrátu a komplexometrickou metódou sme stanovili zvyškovú koncentráciu iónov Ca2 +.
Vplyv času kontaktu CSP a roztoku CaCl2 * 4H2O na výmennú kapacitu CSP za statických podmienok.
(C (Ca2 +) ref = 0,1 mol / l; mcsp = 5,0 g)
So zvýšením času kontaktu fáz sa pozoruje zvýšenie rovnovážnej koncentrácie. A po 3 hodinách sa vytvorí dynamické pohyblivé vyváženie.
6. Obmedzenie doby platnosti bolo odstránené podľa protokolu N 5-94 Medzištátnej rady pre normalizáciu, metrológiu a certifikáciu (IUS 11-12-94)
7. EDÍCIA (január 2002) s dodatkom (IUS 3-91)
Táto norma platí pre iónomeniče a ustanovuje metódy na určenie kapacity dynamickej výmeny s úplnou regeneráciou iónomeniča a s danou spotrebou regeneračnej látky.
Metódy spočívajú v určení množstva iónov absorbovaných z pracovného roztoku jednotkovým objemom napučaného iónomeniča s kontinuálnym prietokom roztoku vrstvou iónomeniča.
1. METÓDA ODBERU VZORIEK
1. METÓDA ODBERU VZORIEK
1.1. Metóda odberu vzoriek je uvedená v regulačnej a technickej dokumentácii konkrétneho výrobku.
1.2. V prípade iónomeničov, v ktorých je hmotnostný podiel vlhkosti menší ako 30%, sa odoberie vzorka (100 ± 10) g. Na napučanie sa vzorka vloží do pohára s objemom 600 ml a naleje sa nasýteným roztokom. chloridu sodného, ktorý by mal nadbytočne pokrývať vrstvu iónomeniča, berúc do úvahy jeho napučiavaciu kapacitu. Po 5 hodinách sa iónomenič premyje destilovanou vodou.
1.3. V prípade iónomeničov s hmotnostným zlomkom vlhkosti viac ako 30%sa vzorka (150 ± 10) g odoberie do pohára s objemom 600 ml a naleje sa 200 ml destilovanej vody.
2. ČINIDLÁ, RIEŠENIA, TABULE, NÁSTROJE
Destilovaná voda podľa GOST 6709 alebo demineralizovaná voda, ktorá spĺňa požiadavky GOST 6709.
Chlorid bárnatý podľa GOST 742, chemicky čistý, roztok s hmotnostným zlomkom 10%.
Chemicky čistý roztok chloridu vápenatého 2-voda (CaCl = 0,01 mol / dm (0,01 N) a (CaCl) = 0,0035 mol / dm (0,0035 N)).
Kyselina chlorovodíková podľa GOST 3118, chemicky čistá, roztoky s hmotnostným zlomkom 5% a koncentráciami (HCl) = 0,5 mol / dm (0,5 N), (HCl) = 0,1 mol / dm (0, 1 N) a ( HCl) = 0,0035 mol / dm (0,0035 N).
Kyselina sírová podľa GOST 4204, chemicky čistá, roztoky s hmotnostným zlomkom 1%, koncentrácia (HSO) = 0,5 mol / dm (0,5 N).
Hydroxid sodný podľa GOST 4328, chemicky čistý, roztoky s hmotnostným zlomkom 2, 4, 5%, koncentrácie (NaOH) = 0,5 mol / dm (0,5 N), (NaOH) = 0,1 mol / dm (0,1 N), (NaOH) = 0,0035 mol / dm (0,0035 N).
Chlorid sodný podľa GOST 4233, chemicky čistý, nasýtený roztok a koncentrácia roztoku (NaCl) = 0,01 mol / dm (0,01 N).
Zmiešaný indikátor pozostávajúci z metylovej červenej a metylénovej modrej alebo metylovej červenej a brómkrezolovej zelene sa pripraví v súlade s GOST 4919.1.
Indikátor metylová oranžová alebo metylová červená, roztok s hmotnostným zlomkom 0,1%, sa pripraví v súlade s GOST 4919.1.
Indikátor fenolftaleín, alkoholový roztok s hmotnostným zlomkom 1%, sa pripravuje v súlade s GOST 4919.1.
Chemické nasiakavé vápno KHPI-1 v súlade s GOST 6755 alebo sodné vápno.
Skúmavka (chlorid vápenatý) podľa GOST 25336.
Kádinka 1000 v súlade s GOST 1770.
Valce podľa GOST 1770 verzie 1-4 s objemom 100 a 250 cm a verzie 1, 2 s objemom 500 a 1000 cm.
Okuliare B alebo H v súlade s GOST 25336 v akejkoľvek verzii s objemom 600 a 1 000 cm3.
Banky Kn-1-250 v súlade s GOST 25336.
Pipety 2-2-100, 2-2-25, 2-2-20 a 2-2-10 podľa NTD.
Byrety podľa NTD typov 1, 2, verzie 1-5, triedy presnosti 1, 2, s kapacitou 25 alebo 50 cm, s delením nie viac ako 0,1 cm a byrety typu 1, 2, verzia 6, presnosť triedy 1, 2, s objemom 2 alebo 5 cm3, s odstupňovaním najviac 0,02 cm3.
Odmerné banky výkonov 1, 2 v súlade s GOST 1770, triedy presnosti 1, 2, s objemom 10, 25 a 100 ml.
Sito s riadiacou mriežkou 0315K v súlade s GOST 6613 s plášťom s priemerom 200 mm.
Pohár ChKTs-5000 v súlade s GOST 25336 alebo vyrobený z polymerizačného materiálu, dostatočný na umiestnenie sita do neho.
Laboratórne zariadenie (pozri výkres) pozostáva z fľaše 1 a sklenenej kolóny 6 s vnútorným priemerom (25,0 ± 1,0) mm a výškou najmenej 600 mm na stanovenie kapacity dynamickej výmeny za podmienok úplnej regenerácie iónomeniča. a vnútorným priemerom (16,0 ± 0,5) mm a výškou najmenej 850 mm na stanovenie za podmienok daného prietoku regeneračnej látky. Filter 7 typu FKP POR 250 XC podľa GOST 25336 alebo iného filtračného zariadenia, ktoré je odolné voči pôsobeniu kyselín a zásad, neumožňuje zrná výmenníka iónov väčšie ako 0,25 mm a s nízkou filtračnou odolnosťou sú spájkované do spodná časť stĺpca. Stĺpec je spojený s fľašou pomocou sklenenej trubice 3 a gumovej hadice 4 so skrutkovou svorkou 5. Aby sa zabránilo vnikaniu oxidu uhličitého zo vzduchu do roztoku hydroxidu sodného, použije sa trubica 2 chloridu vápenatého s absorbérom KhPI-1. je nainštalovaný vo viečku fľaše.
Laboratórne nastavenie
Je dovolené používať iné meracie prístroje s metrologickými vlastnosťami, ktoré nie sú horšie ako špecifikované, ako aj reagenty kvality, ktoré nie sú nižšie ako uvedené.
3. METÓDA NA STANOVENIE KAPACITY DYNAMICKEJ VÝMENY S ÚPLNOU REGENERÁCIOU IONITU
3.1. Príprava na test
3.1.1. Príprava na testovanie sa vykonáva v súlade s GOST 10896 a po príprave sa iónomenič uchováva v uzavretej banke pod vrstvou destilovanej vody.
Výmenník katiónov KU-2-8chS a aniónový výmenník AV-17-8chS nie sú pripravené na testovanie v súlade s GOST 10896.
3.1.2. Vzorka iónomeniča z banky vo forme vodnej suspenzie sa prenesie do valca s objemom 100 cm3 a vrstva iónomeniča sa zhutňuje poklepaním na tvrdý povrch dna valca, až kým sa zmršťovanie nezastaví. Objem živice sa upraví na 100 cm3 a živica sa prenesie do kolóny pomocou destilovanej vody, pričom sa zabezpečí, aby sa medzi granuly živice nedostali žiadne vzduchové bubliny. Prebytočná voda sa odvedie zo stĺpca a ponechá vrstvu 1–2 cm vysokú nad úrovňou iónomeniča.
3.1.3. Iónomenič v kolóne sa premyje destilovanou vodou a prechádza ňou zhora nadol rýchlosťou 1,0 dm3 / h. V tomto prípade sa aniónový výmenník premyje z alkálie (podľa fenolftaleínu) a výmenník katiónov z kyseliny (podľa metylovej oranžovej).
3.1.4. Silne zásadité aniónomeniče v hydroxylovej forme sa rýchlo nabijú a premyjú vodou bez oxidu uhličitého.
3.2. Testovanie
3.2.1. Stanovenie dynamickej výmennej kapacity iónomeničov pozostáva z niekoľkých cyklov, z ktorých každý zahŕňa tri sekvenčné operácie - saturácia, regenerácia, premývanie, ktorých podmienky sú uvedené v tabuľke 1.
stôl 1
Podmienky na určenie kapacity dynamickej výmeny s úplnou regeneráciou iónomeniča
Register | Trieda iónomeničov | Pracovný roztok na nasýtenie iónomeničov | Kontrola sýtosti | Regeneračné | |||
sýtiaci | pranie | regenerácia |
|||||
Dynamická výmenná kapacita pred prelomom () | Silne- | Chlorid vápenatý (CaCl) = 0,01 mol / dm (0,01 N.) | Na koncentráciu iónov vápnika vo filtráte (Ca) = 0,05 mmol / dm (0,05 mg ekv. / Dm) sa stanoví podľa GOST 4151 | Kyselina chlorovodíková, roztok s hmotnostným zlomkom 5% | |||
Silne- | Chlorid sodný (NaCl) = 0,01 mol / dm (0,01 N.) | Kým koncentrácia alkálie neklesne o 0,5 mmol / dm (0,5 mg ekv. / Dm) v porovnaní s jeho maximálnou stabilnou hodnotou vo filtráte [zmiešaný indikátor, titračný roztok, koncentrácia kyseliny chlorovodíkovej (HCl) = 0,01 mol / dm (0,01 N. )] a kým sa obsah iónov chlóru nezvýši v porovnaní s jeho stabilným obsahom vo filtráte (stanovené podľa GOST 15615) | Hydroxid sodný, roztok s hmotnostným zlomkom 5% | ||||
Slabé- | Predtým, ako sa vo filtráte objaví kyselina (metylová oranžová) | ||||||
Plná dynamická výmenná kapacita () | Slabé- | Kyselina chlorovodíková (HCl) = 0,1 mol / dm (0,1 N.) | Pred vyrovnaním koncentrácie filtrátu s koncentráciou pracovného roztoku | Hydroxid sodný, roztok s hmotnostným zlomkom 2% | |||
Poznámky:
1. Pri určovaní koncentrácie iónov Ca v súlade s GOST 4151
2. Špecifické zaťaženie je objem roztoku, ktorý prešiel objemom iónomeniča za 1 hodinu. Napríklad 5 dm / dm · h zodpovedá rýchlosti filtrácie, ktorou prejde 500 cm roztoku (8,3 cm / min). 100 cm iónomeniča za 1 hodinu ....
3. Rýchlosť filtrácie sa nastaví odmeraním objemu filtrátu získaného v určitom časovom intervale v odmernom valci.
Roztoky a voda sa privádzajú zhora nadol. Pri nasýtení aniónového výmenníka stupňov AN-1 a AN-2FN sa roztoky privádzajú zdola nahor.
3.2.2 Pred vykonaním operácií nasýtenia, regenerácie a premytia sa kolóna naplní vhodným roztokom. Vrstva roztoku nad iónomeničom by mala mať (15 ± 3) cm.
3.2.3. Po nasýtení, regenerácii a premytí sa v stĺpci nad iónomeničom ponechá vrstva kvapaliny s výškou 1 až 2 cm.
3.2.4. Stĺpec s iónomeničom je naplnený pracovným roztokom pre špecifickú triedu iónomeniča (pozri tabuľku 1) tak, aby vrstva roztoku nad iónomeničom bola (15 ± 3) cm a bola zvolená vhodná rýchlosť filtrácie.
Keď pracovné roztoky s koncentráciou 0,1 mol / dm (0,1 N) prechádzajú stĺpcom s iónomeničom, filtrát sa zachytáva vo valcoch s objemom 250 ml pri koncentrácii 0,01 mol / dm (0,01 N) - vo valcoch s objemom 1 000 cm. V druhom a nasledujúcom cykle nasýtenia pred objavením sa iónov pracovného roztoku vo filtráte (stanovené po prvom cykle) sa filtrát zachytí v dávkach 100 a 250 cm3, v uvedenom poradí. koncentrácie pracovného roztoku.
3.2.5. Z každej časti filtrátu sa odoberie vzorka a nasýtenie sa kontroluje podľa tabuľky 1.
3.2.6. Potom, čo sa ióny pracovného roztoku objavia v časti filtrátu, vypočíta sa celkový objem filtrátu.
3.2.7. Aby sa určila plná kapacita dynamickej výmeny, roztok sa ďalej nechá prechádzať, kým sa koncentrácia filtrátu nevyrovná koncentrácii pracovného roztoku. Kontrola nasýtenia sa v tomto prípade vykonáva titráciou vzorky kyslým roztokom (hydroxidom sodným) so zmiešaným indikátorom, kým sa farba nezmení.
3.2.8. Pred vykonaním regenerácie sa iónomenič v kolóne uvoľní prúdom destilovanej vody zdola nahor, aby boli všetky zrná iónomeniča v pohybe. Pred operáciou nasýtenia sa vykoná spätné preplachovanie katiónového výmenníka KU-1 a aniónových výmenníkov AN-1 a AN-2FN.
3.2.9. Regenerácia iónomeniča sa vykonáva kyslým roztokom (hydroxidom sodným) rýchlosťou uvedenou v tabuľke 1. Filtrát sa kontinuálne zhromažďuje po častiach s valcom s objemom 250-1 000 cm3 a pridajú sa 3-4 kvapky indikátora. Keď sa vo filtráte objaví kyselina (hydroxid sodný), stanoví sa jej koncentrácia v nasledujúcich častiach. Na kontrolu filtrátu sa vzorka odoberie pipetou alebo odmernou bankou a titruje sa roztokom koncentrácie kyseliny (hydroxidu sodného) (HCl, HSO) = 0,5 mol / dm (0,5 N), (NaOH) = 0,5 mol / dm (0, 5 n.) Za prítomnosti indikátora
3.2.10. Kyslý roztok (hydroxid sodný) sa nechá prechádzať, kým sa koncentrácia filtrátu nevyrovná koncentrácii regeneračného roztoku.
3.2.11. Po regenerácii sa iónomenič premyje destilovanou vodou až do neutrálnej reakcie v metylovej oranžovej (fenolftaleín) rýchlosťou uvedenou v tabuľke 1. Potom sa iónomenič ponechá 1 hodinu v destilovanej vode a filtrát sa znova skontroluje. Ak filtrát nie je neutrálny, iónomenič sa znova premyje.
3.2.12. Stanovenie kapacity dynamickej výmeny je dokončené, ak sú výsledky získané v posledných dvoch cykloch, pričom rozdiel medzi nimi nepresahuje 5% priemerného výsledku.
3.2.13. Dynamická výmenná kapacita aniónového výmenníka AV-17-8chS sa určuje na dvoch paralelných vzorkách podľa prvého cyklu nasýtenia, než sa vo filtráte objavia ióny pracovného roztoku. Filtrát sa odoberá po častiach po 250 cm, pričom sa berie do úvahy aritmetický priemer výsledkov dvoch stanovení, pričom prípustná odchýlka medzi nimi nepresahuje 5% priemerného výsledku.
(Dodatok, ICS 3-91).
4. METÓDA STANOVENIA KAPACITY DYNAMICKEJ VÝMENY S UVEDENOU REGENERAČNOU LÁTKOU
4.1. Príprava na test
4.1.1. Ionit vybraný podľa odsekov 1.2 a 1.3 sa oddelí od malých frakcií metódou mokrého preosievania podľa GOST 10900 pomocou sita s okami N 0315K.
4.1.2. Preosiaty anionit sa vloží do pohára, naleje sa 500 ml roztoku hydroxidu sodného s hmotnostným zlomkom 4% a mieša sa. Po 4 hodinách sa roztok hydroxidu vyleje a aniónomenič sa premýva vodou až do slabo zásaditej reakcie s fenolftaleínom a prevedie sa do kolóny, ako je opísané v ustanovení 3.1.2.
4.1.3. Preosievaný katiónový výmenník sa premyje zo suspenzie a zákalu destilovanou vodou dekantáciou, až kým sa neobjaví ľahká premývacia voda, a prenesie sa do kolóny v súlade s ustanovením 3.1.2.
4.2. Testovanie
4.2.1. Stanovenie dynamickej výmennej kapacity iónomeničov pred objavením sa iónov pracovného roztoku vo filtráte () pozostáva z niekoľkých cyklov, z ktorých každý zahŕňa tri po sebe nasledujúce operácie - saturácia, regenerácia, premývanie, ktorých podmienky sú uvedené v tabuľke 2. Roztoky a voda sa privádzajú zhora nadol. Výška vrstvy kvapaliny nad úrovňou iónomeniča sa nastaví podľa ustanovení 3.2.2 a 3.2.3.
tabuľka 2
Podmienky na stanovenie dynamickej výmennej kapacity iónomeničov pri danej spotrebe regenerujúcej látky
Trieda iónomeničov | Regeneračné | Špecifická spotreba regenerácie | Kontrola čistenia | Pracovný roztok na nasýtenie iónomeniča | Kontrola sýtosti | Rýchlosť filtrácie |
||
sýtosť | umyť | reg- |
||||||
Silne | Kým zvyšková koncentrácia kyseliny vo filtráte nie je väčšia ako | Chlorid vápenatý (CaCl = 0,0035 mol / dm3 (0,0035 N.) | Kým koncentrácia iónov vápnika vo filtráte nie je väčšia (Ca) = 0,05 mmol / dm | |||||
Slabé- | Kyselina sírová, roztok s hmotnostným zlomkom 1% | Do neprítomnosti sulfatácie vo filtráte (vzorka s BaCl v prítomnosti HCl) | Hydroxid sodný (NaOH) = 0,0035 mol / l (0,0035 N.) | Na koncentráciu hydroxidu sodného (NaOH) vo filtráte = 0,1 mmol / dm | ||||
Silne- | Hydroxid sodný s hmotnostným zlomkom 4% | Kým zvyšková koncentrácia hydroxidu sodného vo filtráte nie je väčšia (NaOH) = 0,2 mmol / dm | Chlorid sodný (NaCl) = 0,01 mol / dm (0,01 N.) | Kým sa koncentrácia alkálie nezníži o (NaOH) = 0,7 mmol / dm | ||||
Slabé- | Hydroxid sodný, roztok s hmotnostným zlomkom 4% | Kým zvyšková koncentrácia hydroxidu sodného vo filtráte nie je väčšia ako (NaOH) = 0,2 mmol / dm (0,2 mg ekv. / Dm) pre fenolftaleín | Kyselina chlorovodíková (HCl, HSO) = 0,0035 mol / dm (0,0035 N.) | Kým koncentrácia zvyškovej kyseliny vo filtráte nie je väčšia ako (H) = 0,1 mmol / dm (0,1 mg ekv. / Dm), indikátor je zmiešaný, titračným roztokom je koncentrácia hydroxidu sodného (NaOH) = 0,01 mol / dm (0 , 01 N.) | ||||
Poznámky:
1. Pri vyjadrení rýchlosti špecifickej spotreby regeneračnej látky () v gramoch na mol slovo „mol“ znamená molárnu hmotnosť iónového ekvivalentu (Na, K, Ca, Mg, Cl, NO, HCO, HSO, CO, SO
Atď.).
2. Skutočná spotreba regeneračnej látky by sa nemala líšiť od stanovenej sadzby o viac ako 5%.
3. Pri určovaní koncentrácie iónov Ca v súlade s GOST 4151 je dovolené použiť 2-3 kvapky chrómovo-tmavomodrého indikátora a titrovať roztokom koncentrácie Trilonu B (NaHCON · 2HO) = 0,01 mol / dm (0,01
4. Špecifické zaťaženie je objem roztoku, ktorý prešiel objemom iónomeniča za 1 hodinu. Napríklad 5 dm / dm · h zodpovedá rýchlosti filtrácie, ktorou prejde 500 cm roztoku (8,3 cm / min). 100 cm iónomeniča za 1 hodinu ....
5. Rýchlosť filtrácie sa nastaví odmeraním objemu filtrátu získaného v určitom časovom intervale v odmernom valci.
Aby sa zabránilo omietnutiu katiónovej živice, regenerácia kyselinou a premývanie regeneračných produktov sa vykonávajú bez prerušenia, pričom sa zabráni prestávke medzi operáciami.
Pred vykonaním každého nasledujúceho cyklu sa iónomenič uvoľní prúdom vody zdola nahor, aby boli všetky zrná iónomeniča v pohybe.
4.2.2. Cez iónomenič v kolóne prechádza regeneračný roztok, ktorého objem () v kubických centimetroch sa vypočíta podľa vzorca
kde je špecifikovaná rýchlosť špecifickej spotreby regenerujúcej látky, g / mol (g / g · ekv.);
- dynamická výmenná kapacita; vyberať podľa normatívnej a technickej dokumentácie pre konkrétny iónomenič, mol / m (g ekv. / m); pre iónomeniče značiek AV-17-8, AN-31 a EDE-10P je pri prvej regenerácii povolená zvýšená hodnota kapacity dynamickej výmeny až na 3;
- objem vzorky iónomeniča, cm;
- koncentrácia regeneračného roztoku, g / dm3.
Množstvo regeneračného roztoku sa meria na výstupe z kolóny pomocou valca alebo kadičky. Potom sa kolóna odpojí, hladina roztoku nad iónomeničom v kolóne sa zníži na 1-2 cm a spodná sa uzavrie.
4.2.3. Po regenerácii sa iónomeniče premyjú destilovanou vodou, aby sa odstránila prebytočná kyselina (hydroxid sodný) rýchlosťou uvedenou v tabuľke 2.
Pravidelne odoberajte vzorku filtrátu a titrujte roztokmi koncentrácie hydroxidu sodného (kyselina) (NaOH, HCl, HSO) = 0,1 mol / l (0,1 N) v prítomnosti metyloranžovej (fenolftaleínu).
Umývanie je riadené podľa tabuľky 2.
4.2.4. Po premytí sa kolóna naplní pracovným roztokom a rýchlosť nasýtenia sa nastaví podľa tabuľky 2.
Pri prechode pracovných roztokov s koncentráciou 0,01 mol / dm (0,01 N) kolónou sa filtrát zachytí do valca s objemom 250 ml pri koncentrácii 0,0035 mol / dm (0,0035 N), valca s použije sa objem 1 000 ml. v druhom a nasledujúcich saturačných cykloch pred objavením sa iónov pracovného roztoku vo filtráte (stanovené po prvom cykle) sa filtrát zachytí pri 100 cm a 250 cm3, v uvedenom poradí, na koncentrácie pracovné riešenie.
4.2.5. Na kontrolu nasýtenia sa z časti filtrátu odoberie vzorka a analyzuje sa podľa tabuľky 2. Ak výsledok analýzy ukazuje, že úroveň nasýtenia nedosiahla hodnoty uvedené v tabuľke 2, všetky predchádzajúce vzorky filtrátu sa nemusia analyzovať.
4.2.6. Potom, čo sa ióny pracovného roztoku objavia v časti filtrátu v množstvách uvedených v tabuľke 2, saturácia sa dokončí a vypočíta sa celkový objem filtrátu () a dynamická výmenná kapacita.
4.2.7. Iónomenič sa podrobí druhej regenerácii a premyje sa v súlade s ustanoveniami 4.2.2 a 4.2.3.
Pri výpočte regeneračnej látky potrebnej pre druhý cyklus použite hodnotu dynamickej výmennej kapacity získanú v prvom cykle v súlade s ustanovením 4.2.6.
Pred vykonaním nasledujúcich cyklov nasýtenia sa spotreba regeneračnej látky vypočíta z hodnoty dynamickej výmennej kapacity získanej v predchádzajúcom cykle.
4.2.8. Stanovenie je dokončené, ak sú v posledných dvoch cykloch získané výsledky, ktorých prípustné odchýlky medzi nimi nepresahujú 5% priemerného výsledku, pričom skutočná špecifická spotreba regeneračnej látky sa líši od špecifikovanej rýchlosti maximálne o 5%. .
5. SPRACOVANIE VÝSLEDKOV
5.1. Dynamická výmenná kapacita () v móloch na meter kubický (g ekv. / M) pred objavením sa iónov pracovného roztoku vo filtráte sa vypočíta podľa vzorca
kde je celkový objem filtrátu, ktorý prešiel iónomeničom, než sa objavia ióny pracovného roztoku, cm;
- objem iónomeniča, pozri
5.2. Skutočná spotreba regenerujúcej látky () v gramoch na mol (g / g ekv.) Absorbovaných iónov sa vypočíta podľa vzorca
kde je objem regeneračného roztoku, cm;
- koncentrácia regeneračného roztoku, g / dm 3;
- celkový objem filtrátu prešiel cez iónomenič predtým, ako sa objavia ióny pracovného roztoku, cm;
- koncentrácia pracovného roztoku, mol / dm3 (n.
5.3. Celková dynamická výmenná kapacita () v móloch na meter kubický (g ekv. / M) sa vypočíta podľa vzorca
kde je celkový objem filtrátu, ktorý prešiel cez iónomenič, aby sa vyrovnali koncentrácie filtrátu a pracovného roztoku, cm;
- koncentrácia pracovného roztoku, mol / dm (n);
- objem časti filtrátu po výskyte iónov pracovného roztoku (prienik), cm;
- koncentrácia roztoku v časti filtrátu po objavení iónov pracovného roztoku (prienik), mol / dm (n);
- objem iónomeniča,
5.4. Ako výsledok stanovenia sa berie aritmetický priemer výsledkov posledných dvoch cyklov, pričom povolené odchýlky medzi nimi nepresahujú ± 5%s úrovňou spoľahlivosti 0,95.
Poznámka. Pri vyjadrení dynamickej výmennej kapacity iónomeničov v móloch na meter kubický slovo „mol“ znamená molárnu hmotnosť ekvivalentu iónu (Na, K, Ca, Mg, Cl, NO, HCO, HSO, CO, SO atď. .).
Text dokumentu overuje:
oficiálna publikácia
Ionity. Metódy stanovenia
výmenná kapacita: so. GOST. -
Moskva: Vydavateľstvo IPK Standards, 2002
Všeobecné pojmy
Obecne sa kapacita iónomeničovej živice vzťahuje na množstvo iónov, ktoré môže byť absorbované daným objemom živice. Navyše jednotky na meranie kapacity živice môžu byť rôzne. Napríklad meq / ml (meq / ml), g-eq / l (ekv. / L) alebo kilogran na kubickú stopu (Kgr / ft3). Keď je známa ekvivalentná hmotnosť látky, je možné vypočítať kapacitu živice. Ekvivalentná hmotnosť látky je definovaná ako pomer molárnej hmotnosti látky k jej valencii (striktne povedané k číslu ekvivalencie látky). Molárna hmotnosť vápnika je napríklad 40 g / mol a valencia je 2, potom je ekvivalentná hmotnosť 20 g / mol (40/2 = 20). Iontomeničová živica s výmennou kapacitou 1,95 g-ekv. / L je schopná extrahovať z roztoku 1,95 x 20 = 39 gramov na 1 liter živice.
V praxi je výmenná kapacita živice stanovená v laboratóriách titráciou. Kolóna sa nechá prejsť roztokom hydroxidu sodného (NaOH), do ktorého sa odvážená časť výmenníka katiónov umiestni do vodíkovej formy (H-forma). Časť iónov Na + sa vymení za ióny vodíka. Hydroxid sodný, ktorý nereaguje s iónovou skupinou živice, sa titruje kyselinou. Odpočítaním zvyškovej koncentrácie od počiatočnej koncentrácie hydroxidu sodného sa dá určiť kapacita výmenníka katiónov. Ďalším spôsobom, ako určiť kapacitu výmeny iónov, je prechod roztoku chloridu vápenatého cez vrstvu živice. Podobne sa stanoví kapacita aniónomeničovej živice (v OH-forme), ktorou prechádza kyslý roztok.
Kapacitu živice je možné merať v meq / ml (objem) alebo meq / g (hmotnosť). Ak je stanovená kapacita vyjadrená v meq / g (a to sa týka hmotnosti suchého iónomeniča), potom je pri znalosti obsahu vlhkosti živice ľahké prejsť na meq / ml.
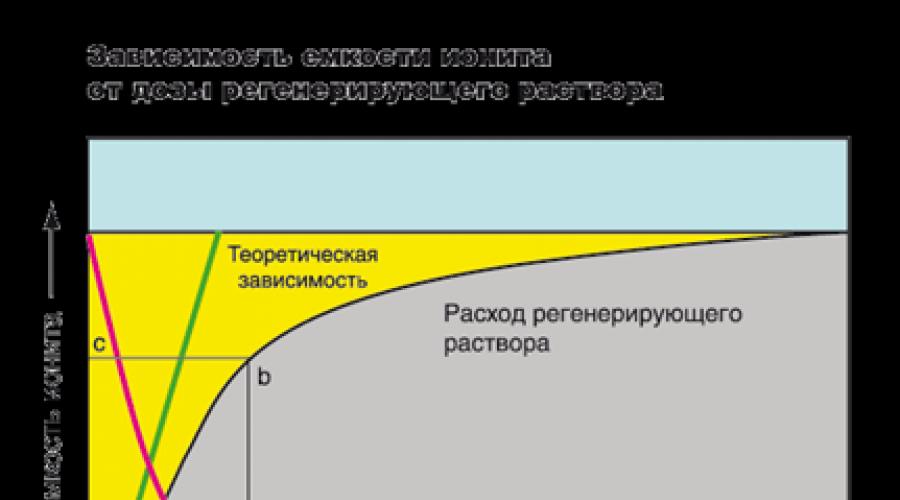
Na obrázku je výmenná kapacita živice graficky znázornená žltou oblasťou umiestnenou medzi zvislými čiarami AN a CL. Sivá oblasť pod krivkou je koncentrácia iónov v upravenej vode. Na začiatku cyklu je koncentrácia iónov vo filtráte veľmi nízka a zostáva konštantná počas celého filtračného cyklu. V okamihu, keď čelo filtrácie dosiahne koniec vrstvy iónomeniča, ióny skĺznu do filtrátu (v obrázok - bod P). Toto je signál pre regeneráciu živice. Regenerácia filtra sa obvykle vykonáva pred prienikom. Napríklad v priemysle môže koncentrácia iónov tvrdosti, pri ktorej sa filter vyberie na regeneráciu, dosiahnuť hodnotu menšiu ako 0,05 0J a v systémoch zmäkčovania domácností - menej ako 0,5 0J. Dĺžka segmentu x - y zodpovedá objemu upravenej vody v litroch alebo galónoch. Plocha obrázku ANLB je celkový príjem iónov živicou a plocha obrázku ANMB je množstvo absorbovaných iónov predtým, ako dôjde k prieniku.
Keď hovoríme o kapacite, často máme na mysli pracovnú, a nie úplnú výmennú kapacitu. Pracovná kapacita nie je konštantná hodnota, závisí od mnohých faktorov: značka iónomeniča, koncentrácia a typ absorbovaných iónov, pH roztoku, požiadavky na čistenú vodu, prietok, výška iónomeničová vrstva a ďalšie požiadavky.

Dosiahnutie vysokého stupňa regenerácie iónov z vodného roztoku vyžaduje zvýšenie dávky regeneračného roztoku (červená čiara). Je však nekonečne nemožné zvýšiť koncentráciu regeneračného roztoku (zelená čiara je teoretický vzťah medzi stupňom regenerácie kapacity živice a spotrebou regeneračného roztoku). V praxi je na dosiahnutie vysokej kapacity potrebné zvýšiť množstvo živice. Počas prvého filtračného cyklu môže stupeň obnovy vlastností iónomeničov dosiahnuť 100%, ale postupom času sa táto hodnota zníži. Napríklad. väčšina výrobcov systémov na zmäkčovanie vody odporúča použiť roztok NaCl s koncentráciou 100 - 125 g / l na obnovenie kapacity výmenníka katiónov na 50 - 55% z celkovej výmennej kapacity.
Pri určovaní kapacity je potrebné poznať iónovú formu živice (soľ, kyselina, zásada). Počas regenerácie alebo počas prevádzky sa objem naplnenej živice mení, prebieha proces nazývaný „dýchanie“ živice. Tabuľka ukazuje, ako sa živice správajú v rôznych procesoch.
Rozlišujte medzi katiónovými a aniónovými výmenníkmi. Reakcie zahŕňajúce iónomeniče sú uvedené v tabuľke.
titrácia iónomeničovej živicovej reakcie

Navyše, v anglickej literatúre symbol SAC označuje silne kyslý menič katiónov, SBA je silne zásaditý výmenník aniónov, WAC je slabo kyslý menič katiónov a WBA je slabo zásaditý menič aniónov. Schopnosť iónovej výmeny je daná prítomnosťou funkčnej skupiny, silne kyslé meniče katiónov obsahujú sulfoskupinu - SO3H a slabo kyslé meniče katiónov obsahujú karboxylovú skupinu - COOH. Silne kyslé meniče katiónov si vymieňajú katióny pri akomkoľvek pH roztoku, to znamená, že sa v roztoku správajú ako silné kyseliny. A slabo kyslé meniče katiónov sú podobné slabým kyselinám a vstupujú do iónomeničovej reakcie iba pri hodnotách pH nad 7. Aniónomeniče obsahujú funkčné skupiny piatich typov: (-NH2, NH =, N?, - N (CH3) 3OH, - N (CH3) 2С2H4OH) ... Prvé tri skupiny dodávajú aniónovému výmenníku slabo zásadité vlastnosti a skupiny - N (CH3) 3OH, - N (CH3) 2С2H4OH - silne zásadité. Slabé zásadité meniče aniónov reagujú so silnými kyslými aniónmi (SO, Cl-, NO) a silne zásaditými aniónmi so silnými a slabými aniónmi (HCO, HSiO) v rozsahu pH od 1 do 14. Keď už hovoríme o kapacite silne zásaditého aniónu výmenník, treba dávať pozor na skutočnosť, že živica obsahuje funkčné skupiny vlastné slabo bázickým aniónomeničom. So starnutím silne zásaditého meniča aniónov alebo pôsobením vysokých teplôt dochádza k poklesu zásaditosti a čiastočnej deštrukcii funkčných skupín.
Pozrime sa podrobnejšie na reakcie prebiehajúce za účasti iónomeničových živíc. Reakcia 1 - zmäkčenie vody na silne kyslom meniči katiónov vo forme soli (Na), 2 - odstránenie dusičnanových iónov na silne zásaditom meniči aniónov v Cl -forme. Použitie chloridu sodného a chloridu draselného ako regeneračného roztoku prispieva k rozšírenému použitiu tohto druhu živice v každodennom živote, priemysle a čistení odpadových vôd. Katiónové výmenníky je možné tiež redukovať kyslými roztokmi (napríklad kyselinou chlorovodíkovou) a aniónomeniče - roztokom hydroxidu sodného (NaOH). V schémach prípravy demineralizovanej vody (reakcie 3 a 4) sa používajú iónomeniče vo forme H a OH. Slabo kyslý menič katiónov vykazuje vlastnosti iónovej výmeny pri vysokých hodnotách pH (reakcia 5) a slabo zásaditý menič aniónov pri nízkych hodnotách pH (reakcia 6). Reakcia 5 - súčasné zmäkčenie a zníženie zásaditosti vody. Je potrebné poznamenať, že živica WBA v dôsledku regenerácie alkalickým roztokom neprechádza do OH-formy, ale do takzvanej FB-formy (voľná báza).
Slabo kyslé meniče katiónov majú v porovnaní so silne kyslými vyššiu výmennú kapacitu, vyznačujú sa vysokou afinitou k iónom vodíka, preto regenerácia prebieha jednoduchšie a rýchlejšie. Je dôležité, aby sa na regeneráciu WAC, ako aj WBA, nepoužívali roztoky chloridu sodného alebo draslíka. Výber konkrétnej značky iónomeničovej živice závisí od mnohých podmienok. Rozlišujú sa napríklad dva typy silne zásaditých aniónomeničov: typ I (funkčná skupina - N (CH3) 3OH) a typ II (-N (CH3) 2C2H4OH). Anionity typu I absorbujú ióny HSiO lepšie ako anionity typu II, ale tieto sa vyznačujú vyššou výmennou kapacitou a lepšie sa regenerujú.
Na záver poznamenávame, že v literatúre, ako aj v pase výrobku je uvedená celková hmotnosť a výmenná kapacita živice, ktoré sú stanovené v laboratóriu. Pracovná kapacita živice je nižšia, ako uvádza výrobca, a závisí od mnohých faktorov, ktoré nie je možné vziať do úvahy v laboratórnych podmienkach (geometrické charakteristiky živicovej vrstvy, špecifické podmienky procesu: prietoky, koncentrácia rozpustených látok, stupeň regenerácia atď.).
Materiály VION sa používajú na čistenie výfukových plynov z ventilácie z priemyslu z rozpustných zložiek, aerosólov kyselín a solí ťažkých kovov, kde sa používajú hlavne vo forme netkaných vpichovaných textílií.
Pracovný postup:
Odvážte 2 g. výmenník katiónov VION KN-1 (suchý). Nalejte do byrety. Počiatočný roztok CuCl2 (3,6 mmol / l) sa nechá prejsť cez kolónu naplnenú výmenníkom katiónov. Ďalej titráciou odtrhneme 50 ml vzorky. Na základe metodiky (odsek 3.1) určíme optickú hustotu vzorky a zistíme koncentráciu medi. Výsledky sú uvedené v tabuľke 3.5.
Tabuľka 3.5
|
С, mmol / l |
||||
Bol zostavený graf závislosti koncentrácie medi vo filtráte od objemu roztoku, ktorý prešiel iónomeničom.
Ryža. 3.4
Sorpčný proces spočíva v úplnej absorpcii prvých častí katiónov výmenníkom katiónov a absorpčná oblasť sa postupne pohybuje pozdĺž kolóny k výstupu. Potom príde okamih, keď v dôsledku vyčerpania kapacity výmenníka katiónov začnú katióny zo stĺpca odchádzať. Z grafu je zrejmé, že koncentrácia medi na výstupe z kolóny sa postupne zvyšuje a má tvar krivky v tvare S, začínajúc od nulových koncentrácií po maximum. Táto krivka sa tiahne pri nízkych koncentráciách soli.
Množstvo medi absorbovanej v stĺpci až do úplného nasýtenia výmenníka katiónov bolo vypočítané ako plocha obrázku ohraničená krivkou v tvare písmena S a priamkou maximálnej koncentrácie:
n =? Vi * (Cmax - Ci) (3)
kde Vi = 50 ml,
Cmax = 3,6 mmol
h1 = 2,20 mmol.
Objemová kapacita výmenníka katiónov bola vypočítaná:
h1 = hl / m k = 2,20 / 2 = 1,10 mmol / g. katiónový výmenník.
Diskusia o výsledkoch
V priebehu experimentálnej práce bola stanovená celková výmenná kapacita troch rôznych katiónových meničov (KU-2-8, KU-1, VION KN-1). Výsledky sú uvedené na obrázku 3.5.

Celková výmenná kapacita výmenníka katiónov je úmerná ploche obrázku, obmedzená krivkou v tvare písmena S a priamkou maximálnej koncentrácie. Ako je vidieť na obrázku 3.5. Kapacity rôznych iónomeničov sú rôzne a sú menšie ako celková výmenná kapacita katiónových meničov uvedených v pase. Celková výmenná kapacita výmenníka katiónov KU-2-8 bola teda experimentálne zistená pod hodnotou pasu o 28%, celková výmenná kapacita živice KU-1 je o 57% nižšia ako hodnota pasu a OEU Výmenník katiónov VION KN-1 je o 39% nižší. Tieto údaje je potrebné vziať do úvahy pri výpočte a návrhu iónomeničov a filtrov.
Iónová výmena prebieha na adsorbentoch, ktorými sú polyelektrolyty (iónomeniče, iónomeniče, iónomeničové živice).
Iónová výmena nazýva sa proces ekvivalentnej výmeny iónov v iónomeniči za iné ióny rovnakého znamienka v roztoku. Proces iónovej výmeny je reverzibilný.
Iontové výmenníky sú rozdelené na katiónové výmenníky, aniónové výmenníky a amfotérne iónomeniče.
Výmenníky katiónov- látky obsahujúce vo svojej štruktúre fixované negatívne nabité skupiny (fixné ióny), v blízkosti ktorých sa nachádzajú mobilné katióny (protiióny), ktoré sa môžu v roztoku vymieňať s katiónmi (obr. 81).
Ryža. 81. Model polyelektrolytovej (katiónovej) matice s pevnými aniónmi a mobilnými protiiónmi, kde - sú pevné ióny;
- koióny, - protiióny
Existujú prírodné výmenníky katiónov: zeolity, permutity, silikagél, celulóza a tiež umelé: tuhé nerozpustné iónové polyméry s vysokou molekulovou hmotnosťou, ktoré najčastejšie obsahujú sulfoskupiny, karboxylovú kyselinu, kyselinu fosfinovú, kyselinu arzénovú alebo kyselinu selenovú. Menej často sa používajú syntetické anorganické katióny, ktorými sú najčastejšie hlinitokremičitany.
Podľa stupňa ionizácie ionogénnych skupín sa katiónové výmenníky delia na silne kyslé a slabo kyslé. Silne kyslé meniče katiónov sú schopné vymeniť svoje mobilné katióny za externé katióny v zásaditých, neutrálnych a kyslých médiách. Slabo kyslé meniče katiónov vymieňajú protiióny za iné katióny iba v zásaditom prostredí. Medzi silne kyslé patria katióny so silne disociovanými kyslými skupinami - kyselina sulfónová. Medzi slabo kyslé patria katiónové výmenníky obsahujúce slabo disociované kyslé skupiny - kyselina fosforečná, karboxyl, oxyfenyl.
Anióny- iónomeniče, ktoré vo svojej štruktúre obsahujú pozitívne nabité ionogénne skupiny (fixné ióny), v blízkosti ktorých sa nachádzajú mobilné anióny (protiióny), ktoré sa môžu v roztoku vymieňať s aniónmi (obr. 82). Rozlišujte prírodné a syntetické anionity.

Ryža. 82. Model matice polyelektrolytu (anión) s fixnými katiónmi a mobilnými protiiónmi, kde + - fixné ióny;
- koióny, - protiióny
Syntetické anionity obsahujú v makromolekulách pozitívne nabité ionogénne skupiny. Slabé zásadité anióny obsahujú primárne, sekundárne a terciárne aminoskupiny, silne zásadité anióny obsahujú skupiny kvartérnych óniových solí a zásad (amónne, pyridínium, sulfóniové, fosfóniové). Silne zásadité aniónomeniče vymieňajú mobilné anióny v kyslých, neutrálnych a zásaditých médiách, slabo zásadité - iba v kyslých médiách.
Amfotérne iónomeniče obsahujú katiónové aj aniónové ionogénne skupiny. Tieto iónomeniče môžu súčasne sorbovať katióny aj anióny.
Kvantitatívna charakteristika iónomeniča je celková výmenná kapacita(POE). Stanovenie OEU sa môže uskutočniť statickou alebo dynamickou metódou na základe reakcií prebiehajúcich v systéme „iónomenič - riešenie“:
RSO 3 - H + + NaOH → RSO 3 - Na + + H20
RNH3 + OH - + HCI → RNH3 + Cl - + H20
Kapacita je daná počtom ionogénnych skupín v iónomeniči a preto by teoreticky mala byť konštantná. V praxi to však závisí od mnohých podmienok. Rozlišujte medzi statickou výmennou kapacitou (COE) a dynamickou výmennou kapacitou (DOE). Statická výmenná kapacita je celková kapacita charakterizujúca celkový počet ionogénnych skupín (v miliekvivalentoch) na jednotku hmotnosti vzduchom sušeného iónomeniča alebo na jednotku objemu nabobtnaného iónomeniča. Prírodné iónomeniče majú malú kapacitu statickej výmeny, nepresahujúcu 0,2-0,3 meq / g. Pri syntetických iónomeničových živiciach sa pohybuje v rozmedzí 3 až 5 meq / g a niekedy dosahuje 10,0 meq / g.
Dynamická alebo pracovná výmenná kapacita sa týka iba tej časti iónových skupín, ktoré sa zúčastňujú výmeny iónov, ku ktorej dochádza za technologických podmienok, napríklad v iónomeničovej kolóne pri určitej relatívnej rýchlosti pohybu iónomeniča a roztoku. Dynamická kapacita závisí od rýchlosti jazdy, veľkosti stĺpca a ďalších faktorov a je vždy menšia ako kapacita statickej výmeny.
Na stanovenie kapacity statickej výmeny iónomeničov sa používajú rôzne metódy. Všetky tieto metódy sa redukujú na nasýtenie iónomeniča akýmkoľvek iónom, potom ho nahradia iným iónom a analyzujú prvý v roztoku. Napríklad je vhodné úplne previesť menič katiónov na formu H + (vodíkové ióny sú protiióny), potom ho opláchnuť roztokom chloridu sodného a výsledný kyslý roztok titrovať zásaditým roztokom. Kapacita sa rovná pomeru množstva kyseliny prechádzajúcej do roztoku k odváženej časti iónomeniča.
Pri statickej metóde sa titruje kyselina alebo zásada, ktoré sa v dôsledku adsorpcie iónovou výmenou objavia v roztoku.
Pri dynamickej metóde sa OEU stanoví pomocou chromatografických kolón. Roztok elektrolytu sa nechá prejsť kolónou naplnenou iónomeničovou živicou a zaznamenáva sa závislosť koncentrácie absorbovaného iónu vo výstupnom roztoku (eluáte) od objemu prechádzajúceho roztoku (výstupná krivka). POE sa vypočíta podľa vzorca
 , ,
| (337) |
kde V celkový - celkový objem roztoku obsahujúceho kyselinu vytesnenú zo živice; s- koncentrácia kyseliny v tomto roztoku; m Je hmotnosť iónomeničovej živice v stĺpci.
Rovnovážnu konštantu iónovej výmeny je možné určiť z údajov o rovnovážnom rozdelení iónov za statických podmienok (rovnovážny stav počas výmeny iónov je popísaný zákonom o hmotnostnom pôsobení), ako aj z dynamickej metódy podľa rýchlosti pohyb zóny látky pozdĺž živicovej vrstvy (elučná chromatografia).
Na iónomeničovú reakciu
![]()
rovnovážna konštanta je
 , ,
| (338) |
kde je koncentrácia iónov v iónomeniči; Je koncentrácia iónov v roztoku.
Použitím iónomeničov môžete zmäkčiť vodu alebo odsoliť soľnú vodu a získať ju tak vhodnú na farmaceutické účely. Ďalšou aplikáciou iónomeničovej adsorpcie vo farmácii je použiť ju na analytické účely ako metódu extrakcie jedného alebo iného analytu zo zmesí.
Príklady riešenia problémov
1. Aktívne uhlie s hmotnosťou 3 g sa umiestnilo do 60 ml roztoku s koncentráciou určitej látky 0,440 mol / l. Roztok s adsorbentom sa miešal, kým sa nestanovila rovnováha adsorpcie, v dôsledku čoho sa koncentrácia látky znížila na 0,350 mol / l. Vypočítajte adsorpčnú rýchlosť a adsorpčnú rýchlosť.
Riešenie:
Adsorpcia sa vypočíta podľa vzorca (325):

Pomocou vzorca (326) určíme stupeň adsorpcie
2. Podľa uvedených údajov pre adsorpciu difenhydramínu na povrch uhlia graficky vypočítajte konštanty Langmuirovej rovnice:
Vypočítajte adsorpciu difenhydramínu v koncentrácii 3,8 mol / l.
Riešenie:
Na grafické určenie konštánt Langmuirovej rovnice použijeme lineárnu formu tejto rovnice (327):
Vypočítajme hodnoty 1 / ale a 1 / s:
Zostavíme graf v súradniciach 1 / ale – 1/s(obr. 83).
Ryža. 83. Grafické vymedzenie konštánt Langmuirovej rovnice
V prípade, že bod NS= 0 je mimo obrázku, použite druhý spôsob y = os + b... Najprv vyberieme akékoľvek dva body ležiace na priamke (obr. 83) a určíme ich súradnice:
(·) 1 (0,15; 1,11); () 2 (0,30; 1,25).

b = y 1 - os 1 = 0,11 - 0,93 * 0,15 = 0,029.
Chápeme to b = 1/ale¥ = 0,029 μmol / m2, preto ale¥ = 34,48 μmol / m 2.
Rovnovážna konštanta adsorpcie K je definovaná nasledovne:
Vypočítajme adsorpciu difenhydramínu v koncentrácii 3,8 mol / l podľa Langmuirovej rovnice (327):
3. Pri štúdiu adsorpcie kyseliny benzoovej na tuhom adsorbente boli získané nasledujúce údaje:
Riešenie:
Na výpočet konštánt Freundlichovej rovnice je potrebné použiť lineárnu formu rovnice (332) v súradniciach lg ( x / t) – lg s izoterma vyzerá ako rovná čiara.
Nájdite hodnoty lg c a lg x / m zahrnuté v linearizovanej Freundlichovej rovnici.

| lg c | –2,22 | –1,6 | –1,275 | –0,928 |
| lg x / m | –0,356 | –0,11 | 0,017 | 0,158 |
Zostavíme graf v súradniciach lg ( x / t) – lg s(obr. 84) .
Ryža. 84. Grafická definícia konštánt Freundlichovej rovnice
Od bodu NS= 0 sa nachádza mimo obrázku (84), ktorý používame druhý spôsob určovanie koeficientov priamky y = os + b(Pozri „Úvodný blok. Základy matematického spracovania experimentálnych údajov“). Najprv vyberieme akékoľvek dva body ležiace na priamke (napríklad body 1 a 2) a určíme ich súradnice:
(·) 1 (–2,0; –0,28); (·) 2 (–1,0; 0,14).
Potom vypočítame sklon podľa vzorca:

b = r 1 - sekera 1 = –0,28 - 0,42 · (–2,0) = 0,56.
Konštanty Freundlichovej rovnice sú:
lg K = b = 0,56;K= 10 0,56 = 3,63;
1/n = a = 0,42.
Vypočítajme adsorpciu kyseliny benzoovej v koncentrácii 0,028 mol / l pomocou Freundlichovej rovnice (330):
4. Pomocou rovnice BET vypočítajte špecifický povrch adsorbentu z údajov o adsorpcii plynného dusíka:
Plocha obsadená molekulou dusíka v hustej monovrstve je 0,08 nm 2, hustota dusíka je 1,25 kg / m 3.
Riešenie:
Rovnica izotermy polymolekulárnej adsorpcie BET v lineárnej forme má tvar (333)
Na zostavenie grafu definujeme hodnoty:
Vynesenie grafu v súradniciach - p / p s(obr. 85).
Používame prvý spôsob(Pozri „Úvodný blok. Základy matematického spracovania experimentálnych údajov“) určujúce koeficienty priamky y = os + b. Určte hodnotu koeficientu podľa grafu b ako súradnica bodu ležiaceho na priamke, ktorej os x je 0 ( NS= 0): b= 5. Vyberte bod na priamke a určte jeho súradnice:
() 1 (0,2; 309).
Potom vypočítame sklon:


Ryža. 85. Grafické stanovenie konštánt rovnice BET polymolekulárnej adsorpčnej izotermickej rovnice
Konštanty rovnice BET polymolekulárnej adsorpčnej izotermy sú:
 ; .
; .
Riešením sústavy rovníc získame ale∞ = 6,6 · 10 –8 m 3 / kg.
Na výpočet limitnej hodnoty adsorpcie priradíme ale∞ až 1 mol:
 .
.
Špecifický povrch adsorbentu je určený vzorcom (329):
5. Polystyrénsulfónový katiónový výmenník vo forme H + s hmotnosťou 1 g bol zavedený do roztoku KCl s počiatočnou koncentráciou s 0 = 100 ekv. / M3 objem V= 50 ml a zmes sa udržiavala do rovnováhy. Vypočítajte rovnovážnu koncentráciu draslíka v iónomeniči, ak je konštanta rovnováhy iónomeničovej rovnováhy = 2,5, a celková výmenná kapacita meniča katiónov PEE = 5 mol-ekvivalentov / kg.
Riešenie:
Na určenie iónomeničovej konštanty používame rovnicu (338). V živici sa ióny H + vymenia za ekvivalentné množstvo iónov K
Hmotnosť výmenníka sulfónových katiónov vo forme H + je stanovená vzorcom (337):


Celkové množstvo anionitu v OH -forme sa rovná:
Hmotnosť meniča aniónov v OH - forme je tiež určená vzorcom (337):
