Wymiana jonów. Jonity i ich klasyfikacja
Pojemność wymiany
W przypadku ilościowych właściwości jonowej i właściwości sorpcji Ionivis stosuje się następujące wartości: pełny, dynamiczny i pracujący zbiornik wymiany.
Pełny zbiornik wymiany(Po.) Określone przez liczbę grup funkcyjnych zdolnych do wymiany jonowej, w jednostce masy suchej lub spuchniętej jonowej i wyraża się w MM-EQ / G lub Me-EQ / L. Jest to stała wartość wskazana w paszporcie jonatu i nie zależy od koncentracji lub charakteru wymiany jonu. Może się to różnić (zmniejszać) z powodu wpływu termicznego, chemicznego lub promieniowania. W prawdziwych warunkach zmniejsza się z czasem z powodu starzenia się matrycy jonatycznej, nieodwracalną absorpcję jonów poisonów (organicznych, żelaza itp.), Który blokuje grupy funkcyjne.
Equilibrium (statyczna) zdolność wymiany zależy od stężenia jonów w wodzie, pH i stosunku woluminów jonaty i roztworu w pomiarach. Trzeba wykonywać obliczenia procesów technologicznych.
Dynamiczny zbiornik wymiany(Codziennie) - Najważniejszy wskaźnik w procesach oczyszczania wody. W prawdziwych warunkach, wielokrotne zastosowanie jonetu w cyklu regeneracji sorpcji, zdolność wymiany nie jest w pełni stosowana, ale tylko częściowo.
Stopień zastosowania jest określany przez regenerację i szybkość przepływu środka regenerującego, czas kontaktu jonatu z wodą i środkiem regenerującym, stężenie soli, pH, konstrukcji i hydrodynamiki używanego urządzenia. Figura pokazuje, że proces oczyszczania wody jest zatrzymany w pewnym stężeniu jonów ograniczających, z reguły, na długo przed pełnym nasyceniem jonetu. Liczba jonów pochłoniętych w tym przypadku, odpowiadający objęciu prostokąta A, przypisany do objętości jonetu i będzie codziennie.
Liczba pochłoniętych jonów odpowiadających całkowitym nasyceniu, gdy Spock jest 1, odpowiadający ilości ilości i obszar zacienionej liczby powyżej krzywej S, nazywany jest całkowitą wydajnością dynamiczną (PD) . W procesach oczyszczania wody typu, zwykle nie przekracza 0,4-0,7.
Figa. jeden
Eksperymentalna część
Odczynniki i rozwiązania:mGCL2 * Sole 6H2O w wodzie destylowanej w kolbie pomiarowym o pojemności 250 cm
Roztwór azotanu wapnia (0,02 m) wytworzono przez rozpuszczenie próbki (1,18 g.) SALI CA (NO3) 2 · 4N20. Po rozpuszczeniu próbki roztwór rozcieńczono w wodzie destylowanej w kolbie pomiarowym o pojemności 250 cm.
Roztwór 2 azotan wapnia (O.1M) przygotowano przez rozpuszczenie próbki (5,09 g.) Sole CA (NO3) 2 · 4N20. Po rozpuszczeniu próbki roztwór rozcieńczono w wodzie destylowanej w kolbie pomiarowym o pojemności 250 cm.
Oryginalne rozwiązanie kompleksu III.przygotowany z Fixanal. Standaryzacja przeprowadzono zgodnie z siarczanem magnezu.
Rozwiązania buforowe przygotowane z NH4Cl "CH.D.A." i NH4OH.
Pozostałe stężenie jonów Mg 2+ określono przez kompleksowe z wskaźnikiem eryoichroma T.
Pozostałe stężenie jonów Ca 2+ określono przez kompleksowe z wskaźnikiem Murcexide.
Stężenie sorbed stwierdzono pod względem początkowego i resztkowego.
Jako sorbent był używany przez rasę zawierającą zeolitę manifestacji Artyhevsky.
Gotowanie sorbentu.
CSP Atheshevsky manifestacja zgniatania, przesianych, zebranych frakcji granulek o wielkości 1 - 2 - 3 mm i wysuszono w szafce suszącej.
Kontener jonowy w trybie statycznym. O 20 cm z roztworem zawierającym jony CA 2+ w innym przypadku, Mg 2+, ze znanym stężeniem i
pewna wartość pH dodano 5,0 g sorbentu, wstrząśnięty przez określony czas i rozdzielił fazę stałą przez filtrację. W
Selektywność miareczkowania chelametometrycznego w odniesieniu do wapnia może być poprawiona przez określenie oznaczania w silnie nośniku alkoholu (przesącz magnezu określono przez stężenie resztkowe jonów około 2+, w drugim przypadku, Mg 2+. Stwierdzono stężenie powierzchni Pod względem źródła i pozostałości.
Metalowy wskaźnik chromowy - mruki.
EDTA, 0,05 m roztwór; mieszanina buforowa AMMonium pH \u003d 9; NaOH, 2M rozwiązanie; Wskaźniki - eryoichrom czarny T i mruki - stałe (mieszanina z NACL pod względem 1: 100).
Definicja metodologii.
1. Próbka analizowanego roztworu przeniesiono do kolby miareczkową, 10 cm mieszaniny buforowej amoniowej (pH 9), dodano 25 cm3 wody destylowanej, na końcówce szpatułki 30 - 40 mg eriohrom z czarnego t przeważają, że system całkowicie rozpuścił wskaźnik. Rozwiązanie nabyte wina. Miareczkowanie roztworu EDTA przeprowadzono kroplami z brzęki z ciągłym mieszaniem do koloru koloru na wyraźnie niebieskim.
2. Próbkę analizowanego roztworu przeniesiono do kolby do miareczkowania, dodać 5 cm 3 2 m roztworu NaOH, 30 cm3 wody destylowanej i na końcówce łopatki 30 moksexide. Rozwiązanie nabyło czerwony kolor. Miareczkowanie przeprowadzono przez roztwór EDTA przed przejściem koloru w fioletowym.
Obliczanie warunków statystycznych w stosunku do jonów wapnia i magnezu.
Określenie zdolności wymiany magnezu
Przez 20 cm3 roztwór chlorku magnezu o stężeniu molowym równoważnym 0,02 mol / l, a sorbent 5,0 s przed suszy do 105 0 s przez 1 godzinę i wstrząsnąć przez określony czas (0,5 godziny). W innym przypadku, 1 godzinę i tak dalej. Po upływie czasu rozwiązanie przesączono. Został podjęty w celu przeanalizowania 5 cm3 przesączu, a pozostałe stężenie jonów mg 2+ określono metodą cerpionometometryczną.
2. Do 20 cm3 roztworu chlorku wapnia o stężeniu molowym równoważnym 0, l mole / L dodano 5,0 g sorbentu wstępnie wysuszonego przy 1050C przez 1 godzinę i wstrząsnąć przez określony czas (0,5 godziny). W innym przypadku, 1 godzinę i tak dalej. Po upływie czasu rozwiązanie przesączono. Został przeanalizowany w celu przeanalizowania 5 cm3 przesączu, a pozostałe stężenie jonów CA2 określono metodą cerpionometometryczną.
Wpływ czasu kontaktu CSP i roztworu CACL2 * 4N2O na zbiorniku wymiany CSP w warunkach statycznych.
(C (CA2 +) ex \u003d 0,1 mol / l; mcsp \u003d 5,0)
Wraz ze wzrostem czasu kontaktu faz obserwuje się wzrost koncentracji równowagi. A po 3 godzinach zainstalowana jest dynamiczna równowaga walcowania.
6. Ograniczenie ważności protokołu zaniechanego nr 5-94 rady międzystanowej w sprawie normalizacji, metrologii i certyfikacji (IUS 11-12-94)
7. Wydanie (styczeń 2002) z poprawką (IUS 3-91)
Norma niniejsza ma zastosowanie do jonitów i ustanawia metody określania dynamicznego zbiornika wymiany z pełną regeneracją jonową oraz z danym zużyciem środka regenerującego.
Metody polegają na określeniu liczby jonów, są wchłaniane z roztworu roboczego przez jednostkę objętości obrzęk jonitu z ciągłym przepływem roztworu przez warstwę jonową.
1. Metoda próbkowania
1. Metoda próbkowania
1.1. Metoda pobierania próbek wskazuje dokumentację regulacyjną i techniczną dla określonych produktów.
1.2. W przypadku jonitów, w których masowa frakcja wilgoci jest mniejsza niż 30%, próbka jest pobierana (100 ± 10). W celu obrzęku próbka jest umieszczona w szklance o pojemności 600 cm i jest wylana z nasyconym roztworem Chlorek sodu, który powinien być pokryty nadmiarem, aby pokryć warstwę jonową z obrzękiem. Po 5 h jonis przemywa się wodą destylowaną.
1.3. Dla jonitów o masowej frakcji wilgotności, ponad 30% jest pobierane przez próbkę (150 ± 10) g do szklanki 600 cm przy pomocy pojemności i 200 cm wody destylowanej.
2. Odczynniki, rozwiązania, naczynia, urządzenia
Woda destylowana zgodnie z Gost 6709 lub zdemineralizowana, spełnia wymagania Gost 6709.
Chlorek baru Według GOST 742, H.Ch. Rozwiązanie o masowej frakcji 10%.
Chlorek 2-wodny wapnia, H.Ch., roztwory stężenia (Sasl \u003d 0,01 mol / dm (0,01 n.) I (SASL) \u003d 0,0035 mol / dm (0,0035 n.).
Kwas salonowy Według GOST 3118, H.Ch., roztwory o frakcji masowej 5% i stężeń (HCl) \u003d 0,5 mol / dm (0,5 N), (HCl) \u003d 0,1 mol / dm (0, 1 n. ) I (NSL) \u003d 0,0035 mol / dm (0,0035 n.).
Kwas siarkowy Według GOST 4204, H.Ch., roztwory o frakcji masowej 1%, stężenie (HSO) \u003d 0,5 mol / dm (0,5 n.).
Wodorotlenek sodu według Gost 4328, H.Ch., roztwory o masowej frakcji 2, 4, 5%, stężenia (NaOH) \u003d 0,5 mol / dm (0,5 N), (NaOH) \u003d 0,1 mol / dm (0,1 n.) (NaOH) \u003d 0,0035 mol / dm (0,0035 n.).
Chlorek sodu zgodnie z GOST 4233, H.C., nasycony roztwór i roztwór stężenia (NaCi) \u003d 0,01 mol / dm (0,01 n.).
Mieszany wskaźnik składający się z czerwonego metylu i błękitu metylenu lub metylu czerwonego i zielonego zieleni jest przygotowywany zgodnie z GOST 4919.1.
Wskaźnik pomarańczowy lub czerwony metylu, roztwór o masowej frakcji 0,1% jest przygotowywany zgodnie z GOST 4919.1.
Wskaźnik fenolftaleiny, roztwór alkoholowy o frakcji masowej 1%, przygotuj się zgodnie z GOST 4919.1.
Wapno chemiczne absorbera CPI-1 Według Gost 6755 lub wapno jest natronem.
Rurka (HLorkalc) według Gost 25336.
Menzur 1000 według Gost 1770.
Cylindry Według GOST 1770 Przedstawienia 1-4 o pojemności 100 i 250 cm i występy 1, 2 o pojemności 500 i 1000 cm.
Okulary w lub N zgodnie z Gost 25336 w dowolnej wydajności o pojemności 600 i 1000 cm.
Kolby KN-1-250 według Gost 25336.
Pipety 2-2-100, 2-2-25, 2-2-20 i 2-2-10 przez NTD.
Burettes na NTD Typy 1, 2, Przedstawienia 1-5, Klasy Dokładności 1, 2 o pojemności 25 lub 50 cm, z ceną podziału nie więcej niż 0,1 cm, a biurwy typy 1, 2, wykonanie 6, dokładność Zajęcia 1, 2 o pojemności 2 lub 5 cm, z ceną podziału nie więcej niż 0,02 cm.
Kolby pomiarowe 1, 2 Według GOST 1770, klasy dokładności 1, 2, o pojemności 10, 25 i 100 cm.
Sito z siatką sterującą 0315K zgodnie z Gost 6613 z osłoną o średnicy 200 mm.
CCC-5000 kubek według Gost 25336 lub z materiału polimeryzacji wystarczającej do umieszczania w niej sito.
Laboratorium instalacji (patrz rysunek) składa się z butelki 1 i szklanej kolumny z 6 średnicy wewnętrznej (25,0 ± 1,0) mm i wysokości co najmniej 600 mm w celu określenia dynamicznej zdolności wymiany w warunkach pełnej regeneracji jonowej i średnicy wewnętrznej (16,0 ± 0,5) mm i wysokość co najmniej 850 mm w celu określenia warunków określonego przepływu środka regenerującego. W dolnej części kolumny filtra WPian 7 Por 250 P 2 250 XC zgodnie z Gost 25336 lub pozostałe urządzenie filtrujące, odporne na kwasy i alkalia, a nie przesyłając ziarna jonizacyjnego więcej niż 0,25 mm i mającą niewielką odporność na filtrowanie . Kolumna jest podłączona do butelki ze szklaną rurą 3 i gumowym węża 4 z klipsem śrubowym 5. Aby zapobiec dwutlenku węgla z powietrza z powietrza do roztworu wodorotlenku sodu do rury do butelki, rurka chloricalium 2 jest zainstalowana z Absorber HPP-1.
Instalacja laboratoryjna.
Dozwolone jest stosować inne przyrządy pomiarowe z charakterystyką metrologiczną nie gorszą niż wymienione, a także odczynniki jakości nie są niższe niż określone.
3. Metoda określania zdolności wymiany dynamicznej z pełną regeneracją jonową
3.1. Przygotowanie do testu
3.1.1. Przygotowanie do testowania przeprowadza się zgodnie z GOST 10896 i po treningu jonowym jest przechowywany w zamkniętej kolbie pod warstwą wody destylowanej.
Marka Kaotionitis KU-2-8 KM i anion marki AB-17-8CS do testu według Gost 10896 nie są przygotowywane.
3.1.2. Próbka jońska z kolby w postaci wodnej zawiesiny jest przenoszona do cylindra o pojemności 100 cm i uszczelnia warstwę jonatu, stukając o stałą powierzchnię dolnej części cylindra do zaprzestania skurczu. Objętość jonów doprowadza się do 100 cm i za pomocą wody destylowanej toleruje jones do kolumny, po pęcherzykach powietrza między granulkami jonikami. Nadmiar wody z kolumny jest osuszona, pozostawiając 1-2 cm warstwy na poziomie jonitu.
3.1.3. IONES w kolumnie przemywa się wodą destylowaną, przekazując ją od góry do dołu z prędkością 1,0 dm / h. W tym samym czasie zapalenie anionii przemywa się z alkali (zgodnie z fenolftalią), a kwasową kationą (według pomarańczy metylowej).
3.1.4. Wysoce wiążące aniony w postaci hydroksylowej są szybko załadowane i przemywane wodą, która nie zawiera dwutlenku węgla.
3.2. Testowanie
3.2.1. Określenie dynamicznej zdolności wymiany IONES składa się z kilku cykli, z których każdy obejmuje trzy kolejne operacje - nasycenie, regeneracja, pranie, których warunki przedstawiono w tabeli 1.
Tabela 1
Warunki określania dynamicznej zdolności wymiany z pełną regeneracją jonową
Wskaźnik | Klasa jonitów. | Rozwiązanie do nasycenia jonitów | Kontrola nasycenia. | Regeneracja | |||
dogadzający | pralnia | regeneracja |
|||||
Dynamiczna zdolność wymiany do Slippath () | Silny- | Chlorek wapnia (CACL) \u003d 0,01 mol / dm (0,01 n.) | Przed stężeniem jonów wapnia w przesączu (CA) \u003d 0,05 mmol / DM (0,05 mg · EQ / DM) są określone przez GOST 4151 | Kwas chlorowodorowy, roztwór z frakcją masową 5% | |||
Silny- | Chlorek sodu (NaCl) \u003d 0,01 mol / dm (0,01 n.) | Przed zmniejszeniem stężenia alkalicznego o 0,5 mmol / DM (0,5 mg EQ / DM) w porównaniu z maksymalną stabilną wartością w przesączu [Wskaźnik mieszany, roztwór tytułowy, stężenie kwasu chlorowodorowego (HCl) \u003d 0,01 mol / dm (0,01 n.)] I przed zwiększeniem zawartości jonów chlorowych w porównaniu z jego zrównoważoną zawartością w przesączu (zdefiniowane zgodnie z GOST 15615) | Wodorotlenek sodu, roztwór o frakcji masowej 5% | ||||
Słabo | Przed pojawieniem się przesączu kwasów (przez pomarańczową metyl) | ||||||
Kompletna dynamiczna pojemność wymiany () | Słabo | Kwas salonowy (HCl) \u003d 0,1 mol / dm (0,1 n.) | Przed wyrównaniem stężenia przesączu z koncentracją roztworu roboczego | Wodorotlenek sodu, roztwór z frakcją masową 2% | |||
Uwagi:
1. Przy określaniu stężenia jonów CA według GOST 4151
2. Specyficzne obciążenie jest objętością roztworu przeszedł przez objętość jonet na 1 godzinę. Na przykład 5 dm / dm · h odpowiada współczynnikowi filtracji, przy którym jest 100 cm roztworu (8,3 cm / min) po 100 cm jonitu.
3. Wskaźnik filtrowania jest ustawiony na pomiar w cylindrze pomiarowym objętości przesącz uzyskanej w określonym przedziale czasu.
Rozwiązania i woda są karmione od góry do dołu. Podczas korzystania z marki Anonita z AN-1, a rozwiązania AN-2FN zmniejszają się z dołu.
3.2.2 Przed przeprowadzeniem operacji nasycenia, regeneracji i prania, kolumna jest wypełniona odpowiednim rozwiązaniem. Warstwa roztworu nad jonem powinna być (15 ± 3) cm.
3.2.3. Po nasyceń, regeneracja i mycie w kolumnie nad jonem, pozostawić warstwę cieczy o wysokości 1-2 cm.
3.2.4. Kolumna jonowa jest wypełniona roztworem roboczym dla określonej klasy jonitu (patrz tabela 1), tak że warstwa roztworu nad jonem jest (15 ± 3) cm i wybierz odpowiednią szybkość filtracji.
Gdy stężenie 0,1 mola / dm przechodzi przez kolumnę z jonem (0,1 N), przesącz zebrano w cylindrach o pojemności 250 cm, w stężeniu 0,01 mol / dm (0,01 n.) - w cylindry o pojemności 1000 cm. W drugim i kolejnym cykle nasyceniu przed pojawieniem się jonów roztworów roboczych w przesączu (określony po pierwszym cyklu) przesącz zbierany jest przez części 100 i 250 cm według stężeń Rozwiązanie robocze.
3.2.5. Od każdej części przesączu próbkę jest pobierana i kontroluje nasycenie zgodnie z tabelą 1.
3.2.6. Po pojawieniu się w części przesączu jony roztworu roboczego obliczają całkowitą objętość przesącza.
3.2.7. Aby określić całkowitą wydajność dynamiczną wymianę, roztwór jest kontynuowany w celu dopasowania stężenia przesączu z stężeniem roztworu roboczego. Kontrola nasycenia w tym przypadku przeprowadza się przez miareczkowanie próbki o roztworze kwasu (wodorotlenku sodu) z mieszanym wskaźnikiem przed zmianą koloru.
3.2.8. Przed przeprowadzeniem regeneracji jonity w kolumnie wybuchają prąd wody destylowanej z dna, aby wszystkie jonowe ziarna są w ruchu. Eksplozja marki KU-1 marki i anionów marek AN-1 i AN-2FN są przeprowadzane przed operacją nasycenia.
3.2.9. Regeneracja jonowa prowadzona jest z roztworem kwasu (wodorotlenku sodu) w tempie określonej w tabeli 1. Przesącz jest stale montowany przez cylinder za pomocą cylindra o objętości 250-1000 cm, dodając 3-4 kropli wskaźnika. Gdy pojawia się kwas (wodorotlenek sodu), jego stężenie określa się w przesączu w kolejnych porcjach. Aby kontrolować przesącz, próbka jest pobierana pipetą lub mierzalną kolbą i miareczkowatą roztworu stężenia kwasu (wodorotlenku sodu) (HSL, HSO) \u003d 0,5 mol / dm (0,5 N), (NaOH) \u003d 0,5 mol / DM (0, 5 n.) W obecności wskaźnika
3.2.10. Roztwór kwasowy (wodorotlenek sodu) jest przekazywany do wyrównania stężenia przesączu z stężeniem roztworu regeneracyjnego.
3.2.11. Ionis po regeneracji przemywa się wodą destylowaną do neutralnej reakcji według pomarańczy metylowej (fenolftalen) z prędkością określoną w tabeli 1. Następnie jon trzyma się w wodzie destylowanej przez 1 godzinę, a przesącz ponownie sprawdź. Jeśli przesącz nie ma reakcji neutralnej, jon jest ponownie myty.
3.2.12. Definicja dynamicznej zdolności wymiany jest zakończona, jeśli ostatnie cykle uzyskały wyniki, rozbieżność między tym, której nie przekracza 5% średniego wyniku.
3.2.13. Dynamiczna wymienna pojemność anionu AB-17-8CC określa się przez dwie równoległe próbki w pierwszym cyklu nasycania, przed pojawieniem się jonów roztworów roboczych w przesączu. Przesącz zbiera się przez porcje 250 cm. W przypadku wyniku, średnie wyniki arytmetyczne dwóch definicji, dopuszczalna rozbieżność między nią nie przekracza 5% średniego wyniku.
(Poprawka, IUS 3-91).
4. Metoda określania dynamicznych pojemników wymiany z danym zużyciem regenerującego
4.1. Przygotowanie do testu
4.1.1. IONIS, wybrany zgodnie z zastrzeżeniem 1.2 i 1,3, jest oddzielona od małych frakcji metodą mokrego wzajemnego odmięcia zgodnie z Gost 10900, stosując sito z siatką N 0315K.
4.1.2. Oddzielony anionitowy umieszcza się w szklance, 500 cm roztworu wodorotlenku sodu o masowej frakcji 4% mieszano i mieszano. Po 4 godzinach roztwór wodorotlenku jest odprowadzany, a anion przemywa się wodą do lekko alkalicznej reakcji zgodnie z fenolftalią i przeniesiono do kolumny, jak wskazano w klauzuli 3.1.2.
4.1.3. Oddzielona kation przemywa się z zawiesinę i zmutowaną wodą destylowaną z dekantacją przed pojawieniem się lekkiej wody do mycia i przeniesiono do kolumny zgodnie z klauzulą \u200b\u200b3.1.2.
4.2. Testowanie
4.2.1. Określenie dynamicznego zbiornika wymiany jonity przed pojawieniem się jonów roztworu roboczego w przesączu () składa się z kilku cykli, z których każdy obejmuje trzy kolejne operacje - nasycenie, regeneracja, pranie, których warunki są pokazane w tabeli 2. Rozwiązania i woda są karmione od góry do dołu. Wysokość warstwy płynnej powyżej poziomu jonetu jest ustawiona zgodnie z PP.3.2.2 i 3.2.3.
Tabela 2
Warunki określania dynamicznej zdolności wymiany IONES w danym zużyciu regeneracji
Klasa jonitów. | Regeneracja | Określona stopa wartości regenerowana | Umywalka | Rozwiązanie nasycenia jonite. | Kontrola nasycenia. | Prędkość filtracji |
||
nASA. | pierdolony | rejestry |
||||||
Silny | Do pozostałego koncentracji kwasu w przesączu | Chlorek wapnia (Sasl \u003d 0,0035 mol / dm (0,0035 n.) | Przed stężeniem jonów wapnia w przesączu więcej (ca) \u003d 0,05 mmol / dm | |||||
Słabo | Kwas siarkowy, roztwór o frakcji masowej 1% | Aż do nieobecności w przesączu sulfacji (próbka z bacll w obecności HCl) | Wodorotlenek sodu (NaOH) \u003d 0,0035 mol / dm (0,0035 n.) | Do stężenia w filtrach wodorotlenku sodu (NaOH) \u003d 0,1 mmol / dm | ||||
Silny- | Wodorotlenek sodu z frakcją masową 4% | Do pozostałego stężenia wodorotlenku sodu w przesączu nie więcej (NaOH) \u003d 0,2 mmol / dm | Chlorek sodu (NaCi) \u003d 0,01 mol / dm (0,01 n.) | Przed zmniejszeniem stężenia alkalicznego na (NaOH) \u003d 0,7 mmol / dm | ||||
Słabo | Wodorotlenek sodu, roztwór z frakcją masową 4% | Do pozostałego stężenia wodorotlenku sodu w przesączu, a nie więcej (NaOH) \u003d 0,2 mmol / dm (0,2 mg · EQ / DM) przez fenolftalia | Kwas soli (siarki) (HSL, HSO) \u003d 0,0035 mol / dm (0,0035 n.) | Do pozostałego stężenia kwasu w przesączu nie jest więcej (h) \u003d 0,1 mmol / dm (0,1 mg · EQ / DM), wskaźnik jest mieszany, roztwór tytułowy - stężenie wodorotlenku sodu (NaOH) \u003d 0,01 mol / dm (0, 01 n.) | ||||
Uwagi:
1. Wyrazując normę specyficznego natężenia przepływu środka regeneracyjnego () w gramach na mole pod słowem "kret" oznacza masę molową ekwiwalentu jonowego (NA, K, CA, MG, CL, NO, NSO, HSO, CO, Więc
Itp.).
2. Rzeczywisty natężenie przepływu środka regenerującego nie powinno różnić się od określonej normy o więcej niż 5%.
3. Przy określaniu stężenia jonów SA zgodnie z GOST 4151, stosowanie 2-3 kropli wskaźnika Chromu-ciemnoniebieskiego niebieskiego i miareczkowania stężenia Trylon-B (Nahon · 2HO) \u003d 0,01 mol / dm (0,01
4. Specyficzne obciążenie jest objętością roztworu przeszedł przez objętość joniza na 1 godzinę. Na przykład 5 dm / dm · h odpowiada szybkości filtracji, w którym znajduje się 100 cm roztworu (8,3 cm / min) 100 cm jonitu.
5. Wskaźnik filtracji jest ustawiony na pomiar w cylindrze pomiarowym objętości przesącz uzyskanej w określonym przedziale czasu.
W celu uniknięcia uszkodzeń zapalenia kationizacji, regeneracja kwasu i prania z produktów regeneracyjnych jest przeprowadzana bez zatrzymywania, nie pozwalająca na szczelinę między operacjach.
Przed przystąpieniem do każdego kolejnego cyklu jon shyling przepływ wody od dołu do góry, aby wszystkie ziarna jonowe są w ruchu.
4.2.2. Dzięki IONES w kolumnie, roztwór regenerujący jest przekazywany, objętość, który () w centymetrach sześciennych jest obliczana przez wzór
gdzie jest dana wartość specyficznego natężenia przepływu środka regenerującego, g / mola (g / g · eq);
- dynamiczny zbiornik wymiany; Wybierz zgodnie z dokumentacją regulacyjną i techniczną na określonej IONIS, MOL / M (R · EQ / M); Dla Ionitów, AB-17-8, AN-31 i stopnie EDE-10P są dozwolone dla pierwszej regeneracji zwiększonej wartości dynamicznej wymiany do 3;
- próbki jonity, cm;
- Stężenie zaprawy regenerującej, g / dm.
Ilość roztworu regenerującego jest mierzona na wyjściu kolumny z cylindrem lub benzur. Następnie kolumna jest odłączona, poziom roztworu nad jonem w kolumnie jest obniżany do 1-2 cm i zamknął dolną dla
4.2.3. Ionites po regeneracji przemywa się wodą destylowaną z nadmiaru kwasu (wodorotlenku sodu) w tempie wskazanej w tabeli 2.
Okresowo wybierz próbkę przesączu i miareczkowanie roztworów wodorotlenku sodu (kwasowe) stężenie (NaOH, HCl, HSO) \u003d 0,1 mola / dm (0,1 n.) W obecności pomarańczy metylowej (fenolftalen).
Pranie jest kontrolowane przez Tabela 2.
4.2.4. Po przemyciu kolumna jest wypełniona wirnikiem i ustaw szybkość nasycenia z tabeli 2.
Podczas pracy w kolumnie roboczych roztworów stężeń 0,01 mol / dm (0,01 n.) Przesącz zbierany jest do cylindra o pojemności 250 cm, w stężeniu 0,0035 mol / dm (0,0035 n.) Użyj cylindra z a pojemność 1000 cm. Drugie i kolejne cykle nasycenia przed pojawieniem się jonów moździerzowych w przesączu (określony po pierwszym cyklu), przesącz zebrano odpowiednio przez 100 i 250 cm, stężenia roztworu roboczego.
4.2.5. Aby kontrolować nasycenie z części przesączu, próbka jest pobierana i analizowana zgodnie z tabelą 2. Jeśli wynik analizy pokazuje, że poziom nasycenia nie dotarł do wartości określonych w tabeli 2, wszystkie poprzednie próbki przesącza nie mogą być analizowane.
4.2.6. Po pojawieniu się w poradzie przesączania roztworów roboczych jonów w ilościach, o których mowa w tabeli 2, nasycenie jest kompletne i obliczane całkowitą przesącz () i dynamiczny pojemnik wymiany.
4.2.7. Jon jest poddawany drugim regeneracji i prandynować zgodnie z ust ..2.2 i 4.2.3.
Przy obliczaniu środka regeneracyjnego wymaganego dla drugiego cyklu, wartość dynamicznego pojemnika wymiany uzyskana w pierwszym cyklu zgodnie z klauzulą \u200b\u200b4.2.6 jest stosowany zgodnie z klauzulą \u200b\u200b4.2.6.
Przed przeprowadzeniem kolejnych cykli nasycenia, zużycie zużycia regenerującego jest obliczana przez wielkość dynamicznej wydajności wymiany uzyskanej w poprzednim cyklu.
4.2.8. Koniec definicji, jeśli ostatnie cykle uzyskały wyniki dozwolone przez rozbieżności między którymi nie przekraczają 5% średniego wyniku, z rzeczywistym specyficznym natężeniem przepływu środka regeneracyjnego, różniących się od określonej normy przez nie więcej niż 5%.
5. Przetwarzanie wyników
5.1. Dynamiczna pojemność wymiany () w liczniku sześciennym (R · EQ / m), aż roztwór operacyjny pojawi się w przesączu, są obliczane przez wzór
gdzie - całkowita objętość przesączu przeszedł przez IONES przed pojawieniem jonów roztworu roboczego, patrz;
- objętość jonetu, patrz
5.2. Rzeczywisty natężenie przepływu środka regenerującego () w gramach na molę (G / G EQ) wchłoniętym jonami jest obliczana przez wzór
gdzie jest objętość regenerującego zaprawy, patrz;
- stężenie roztworu regenerującego, g / dm;
- całkowita ilość przesączu przepuszczona przez IONES, aż pojawi się jony roztworu roboczego, patrz;
- stężenie roztworu roboczego, mol / dm (n.
5.3. Kompletna wydajność dynamiczna () w mole na metr sześcienny (R · EQ / M) są obliczane według wzoru
gdzie - całkowita ilość przesączu przepuszczona przez IONES w celu wyrównania stężeń przesączu i roztworu roboczego, cm;
- stężenie roztworu roboczego, mol / dm (n.);
- objętość części przesączu po pojawieniu jonów roztworu roboczego (pomiń), cm;
- stężenie roztworu w porcjach przesączu po pojawieniu jonów roztworu roboczego (SKIP), mol / dm (n.);
- głośność jonetu,
5.4. W wyniku definicji, średnie wyniki arytmetyczne dwóch ostatnich cykli, rozbieżności między którymi nie przekraczają ± 5%, z zaufanym prawdopodobieństwem \u003d 0,95.
Uwaga. Wyrażając dynamiczną zdolność wymiany jonity w liczniku sześciennym pod słowem "kret", istnieje molowa masa równoważnika jonowego (NA, K, CA, MG, CL, NO, NSO, HSO, CO, tak itp ).
Tekst dokumentu jest wiercony przez:
oficjalna edycja
Jonity. Metody określania
wydajność wymiany: SAT. Gostow. -
M.: IPK Wydawnictwo Standardy, 2002
Pojęcia ogólne
W ogólnych słowach, w ramach zdolności żywicy jonowej jest rozumiana jako liczba jonów, która może być wchłaniana przez pewną ilość żywicy. Co więcej, jednostka pomiaru pojemności żywicy może być inna. Na przykład mm-eq / ml (MEQ / ml), Pan (EQ / L) lub Kilogran na stopie sześciennej (KGR / FT3). Znając równoważną masę materii, możesz obliczyć zbiornik żywicy. Równoważna masa substancji definiuje się jako stosunek masy molowej substancji do jego wartości zawodowej (ściśle mówiący, do liczby równoważności substancji). Na przykład, masa molowa wapnia wynosi 40 g / mol, a wartość 2, a następnie równoważna masa jest równa 20 g / mol (40/2 \u003d 20). Żywicę jonową z wymiennością 1,95 g - EQ / L jest w stanie usunąć 1,95 H 20 \u003d 39 gramów z roztworu na 1 litr żywicy.
W praktyce zdolność wymiany żywicy określa się w laboratoriach miareczkowania. Przez kolumnę, w której umieszcza się soda w postaci wodoru (formularz H), przeszedł roztwór wodorotlenku sodu (NaOH). Część jonów Na + jest wymieniana dla jonów wodorowych. Wodorotlenek sodu, który nie wejdzie do reakcji z grupą żywicy jonową, jest czyszczony kwasem. Sut z początkowego stężenia wodorotlenku sodu, stężenie resztkowego można określić za pomocą pojemnika kationowego. Innym sposobem ustalenia zdolności wymiany jonów przechodzą przez warstwę żywicy roztworu chlorku wapnia. Podobnie, zbiornik żywicy anionu (w postaci OH) jest określony, przez które przekazuje się roztwór kwasowy.
Pojemność żywicy może być mierzona w MM-EQ / ML (objętość) lub Mg-EQ / G (waga). Jeśli zdefiniowano pojemnik wyrażony w MM-EQ / G (i masa suchego jonu jest przeznaczona), a następnie znając wilgotność żywicy, łatwo jest przejść do MM-EQ / ml.
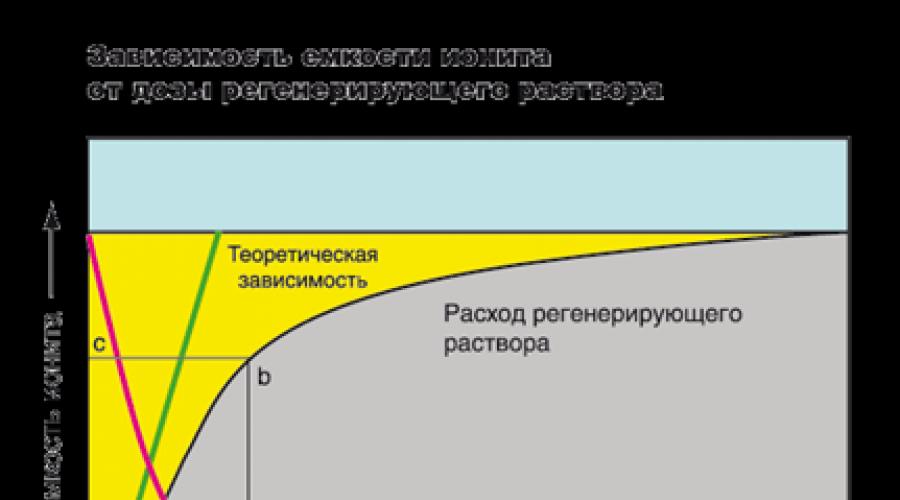
Na rysunku pojemność wymiany żywicy przedstawiono graficznie obszarem żółtego koloru znajdującego się między pionowym prostym a cl. Obszar szary, znajdujący się poniżej krzywej, jest stężenie jonów w oczyszczonej wodzie. Na początku cyklu stężenie jonów w przesączu jest bardzo mały, i pozostaje stała w całym filtracy, w momencie, gdy front filtracyjny osiąga koniec warstwy IONE, IONES występują do przesączu (w Rysunek - punkt P). Jest to sygnał do regeneracji żywicy. Zwykle regeneracja filtra jest przeprowadzana do Slippha. Na przykład w przemyśle, stężenie jonów sztywności, w których filtr pochodzi do regeneracji może osiągnąć wartość mniejszą niż 0,05 03, oraz w krajowych systemach mięknych - mniej niż 0,5 0. Długość segmentu X - Y odpowiada objętości oczyszczonej wody w litrach lub galonach. Obszar Rysunku AnlB jest kompletną absorpcją jonów żywicy, a obszar figurowy ANMB jest liczbą pochłanianych jonów aż do wystąpienia SLIPPAT.
Mówiąc o zbiorniku, często oznacza, że \u200b\u200bpracujesz dokładnie, a nie kompletny kontener wymiany. Pojemność robocza nie jest stałą wartością, zależy to od zestawu czynników: marki jonowej, stężenia i rodzaju pochłoniętej jonów, pH roztworu, na wymogów oczyszczonej wody, natężenia przepływu, wysokość warstwy jonowej i innych wymagań.

Osiągnięcie wysokiego stopnia ekstrakcji jonów z roztworu wodnego wymaga wzrostu dawki roztworu regeneracyjnego (czerwona linia). Jednakże zwiększenie stężenia roztworu regenerującego jest nieskończenie niemożliwe (zielona linia jest uzależnieniem teoretycznym między stopniem redukcji pojemności żywicy a natężeniem przepływu roztworu regeneracyjnego). W praktyce, aby osiągnąć wysoką pojemność, konieczne jest zwiększenie liczby żywic. Dzięki pierwszym filtracyklu stopień redukcji właściwości wymiany jonowej może osiągnąć 100%, ale w czasie tej wartości spadnie. Na przykład. Większość producentów systemów zmiękczania wody zaleca się stosowanie roztworu NaCl o stężeniu 100-125 g. / L, aby przywrócić pojemność kationu do 50 - 55% całkowitego kontenera wymiany.
Przy określaniu pojemnika konieczne jest znanie formy jonowej żywicy (sól, kwas, główny). Z regeneracją lub w procesie działania objętość pompowanej zmiany żywicy, proces zwany żywicą zwaną "oddychaniem". Tabela pokazuje, jak żywice zachowują się w różnych procesach.
Odróżnij kation i anionics. Reakcje, w których jony są zaangażowane w tabelę.
miareczkowanie reakcji żywicy jonowej

Ponadto w literaturze angielskiej symbol SAC wskazuje na silnie kwasową kation, SBA jest wysoce przydatnym anionem, WAC jest słabo kwasową kationem, a WBA jest słabo przyjaznym anionem. Zdolność do wymiany jonowej jest określona przez obecność grupy funkcyjnej, silnie kwasowe kationy zawierają grupę sulfo - SO3H i słabo kwas kwasowo-kwasowej grupy karboksylowej - COOH. Silnie kwasowe kationy są wymieniane przez kationy w dowolnych wartościach pH, \u200b\u200bktóre są, zachowują się jak silne kwasy w roztworze. Słabo kwas kwasowy kation jest podobny do słabych kwasów i reaguje na wymianę jonów tylko przy wartościach pH powyżej 7. Anice zawierają grupy funkcyjne pięciu typów: (-NH2, NH \u003d, N? - N (CH3) 3OH, - N (CH3) 2OH4OH). Pierwsze trzy grupy dają anion słabo przyjaznych właściwościach, a grupy - N (CH3) 3OH, - N (CH3) 2C2H4OH - silnie górnictwo. Słabo przyjazne aniony reagują z anionami silnych kwasów (tak, cl-no) i wysoce wiążące z anionami silnych i słabych (HCO, HSIO) w zakresie pH od 1 do 14. Mówiąc o zbiorniku bardzo wiązania Anion, powinieneś zwracać uwagę na to w żywicy istnieją grupy funkcjonalne w związku i słabo przyjazny anionics. Podczas starzenia się wysoko wiążącym anion lub pod działaniem wysokich temperaturach istnieje spadek linii bazowej i częściowego zniszczenia grup funkcyjnych.
Rozważ więcej reakcji wyciekających z udziałem żywic jonowych. Reakcja 1 - zmiękczanie wody na silnie kwaśnej kationu soli (NA), 2 - usuwanie jonów azotanów na wysoce wiążącym anionie w formularzu Cl. Zastosowanie jako regenerujący roztwór chlorku sodu i chlorku potasu przyczynia się do powszechnego zastosowania tego typu żywicy w życiu codziennym, przemyśle i oczyszczaniu ścieków. Kationian można również przywrócić przez roztwory kwasowe (na przykład kwas chlorowodorowy), a aniony - roztwór sody kaustycznej (NaOH). Ionity w formularzu H i OH są stosowane w schematach do wytwarzania opuszczonej wody (reakcja 3 i 4). Słabo kwaśna kation jest wskazywana przez właściwości jonowe w wysokich wartościach pH (reakcja 5) i słabo osiowy anionit - przy niskich wartościach pH (reakcja 6). Reakcja 5 jest jednoczesna zmiękczanie i zmniejszona przez alkaliczność wody. Należy zauważyć, że żywica WBA w wyniku regeneracji roztworu alkalicznego nie jest przesyłana w formie OH, ale tak zwana forma FB (wolna baza).
Słabo kwaśna kationografia w porównaniu z silnymi kwasami ma wyższą zdolność wymiany, charakteryzują się dużym powinowactwem jonów wodorowych, więc regeneracja przebiega łatwiej i szybsza. Ważne jest, aby do regeneracji WAC, a także WBA, roztwory chlorku sodu lub potasu nie są używane. Wybór jednej lub innej marki żywicy jonowej zależy od wielu warunków. Na przykład wyróżniają się dwa rodzaje wysoko górniczych anionii: typ I (grupa funkcjonalna - N (CH3) 3OH) i typu II (-N (CH3) 2C2H4OH). Aniony typu I są lepsze wchłaniać jony HSIO, w przeciwieństwie do anionii typu II, ale te ostatnie charakteryzują się wyższą wydajnością wymiany i lepiej regenerowany.
Podsumowując, zauważamy, że w literaturze, a także w paszporcie na produktach, wskazana jest całkowita waga i zbiornik wymiany żywicy, które są określone w laboratorium. Zdolność robocza żywicy jest niższa niż producent zadeklarowany i zależy od wielu czynników, których nie można brać pod uwagę w warunkach laboratoryjnych (charakterystyki geometryczne warstwy żywicy, specyficzne warunki procesu: prędkości strumieniowe, stężenie substancji rozpuszczonych, stopień regeneracji itp.).
Materiały Vion stosuje się do czyszczenia emisji gazu odpadowego wentylacyjnego z komponentów rozpuszczalnych, aerozole kwasów i soli metali ciężkich, gdzie są one stosowane głównie w postaci włókninowych płótnach wspinaczkowych.
Postęp:
Ważyli 2 gr. Kationita Vion KN-1 (suche). Wlać do najdalszego. Przesuń oryginalny CUCL 2 (3,6 mmol / L) przez kolumnę wypełnioną kationitem. Następnie mieliśmy próbkę do miareczkowania 50 ml. W oparciu o metodologię (pkt 3.1) określamy gęstość optyczną próbki i znajdziemy stężenie miedzi. Wyniki przedstawiono w tabeli 3.5.
Tabela 3.5.
|
C, mmol / l |
||||
Zbudowali wykres uzależnienia stężenia miedzi w przesączu z objętości roztworu przeszedł przez jonetę.
Figa. 3.4.
Proces sorpcji jest w pełni absorbujący pierwsze części kationów przez kation, a obszar absorpcyjny stopniowo porusza się wzdłuż kolumny do wyjścia. Następnie moment występuje, gdy ze względu na wyczerpanie kontenera kationów kationy zaczynają wydostać się z kolumny. Od wykresu widać, że stężenie miedzi na wylocie kolumny wzrasta stopniowo i ma postać krzywej w kształcie litery S, od zerowych stężeń do maksimum. Ta krzywa jest rozciągnięta z małymi stężeniami soli.
Obliczono ilość miedzi, która wchłaniała kolumnę do całkowitego nasycenia kationu, jako obszar figury, ograniczoną krzywą w kształcie litery S i bezpośredniego maksymalnego stężenia:
h \u003d? VI * (Cmax - CI) (3)
gdzie VI \u003d 50 ml,
Cmax \u003d 3,6mmol.
h1 \u003d 2,20 mmol.
Obliczono pojemnik objętościowy kationu:
z1 \u003d H1 / m K \u003d 2,20 / 2 \u003d 1,10 mmol / gr. Kationata.
Dyskusja na wynikach
Podczas pracy eksperymentalnej określono całkowitą zdolność wymiany trzech różnych kationów (KU-2-8, KU-1, Vion KN-1). Wyniki przedstawiono na rysunku 3.5.

Całkowita zbiornik wymiany kationów jest proporcjonalna do obszaru figury, ograniczonej krzywej w kształcie litery S i bezpośredniego stężenia maksymalnego. Jak widać na rysunku 3.5. Pojemniki różnych jonitów są różne i mniejsze niż całkowita wymienna zdolność kationów podanych w paszporcie. Więc całkowita zdolność wymiany kationów KU-2-8 występuje eksperymentalnie poniżej wartości paszportu o 28%, całkowita zdolność wymiany KU-1 jest niższa niż wartość paszportowa o 57%, a kationem Vion KN-1 wynosi 39%. Dane te muszą być brane pod uwagę przy obliczaniu i projektowaniu aparatów i filtrów i filtrów jonowych.
Ion Exchange ma wpływ na te adsorbenty, które są polielektrolity (wymienniki jonowe, jonity, żywice jonowe).
Wymiana jonówrównoważny proces wymiany jonizacji w wymieniacz jonowym jest nazywany innymi jonami tego samego znaku w roztworze. Proces wymiany jonowej jest odwracalny.
Ionity są podzielone na katary, aniona i jonity amfoteryczne.
Kationites.- substancje zawierające stałe naładowane grupy w ich strukturze (stałe jony), które poruszają się ruchomymi kationami (przeciwjonami), które mogą wymieniać się z kationami w roztworze (rys. 81).
Figa. 81. Model macierzy polielektrolitu (kation) ze stałymi anionami i ruchomymi przeciwjonami, gdzie - stałe jony;
- Cneeses, - Uszkodzenia
Naturalne kationy: Zeolits, zapalenie permuticy, żel krzemionkowy, celulozę, jak również sztuczne: wysokiej masie cząsteczkowej Solidne nierozpuszczalne polimery jonowe zawierające najczęściej grupy sulfo, karboksyl, fosfinowo-kwas, kwas arsenowy lub grupy seleniczne. Syntetyczne kationy nieorganiczne, które najczęściej używane przez aluminiowatych.
W zależności od stopnia jonizacji grup jonowych kationy są podzielone na ciężki kwas i słabość. Silnie kwasowe kationy są zdolne do wymiany ich mobilnych kationów w stosunku do zewnętrznych kationów w środowiskach alkalicznych, neutralnych i kwasowych. Słabo kwasowa wymiana kationów wymiana przeciwjonom w stosunku do innych kationów tylko w środowisku alkalicznym. Silnie kwaśne są kationis z silnie oddzielnymi grupami kwasowymi - kwas sulfonowy. Słabo kwas obejmuje kationis zawierający słabe grupy kwasowe kwasowe - kwas fosforowy, karboksyl, oksyfenyl.
Anionity- Wymienniki jonowe zawierające pozytywnie naładowane grupy jonowe w ich strukturze (stałe jony), które poruszają się anionami (przeciwjonami), które mogą wymieniać się z anionami, które są w roztworze (rys. 82). Odróżnij naturalne i syntetyczne anionics.

Figa. 82. Model matrycy polielektrolitu (anion) z ustalonymi kationami i ruchomymi przeciwjonami, gdzie + są ustalone jonami;
- Cneeses, - Uszkodzenia
Aniontyka syntetyczna zawiera pozytywnie naładowane grupy jonowe w makrouków. Słabo przytulnie Anionics są w ich składzie pierwotne, wtórne i trzeciorzędowe grupy aminowe, wysoce wiążące aniony zawierają grupy czwartorzędowych soli i baz (amon, pirydyński, sulfon, fosfonium). Wysoce wiążące aniony Wymiana w przenoszeniu anionów kwaśnych, neutralnych i alkalicznych, słabo osi - tylko w środowisku kwaśnym.
Amfoteryczne jonity.zawierają zarówno kationowe, jak i anionowe grupy jonowe. Te IONES mogą saglity zarówno kationów, jak i aniony.
Ilościowa charakterystyka jonów jest pełny zbiornik wymiany(PO). Określenie można prowadzić metodą statyczną lub dynamiczną na podstawie reakcji płynących w systemie IONBIT - rozwiązanie:
RSO 3 - H + + NaOH → RSO 3 - NA + + H2O
RNH 3 + OH - + HCl → RNH 3 + CL - + H2O
Pojemność określana jest przez liczbę grup jonowych w jonorze, a zatem teoretycznie musi istnieć stała wartość. Jednak praktycznie zależy to jednak od wielu warunków. Istnieją statyczne zbiorniki wymiany (SEO) i dynamiczna wymienność (DeE). Wydajność wymiany statycznej jest kompletnym pojemnikiem, który charakteryzuje całkowitą liczbę grup jonowych (w Milkiequiwalentach) na jednostkę masy jonowej suchej lub jednostki na jednostce opuchniętej Ionis. Naturalne jonity mają małą statyczną zdolność metaboliczną, nieprzekraczającą 0,2-0,3 Mekv / g. W przypadku żywic syntetycznych jonowych znajduje się w odległości 3-5 MEKV / g, a czasami osiąga 10,0 MEQ / g.
Dynamiczna lub praca, wymienna zdolność ma zastosowanie tylko do części jongePod, które są zaangażowane w wymianę jonową, która występuje w warunkach technologicznych, na przykład w kolumnie jonowej w pewnej względnej prędkości jonitu i roztworu. Dynamiczna pojemność zależy od prędkości ruchu, wielkości kolumny i innych czynników i jest zawsze mniejsza niż statyczna zdolność metaboliczna.
Aby określić statyczny zbiornik jonitów, stosuje się różne metody. Wszystkie te metody są zredukowane do nasycenia jonetu przez dowolne jon, a następnie przemieszczając ją innym jonem i analizą pierwszego rozwiązania. Na przykład kationit jest dogodnie przetłumaczony na H + -form (przeciwdziałanie jonów wodorowych), a następnie spłukać roztworem chlorku sodu i uzyskanym roztworem kwaśnym jest usuwany za pomocą roztworu alkalicznego. Pojemność jest równa stosunkowi ilości kwasu, który przeszedł do roztworu kwasu do nastroju Iononu.
W przypadku metody statycznej kwas lub alkalia jest miareczkowana, co w wyniku adsorpcji jonowej pojawiają się w roztworze.
W przypadku dynamicznej metody jest określona przez kolumny chromatograficzne. Przez kolumnę wypełnioną żywicą jonową, roztwór elektrolitu jest przekazywany, a zależność stężenia absorbowanego jonu w przestarzałym roztworze (eluat) jest rejestrowany z objętości przeszłości (krzywej wyjściowej). Poza obliczoną formułą
 , ,
| (337) |
gdzie V. Łącznie - całkowita objętość obejmująca kwas dostarczany z żywicy; z - stężenie kwasu w tym rozwiązaniu; m. - Masa żywicy wymiany jonowej w kolumnie.
Stała wymiana równowagi można określić z danych na dystrybucji równowagi jonów w warunkach statycznych (stan równowagi wymiany jonowej jest opisany przez prawo Mszy), a także dynamiczną metodę szybkości przenoszenia strefy substancja wzdłuż warstwy żywicy (eluent chromatografii).
Za reakcję wymiany jonowej
![]()
stała równowaga jest równa
 , ,
| (338) |
gdzie - koncentracja jonów w jonie; - koncentracja jonów w roztworze.
Stosując jonikę, można zmiękczyć wodę lub odsetek wodę soli i nadaje się do celów farmaceutycznych. Kolejne wykorzystanie adsorpcji jonowej w aptece jest użycie go do celów analitycznych jako sposobu wyodrębniania z mieszanin jednego lub innego elementu analizowanego.
Przykłady rozwiązywania problemów
1. W 60 ml roztworu o stężeniu niektórych substancji, 0,440 mol / l umieszczony węglem aktywnym ważenie 3 g. Roztwór z adsorbentem wstrząsano w celu ustanowienia równowagi adsorpcyjnej, w wyniku czego stężenie substancji zmniejszyło się do 0,350 mol / l. Oblicz wartość adsorpcji i stopień adsorpcji.
Decyzja:
Adsorpcja jest obliczana według wzoru (325):

Według wzoru (326), określ stopień adsorpcji
2. Zgodnie z podanymi danymi, do adsorpcji Dimedrol na powierzchni węgla, oblicz stałe graficznie równania Langmura:
Oblicz adsorpcję Dimedrolu w stężeniu 3,8 mol / l.
Decyzja:
Aby graficznie określić stałe równania LangMuiru, używamy kształtu liniowego tego równania (327):
Oblicz 1 / ale i 1 / z:
Zbuduj harmonogram współrzędnych 1 / ale – 1/z(Rys. 83).
Figa. 83. Graficzna definicja stałych równania Langmura
W przypadku, gdy punkt h.\u003d 0 znajduje się poza rysunkiem, użyj drugi sposób y \u003d ax + b. Najpierw wybierz dwa dowolne punkty leżące na prostej (rys. 83) i określ ich współrzędne:
(·) 1 (0,15; 1,11); (·) 2 (0,30; 1,25).

b \u003d y 1 - AX 1 \u003d0,11 - 0,93 · 0,15 \u003d 0,029.
Dostajemy to b. = 1/ale ¥ \u003d 0,029 μmol / m 2, dlatego ale ¥ \u003d 34.48 μmol / m 2.
Stała równowaga adsorpcyjna K.określony w następujący sposób:
Oblicz adsorpcję diprololu w stężeniu 3,8 mol / l przez równanie LangMuir (327):
3. Podczas badania adsorpcji kwasu benzoesowego na stałym adsorbencie następujące dane uzyskane:
Decyzja:
Aby obliczyć stałe równania Freundlich, konieczne jest stosowanie linii liniowej równania (332), we współrzędnych LG ( x / T.) – lG. z Isotermima ma rodzaj bezpośredniego.
Znajdź wartości LG. dO. i lg. x / m.zawarte w liniowane równanie Freundlich.

| LG. dO. | –2,22 | –1,6 | –1,275 | –0,928 |
| LG. x / m. | –0,356 | –0,11 | 0,017 | 0,158 |
Zbuduj harmonogram we współrzędnych LG ( x / T.) – lG. z(Rys. 84) .
Figa. 84. Graficzna definicja stałych równania Freundlich
Od momentu h.\u003d 0 zlokalizowany poza obrazkiem (84), używamy drugi sposób Definicja współczynników bezpośrednich y \u003d ax + b(Patrz "Blok wprowadzający. Podstawy matematycznego przetwarzania danych eksperymentalnych"). Najpierw wybierz dwa punkty leżące na linii prostej (na przykład punkty 1 i 2) i określ ich współrzędne:
(·) 1 (-2.0; -0.28); (·) 2 (-1,0; 0,14).
Następnie obliczymy współczynnik kątowy według wzoru:

b \u003d y. 1 - AX. 1 = -0,28 - 0,42 · (-2.0) \u003d 0,56.
Stałe równania Freundlicha są równe:
lG. K \u003d b \u003d0,56; K.= 10 0,56 = 3,63;
1/n \u003d a \u003d0,42.
Oblicz adsorpcję kwasu benzoesowego w stężeniu 0,028 mol / l stosując równanie Freundlich (330):
4. Korzystając z równania zakładu, oblicz specyficzną powierzchnię adsorbentu zgodnie z danymi w zakresie adsorpcji azotu gazowego:
Obszar zajmowany przez cząsteczkę azotową w gęstym monowarstwie wynosi 0,08 nm2, gęstość azotu wynosi 1,25 kg / m3.
Decyzja:
Równanie polimolekularnej adsorpcji zakładu w formularzu liniowym ma formularz (333)
Aby zbudować wykres, określ wartości:
Zbuduj harmonogram współrzędnych - p / p s (Rys. 85).
Za pomocą pierwsza metoda (Patrz "Blok wprowadzający. Podstawy przetwarzania matematycznego danych eksperymentalnych") Definicja współczynników bezpośrednich y \u003d ax + b. Definiujemy wartość współczynnika b.jako rzędna punktu leżącego na bezpośrednie, co jest absursem równym 0 ( h.= 0): b. \u003d 5. Wybierz punkt na prostym i określ jego współrzędne:
(·) 1 (0,2; 309).
Następnie obliczymy współczynnik kątowy:


Figa. 85. Graficzna definicja stałych z adsorpcji polimolekularnej
Stałe równanie izotermy polimolekularnej zakładu adsorpcji są równe:
 ; .
; .
Rozwiązywanie systemu równań, zdobądź ale ∞ \u003d 6,6 · 10 -8 m 3 / kg.
Aby obliczyć wartość graniczną adsorpcji, weźmiemy ale ∞ do 1 mol:
 .
.
Wartość określonej powierzchni adsorbentu znajduje się wzorem (329):
5. WILNYRENE SULFOCHIONIS W N +-Forma Waga 1 g została wprowadzona do roztworu KCl z stężeniem wyjściowym z 0 \u003d 100 EQ / M 3 objętość V.\u003d 50 ml i mieszaninę utrzymywano do stanu równowagi. Oblicz stężenie równowagi potasu w jonatu, jeśli stała z równowagi jonowej \u003d 2,5, a całkowita wymiana zbiornika kationu jest PO \u003d 5 MOL-EQ / kg.
Decyzja:
Aby określić stałą wymiany jonowej, stosować równanie (338). W żywicy, wymiana jonów H + na równoważnej liczbie jonów K.
Masa zapalenia sulfonii w H + -form jest określona przez wzór (337):


Całkowita liczba anionu w tym --form jest równa:
Masa anionu jest również określona przez wzór (337):
