Calcoli di effetti termici delle reazioni. Metodi per il calcolo degli effetti termici delle reazioni chimiche a diverse temperature
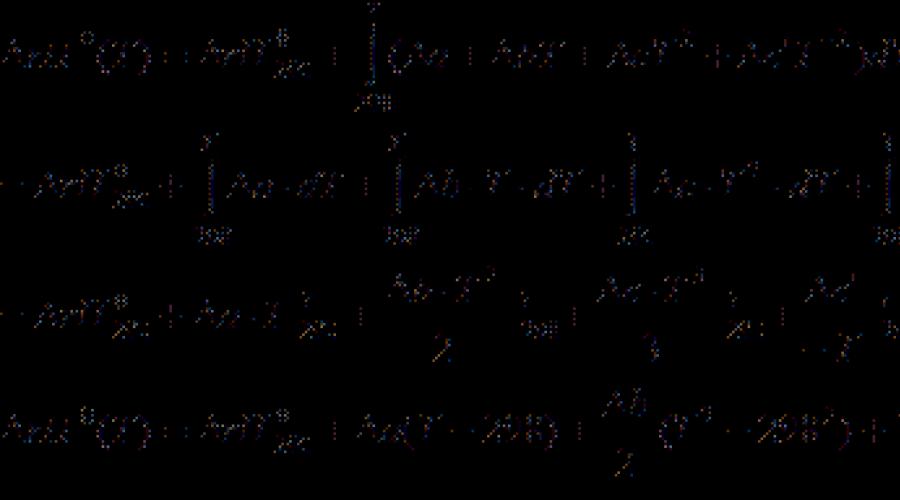
Tutti i metodi per il calcolo degli effetti termici sono basati sull'equazione Kirchoff nella forma integrale.
Più spesso, standard 298.15k viene utilizzato come prima temperatura.
Tutti i metodi per il calcolo degli effetti termici sono ridotti ai metodi per prendere l'integrante della parte destra dell'equazione.
Metodi di presa integrali:
I. Cappucci di calore medio. Questo metodo è il più semplice ed accurato. In questo caso, l'espressione sotto il segno integrale viene sostituita dalla variazione della capacità termica media, che non dipende dalla temperatura nell'intervallo selezionato.
La capacità termica media è tabulata e misurata per la maggior parte delle reazioni. Sono facili da calcolare sui dati di riferimento.
II. In base a veri tappi di calore. (Con l'aiuto di righe di temperatura)
In questo metodo, l'espressione di integrazione della capacità termica è scritta come intervallo di temperatura:

III. Secondo componenti ad alta temperatura di entalpia. Questo metodo è stato ampiamente distribuito con lo sviluppo della tecnologia dei razzi quando si calcola gli effetti termici delle reazioni chimiche a temperature elevate. Si basa sulla definizione della capacità termica ISOBAR:

Componente ad alta temperatura di entalpia. Mostra quanto l'entalpia della sostanza individuale cambierà quando viene riscaldato a un certo numero di gradi.
Per la reazione chimica, scrivi:

In questo modo:
Conferenza numero 3.
Piano di lezione:
1. II La legge della termodinamica, della definizione, del record matematico.
2. Analisi del II della legge della termodinamica
3. Il calcolo delle variazioni di entropia in alcuni processi
qui e ulteriori indici iO. fare riferimento alle sostanze iniziali o reagenti e indici j.- per finire sostanze o prodotti di reazione; e - coefficienti stechiometrici nell'equazione di reazione per i materiali di partenza e i prodotti di reazione, rispettivamente.
Esempio:Calcola l'effetto termico della reazione di sintesi di metanolo in condizioni standard.
Decisione: Per i calcoli, useremo i dati di riferimento in base al calore standard della formazione coinvolta nella reazione delle sostanze (vedere la tabella. 44 a pagina 72 del libro di riferimento).
L'effetto termico della reazione di sintesi di metanolo in base alle condizioni standard in base alla prima conseguenza della legge GESS (Equazione 1.15) è uguale:
Quando si calcola gli effetti termici delle reazioni chimiche, è necessario tenere conto del fatto che l'effetto termico dipende dallo stato aggregato dei reagenti e dal tipo di registrazione dell'equazione di reazione chimica:
Sulla seconda conseguenza della legge Gessa, l'effetto termico può essere calcolato utilizzando il calore della combustione Δ c h.Come la differenza nel calore del calore della combustione dei materiali di partenza e dei prodotti di reazione (tenendo conto dei coefficienti stechiometrici):
dove δ. R c P. - caratterizza il cambiamento nella capacità di calore isobarico del sistema come risultato del flusso di una reazione chimica ed è chiamato il coefficiente di temperatura dell'effetto termico della reazione.
Dal differenziale Kirchhoff Equation Segue che la dipendenza dell'effetto termico sulla temperatura è determinata dal segno Δ R c P.. Dipende dal fatto che più, la capacità termica totale delle sostanze iniziali o la capacità termica totale dei prodotti di reazione. Analizziamo l'equazione differenziale di Kirchhoff.
1. Se il coefficiente di temperatura Δ R c P.\u003e 0, quindi derivato  \u003e 0 e funzione
\u003e 0 e funzione  crescente. Di conseguenza, l'effetto termico della reazione con la temperatura crescente aumenta.
crescente. Di conseguenza, l'effetto termico della reazione con la temperatura crescente aumenta.
2. Se il coefficiente di temperatura Δ R c P.< 0, то производная  < 0 и функция
< 0 и функция  discendente. Di conseguenza, l'effetto termico della reazione con la temperatura crescente diminuisce.
discendente. Di conseguenza, l'effetto termico della reazione con la temperatura crescente diminuisce.
3. Se il coefficiente di temperatura Δ R c P. \u003d 0, quindi derivato  \u003d 0 I.
\u003d 0 I.  . Di conseguenza, l'effetto termico della reazione non dipende dalla temperatura. Questo caso non si verifica nella pratica.
. Di conseguenza, l'effetto termico della reazione non dipende dalla temperatura. Questo caso non si verifica nella pratica.
Le equazioni differenziali sono convenienti per l'analisi, ma a disagio per i calcoli. Per ottenere un'equazione per il calcolo dell'effetto termico di una reazione chimica, nell'incrociare l'equazione differenziale di Kirchhoff, separando le variabili:


La capacità termica delle sostanze dipende dalla temperatura, quindi, e  . Tuttavia, nella regione delle temperature comunemente utilizzate nei processi chimici e tecnologici, questa dipendenza non è significativa. Per scopi pratici, le sostanze medio-capacità di calore vengono utilizzate nell'intervallo di temperatura da 298 alla temperatura specificata.
. Tuttavia, nella regione delle temperature comunemente utilizzate nei processi chimici e tecnologici, questa dipendenza non è significativa. Per scopi pratici, le sostanze medio-capacità di calore vengono utilizzate nell'intervallo di temperatura da 298 alla temperatura specificata.  che sono dati nei libri di riferimento. Coefficiente di temperatura dell'effetto termico, calcolato usando la capacità di calore media:
che sono dati nei libri di riferimento. Coefficiente di temperatura dell'effetto termico, calcolato usando la capacità di calore media:
Esempio:Calcola l'effetto termico della reazione di sintesi di metanolo ad una temperatura di 1000 a pressione standard.
Decisione: Per i calcoli, utilizzeremo i dati di riferimento sulla capacità termica media delle sostanze coinvolte nella reazione nell'intervallo di temperatura da 298 a 1000 K (vedere la Tabella 40 a pagina 56 della directory):
Cambiamenti nella capacità termica media del sistema a causa del flusso di una reazione chimica:
Il secondo inizio della termodinamica
Uno dei compiti più importanti della termodinamica chimica è quello di chiarire la Possibilità principale (o l'incapacità) del flusso spontaneo di una reazione chimica nella direzione in esame. Nei casi in cui è chiaro che questa interazione chimica può verificarsi, è necessario determinare il grado di trasformazione delle sostanze sorgente e la resa dei prodotti di reazione, cioè la pienezza della reazione
La direzione del corso del processo spontaneo può essere determinata sulla base della seconda legge o dell'inizio della termodinamica formulata, ad esempio, sotto forma di un postulato di Clausius:
Il calore in sé non può muoversi da un corpo freddo a caldo, cioè, tale processo è impossibile, il solo risultato del quale era la transizione del calore dal corpo con una temperatura inferiore al corpo con una temperatura più alta.
Vengono proposte una varietà di formulazioni del secondo inizio della termodinamica. Thomson's Wording - Planck:
L'Eterno motore del secondo tipo è impossibile, cioè una macchina così periodica attiva è impossibile, che consentirebbe di ottenere il funzionamento solo raffreddando la fonte di calore.
La formulazione matematica del secondo inizio della termodinamica si verifica quando si analizza il funzionamento delle macchine termiche nelle opere di N. Carno e R. Clausius.
Clausius è stata introdotta una funzione di stato S., denominato entropia, il cambiamento in cui è uguale al calore del processo reversibile, riferito alla temperatura
Per qualsiasi processo
 | (1.22) |
L'espressione risultante è un'espressione matematica del secondo inizio della termodinamica.
Calore standard dell'istruzione (entalpia della formazione) sostanze Si chiama l'entalpia della formazione della formazione di 1 preghiera di questa sostanza dagli elementi (semplici sostanze, cioè costituite da atomi di una specie) nello stato standard più stabile. Gli entallive ambientali standard (CJ / MOL) sono forniti nei libri di riferimento. Quando si utilizzano i valori di riferimento, è necessario prestare attenzione allo stato di fase delle sostanze coinvolte nella reazione. L'entalpia di formazione delle sostanze semplici più stabili è 0.
Corollario dalla legge GESS sul calcolo degli effetti termici delle reazioni chimiche sul calore dell'istruzione : standard l'effetto termico della reazione chimica è pari al calore del calore della formazione dei prodotti di reazione e del calore della formazione delle sostanze sorgente, tenendo conto dei coefficienti stechiometrici (quantità di talpe) dei reagenti:
Ch. 4 + 2 co \u003d 3 c ( grafite ) + 2 H. 2 O.
tV a gas a gas. gas
Il calore della formazione di sostanze in questi stati di fase è mostrato nella tabella. 1.2.
Tabella 1.2.
Calda formazione di sostanze
Decisione
Dal momento che la reazione passa quando P.\u003d Const, quindi l'effetto termico standard si trova come un cambiamento in entalpia secondo il conosciuto calore dell'istruzione per conseguenza della legge GESS (Formula (1.17):
ΔН. di 298 \u003d (2 · (-241.81) + 3 · 0) - (-74.85 + 2 · (-110,53)) \u003d -187,71 kJ \u003d -187710 J.
ΔН. di 298 < 0, реакция является экзотермической, протекает с выделением теплоты.
Modifica dell'energia interna che troviamo sulla base dell'equazione (1.16):
Δu. di 298 = Δh. di 298 – Δ ν · Rt..
Per questa reazione dei cambiamenti nel numero di moli di sostanze gassose dovute al passaggio di una reazione chimica Δν = 2 – (1 + 2) = –1; T.\u003d 298 k, quindi
Δ U. di 298 \u003d -187710 - (-1) · 8,314 · 298 \u003d -185232 J.
Calcolo degli effetti termici standard delle reazioni chimiche in base al calore standard della combustione delle sostanze coinvolte nella reazione
Sostanze standard di combustione di calore (entalpia di combustione)
si chiama l'effetto termico dell'ossidazione completa di 1 preghiera di una determinata sostanza (fino a ossidi più alti o composti appositamente indicati) con ossigeno, a condizione che le sostanze iniziali e finite abbiano una temperatura standard. Sostanze ad entalpia di combustione standard  (KJ / MOL) sono dati nei libri di riferimento. Quando si utilizzano i valori di riferimento, è necessario prestare attenzione al segno dell'elefante della reazione di combustione, che è sempre esotermica ( Δ
H.
<0), а в таблицах указаны величины
(KJ / MOL) sono dati nei libri di riferimento. Quando si utilizzano i valori di riferimento, è necessario prestare attenzione al segno dell'elefante della reazione di combustione, che è sempre esotermica ( Δ
H.
<0), а в таблицах указаны величины
 .
. Combustione entalpia di ossidi più alti (ad esempio, l'acqua e l'anidride carbonica) sono uguali a 0.
Combustione entalpia di ossidi più alti (ad esempio, l'acqua e l'anidride carbonica) sono uguali a 0.
Corollario dalla legge GESS sul calcolo degli effetti termici delle reazioni chimiche sul calore della combustione : l'effetto termico standard della reazione chimica è pari al calore del calore della combustione delle sostanze iniziali e del calore della combustione dei prodotti di reazione, tenendo conto dei coefficienti stechiometrici (quantità di talpe) dei reagenti:
C. 2 H. 4 + H. 2 O. \u003d S. 2 N. 5 È LUI.
Proprio come una delle caratteristiche fisiche di una persona è la forza fisica, la caratteristica più importante di qualsiasi comunicazione chimica è il potere della comunicazione, cioè. La sua energia.
Richiama che l'energia chimica del legame - questa energia assegnata nella formazione di un legame chimico o dell'energia che deve essere spesa per distruggere questa connessione.
La reazione chimica in generale è la conversione di una sostanza in altri. Di conseguenza, durante la reazione chimica, c'è una rottura di alcune connessioni e la formazione di altri, cioè. Girare l'energia.
La legge fondamentale della fisica afferma che l'energia non deriva dal nulla e non scompare senza una traccia, ma passa solo da una specie all'altra. In virtù della sua universalità, questo principio è ovviamente applicabile a una reazione chimica.
Effetto termico della reazione chimica chiamato la quantità di calore,
assegnato (o assorbito) durante la reazione e il relativo a 1 miglia reagito (o la risultante) sostanza.
L'effetto termico è indicato dalla lettera D e, come regola, viene misurata in KJ / MOL o Kcal / Mol.
Se la reazione si verifica con il rilascio del calore (Q\u003e 0), è chiamato esotermico e, se con assorbimento del calore (Q< 0) – эндотермической.
Se è schematicamente ritrarre il profilo energetico della reazione, quindi per le reazioni endotermiche, i prodotti sono sopra l'energia dei reagenti, e per esotermica - al contrario, i prodotti di reazione si trovano sotto energia (più stabile) dei reagenti.
È chiaro che più grande reagisce la sostanza, maggiore è la quantità di energia è separata (o assorbita), cioè. L'effetto termico è direttamente proporzionale alla quantità di sostanza. Pertanto, l'atteggiamento dell'effetto termico a 1 molo della sostanza è dovuto al nostro desiderio di confrontare gli effetti termici di varie reazioni.
Conferenza 6. Termochimica. L'effetto termico dell'esempio di reazione chimica 1. Con il restauro di 8,0 g di ossido di rame (II) è stato formato l'ossido di idrogeno, il rame metallico e le coppie di acqua e 7,9 kJ si riscaldano. Calcola l'effetto termico della reazione della riduzione dell'ossido di rame (II).
Decisione. Equazione di reazione di CUO (TV.) + H2 (G.) \u003d Cu (TV.) + H2 O (G.) + Q (*)
Fai una proporzione durante il restauro di 0,1 MOL - 7,9 kJ è assegnato durante il restauro di 1 MOL - X KJ
Dove x \u003d + 79 kj / talpa. Equazione (*) prende
CUO (TV.) + H2 (G.) \u003d Cu (TV.) + H2 O (G.) +79 KJ
Equazione termochimica- Questa è un'equazione di reazione chimica, che indica lo stato aggregato dei componenti della miscela di reazione (reagenti e prodotti) e l'effetto termico della reazione.
In modo da sciogliere il ghiaccio o evaporare l'acqua, è necessario spendere alcune quantità di calore, mentre durante il congelamento dell'acqua liquida o della condensa del vapore acqueo sono state assegnate gli stessi importi. Ecco perché è freddo quando uscivamo dall'acqua (l'evaporazione dell'acqua dalla superficie del corpo richiede costi energetici), e la sudorazione è un meccanismo protettivo biologico dal surriscaldamento del corpo. Al contrario, il congelatore si congela l'acqua e riscalda la stanza circostante, dandola un calore eccessivo.
Questo esempio mostra gli effetti termici dei cambiamenti nello stato di acqua aggregata. Il calore della fusione (a 0o c) λ \u003d 3.34 × 105 j / kg (fisica) o ql. \u003d - 6.02 KJ / MOL (chimica), evaporazione del calore (vaporizzazione) (a 100o c) Q \u003d 2,26 × 106 J / kg (fisica) o Qisp. \u003d - 40.68 KJ / MOL (chimica).
fusione
evaporazione |
|||||
oBR, 298.
Conferenza 6. Termochimica. L'effetto termico della reazione chimica è ovviamente, i processi di sublimazione sono possibili quando il solido
entra nella fase del gas, bypassando lo stato liquido e i processi inversi della deposizione (cristallizzazione) dalla fase del gas, è anche possibile calcolare o misurare l'effetto termico.
È chiaro che in ogni sostanza ci sono legami chimici, quindi, ogni sostanza ha una riserva energetica. Tuttavia, non tutte le sostanze possono essere trasformate tra loro con una reazione chimica. Pertanto, ha accettato di introdurre uno stato standard.
Stato standard di sostanza- Questo è uno stato aggregato di una sostanza a una temperatura di 298 K, una pressione di 1 atmosfera nella più stabile moderazione allotropica in queste condizioni.
Condizioni standard- Questa è la temperatura di 298 K e pressione 1 atmosfera. Le condizioni standard (stato standard) sono indicate dall'indice0.
Connessione di formazione del calore standard si chiama l'effetto termico della reazione chimica della formazione di questo composto da semplici sostanze prese nel loro stato standard. Il calore della formazione composto è indicato dal simbolo Q.0 Per una varietà di composti, la formazione termica standard è riportata nei libri di riferimento dei valori fisico-chimici.
Il calore standard della formazione di semplici sostanze è uguale a 0. Ad esempio, Q0 ARR., 298 (O2, GAS) \u003d 0, Q0 ARR., 298 (C, TV, GRAFITE) \u003d 0.
Per esempio . Registra l'equazione termochimica per la formazione di solfato di rame (II). Dal libro di riferimento Q0 ARR, 298 (CUSO4) \u003d 770 KJ / MOL.
Cu (TV) + S (TV.) + 2O2 (G.) \u003d CUSO4 (TV) + 770 KJ.
Nota: l'equazione termochimica può essere registrata per qualsiasi sostanza, tuttavia, è necessario capire che nella vita reale la reazione si verifica in modo completamente diverso: dai reagenti elencati si formano quando l'ossido riscaldato di rame (II) e zolfo (IV ), ma il solfato di rame (II) non è formato. Conclusione importante: l'equazione termochimica è un modello che consente i calcoli, è ben coerente con altri dati termochimici, ma non resistono alla verifica della pratica (cioè non è in grado di prevedere correttamente la possibilità o l'incapacità di reazione).
(B J) - Σ A I × q arr 0, 298 I
Conferenza 6. Termochimica. Effetto termico della reazione chimica
Una precisazione. Per non ingannarti, aggiungerò immediatamente questa termodinamica chimica può prevedere la possibilità / impossibilità di reazioneTuttavia, ciò richiede più gravi "strumenti" che vanno oltre il corso scolastico della chimica. L'equazione termochimica rispetto a queste tecniche è il primo passo sullo sfondo della piramide dell'Heopse - senza che non possa fare, ma non alto.
ESEMPIO 2. Calcola l'effetto termico della condensazione d'acqua che pesa 5,8 g. Il processo di condensa è descritto dall'equazione termochimica H2 O (G.) \u003d H2 O (G.) + Q - Condensa di condensa di solito processo di condensazione di calore esotermico a 25o c 37 kj / mol (directory).
Di conseguenza, Q \u003d 37 × 0.32 \u003d 11.84 KJ.
Nel 19 ° secolo, il farmacia russo, che ha studiato gli effetti termici delle reazioni, è stato consolidato sperimentalmente la legge della conservazione dell'energia in relazione alle reazioni chimiche - la legge della hess.
L'effetto termico della reazione chimica non dipende dal percorso del processo ed è determinato solo dalla differenza di stati finiti e iniziali.
Dal punto di vista della chimica e della matematica, questa legge significa che siamo liberi di calcolare il processo per scegliere qualsiasi "traiettoria del calcolo", perché il risultato non dipende da esso. Per questo motivo, la legge molto importante di Hess ha incredibilmente importante corollario della legge Gess.
L'effetto termico della reazione chimica è pari alla somma del calore della formazione dei prodotti di reazione al netto del calore della formazione di reagenti (tenendo conto dei coefficienti stechiometrici).
Dal punto di vista del buon senso, questa indagine corrisponde al processo in cui tutti i reagenti si sono trasformati in sostanze semplici, che sono state poi raccolte in un modo nuovo, in modo che i prodotti di reazione siano stati ottenuti.
Nella forma dell'equazione, la conseguenza della legge Gess sembra l'equazione di reazione: A 1 A 1 + A 2 A 2 + ... + A N AN \u003d B 1 B 1 + B 2 B 2 + ... B.
Allo stesso tempo, a I I IB J sono coefficienti stechiometrici, un I - reagenti, B J - Prodotti di reazione.
Quindi la conseguenza della legge GESSA ha la forma Q \u003d Σ B J × Q Arr. 0, 298
k bk + q
(A i)
Conferenza 6. Termochimica. L'effetto termico di una reazione chimica poiché il calore standard della formazione di molte sostanze
a) Immersi a tavoli speciali o B) può essere determinato sperimentalmente, diventa possibile prevedere (calcolare) l'effetto termico di un numero molto elevato di reazioni con una precisione sufficientemente elevata.
ESEMPIO 3. (La conseguenza della legge GESS). Calcola l'effetto termico della conversione del vapore di metano che si verifica nella fase del gas in condizioni standard:
CH4 (G.) + H2 O (G.) \u003d CO (G.) + 3 H2 ()
Determina se questa reazione è esotermica o endotermica?
Soluzione: la conseguenza della legge Gess
Q \u003d 3 q0 | D) + q 0 | (CO, D) -Q 0 | D) -Q 0 | O, d) - in generale. |
|||||
oBR, 298. | oBR, 298. | oBR, 298. | oBR, 298. | ||||||
Q ob0. | 298 (H 2, D) \u003d 0 | Sospienza semplice in condizioni standard |
|||||||
Dal libro di riferimento troviamo il calore della formazione dei componenti rimanenti della miscela.
O, d) \u003d 241,8 | (CO, D) \u003d 110.5 | D) \u003d 74,6 | |||||||||
oBR, 298. | oBR, 298. | oBR, 298. | |||||||||
Sosteniamo i valori all'equazione
Q \u003d 0 + 110.5 - 74.6 - 241.8 \u003d -205,9 KJ / MOL, la reazione è altamente endothermich.
Risposta: Q \u003d -205,9 KJ / MOL, Endothermal
ESEMPIO 4. (Applicazione del GESSA). Il calore delle reazioni è noto
C (TV) + ½ o (g.) \u003d CO (G.) + 110,5 KJ
C (TV.) + O2 (G.) \u003d CO2 (G.) + 393,5 KJ Trova l'effetto termico della reazione 2CO (G.) + O2 (G.) \u003d 2CO2 (G.). Decisione moltiplicando il primo e il secondo Equazione su 2.
2c (TV.) + O2 (G.) \u003d 2CO (G.) + 221 KJ 2C (TV.) + 2O2 (G.) \u003d 2CO2 (G.) + 787 KJ
Submettere la seconda equazione il primo
O2 (G.) \u003d 2CO2 (G.) + 787 KJ - 2CO (G.) - 221 KJ,
2CO (G.) + O2 (G.) \u003d 2CO2 (G.) + 566 KJ Risposta: 566 KJ / MOL.
Nota: quando si studia la termochimica, consideriamo la reazione chimica dall'esterno (esterno). Al contrario, termodinamica chimica - la scienza del comportamento dei sistemi chimici - considera il sistema dall'interno e opera con il concetto di "entalpia" h come energia termica del sistema. Entoly, tali.
Conferenza 6. Termochimica. L'effetto termico della reazione chimica è lo stesso significato della quantità di calore, ma ha il segno opposto: se l'energia si distingue dal sistema, il suo ambiente diventa e riscaldato, e il sistema perde energia.
Letteratura:
1. Tutorial, V.V. Eremin, n.e. Kuzmenko et al., Chimica Grado 9, paragrafo 19,
2. Manuale educativo e metodologico "Fondamenti della chimica generale" parte 1.
Compilatori - S.G. Baram, I.n. Mironova. - Prendo con te! Per la prossima occupazione del seminario
3. A.V. Manuilles. Nozioni di base della chimica. http://hemi.nsu.ru/index.htm.
§9.1 L'effetto termico della reazione chimica. Le principali leggi della termochimica.
§9.2 ** Termochimica (continua). Il calore della formazione della sostanza dagli elementi.
Educazione ad entalpia standard.
Attenzione!
Andiamo a risolvere i compiti di liquidazione, quindi, la calcolatrice è anche auspicabile per i seminari in chimica.
La termochistica studia gli effetti termici delle reazioni chimiche. In molti casi, queste reazioni si verificano a un volume costante o una pressione costante. Dalla prima legge della termodinamica, ne consegue che in queste condizioni di calore è una funzione funzione. Con un volume costante di calore uguale al cambiamento nell'energia interna:
e a pressione costante, il cambiamento di entalpia:
Queste uguaglianze nell'applicazione alle reazioni chimiche sono essenziali gessa Legge:
L'effetto termico della reazione chimica che scorre a pressione costante o volume costante non dipende dal percorso di reazione, ed è determinato solo dallo stato dei reagenti e dei prodotti di reazione.
In altre parole, l'effetto termico della reazione chimica è di modificare la funzione di stato.
In termochimica, in contrasto con altre applicazioni termodinamiche, il calore è considerato positivo se è evidenziato nell'ambiente, cioè. se un H. < 0 или U.
< 0. Под тепловым эффектом химической реакции
понимают значение H. (che è chiamato semplicemente "reazione entalpia") o U. reazioni.
Se la reazione procede in soluzione o fase solida, dove la modifica del volume è leggermente,
H. = U. + (pV.) U.. (3.3)
Se i gas perfetti sono coinvolti nella reazione, quindi a una temperatura costante
H. = U. + (pV.) = U. + n. Rt., (3.4)
dove n è un cambiamento nel numero di talpe di gas nella reazione.
Al fine di facilitare il confronto dell'entratio di varie reazioni, utilizzare il concetto di "stato standard". Le condizioni standard sono lo stato della sostanza pura ad una pressione di 1 bar (\u003d 10 5 PA) e una determinata temperatura. Per i gas, questa è una condizione ipotetica ad una pressione di 1 bar, che ha le proprietà del gas infinitamente sparso. L'entalpia della reazione tra sostanze in condizioni standard a temperature T., denota ( r. Significa "reazione"). Nelle equazioni termochimiche, non solo le formule di sostanze, ma anche i loro stati aggregati o le modifiche cristalline sono indicate.
Dalla legge della hess, importanti conseguenze flusso, che consentono di calcolare l'entalpia delle reazioni chimiche.
Corollario 1.
![]()
uguale alla differenza nella formazione di entalpia standard di prodotti di reazione e reagenti (tenendo conto dei coefficienti stechiometrici):
Entalpia standard (calore) della formazione di sostanze (f. significa "formazione") ad una determinata temperatura chiamata entalpia della formazione della formazione di una preghiera di questa sostanza da elementisituato nello stato standard più sostenibile. Secondo questa definizione, l'entalpia della formazione delle sostanze semplici più stabili nello stato standard è 0 a qualsiasi temperatura. Gli entalpie di formazione di formazione di sostanze a una temperatura di 298 K sono forniti nei libri di riferimento.
I concetti di "entalpia dell'istruzione" sono usati non solo per sostanze convenzionali, ma anche per ioni in soluzione. Allo stesso tempo, l'ION H + è ricevuto per punto di riferimento, per il quale si suppone che l'entalpia standard della formazione nella soluzione acquosa dovrebbe essere zero: ![]()
Corollario 2. Entalpia standard di reazione chimica
![]()
uguale alla differenza di entalpia di combustione di reagenti e prodotti di reazione (tenendo conto dei coefficienti stechiometrici):
(c. Significa "Comboritore"). L'entalpia standard (calore) della combustione della sostanza è chiamato entalpia della reazione dell'ossidazione totale di una sostanza di preghiera. Questa conseguenza è solitamente utilizzata per calcolare gli effetti termici delle reazioni organiche.
Corollario 3. L'entalpia della reazione chimica è pari alla differenza dell'energia dei legami chimici lacerati e risultanti.
Energia di comunicazione A-B è chiamato l'energia necessaria per rompere il legame e la diluizione delle particelle risultanti alla distanza infinita:
AB (G) A (G) + B (G).
L'energia della comunicazione è sempre positiva.
La maggior parte dei dati termochimici nei libri di riferimento sono forniti ad una temperatura di 298 K. per calcolare gli effetti termici ad altre temperature kirchhoff Equation.:
(Forma differenziale) (3.7)
 (forma integrale) (3.8)
(forma integrale) (3.8)
dove C P. - la differenza della capacità termica isobarica dei prodotti di reazione e dei materiali di partenza. Se la differenza T. 2 - T. 1 è piccolo, quindi puoi prendere C P. \u003d const. Con una grande differenza di temperatura, è necessario utilizzare la dipendenza della temperatura C P.(T.) Genere:
dove sono i coefficienti uN., b., c. eccetera. Per le singole sostanze, prendono dalla directory e il segno indica la differenza tra i prodotti e i reagenti (tenendo conto dei coefficienti).
Esempi
Esempio 3-1. Gli entalpie di formazione di formazione di acqua liquida e gassosa a 298 K sono pari a -285,8 e -241,8 kJ / mol, rispettivamente. Calcola l'entalpia dell'evaporazione dell'acqua a questa temperatura.
Decisione. L'entalpia di educazione corrisponde alle seguenti reazioni:
H 2 (G) + POSTO 2 (G) \u003d H 2 O (G), H. 1 0 = -285.8;
H 2 (G) + POSTO 2 (G) \u003d H 2 O (G), H. 2 0 = -241.8.
La seconda reazione può essere effettuata in due fasi: prima bruciare idrogeno per formare acqua liquida dalla prima reazione, e quindi evaporare l'acqua:
H 2 O (G) \u003d H 2 O (G), H. 0 è \u003d?
Quindi, secondo la legge della hess,
H. 1 0 + H. 0 è \u003d. H. 2 0 ,
a partire dal H. 0 ISP \u003d -241.8 - (-285.8) \u003d 44,0 kJ / mol.
Risposta. 44,0 KJ / MOL.
Esempio 3-2. Calcola la reazione entalpia
6c (G) + 6H (G) \u003d C 6 H 6 (G)
a) sugli entalpie di educazione; b) sulle energie di comunicazione, sotto il presupposto che sono fissati doppi legami nella molecola C 6 H 6.
Decisione. a) Educazione entalpia (in kj / talpa) troviamo nella directory (ad esempio, p.w.atkins, chimica fisica, 5a edizione, pp. c9-c15): F H. 0 (C 6 H 6 (G)) \u003d 82,93, F H. 0 (c (g)) \u003d 716.68, F H. 0 (h (d)) \u003d 217,97. La reazione entalpia è:
R h. 0 \u003d 82.93 - 6 716.68 - 6 217.97 \u003d -5525 KJ / MOL.
b) In questa reazione, i legami chimici non sono rotti, ma solo formato. Nel ravvicinamento delle doppie legami fisse, la molecola C 6 H 6 contiene 6 legami C-H, 3 della comunicazione C - C e 3 della comunicazione c \u003d c. Collegamenti energetici (in KJ / MOL) (P.W.Atkins, Chimica fisica, 5a edizione, p. C7): E.(C-h) \u003d 412, E.(C-c) \u003d 348, E.(C \u003d c) \u003d 612. L'entalpia di reazione è uguale a:
R h. 0 \u003d - (6 412 + 3 348 + 3 612) \u003d -5352 KJ / MOL.
La differenza con il risultato esatto è -5525 KJ / MOL è dovuto al fatto che nella molecola del benzene non ci sono legami singoli di c - c e doppi legami c \u003d c, e ci sono 6 legami aromatici con C C.
Risposta. a) -5525 kj / mol; b) -5352 kj / talpa.
Esempio 3-3. Utilizzando i dati di riferimento, calcola l'entalpia della reazione
3CU (TV) + 8hno 3 (AQ) \u003d 3CU (NO 3) 2 (AQ) + 2No (G) + 4H 2 O (G)
Decisione. L'equazione di reazione ionica abbreviata ha la forma:
3CU (TV) + 8H + (AQ) + 2NO 3 - (AQ) \u003d 3CU 2+ (AQ) + 2No (G) + 4H 2 O (G).
Secondo la legge GESS, la reazione entalpia è uguale a:
R h. 0 = 4 F H. 0 (H 2 O (G)) + 2 F H. 0 (No (G)) + 3 F H. 0 (Cu 2+ (AQ)) - 2 F H. 0 (No 3 - (AQ))
(Moraulpia della formazione di rame e ion h + sono uguali, per definizione, 0). Educazione educativa sottotillante (P.W.Atkins, Chimica fisica, 5a edizione, PP. C9-C15), troviamo:
R h. 0 \u003d 4 (-285.8) + 2 90.25 + 3 64.77 - 2 (-205.0) \u003d -358.4 KJ
(per tre preghiera in rame).
Risposta. -358,4 KJ.
Esempio 3-4. Calcola l'entalpia della combustione di metano a 1000 k se l'entalpia della formazione è data a 298 a: F H. 0 (CH 4) \u003d -17,9 kcal / mol F H. 0 (CO 2) \u003d -94.1 kcal / mol F H. 0 (h 2 o (g)) \u003d -57,8 kcal / mol. La capacità termica dei gas (in cal / (falena K)) nell'intervallo da 298 a 1000 K è uguale:
C P (CH 4) \u003d 3.422 + 0.0178. T., C P.(O 2) \u003d 6.095 + 0,0033. T.,
C P (CO 2) \u003d 6.396 + 0.0102. T., C P.(H 2 O (D)) \u003d 7.188 + 0.0024. T..
Decisione. Reazione di combustione di metano a volta
CH 4 (G) + 2O 2 (G) \u003d CO 2 (G) + 2H 2 O (G)
a partire da 298:
94.1 + 2 (-57.8) - (-17.9) \u003d -191.8 Kcal / mol.
Trova la differenza di capacità termica in funzione della temperatura:
C P. = C P.(CO 2) + 2 C P.(H 2 o (d)) - C P.(CH 4) - 2 C P.(O 2) \u003d
= 5.16 - 0.0094T. (Cal / (falena k)).
L'entalpia della reazione a 1000 al calcolo secondo l'equazione di Kirchhoff:
= +  = -191800 + 5.16
= -191800 + 5.16
(1000-298) - 0,0094 (1000 2 -298 2) / 2 \u003d -192500 CAL / MOL.
Risposta. -192.5 kcal / talpa.
COMPITI
3-1. Quanti calore sarà richiesto per la traduzione di 500 g al (t.pl. 658 o c, H. 0 PL \u003d 92,4 CAL / G), presi a temperatura ambiente, nello stato fuso, se C P.(Al TV) \u003d 0,183 + 1.096 10 -4 T. CAL / (G K)?
3-2. Reazione ad entalpia standard Caco 3 (TV) \u003d cao (TV) + CO 2 (G) che si verificano in una nave aperta ad una temperatura di 1000 K pari a 169 kJ / mol. Cosa è uguale al calore di questa reazione che scorre alla stessa temperatura, ma nella nave chiusa?
3-3. Calcola l'energia interna standard della formazione del benzene liquido a 298 k, se l'entalpia standard della sua formazione è 49,0 kJ / mol.
3-4. Calcola l'entalpia della formazione n 2 o 5 (d) a T. \u003d 298 K in base ai seguenti dati:
2No (G) + o 2 (G) \u003d 2No 2 (G), H. 1 0 \u003d -114.2 KJ / MOL,
4NO 2 (G) + O 2 (G) \u003d 2N 2 O 5 (G), H. 2 0 \u003d -110.2 KJ / MOL,
N 2 (G) + O 2 (G) \u003d 2No (G), H. 3 0 \u003d 182,6 KJ / MOL.
3-5. MOTOLPIA La combustione-glucosio, -frosi e saccarosio a 25 ° C sono uguali a -2802,
-2810 e -5644 kJ / mol, rispettivamente. Calcola il calore dell'idrolisi del saccarosio.
3-6. Determinare l'entalpia della formazione della formazione di B 2 ore 6 (G) quando T. \u003d 298 da i seguenti dati:
B 2 H 6 (G) + 3O 2 (G) \u003d B 2 O 3 (TV) + 3H 2 O (G), H. 1 0 \u003d -2035,6 KJ / MOL
2b (TV) + 3/2 o 2 (G) \u003d B 2 O 3 (TV), H. 2 0 \u003d -1273,5 KJ / MOL,
H 2 (G) + 1/2 o 2 (G) \u003d H 2 O (G), H. 3 0 \u003d -2241,8 KJ / MOL.
3-7. Calcola il calore della formazione di solfato di zinco da semplici sostanze quando T. \u003d 298 K in base ai seguenti dati.