Υπολογισμοί θερμικών επιδράσεων των αντιδράσεων. Μέθοδοι υπολογισμού των θερμικών επιδράσεων των χημικών αντιδράσεων σε διαφορετικές θερμοκρασίες
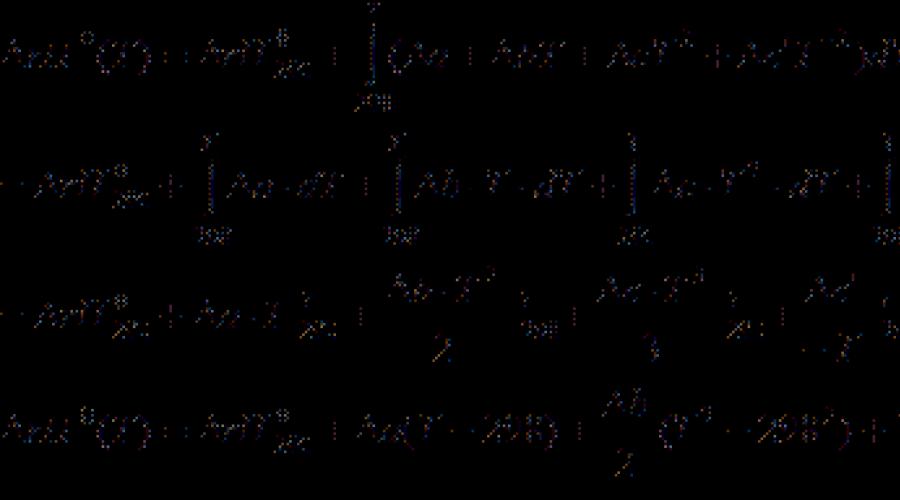
Όλες οι μέθοδοι υπολογισμού των θερμικών επιδράσεων βασίζονται στην εξίσωση Kirchoff στην ενσωματωμένη μορφή.
Τις περισσότερες φορές, το πρότυπο 298.15K χρησιμοποιείται ως η πρώτη θερμοκρασία.
Όλες οι μέθοδοι υπολογισμού των θερμικών επιδράσεων μειώνονται σε μεθόδους λήψης του ολοκληρώματος του δεξιού μέρους της εξίσωσης.
Ενσωματωμένες μεθόδους λήψης:
I. Μεσαία καπάκια θερμότητας. Αυτή η μέθοδος είναι η ευκολότερη και πιο ακριβής. Στην περίπτωση αυτή, η έκφραση κάτω από το ενσωματωμένο σημάδι αντικαθίσταται από την αλλαγή της μέσης θερμικής ικανότητας, η οποία δεν εξαρτάται από τη θερμοκρασία στην επιλεγμένη περιοχή.
Η μέση θερμική ικανότητα καταγράφεται και μετράται για τις περισσότερες αντιδράσεις. Είναι εύκολο να υπολογιστούν σε δεδομένα αναφοράς.
Ii. Σύμφωνα με τα αληθινά καπάκια θερμότητας. (Με τη βοήθεια των σειρών θερμοκρασίας)
Σε αυτή τη μέθοδο, η ενσωμάτωση έκφρασης θερμικής ικανότητας γράφεται ως περιοχή θερμοκρασίας:

III. Σύμφωνα με εξαρτήματα υψηλής θερμοκρασίας της ενθαλπίας. Αυτή η μέθοδος διανεμήθηκε ευρέως με την ανάπτυξη της τεχνολογίας πυραύλων κατά τον υπολογισμό των θερμικών επιδράσεων των χημικών αντιδράσεων σε υψηλές θερμοκρασίες. Βασίζεται στον ορισμό της θερμικής ικανότητας της Isobar:

Εξαρτήματα υψηλής θερμοκρασίας της ενθαλπίας. Δείχνει πόση η ενθαλπία της ατομικής ουσίας θα αλλάξει όταν θερμαίνεται σε ένα ορισμένο αριθμό βαθμών.
Για χημική αντίδραση, γράψτε:

Με αυτόν τον τρόπο:
Αριθμός διάλεξης 3.
Σχέδιο διαλέξεων:
1. ΙΙ Ο νόμος της θερμοδυναμικής, ορισμός, μαθηματική εγγραφή.
2. Ανάλυση του νόμου της θερμοδυναμικής
3. Υπολογισμός των αλλαγών εντροπίας σε ορισμένες διαδικασίες
εδώ και περαιτέρω ευρετήρια ΕΓΩ. Ανατρέξτε στις αρχικές ουσίες ή αντιδραστήρια και δείκτες Ι.- σε πεπερασμένες ουσίες ή προϊόντα αντίδρασης · και - στοιχειομετρικοί συντελεστές στην εξίσωση αντίδρασης για τα αρχικά υλικά και προϊόντα αντίδρασης, αντίστοιχα.
Παράδειγμα:Υπολογίστε τη θερμική επίδραση της αντίδρασης σύνθεσης μεθανόλης υπό τυπικές συνθήκες.
Απόφαση: Για τους υπολογισμούς, θα χρησιμοποιήσουμε δεδομένα αναφοράς σύμφωνα με την πρότυπη θερμότητα του σχηματισμού που εμπλέκεται στην αντίδραση των ουσιών (βλέπε πίνακα. 44 στη σελίδα 72 του βιβλίου αναφοράς).
Η θερμική επίδραση της αντίδρασης σύνθεσης μεθανόλης υπό τυποποιημένες συνθήκες υπό την πρώτη συνέπεια του νόμου περί GESS (εξίσωση 1.15) είναι ίση:
Κατά τον υπολογισμό των θερμικών επιδράσεων των χημικών αντιδράσεων, είναι απαραίτητο να ληφθεί υπόψη ότι η θερμική δράση εξαρτάται από τη συνολική κατάσταση των αντιδραστηρίων και τον τύπο καταγραφής της ισορροπίας της χημικής αντίδρασης:
Με τη δεύτερη συνέπεια του νόμου GESSA, η θερμική επίδραση μπορεί να υπολογιστεί χρησιμοποιώντας τη θερμότητα της καύσης Δ C H.Ως διαφορά στη θερμότητα της θερμότητας της καύσης των αρχικών υλικών και των προϊόντων αντίδρασης (λαμβάνοντας υπόψη τους στοιχειομετρικούς συντελεστές):
όπου δ. R c p. - χαρακτηρίζει την αλλαγή της ισοβαρικής θερμικής ικανότητας του συστήματος ως αποτέλεσμα της ροής μιας χημικής αντίδρασης και ονομάζεται συντελεστής θερμοκρασίας της θερμικής επίδρασης της αντίδρασης.
Από τη διαφορική εξίσωση Kirchhoff ακολουθεί ότι η εξάρτηση της θερμικής επίδρασης στη θερμοκρασία καθορίζεται από το σύμβολο Δ R c p.. Εξαρτάται από το γεγονός ότι περισσότερο, η συνολική θερμική ικανότητα των αρχικών ουσιών ή η συνολική θερμική ικανότητα των προϊόντων αντίδρασης. Ας αναλύσουμε τη διαφορική εξίσωση του Kirchhoff.
1. Εάν ο συντελεστής θερμοκρασίας Δ R c p.\u003e 0, στη συνέχεια παράγωγο  \u003e 0 και λειτουργία
\u003e 0 και λειτουργία  αυξάνοντας. Κατά συνέπεια, η θερμική επίδραση της αντίδρασης με αυξανόμενη θερμοκρασία αυξάνεται.
αυξάνοντας. Κατά συνέπεια, η θερμική επίδραση της αντίδρασης με αυξανόμενη θερμοκρασία αυξάνεται.
2. Εάν ο συντελεστής θερμοκρασίας Δ R c p.< 0, то производная  < 0 и функция
< 0 и функция  φθίνων. Κατά συνέπεια, η θερμική επίδραση της αντίδρασης με αυξανόμενη θερμοκρασία μειώνεται.
φθίνων. Κατά συνέπεια, η θερμική επίδραση της αντίδρασης με αυξανόμενη θερμοκρασία μειώνεται.
3. Εάν ο συντελεστής θερμοκρασίας Δ R c p. \u003d 0, στη συνέχεια παράγωγο  \u003d 0 Ι.
\u003d 0 Ι.  . Κατά συνέπεια, η θερμική επίδραση της αντίδρασης δεν εξαρτάται από τη θερμοκρασία. Η υπόθεση αυτή δεν συμβαίνει στην πράξη.
. Κατά συνέπεια, η θερμική επίδραση της αντίδρασης δεν εξαρτάται από τη θερμοκρασία. Η υπόθεση αυτή δεν συμβαίνει στην πράξη.
Οι διαφορικές εξισώσεις είναι βολικές για ανάλυση, αλλά άβολα για υπολογισμούς. Προκειμένου να επιτευχθεί μια εξίσωση για τον υπολογισμό της θερμικής επίδρασης μιας χημικής αντίδρασης, στη διασταύρωση της διαφορικής εξίσωσης του Kirchhoff, διαχωρίζοντας τις μεταβλητές:


Η θερμική ικανότητα των ουσιών εξαρτάται επομένως από τη θερμοκρασία και  . Ωστόσο, στην περιοχή των θερμοκρασιών που χρησιμοποιούνται συνήθως σε χημικές και τεχνολογικές διεργασίες, αυτή η εξάρτηση δεν είναι σημαντική. Για πρακτικούς σκοπούς, οι ουσίες μέσης θερμότητας χρησιμοποιούνται στην περιοχή θερμοκρασίας από 298 έως την καθορισμένη θερμοκρασία.
. Ωστόσο, στην περιοχή των θερμοκρασιών που χρησιμοποιούνται συνήθως σε χημικές και τεχνολογικές διεργασίες, αυτή η εξάρτηση δεν είναι σημαντική. Για πρακτικούς σκοπούς, οι ουσίες μέσης θερμότητας χρησιμοποιούνται στην περιοχή θερμοκρασίας από 298 έως την καθορισμένη θερμοκρασία.  που δίνονται στα βιβλία αναφοράς. Συντελεστής θερμοκρασίας θερμικής επίδρασης, υπολογιζόμενη με τη χρήση μέσου θερμότητας:
που δίνονται στα βιβλία αναφοράς. Συντελεστής θερμοκρασίας θερμικής επίδρασης, υπολογιζόμενη με τη χρήση μέσου θερμότητας:
Παράδειγμα:Υπολογίστε τη θερμική επίδραση της αντίδρασης σύνθεσης μεθανόλης σε θερμοκρασία 1000 έως και τυποποιημένη πίεση.
Απόφαση: Για τους υπολογισμούς, θα χρησιμοποιήσουμε τα δεδομένα αναφοράς σχετικά με τη μέση θερμική ικανότητα των ουσιών που εμπλέκονται στην αντίδραση στην περιοχή θερμοκρασίας από 298 έως 1000 K (βλ. Πίνακα 40 στη σελίδα 56 του καταλόγου):
Αλλαγές στη μέση θερμική ικανότητα του συστήματος ως αποτέλεσμα της ροής μιας χημικής αντίδρασης:
Τη δεύτερη αρχή της θερμοδυναμικής
Ένα από τα σημαντικότερα καθήκοντα της χημικής θερμοδυναμικής είναι να αποσαφηνιστεί η κύρια πιθανότητα (ή η ανικανότητα) της αυθόρμητης ροής μιας χημικής αντίδρασης στην υπό εξέταση κατεύθυνση. Σε περιπτώσεις όπου καθίσταται σαφές ότι μπορεί να συμβεί αυτή η χημική αλληλεπίδραση, είναι απαραίτητο να προσδιοριστεί ο βαθμός μετασχηματισμού των πηγών ουσίας και η απόδοση των προϊόντων αντίδρασης, δηλαδή την πληρότητα της αντίδρασης
Η κατεύθυνση της πορείας της αυθόρμητης διαδικασίας μπορεί να καθοριστεί με βάση τον δεύτερο νόμο ή την έναρξη της θερμοδυναμικής που διατυπώνεται, για παράδειγμα, με τη μορφή ενός Clausius Postulate:
Η ίδια η θερμότητα δεν μπορεί να μετακινηθεί από ένα κρύο σώμα σε ζεστό, δηλαδή, μια τέτοια μέθοδος είναι αδύνατη, το μόνο αποτέλεσμα της οποίας ήταν η μετάβαση της θερμότητας από το σώμα με χαμηλότερη θερμοκρασία στο σώμα με υψηλότερη θερμοκρασία.
Προτείνεται μια ποικιλία σκευασμάτων της δεύτερης έναρξης της θερμοδυναμικής. Η διατύπωση του Thomson - Planck:
Ο αιώνιος κινητήρας του δεύτερου είδους είναι αδύνατος, δηλαδή, μια τέτοια περιοδικά ενεργή μηχανή είναι αδύνατη, η οποία θα επέτρεπε την απόκτηση λειτουργίας μόνο με την ψύξη της πηγής θερμότητας.
Η μαθηματική συνταγοποίηση της δεύτερης έναρξης της θερμοδυναμικής εμφανίζεται κατά την ανάλυση της λειτουργίας θερμικών μηχανημάτων στα έργα του Ν. Carno και του R. Clausius.
Ο Clausius εισήγαγε μια κατάσταση κατάστασης ΜΙΚΡΟ., που ονομάζεται εντροπία, η αλλαγή στην οποία είναι ίση με τη θερμότητα της αναστρέψιμης διαδικασίας, που αναφέρεται σε θερμοκρασία
Για οποιαδήποτε διαδικασία
 | (1.22) |
Η προκύπτουσα έκφραση είναι μια μαθηματική έκφραση της δεύτερης έναρξης της θερμοδυναμικής.
Τυπική ζεστασιά της εκπαίδευσης (ενθαλμάτης εκπαίδευσης) ουσίες Ονομάζεται ενθαλπία του σχηματισμού του σχηματισμού 1 προσεύχοντος αυτής της ουσίας από τα στοιχεία (απλές ουσίες, που αποτελείται από άτομα ενός είδους) στην πιο σταθερή πρότυπο κράτος. Οι τυποποιημένες περιβαλλοντικές ενέργειες (CJ / mol) δίνονται σε βιβλία αναφοράς. Όταν χρησιμοποιείτε τιμές αναφοράς, είναι απαραίτητο να δοθεί προσοχή στην κατάσταση φάσης των ουσιών που εμπλέκονται στην αντίδραση. Ενθαλπία σχηματισμού των πιο σταθερών απλών ουσιών είναι 0.
Από το νόμο Gess σχετικά με τον υπολογισμό των θερμικών επιπτώσεων των χημικών αντιδράσεων στη θερμότητα της εκπαίδευσης : πρότυπο Η θερμική επίδραση της χημικής αντίδρασης είναι ίση με τη θερμότητα της θερμότητας του σχηματισμού των προϊόντων αντίδρασης και τη θερμότητα του σχηματισμού των πηγών, λαμβάνοντας υπόψη τους στοιχειομετρικούς συντελεστές (ποσότητες γραμμομορίων) των αντιδραστηρίων:
Ch 4 + 2 CO \u003d 3 C ( γραφίτης ) + 2 Η. 2 Ο.
Τηλεόραση αερίου αερίου. αέριο
Η θερμότητα του σχηματισμού ουσιών σε αυτές τις περιοχές φάσης παρουσιάζεται στον πίνακα. 1.2.
Πίνακας 1.2.
Ζεστό σχηματισμό ουσιών
Απόφαση
Δεδομένου ότι η αντίδραση περνάει όταν Π.\u003d Const, τότε η τυπική θερμική επίδραση βρίσκεται ως αλλαγή στην ενθαλπία σύμφωνα με τη γνωστή θερμότητα της εκπαίδευσης κατά συνέπεια του νόμου GESS (Formula (1,17):
ΔΝ. σχετικά με 298 \u003d (2 · (-241.81) + 3 · 0) - (-74.85 + 2 · (-110,53)) \u003d -187,71 kJ \u003d -187710 J.
ΔΝ. σχετικά με 298 < 0, реакция является экзотермической, протекает с выделением теплоты.
Αλλαγή της εσωτερικής ενέργειας που βρίσκουμε με βάση την εξίσωση (1.16):
Δu. σχετικά με 298 = Δh. σχετικά με 298 – Δ ν · rt..
Για αυτή την αντίδραση των αλλαγών στον αριθμό των γραμμομορίων αέριων ουσιών λόγω της διέλευσης μιας χημικής αντίδρασης Δν = 2 – (1 + 2) = –1; Τ.\u003d 298 K, τότε
Δ U. σχετικά με 298 \u003d -187710 - (-1) · 8,314 · 298 \u003d -185232 J.
Υπολογισμός των τυποποιημένων θερμικών επιδράσεων των χημικών αντιδράσεων σύμφωνα με την πρότυπη θερμότητα της καύσης των ουσιών που εμπλέκονται στην αντίδραση
Τυπική καύση θερμότητας (ενθαλπία καύσης) ουσία
Ονομάζεται θερμική επίδραση της πλήρους οξείδωσης 1 προσευχής μιας δεδομένης ουσίας (έως υψηλότερα οξείδια ή ειδικά υποδεικνυόμενες ενώσεις) με οξυγόνο, υπό την προϋπόθεση ότι οι αρχικές και οι πεπερασμένες ουσίες έχουν μια τυπική θερμοκρασία. Τυπικές ουσίες ενθαλπίας καύσης  (Kj / mol) δίνονται σε βιβλία αναφοράς. Όταν χρησιμοποιείτε τιμές αναφοράς, είναι απαραίτητο να δώσετε προσοχή στο σημάδι του ελέφαντα της αντίδρασης καύσης, η οποία είναι πάντα εξωθερμική ( Δ
Η.
<0), а в таблицах указаны величины
(Kj / mol) δίνονται σε βιβλία αναφοράς. Όταν χρησιμοποιείτε τιμές αναφοράς, είναι απαραίτητο να δώσετε προσοχή στο σημάδι του ελέφαντα της αντίδρασης καύσης, η οποία είναι πάντα εξωθερμική ( Δ
Η.
<0), а в таблицах указаны величины
 .
. Η εννεπατημένη καύση υψηλότερων οξειδίων (για παράδειγμα, το νερό και το διοξείδιο του άνθρακα) είναι ίσο με το 0.
Η εννεπατημένη καύση υψηλότερων οξειδίων (για παράδειγμα, το νερό και το διοξείδιο του άνθρακα) είναι ίσο με το 0.
Από το νόμο Gess σχετικά με τον υπολογισμό των θερμικών επιδράσεων των χημικών αντιδράσεων στη θερμότητα της καύσης : Η τυπική θερμική επίδραση της χημικής αντίδρασης είναι ίση με τη θερμότητα της θερμότητας της καύσης των αρχικών ουσιών και της θερμότητας της καύσης των προϊόντων αντίδρασης, λαμβάνοντας υπόψη τους στοιχειομετρικούς συντελεστές (ποσότητα moles) των αντιδραστηρίων:
ΝΤΟ. 2 Η. 4 + Η. 2 Ο. \u003d S. 2 Ν. 5 ΕΙΝΑΙ ΑΥΤΟΣ.
Ακριβώς όπως ένα από τα φυσικά χαρακτηριστικά ενός ατόμου είναι η σωματική δύναμη, το πιο σημαντικό χαρακτηριστικό οποιασδήποτε χημικής επικοινωνίας είναι η δύναμη της επικοινωνίας, δηλ. Την ενέργειά της.
Θυμηθείτε ότι η ενέργεια του χημικού δεσμού - αυτή η ενέργεια που κατανέμεται στο σχηματισμό χημικού δεσμού ή της ενέργειας που πρέπει να δαπανηθεί για να καταστρέψει αυτή τη σύνδεση.
Η χημική αντίδραση γενικά είναι η μετατροπή μιας ουσίας σε άλλους. Κατά συνέπεια, κατά τη διάρκεια της χημικής αντίδρασης, υπάρχει σπάσιμο ορισμένων συνδέσεων και ο σχηματισμός άλλων, δηλ. Περιστρέφοντας ενέργεια.
Ο θεμελιώδης νόμος της φυσικής δηλώνει ότι η ενέργεια δεν προκύπτει από τίποτα και δεν εξαφανίζεται χωρίς ίχνος, αλλά μόνο περνά από ένα είδος στο άλλο. Με την καθήκον της, αυτή η αρχή είναι προφανώς εφαρμόσιμη σε μια χημική αντίδραση.
Θερμική επίδραση της χημικής αντίδρασης Ονομάζεται το ποσό της θερμότητας,
(Ή απορροφάται) κατά τη διάρκεια της αντίδρασης και το σε σχέση με το 1 mol αντέδρασαν (ή την προκύπτουσα) ουσία.
Η θερμική δράση υποδεικνύεται από το γράμμα Q και, κατά κανόνα, μετράται σε KJ / mol ή Kcal / mol.
Εάν η αντίδραση συμβεί με απελευθέρωση θερμότητας (Q\u003e 0), ονομάζεται εξωθερμική και αν με απορρόφηση θερμότητας (Q< 0) – эндотермической.
Εάν είναι σχηματικά να απεικονιστεί το ενεργειακό προφίλ της αντίδρασης, στη συνέχεια για ενδοθερμικές αντιδράσεις, τα προϊόντα είναι πάνω από την ενέργεια από τα αντιδραστήρια και για εξωθερμική - αντίθετα, τα προϊόντα αντίδρασης βρίσκονται κάτω από την ενέργεια (πιο σταθερά) από τα αντιδραστήρια.
Είναι σαφές ότι όσο μεγαλύτερη η ουσία αντιδρά, τόσο μεγαλύτερη είναι η ποσότητα ενέργειας διαχωρίζεται (ή απορροφάται), δηλ. Η θερμική επίδραση είναι άμεσα ανάλογη με την ποσότητα της ουσίας. Ως εκ τούτου, η στάση της θερμικής επίδρασης σε 1 mol της ουσίας οφείλεται στην επιθυμία μας να συγκρίνουμε τις θερμικές επιδράσεις των διαφόρων αντιδράσεων.
Διάλεξη 6. Θερμοκυλία. Η θερμική επίδραση του Παράδειγμα Χημικής Αντίδρασης 1. Με την αποκατάσταση 8,0 g οξειδίου του οξειδίου του χαλκού (II) του υδρογόνου, σχηματίστηκαν μέταλλο χαλκού και ζεύγη νερού και 7,9 kJ βόλτα έξω. Υπολογίστε τη θερμική επίδραση της αντίδρασης της μείωσης του οξειδίου του χαλκού (II).
Απόφαση. Εξίσωση αντίδρασης Cuo (τηλεόραση) + H2 (G.) \u003d Cu (τηλεόραση.) + H2O (G.) + Q (*)
Κάνετε μια αναλογία κατά την αποκατάσταση 0,1 mol - 7,9 kJ κατανέμεται κατά την αποκατάσταση 1 mol - x kj
Όπου x \u003d + 79 kj / mole. Η εξίσωση (*) παίρνει
Cuo (τηλεόραση) + H2 (G.) \u003d Cu (τηλεόραση.) + H2O (G.) +79 KJ
Θερμοκημική εξίσωση- Αυτή είναι μια εξίσωση χημικής αντίδρασης, η οποία υποδεικνύει τη συνολική κατάσταση των συστατικών του μίγματος αντίδρασης (αντιδραστήρια και προϊόντα) και της θερμικής επίδρασης της αντίδρασης.
Έτσι ώστε να λιώσει τον πάγο ή να εξατμιστεί νερό, είναι απαραίτητο να δαπανηθούν ορισμένες ποσότητες θερμότητας, ενώ κατά τη διάρκεια της κατάψυξης υγρού νερού ή συμπύκνωσης του υδρατμού διατίθενται οι ίδιες ποσότητες. Αυτός είναι ο λόγος για τον οποίο είναι κρύο όταν βγαίνουμε από το νερό (η εξάτμιση του νερού από την επιφάνεια του σώματος απαιτεί το ενεργειακό κόστος) και η εφίδρωση είναι ένας βιολογικός προστατευτικός μηχανισμός από την υπερθέρμανση του σώματος. Αντίθετα, ο καταψύκτης παγώνει το νερό και θερμαίνει το γύρω δωμάτιο, δίνοντάς της μια υπερβολική θερμότητα.
Αυτό το παράδειγμα δείχνει τις θερμικές επιδράσεις των αλλαγών στη συνολική κατάσταση του νερού. Η θερμότητα τήξης (στους 0 ° C) λ \u003d 3.34 × 105 J / kg (φυσική) ή QL. \u003d - 6.02 kj / mol (χημεία), εξάτμιση θερμότητας (εξάτμιση) (στο 100o C) Q \u003d 2.26 × 106 J / kg (φυσική) ή Qisp. \u003d - 40,68 kj / mol (χημεία).
τήξη
εξάτμιση |
|||||
oBR, 298.
Διάλεξη 6. Θερμοκυλία. Η θερμική επίδραση της χημικής αντίδρασης είναι φυσικά, οι διαδικασίες εξάχνωσης είναι δυνατές όταν το στερεό
Πηγαίνει στην αέρια φάση, παρακάμπτοντας την υγρή κατάσταση και τις αντίστροφες διεργασίες απόθεσης (κρυστάλλωση) από την αέρια φάση, είναι επίσης δυνατή η υπολογισμός ή η μέτρηση της θερμικής δράσης.
Είναι σαφές ότι σε κάθε ουσία υπάρχουν χημικά ομόλογα, επομένως, κάθε ουσία έχει κάποιο ενεργειακό αποθεματικό. Ωστόσο, δεν μπορούν να μετατραπούν όλες οι ουσίες μεταξύ τους με μία χημική αντίδραση. Ως εκ τούτου, συμφώνησε να εισαγάγει ένα πρότυπο κράτος.
Τυπική κατάσταση ουσίας- Πρόκειται για μια συνολική κατάσταση μιας ουσίας σε θερμοκρασία 298 Κ, πίεση 1 ατμόσφαιρας στην πιο σταθερή αλλοτροπική τροποποίηση σε αυτές τις συνθήκες.
Τυποποιημένες συνθήκες- Αυτή είναι η θερμοκρασία των 298 K και της ατμόσφαιρας πίεσης 1. Οι τυπικές συνθήκες (τυποποιημένη κατάσταση) υποδεικνύεται από το ευρετήριο0.
Τυπική σύνδεση σχηματισμού θερμότητας Ονομάζεται θερμική επίδραση της χημικής αντίδρασης του σχηματισμού αυτής της ένωσης από απλές ουσίες που λαμβάνονται στην κατάσταση του κανονικού τους. Η θερμότητα του σχηματισμού της ένωσης υποδεικνύεται από το σύμβολο Q.0 Για μια ποικιλία ενώσεων, η τυπική θερμική εκπαίδευση δίνεται στα βιβλία αναφοράς φυσικοχημικών αξιών.
Η τυποποιημένη θερμότητα του σχηματισμού απλών ουσιών είναι ίση με το 0. Για παράδειγμα, Q0 Arr., 298 (O2, αέριο) \u003d 0, Q0 arr, 298 (C, τηλεόραση, γραφίτης) \u003d 0.
Για παράδειγμα . Καταγράψτε την θερμοχημική εξίσωση για το σχηματισμό θειικού χαλκού (II). Από το βιβλίο αναφοράς Q0 ARR, 298 (CUSO4) \u003d 770 kJ / mol.
Cu (τηλεόραση) + S (τηλεόραση.) + 2O2 (G.) \u003d CUSO4 (TV) + 770 KJ.
Σημείωση: Η θερμοχημική εξίσωση μπορεί να καταγραφεί για οποιαδήποτε ουσία, ωστόσο, είναι απαραίτητο να κατανοήσουμε ότι στην πραγματική ζωή η αντίδραση συμβαίνει με έναν εντελώς διαφορετικό τρόπο: από τα αναφερόμενα αντιδραστήρια σχηματίζονται όταν θερμαίνεται οξείδιο του χαλκού (II) και του θείου (IV ), αλλά δεν σχηματίζεται το θειικό χαλκό (II). Σημαντικό συμπέρασμα: Η θερμοχημική εξίσωση είναι ένα μοντέλο που επιτρέπει στους υπολογισμούς, είναι καλά σύμφωνο με άλλα θερμοχημικά δεδομένα, αλλά δεν αντέχει την επαλήθευση της πρακτικής (δηλαδή, ανίκανος να προβλέπει σωστά τη δυνατότητα ή την αδυναμία αντίδρασης).
(B j) - σ Α I Q Q Arr 0, 298 I
Διάλεξη 6. Θερμοκυλία. Θερμική επίδραση της χημικής αντίδρασης
Διευκρίνιση. Για να μην σας παραπλανήσει, θα προσθέσω αμέσως αυτή τη χημική θερμοδυναμική Μπορεί να προβλέψει τη δυνατότητα / αδυναμία αντίδρασηςΩστόσο, αυτό απαιτεί πιο σοβαρά "εργαλεία" που υπερβαίνουν τη σχολική πορεία της χημείας. Η θερμοχημική εξίσωση σε σύγκριση με αυτές τις τεχνικές είναι το πρώτο βήμα στο φόντο της πυραμίδας της Hearse - χωρίς να μην μπορεί να κάνει, αλλά όχι υψηλό.
Παράδειγμα 2. Υπολογίστε τη θερμική επίδραση της συμπύκνωσης νερού που ζυγίζει 5,8 g. Η διαδικασία συμπύκνωσης περιγράφεται από την θερμοχημική εξίσωση Η2Ο (G.) \u003d Η2Ο (G.) + Q - Συμπύκνωση Q συνήθως εξωθερμική διαδικασία συμπύκνωσης θερμότητας σε 25ο C 37 KJ / mol (κατάλογο).
Συνεπώς, q \u003d 37 × 0,32 \u003d 11,84 kj.
Τον 19ο αιώνα, ο Ρώσος Χημικός, ο οποίος μελέτησε τις θερμικές επιπτώσεις των αντιδράσεων, καθιέρωσε πειραματικά το δίκαιο της εξοικονόμησης ενέργειας σε σχέση με τις χημικές αντιδράσεις - ο νόμος της ΕΣΕ.
Η θερμική επίδραση της χημικής αντίδρασης δεν εξαρτάται από τη διαδρομή επεξεργασίας και καθορίζεται μόνο από τη διαφορά των πεπερασμένων και αρχικών κρατών.
Από την άποψη της Χημείας και των Μαθηματικών, ο νόμος αυτός σημαίνει ότι είμαστε ελεύθεροι να υπολογίσουμε τη διαδικασία για να επιλέξετε οποιαδήποτε "τροχιά υπολογισμού", επειδή το αποτέλεσμα δεν εξαρτάται από αυτό. Για το λόγο αυτό, ο πολύ σημαντικός νόμος της Hess έχει ένα απίστευτα σημαντικό Φορέμα του νόμου Gess.
Η θερμική επίδραση της χημικής αντίδρασης είναι ίση με το άθροισμα της θερμότητας του σχηματισμού των προϊόντων αντίδρασης δίχτυ της θερμότητας του σχηματισμού αντιδραστηρίων (λαμβάνοντας υπόψη τους στοιχειομετρικούς συντελεστές).
Από την άποψη της κοινής λογικής, αυτή η έρευνα αντιστοιχεί στη διαδικασία στην οποία όλα τα αντιδραστήρια μετατράπηκαν πρώτα σε απλές ουσίες, οι οποίες στη συνέχεια συγκεντρώθηκαν με έναν νέο τρόπο, έτσι ώστε να ληφθούν τα προϊόντα αντίδρασης.
Με τη μορφή της εξίσωσης, η συνέπεια του νόμου GESS μοιάζει με την εξίσωση της αντίδρασης: A 1 A 1 + A 2 A 2 + ... + a n an \u003d b 1 b 1 + b 2 b 2 + ... σι
Ταυτόχρονα, ένα I I IB J είναι στοιχειομετρικοί συντελεστές, ένα i - αντιδραστήρια, B J - προϊόντα αντίδρασης.
Στη συνέχεια, η συνέπεια του νόμου Gessa έχει τη μορφή Q \u003d Σ Β J × Q Arr. 0, 298
k bk + q
(Α)
Διάλεξη 6. Θερμοκυλία. Η θερμική επίδραση μιας χημικής αντίδρασης από την κανονική θερμότητα του σχηματισμού πολλών ουσιών
α) δεσμευμένη σε ειδικούς πίνακες ή β) μπορεί να προσδιοριστεί πειραματικά, καθίσταται δυνατή η πρόβλεψη (υπολογίζεται) η θερμική επίδραση ενός πολύ μεγάλου αριθμού αντιδράσεων με επαρκώς υψηλή ακρίβεια.
Παράδειγμα 3. (Η συνέπεια του νόμου Gess). Υπολογίστε τη θερμική επίδραση της μετατροπής ατμού του μεθανίου που εμφανίζεται στη φάση αερίου υπό τυποποιημένες συνθήκες:
CH4 (G.) + Η2Ο (G.) \u003d CO (G.) + 3 H2 ()
Προσδιορίστε αν αυτή η αντίδραση είναι εξωθερμική ή ενδοθερμική;
Λύση: η συνέπεια του νόμου Gess
Q \u003d 3 Q0 | Δ) + q 0 | (CO, D) -Q 0 | D) -q 0 | Δ, δ) - Γενικά. |
|||||
oBR, 298. | oBR, 298. | oBR, 298. | oBR, 298. | ||||||
Q ob0. | 298 (H 2, D) \u003d 0 | Απλή ουσία σε τυπική κατάσταση |
|||||||
Από το βιβλίο αναφοράς βρίσκουμε τη ζεστασιά του σχηματισμού των υπόλοιπων συστατικών του μείγματος.
O, d) \u003d 241,8 | (CO, D) \u003d 110,5 | Δ) \u003d 74.6 | |||||||||
oBR, 298. | oBR, 298. | oBR, 298. | |||||||||
Υποκαθιστούμε τις τιμές στην εξίσωση
Q \u003d 0 + 110,5 - 74,6 - 241,8 \u003d -205,9 kJ / mol, η αντίδραση είναι εξαιρετικά endothermich.
Απάντηση: Q \u003d -205.9 kj / mol, enverthermal
Παράδειγμα 4. (Εφαρμογή της Gessa). Η ζεστασιά των αντιδράσεων είναι γνωστή
C (τηλεόραση) + ½ o (g.) \u003d Co (g.) + 110,5 kJ
C (Τηλεόραση) + 02 (G.) \u003d CO2 (G.) + 393,5 KJ Βρείτε τη θερμική επίδραση της αντίδρασης 2CO (G.) + O2 (G.) \u003d 2CO2 (g.). Απόφαση πολλαπλασιασμού του πρώτου και του δεύτερου Εξίσωση στις 2
2C (τηλεόραση.) + O2 (g.) \u003d 2co (g.) + 221 kJ 2c (τηλεόραση) + 2Ο2 (g.) \u003d 2co2 (g.) + 787 kj
Από τη δεύτερη εξίσωση το πρώτο
O2 (G.) \u003d 2CO2 (G.) + 787 KJ - 2CO (G.) - 221 KJ,
2CO (G.) + O2 (G.) \u003d 2CO2 (G.) + 566 KJ Απάντηση: 566 KJ / Mol.
Σημείωση: Κατά τη μελέτη της θερμοχημεία, θεωρούμε τη χημική αντίδραση από το εξωτερικό (έξω). Αντίθετα, η χημική θερμοδυναμική - η επιστήμη της συμπεριφοράς των χημικών συστημάτων - θεωρεί το σύστημα από το εσωτερικό και λειτουργεί με την έννοια της "ενθαλπίας" Η ως η θερμική ενέργεια του συστήματος. Entarpy, όπως
Διάλεξη 6. Θερμοκυλία. Η θερμική επίδραση της χημικής αντίδρασης είναι η ίδια έννοια με την ποσότητα θερμότητας, αλλά έχει το αντίθετο σημάδι: εάν η ενέργεια διακρίνεται από το σύστημα, το περιβάλλον του παίρνει και θερμαίνεται και το σύστημα χάνει ενέργεια.
Βιβλιογραφία:
1. Tutorial, v.v. Eremin, Ν.Ε. Kuzmenko et αϊ., Χημεία βαθμού 9, παράγραφος 19,
2. Εκπαιδευτικό και μεθοδολογικό εγχειρίδιο "Βασικές αρχές της Γενικής Χημείας" Μέρος 1.
Συγκριτές - S.G. Baram, i.n. Mironova. - Πάρε μαζί σου! Για την επόμενη κατοχή σεμιναρίων
3. Α.Β. Manuilles. Βασικά στοιχεία της χημείας. http://hemi.nsu.ru/index.htm.
§9.1 Η θερμική επίδραση της χημικής αντίδρασης. Τους κύριους νόμους της θερμοχημεία.
§9.2 ** Θερμοκυλία (συνέχεια). Τη θερμότητα του σχηματισμού της ουσίας από τα στοιχεία.
Πρότυπη ενθαλπική εκπαίδευση.
Προσοχή!
Επομένως, θα λύσουμε τα καθήκοντα διακανονισμού, η αριθμομηχανή είναι επίσης επιθυμητή για σεμινάρια στη χημεία.
Η θερμοχημεία μελετά τις θερμικές επιδράσεις των χημικών αντιδράσεων. Σε πολλές περιπτώσεις, αυτές οι αντιδράσεις εμφανίζονται σε σταθερό όγκο ή σταθερή πίεση. Από τον πρώτο νόμο της θερμοδυναμικής, ακολουθεί ότι υπό αυτές τις συνθήκες θερμότητας είναι μια λειτουργία λειτουργίας. Με σταθερό όγκο θερμότητας ίσο με την αλλαγή της εσωτερικής ενέργειας:
Και σε σταθερή πίεση, η αλλαγή στην ενθαλπία:
Αυτές οι ισοτιμότητες στην αίτηση σε χημικές αντιδράσεις είναι απαραίτητες Νόμος της Gessa:
Η θερμική επίδραση της χημικής αντίδρασης που ρέει σε σταθερή πίεση ή σταθερή όγκο δεν εξαρτάται από τη διαδρομή αντίδρασης και προσδιορίζεται μόνο από την κατάσταση αντιδραστηρίων και προϊόντων αντίδρασης.
Με άλλα λόγια, η θερμική επίδραση της χημικής αντίδρασης είναι η αλλαγή της λειτουργίας κατάστασης.
Στην θερμοχημεία, σε αντίθεση με άλλες θερμοδυναμικές εφαρμογές, η θερμότητα θεωρείται θετική αν επισημανθεί στο περιβάλλον, δηλ. αν ένα Η. < 0 или U.
< 0. Под тепловым эффектом химической реакции
понимают значение Η. (που ονομάζεται απλά "αντίδραση ενθαλπίας") ή U. αντιδράσεις.
Εάν η αντίδραση προχωρά σε διάλυμα ή στερεή φάση, όπου η αλλαγή στην ένταση είναι ελαφρώς,
Η. = U. + (Φωτοβολώ) U.. (3.3)
Εάν τα τέλεια αέρια εμπλέκονται στην αντίδραση, στη συνέχεια σε μια σταθερή θερμοκρασία
Η. = U. + (Φωτοβολώ) = U. + n. Rt, (3.4)
όπου το η είναι μια αλλαγή στον αριθμό των αιματηρών αερίων στην αντίδραση.
Προκειμένου να διευκολυνθεί η σύγκριση του ενθουσιωδίου διαφόρων αντιδράσεων, χρησιμοποιήστε την έννοια της "πρότυπης κατάστασης". Η τυπική κατάσταση είναι η κατάσταση της καθαρής ουσίας σε πίεση 1 bar (\u003d 10 5 ΡΑ) και μια δεδομένη θερμοκρασία. Για τα αέρια, αυτή είναι μια υποθετική κατάσταση σε πίεση 1 bar, η οποία έχει τις ιδιότητες απείρως αραιής αερίου. Η ενθαλπία της αντίδρασης μεταξύ των ουσιών σε τυποποιημένες συνθήκες σε θερμοκρασίες Τ., δηλώνει ( r. Σημαίνει "αντίδραση"). Σε θερμοχημικές εξισώσεις, όχι μόνο οι τύποι ουσιών, αλλά και τα συσσωρευμένα κράτη ή οι κρυσταλλικές τροποποιήσεις τους υποδεικνύονται.
Από το νόμο της ΕΣΚ, σημαντικές συνέπειες, οι οποίες επιτρέπουν τον υπολογισμό της ενθαλπίας χημικών αντιδράσεων.
Επικάλυψη 1.
![]()
ίση με τη διαφορά στο τυποποιημένο σχηματισμό ενθουσιωδών προϊόντων αντίδρασης και αντιδραστηρίων (λαμβάνοντας υπόψη τους στοιχειομετρικούς συντελεστές):
Πρότυπη ενθαλπία (θερμότητα) σχηματισμού ουσιών (ΦΑ. σημαίνει "σχηματισμό") σε μια δεδομένη θερμοκρασία που ονομάζεται ενθαλπία του σχηματισμού του σχηματισμού μιας προσευχής αυτής της ουσίας Από στοιχείαπου βρίσκεται στο πιο βιώσιμο πρότυπο κράτος. Σύμφωνα με αυτόν τον ορισμό, η ενθαλπία σχηματισμού των πιο σταθερών απλών ουσιών στην τυποποιημένη κατάσταση είναι 0 σε οποιαδήποτε θερμοκρασία. Οι τυποποιημένες ενέργειες σχηματισμού ουσιών σε θερμοκρασία 298 κ. Δίνεται σε βιβλία αναφοράς.
Οι έννοιες της "ενθαλπίας εκπαίδευσης" χρησιμοποιούνται όχι μόνο για συμβατικές ουσίες, αλλά και για ιόντα σε διάλυμα. Ταυτόχρονα, το ιόν Η + λαμβάνεται ανά σημείο αναφοράς, για το οποίο η τυποποιημένη ενθαλπία σχηματισμού σε υδατικό διάλυμα υποτίθεται ότι είναι μηδέν: ![]()
Επικάλυψη 2. Πρότυπη ενθαλπία χημικής αντίδρασης
![]()
ίση με τη διαφορά της ενθαλπίας της καύσης των αντιδραστηρίων και των προϊόντων αντίδρασης (λαμβάνοντας υπόψη τους στοιχειομετρικούς συντελεστές):
(ΝΤΟ. Σημαίνει "combucer"). Η τυποποιημένη ενθαλπία (θερμότητα) της καύσης της ουσίας ονομάζεται ενθαλπία της αντίδρασης της συνολικής οξείδωσης μιας προσευχής. Αυτή η συνέπεια χρησιμοποιείται συνήθως για τον υπολογισμό των θερμικών επιδράσεων των οργανικών αντιδράσεων.
Συγκόλληση 3. Η ενθαλπία της χημικής αντίδρασης είναι ίση με τη διαφορά της ενέργειας των σχισμένων και των προκύπτουσας χημικών δεσμών.
Ενέργεια επικοινωνίας Το A-B ονομάζεται ενέργεια που απαιτείται για να σπάσει τον δεσμό και την αραίωση των προκύπτοντων σωματιδίων στην άπειρη απόσταση:
Ab (g) a (g) + b (g).
Η ενέργεια επικοινωνίας είναι πάντα θετική.
Τα περισσότερα θερμοχημικά δεδομένα στα βιβλία αναφοράς δίδονται σε θερμοκρασία 298 Κ. Για τον υπολογισμό των θερμικών επιδράσεων σε άλλες θερμοκρασίες χρησιμοποιούν kirchhoff Εξίσωση:
(Διαφορική μορφή) (3.7)
 (Ενσωματωμένη μορφή) (3.8)
(Ενσωματωμένη μορφή) (3.8)
Οπου C Π. - τη διαφορά της ισοβαρικής θερμικής ικανότητας των προϊόντων αντίδρασης και των πρώτων υλών. Αν διαφορά Τ. 2 - Τ. 1 είναι μικρό, τότε μπορείτε να πάρετε C Π. \u003d const. Με μεγάλη διαφορά θερμοκρασίας, είναι απαραίτητο να χρησιμοποιηθεί η εξάρτηση από τη θερμοκρασία C Π.(Τ.) Τύπος:
Όπου είναι οι συντελεστές ΕΝΑ., ΣΙ., ΝΤΟ. και τα λοιπά. Για μεμονωμένες ουσίες, λαμβάνουν από τον κατάλογο και το σύμβολο υποδεικνύει τη διαφορά μεταξύ των προϊόντων και των αντιδραστηρίων (λαμβάνοντας υπόψη τους συντελεστές).
Παραδείγματα
Παράδειγμα 3-1. Οι τυποποιημένες ενάλλεινες του σχηματισμού υγρού και αερίου νερού στα 298 Κ είναι ίσα με -285,8 και -241,8 kJ / mol, αντίστοιχα. Υπολογίστε την ενθαλπία εξάτμισης νερού σε αυτή τη θερμοκρασία.
Απόφαση. Η ενθαλπία εκπαίδευσης αντιστοιχεί στις ακόλουθες αντιδράσεις:
Η2 (g) + όσο 2 (g) \u003d Η2Ο (g), Η. 1 0 = -285.8;
Η2 (g) + όσο 2 (g) \u003d Η2Ο (g), Η. 2 0 = -241.8.
Η δεύτερη αντίδραση μπορεί να διεξαχθεί σε δύο στάδια: πρώτα καύση υδρογόνο για να σχηματίσουν υγρό νερό με την πρώτη αντίδραση και στη συνέχεια να εξατμιστούν το νερό:
Η2Ο (g) \u003d Η2Ο (g), Η. 0 είναι \u003d?
Στη συνέχεια, σύμφωνα με το νόμο της ΕΣΚ,
Η. 1 0 + Η. 0 είναι \u003d. Η. 2 0 ,
Από Η. 0 ISP \u003d -241.8 - (-285.8) \u003d 44,0 kJ / mol.
Απάντηση. 44,0 kJ / mol.
Παράδειγμα 3-2. Υπολογίστε την αντίδραση ενθαλπίας
6C (g) + 6Η (g) \u003d C6H 6 (g)
α) στις ενθαλπές εκπαίδευσης · β) Στις ενέργειες επικοινωνίας, υπό την υπόθεση ότι τα διπλά δεσμοί στο μόριο C6H6 είναι σταθερές.
Απόφαση. α) Ενθαλπία εκπαίδευσης (στο KJ / Mole) Βρίσκουμε στον κατάλογο (για παράδειγμα, P.W.atkins, Φυσική Χημεία, 5η έκδοση, σελ. C9-C15): F H. 0 (C6H 6 (g)) \u003d 82,93, F H. 0 (c (g)) \u003d 716,68, F H. 0 (h (d)) \u003d 217,97. Η αντίδραση ενθαλπίας είναι:
R H. 0 \u003d 82,93 - 6 716,68 - 6 217,97 \u003d -5525 kJ / mol.
β) Σε αυτή την αντίδραση, οι χημικοί δεσμοί δεν είναι σπασμένοι, αλλά σχηματίζονται μόνο. Στην προσέγγιση των σταθερών διπλών δεσμών, το μόριο C6H6 περιέχει 6 δεσμούς C-H, 3 της επικοινωνίας C - C και 3 της επικοινωνίας C \u003d C. Ενέργεια (στο KJ / Mol) (P.W.atkins, Φυσική Χημεία, 5η έκδοση, σελ. C7): ΜΙ.(C- H) \u003d 412, ΜΙ.(C-C) \u003d 348, ΜΙ.(C \u003d C) \u003d 612. Η ενθαλπία αντίδρασης είναι ίση με:
R H. 0 \u003d - (6 412 + 3 348 + 3 612) \u003d -5352 kJ / mol.
Η διαφορά με το ακριβές αποτέλεσμα είναι -5525 kJ / mol οφείλεται στο γεγονός ότι στο μόριο βενζολίου δεν υπάρχουν μόνο δεσμοί C-C και διπλούς δεσμούς C \u003d C και υπάρχουν 6 αρωματικοί δεσμοί με C C.
Απάντηση. α) -5525 kJ / mol; β) -5352 kJ / mol.
Παράδειγμα 3-3. Χρησιμοποιώντας δεδομένα αναφοράς, υπολογίστε την ενθαλπία της αντίδρασης
3CU (TV) + 8HO3 (AQ) \u003d 3CU (αριθμός 3) 2 (υδατικό) + 2no (g) + 4Η2O (g)
Απόφαση. Η συντομευμένη εξίσωση ιοντικής αντίδρασης έχει τη μορφή:
3cu (TV) + 8Η + (AQ) + 2no3 - (AQ) \u003d 3cu2 + (υδατ.) + 2ΝΟ (g) + 4Η2Ο (g).
Σύμφωνα με τον νόμο Gess, η αντίδραση ενθαλπίας είναι ίση με:
R H. 0 = 4 F H. 0 (Η2Ο (g)) + 2 F H. 0 (όχι (g)) + 3 F H. 0 (CU 2+ (AQ)) - 2 F H. 0 (αριθ. 3 - (AQ))
(Η ενίσχυση του σχηματισμού χαλκού και ιόντων Η + είναι ίση, εξ ορισμού, 0). Υποχρεωτική εκπαίδευση εκπαίδευσης (P.W.atkins, Φυσική Χημεία, 5η έκδοση, σελ. C9-C15), Βρίσκουμε:
R H. 0 \u003d 4 (-285,8) + 2 90,25 + 3 64,77 - 2 (-205.0) \u003d -358,4 kj
(ανά τριών προσευχόμενων χαλκού).
Απάντηση. -358,4 kj.
Παράδειγμα 3-4. Υπολογίστε την ενθαλπία της καύσης του μεθανίου στα 1000 Κ εάν η ενθαλπία σχηματισμού δίνεται στα 298 έως: F H. 0 (CH4) \u003d -17,9 kcal / mol F H. 0 (CO 2) \u003d -94.1 kcal / mol F H. 0 (Η2Ο (g)) \u003d -57,8 kcal / mol. Η θερμική ικανότητα των αερίων (σε Cal / (Moth k)) στην περιοχή από 298 έως 1000 K είναι ίση:
C P (CH4) \u003d 3.422 + 0.0178. Τ., C Π.(O 2) \u003d 6.095 + 0.0033. Τ.,
C P (CO 2) \u003d 6.396 + 0.0102. Τ., C Π.(Η2Ο (g)) \u003d 7.188 + 0.0024. Τ..
Απόφαση. Αντίδραση καύσης μεθανίου ενισχύσεως
CH4 (g) + 2Ο2 (g) \u003d CO2 (g) + 2Η2O (g)
σε 298 σε ίση:
94.1 + 2 (-57.8) - (-17.9) \u003d -191,8 kcal / mol.
Βρείτε τη διαφορά της θερμότητας ως συνάρτηση της θερμοκρασίας:
C Π. = C Π.(CO 2) + 2 C Π.(H2O (G)) - C Π.(CH4) - 2 C Π.(O 2) \u003d
= 5.16 - 0.0094Τ. (Cal / (Moth. K)).
Η ενθαλπία της αντίδρασης σε 1000 στον υπολογισμό σύμφωνα με την εξίσωση Kirchhoff:
= +  = -191800 + 5.16
= -191800 + 5.16
(1000-298) - 0,0094 (1000 2-298 2) / 2 \u003d -192500 Cal / mol.
Απάντηση. -192.5 KCAL / Mole.
ΚΑΘΗΚΟΝΤΑ
3-1. Πόση θερμότητα θα απαιτηθεί για τη μετάφραση των 500 g Al (t.pl. 658 o C, Η. 0 PL \u003d 92,4 CAL / g), που λαμβάνονται σε θερμοκρασία δωματίου, σε τετηγμένη κατάσταση, εάν C Π.(Al TV) \u003d 0,183 + 1,096 10 -4 Τ. CAL / (G K);
3-2. Τυπική αντίδραση ενθαλπίας CACO 3 (TV) \u003d CAO (TV) + CO 2 (g) που εμφανίζεται σε ένα ανοικτό δοχείο σε θερμοκρασία 1000 Κ, ίση με 169 kJ / mol. Τι είναι ίσο με τη θερμότητα αυτής της αντίδρασης που ρέει στην ίδια θερμοκρασία, αλλά στο κλειστό δοχείο;
3-3. Υπολογίστε την τυπική εσωτερική ενέργεια του σχηματισμού υγρού βενζολίου στα 298 Κ, εάν η τυποποιημένη ενθαλπία του σχηματισμού του είναι 49,0 kJ / mol.
3-4. Υπολογίστε την ενθαλπία σχηματισμού n 2 o 5 (d) στο Τ. \u003d 298 K με βάση τα ακόλουθα δεδομένα:
2no (g) + o 2 (g) \u003d 2no2 (g), Η. 1 0 \u003d -114.2 kj / mol,
4no 2 (g) + o 2 (g) \u003d 2n2O5 (g), Η. 2 0 \u003d -110.2 kJ / mol,
N 2 (g) + o 2 (g) \u003d 2no (g), Η. 3 0 \u003d 182.6 kJ / mol.
3-5. Η ενσωματωμένη γλυκόζη της ενίσχυσης, η απόρριψη και η σακχαρόζη στους 25 ° C είναι ίσοι με -2802,
-2810 και -5644 kJ / mol, αντίστοιχα. Υπολογίστε τη ζεστασιά της υδρόλυσης της σακχαρόζης.
3-6. Προσδιορίστε την ενθαλπία σχηματισμού του σχηματισμού B 2H 6 (g) όταν Τ. \u003d 298 από τα ακόλουθα δεδομένα:
Β 2Η 6 (g) + 302 (g) \u003d Β2O3 (τηλεόραση) + 3Η2O (g), Η. 1 0 \u003d -2035,6 kJ / mol
2b (TV) + 3/2 o 2 (g) \u003d b 2 o 3 (τηλεόραση), Η. 2 0 \u003d -1273,5 kJ / mol,
Η2 (g) + 1/2O2 (g) \u003d Η2Ο (g), Η. 3 0 \u003d -2241.8 kJ / mol.
3-7. Υπολογίστε τη θερμότητα του σχηματισμού θειικού ψευδαργύρου από απλές ουσίες όταν Τ. \u003d 298 K με βάση τα ακόλουθα δεδομένα.