Των χαρακτηριστικών των ατόμων στοιχείων που αναφέρονται παρακάτω. Χημεία
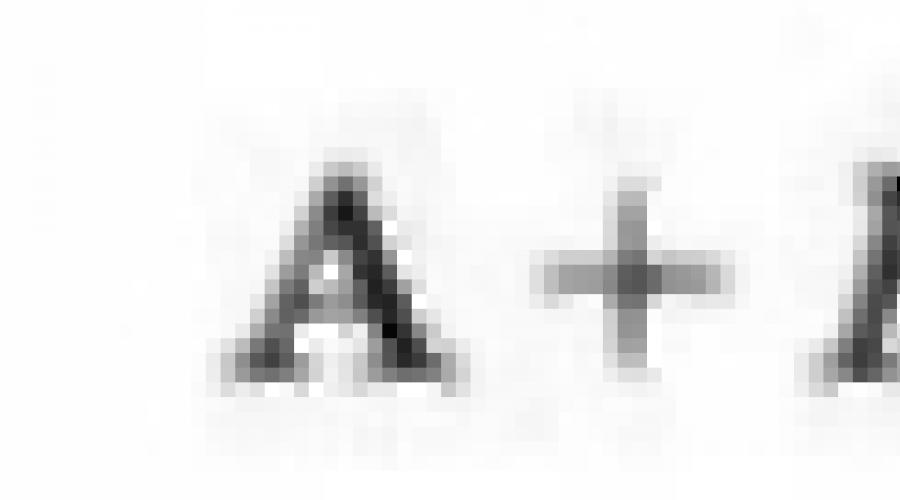
Η εξέταση αριθ. 2 περιέχει εργασίες στα ακόλουθα θέματα:
- Περιοδικό σύστημα
- Τη συχνότητα αλλαγής των ιδιοτήτων των στοιχείων και των ενώσεών τους.
- Χημικός δεσμός. Μέθοδος Sun.
- Χημικός δεσμός. Mo μεθόδου.
- Χημικός δεσμός. Σύνδεση ιόντων.
- Χημικός δεσμός σε σύνθετες ενώσεις.
Δοκιμή για γνώση Έλεγχος:
1. από τα χαρακτηριστικά των ατόμων στοιχείων που αναφέρονται παρακάτω περιοδικά
(1) χρέωση Atom Nuclei.
(2) σχετική ατομική μάζα.
(3) τον αριθμό των ενεργειακών επιπέδων στο άτομο ·
(4) Ο αριθμός των ηλεκτρονίων στο επίπεδο εξωτερικής ενέργειας.
2. Μέσα στην περίοδο, η αύξηση του αριθμού αλληλουχίας του στοιχείου συνήθως συνοδεύεται από
(1) με μείωση της ατομικής ακτίνας και αύξηση της ηλεκτροεγκεκριμένης του ατόμου.
(2) αύξηση της ατομικής ακτίνας και μείωση της ηλεκτρομετριμότητας του ατόμου.
(3) με μείωση της ατομικής ακτίνας και μείωση της ηλεκτρομερεσιμότητας του ατόμου.
(4) Αύξηση της ατομικής ακτίνας και αύξηση της ηλεκτρομερεσιμότητας του ατόμου.
3. Το άτομο του στοιχείου είναι ο ευκολότερος τρόπος να δώσετε ένα ηλεκτρόνιο (οι αριθμοί σημαίνουν τον αριθμό ακολουθίας του στοιχείου):
(1) νάτριο, 11, (2) μαγνήσιο, 12; (3) αλουμίνιο, 13, (4) Silicon, 14;
4. Τα άτομα των στοιχείων 1α του περιοδικού συστήματος στοιχείων έχουν τον ίδιο αριθμό
(1) ηλεκτρόνια στο εξωτερικό ηλεκτρονικό επίπεδο.
(2) νετρόνια.
(3) Όλα τα ηλεκτρόνια.
5. Τα στοιχεία εντοπίζονται με τη σειρά της αυξανόμενης ηλεκτρομετριμότητας στη σειρά
(1) όπως, se, cl, f; (2) C, I, B, SI; (3) br, p, h, sb; (4) o, se, br, te.
6. Κατά τη δεύτερη και τρίτη περίοδο του περιοδικού συστήματος, καθώς το μέγεθος των ατόμων στοιχείων μειώνεται
(1) Το μέγεθος των ιόντων τους μειώνεται επίσης.
(2) Η ηλεκτρική ενέργεια μειώνεται.
(3) οι μεταλλικές ιδιότητες των στοιχείων αποδυναμώνουν.
(4) Οι μεταλλικές ιδιότητες των στοιχείων ενισχύονται.
7. Ποιος αριθμός περιλαμβάνει μόνο μεταβατικά στοιχεία:
(1) Στοιχεία 11, 14, 22, 42. (2) Στοιχεία 13, 33, 54, 83.
(3) Στοιχεία 24, 39, 74, 80. (4) Στοιχεία 19, 32, 51, 101;
8. Ποιο από τα παρακάτω στοιχεία έχει χημικές ιδιότητες, επιτρέποντας να μιλήσει για την ομοιότητά του με το στοιχείο ασβεστίου:
(1) άνθρακας. ΑΠΟ; (2) νάτριο, na; (3) Καλάμι. ΠΡΟΣ ΤΗΝ; (4) Strontium, SR;
9. Οι μη μεταλλικές ιδιότητες των στοιχείων που βρίσκονται στις κύριες υποομάδες του περιοδικού συστήματος Δ. Ι. Mendeleev είναι πιο έντονοι σε εκείνους εκείνων που βρίσκονται
(1) στην κορυφή της υποομάδας.
(2) στο κάτω μέρος της υποομάδας.
(3) στη μέση της υποομάδας.
(4) Σε όλα τα στοιχεία, η υποομάδα εκφράζεται περίπου στον ίδιο βαθμό.
10. Ποιος αριθμός στοιχείων αντιπροσωπεύεται σε αύξουσα σειρά ατομικής ακτίνας:
(1) O, S, SE, εκείνους. (2) C, N, O, F; (3) Na, mg, al, si; (4) i, br, cl, f;
11. Μεταλλική φύση των ιδιοτήτων των στοιχείων σε μια σειρά mg-ca-sr-ba
(1) μειώνεται.
(2) αυξήσεις.
(3) δεν αλλάζει.
12. Μη μεταλλική φύση των ιδιοτήτων των στοιχείων σε έναν αριθμό n-p-as-sb-bi
(1) μειώνεται.
(2) αυξήσεις.
(3) δεν αλλάζει.
(4) μειώνεται και στη συνέχεια αυξάνεται.
13. Ποιο ατμό στο καθορισμένο σύνολο στοιχείων - Ca, P, Si, AG, Ni, όπως - έχει τις πιο παρόμοιες χημικές ιδιότητες:
(1) Α.Ε., Si; (2) ag, ni; (3) p, όπως και? (4) ni, r;
14. Σύμφωνα με τις χημικές του ιδιότητες, το ραδιενεργό στοιχείο του ραδίου είναι πλησιέστερο
(1) καίσιο. (2) βάριο. (3) Λανθάνος; (4) Ακτινία.
15. Με βάση τη θέση του στοιχείου Lanthan στο περιοδικό σύστημα, είναι ασφαλές να ισχυριστεί ότι για τους Λανθάνους, ο πιο χαρακτηριστικός βαθμός οξείδωσης θα είναι
(1) +1; (2) +2; (3) +3; (4) +4.
16. Οι κύριες ιδιότητες των υδροξειδίων των στοιχείων της ομάδας 1α καθώς αυξάνεται ο αριθμός αλληλουχίας
(1) Μείωση.
(2) αύξηση ·
(3) παραμένουν αμετάβλητες.
(4) Μείωση και στη συνέχεια αυξάνεται.
17. Με βάση τη θέση των στοιχείων του περιοδικού συστήματος, η πλέον πιθανή άρθρωση της Γερμανίας με σεληνίου μπορεί να απεικονιστεί από τον τύπο.
18. Το υποθετικό στοιχείο Ζ σχηματίζει ZCL5 χλωριούχο. Ποια είναι η πιο πιθανή φόρμουλα για το οξείδιο του:
(1) ZO 2; (2) ZO 5; (3) Z 2 o 5; (4) Z 5 o 2;
19. Οι απλές ουσίες των στοιχείων έχουν τη μεγαλύτερη ομοιότητα των φυσικών και χημικών ιδιοτήτων:
(1) li, s; (2) να είναι, cl; (3) F, Cl; (4) Li, F;
20. από τα στοιχεία της τρίτης περιόδου κατωτέρω, οι πιο έντονες μη μεταλλικές ιδιότητες έχουν
(1) αλουμίνιο. (2) πυρίτιο. (3) θείο; (4) χλώριο.
21. από τα παραπάνω στοιχεία ΙΙΙΑ, ο όμιλος προφέρεται μη μεταλλικές ιδιότητες
(1) Bor; (2) αλουμίνιο. (3) γαλλίου; (4) Ινδία.
22. Ποιο από τα παραπάνω στοιχεία της τέταρτης περιόδου του περιοδικού συστήματος εκδηλώνει τις ίδιες τιμές σθένους στην ένωση υδρογόνου τους και στο υψηλότερο οξείδιο:
(1) βρώμιο; (2) Γερμανία. (3) αρσενικό. (4) σεληνίου;
23. Η φύση των οξειδίων στη σειρά P 2 o 5 -Sio 2 -L 2 o z -mgo αλλάζει ως εξής:
(1) από το κύριο προς όξινο.
(2) από το οξύ έως το κύριο.
(3) από την κύρια enphotoner.
(4) από αμφοτερική έως όξινο.
24. Γράψτε τους τύπους υψηλότερων οξειδίων στοιχείων και αντίστοιχων οξέων. Ονομάστε αυτά τα οξέα:
25. Με βάση τη θέση του στοιχείου του περιοδικού συστήματος, γράψτε τις ενώσεις του που παρατίθενται παρακάτω:
26. Από τον παραπάνω κατάλογο στοιχείων: BE, B, C, N, AL, SI, P, S, GA, GE, όπως, BR - EO 2 οξείδια τύπου, και τα υδρίδια του τύπου A 4 -.
27. Με βάση τη θέση του στοιχείου του περιοδικού συστήματος, την παραγωγή των τύπων για το υψηλότερο οξείδιο και το υδροξείδιο του και να υποδείξει τη φύση τους:
28. Το στοιχείο με τον αριθμό αλληλουχίας 34 σχηματίζει μια ένωση υδρογόνου, υψηλότερο οξείδιο και υδροξείδιο. Το τελευταίο εκδηλώνεται
(1) Οξικές ιδιότητες.
(2) Βασικές ιδιότητες.
(3) Αμφοτερικές ιδιότητες.
29. Ο μέγιστος αριθμός χημικών στοιχείων που μπορούν να συμπληρώσουν την έκτη περίοδο του περιοδικού συστήματος πρέπει να είναι ίση με
(1) 8; (2) 18; (3) 32; (4) 50.
30. Πρέπει να είναι ο μέγιστος αριθμός στοιχείων στο έβδομομερο
(1) 18; (2) 32; (3) 50; (4) 72.
31. Την έβδομη περίοδο, το τελευταίο πρέπει να είναι στοιχείο από τον αριθμό ακολουθίας
(1) 118; (2) 114; (3) 112; (4) 110.
32. Οι ιδιότητες των αλκαλικών μετάλλων πρέπει να αναμένονται από στοιχεία με αριθμούς ακολουθίας
(1) 111 και 190 · (2) 119 και 169 · (3) 137 και 187 · (4) 155 και 211.
33. Η διαμόρφωση των τροχιά του βισμούθου των ηλεκτροβόλων σθένος συμπίπτει με
(1) Σελήνιο και Τελούριο.
(2) άζωτο και φώσφορο.
(3) πυρίτιο και γερμάνιο ·
(4) Niobium και Tanthal.
34. Το στοιχείο με τον αριθμό σειράς 117 πρέπει να αποδοθεί σε
(1) αλκαλικά μέταλλα. (3) αλογόνα.
(2) μέταλλα αλκαλικής γης. (4) Μεταβατικά στοιχεία.
35. Η μέγιστη σθένος μολύβδου σε ενώσεις οξυγόνου είναι:
(1) ΙΙ; (2) IV; (3) vi; (4) VIII.
36. Ο τύπος των τροχιών των ηλεκτροβόλων σθένος στην Ινδία συμπίπτει
(1) am και fr; (2) pb και sn; (3) al και ga; (4) CU και AG.
37. Ο Τιτάνας αναφέρεται
(1) ΜΙΚΡΟ.-; (2) Π.-; (3) ΡΕ.-; (4) ΦΑ.- Στοιχεία.
38. Μέγιστη σθένος βρωμίου σε ενώσεις οξυγόνου
(1) i; (2) III; (3) v; (4) VII.
39. Η έβδομη περίοδος του συστήματος στοιχείων πρέπει να τερματίσει το στοιχείο με τον αριθμό ακολουθίας
(1) 108; (2) 110; (3) 118; (4) 128.
40. Η γωνία μεταξύ των συνδέσμων του Η-Ε είναι η μεγαλύτερη στο μόριο της σύνδεσης
(1) H 2, (2) H 2 SE; (3) h 2 s; (4) H 2 O.
41. Σε μια σειρά K-Ca-SC-TI, η ακτίνα των ατόμων (μειώνεται, αυξάνεται).
42. Ενέργεια που καθορίζεται στον SL ° (G.) → CL + Εξίσωση (G.) + E - 1254 KJ, είναι για το άτομο χλωρίου
(1) ενέργεια χημικών ομολόγων ·
(2) Ενέργεια ιονισμού.
(3) Ηλεκτρογένεια.
(4) συγγένεια με το ηλεκτρόνιο.
43. Η συγγένεια για το ηλεκτρόνιο καλείται
(1) η ενέργεια που απαιτείται για τον διαχωρισμό ενός ηλεκτρονίου από ένα ανεξάρτητο άτομο.
(2) Η ικανότητα του ατόμου αυτού του στοιχείου να καθυστερήσει την πυκνότητα ηλεκτρονίων.
(3) μετάβαση ηλεκτρονίων σε υψηλότερο επίπεδο ενέργειας ·
(4) Η απομόνωση ενέργειας όταν ένα ηλεκτρόνιο συνδέεται με ένα άτομο ή ένα ιόν.
44. Ποιο από τα στοιχεία είναι η μεγαλύτερη αξία της ενέργειας ιονισμού:
(1) Li; (2) f; (3) fe; (4) I;
45. Ενέργεια που δαπανάται για την αφαίρεση ενός ηλεκτρονίου από ένα άτομο στοιχείων σε μια αέρια κατάσταση, στο μαγνήσιο
(1) λιγότερο από το νάτριο και περισσότερο από το αλουμίνιο.
(2) περισσότερο από το νάτριο και λιγότερο από αυτό του αλουμινίου.
(3) λιγότερο από το νάτριο και το αλουμίνιο.
(4) περισσότερο από το νάτριο και το αλουμίνιο.
46. \u200b\u200bΜε βάση την ανάλυση των ηλεκτρονικών δομών ατόμων και θέσεων στοιχείων στο περιοδικό σύστημα, διευκρινίστε ποια από τα δύο δύο άτομα που ακολουθούν έχουν μεγαλύτερη συγγένεια με το ηλεκτρόνιο:
(1) κάλιο ή ασβέστιο.
(2) θείο ή χλώριο.
(3) υδρογόνο ή λίθιο;
47. Τα χημικά στοιχεία βρίσκονται κατά σειρά αυξανόμενης ηλεκτρομετρίας στη σειρά
(1) Si, P, SE, RR, SL, O; (2) Si, P, R, SE, C1, O;
(3) P, Si, FRA, SE, C1, O; (4) SE, SI, P, R, C1, O.
48. Τι είναι ένα σύνολο στοιχείων καθώς αυξάνουν τις ατομικές τους ακτίνες:
(1) Na, mg, al, si; (3) O, S, SE, αυτά.
(2) C, O, N, F; (4) i, br, c1, f;
49. Σε ένα αριθμό αλκαλιμετάλλων (από Li έως CS), το καίσιο είναι το λιγότερο ηλεκτροενεργό. Αυτό εξηγείται από αυτό που έχει
(1) ο μεγαλύτερος αριθμός νετρονίων στον πυρήνα.
(2) μεγαλύτερο αριθμό ηλεκτρονίων σθένους σε σύγκριση με άλλα στοιχεία ·
(3) μια μεγάλη ατομική μάζα.
(4) Τα καθαρά ηλεκτρόνια, στον μεγαλύτερο βαθμό που απομακρύνθηκε από τον πυρήνα του ατόμου.
50. Η ισοηλεκτρονική ονομάζεται ιόντα που έχουν τον ίδιο αριθμό ηλεκτρονίων και την ίδια δομή του εξωτερικού επιπέδου ηλεκτρονίων. Τα ιόντα περίπου 2-, F -, Na +, mg2 +, Α1 3+ έχουν ηλεκτρονική διαμόρφωση του αέριο NOO του NOON και είναι διατεταγμένα σε αύξουσα σειρά ατομικών μάζας των στοιχείων. Την ίδια στιγμή τα ακτίνα ιόντων τους
(1) πρακτικά δεν αλλάζουν.
(2) Μείωση.
(3) αύξηση ·
(4) Μείωση, στη συνέχεια αυξάνεται.
51. Ένα παράδειγμα ενός μη πολικού μορίου που έχει ένα πολικό ομοιοπολικό δεσμό θα είναι
(1) n 2; (2) H2O; (3) nh 3; (4) CCl 4.
52. από τα ανωτέρω μόρια: Η2, Ο2, Η2Ο, CO2, CH4, H 2S - πολική είναι.
53. Σε ποια από τις ενώσεις μεταξύ των ατόμων, σχηματίζεται ένας ομοιοπολικός δεσμός στον μηχανισμό αποδέκτη δότη:
(1) KSL; (2) NH4Cl; (3) CCl 4. (4) CO 2;
54. Οι οδικοί τροχοί του ατόμου βηρυλλίου στο μόριο υδριδίου του βηρύλλίου υβριδοποιούνται ανά τύπο
(1) sp.; (2) sP 2.; (3) sP 3.;(4) d 2 sp 3,
Και το μόριο έχει μια δομή:
55. Οι οδικοί τροχοί του ατόμου βορίου στο μόριο TF 3 υβριδοποιούνται ανά τύπο
(1) sp.; (2) sP 2.; (3) sP 3.;(4) d 2 sp 3,
Και το μόριο έχει μια δομή:
α) γραμμική · γ) τετραεδρικά ·
(β) επίπεδη; (δ) οκταεδρικά.
56. Η παρουσία τεσσάρων ισοδύναμων δεσμών του C - H στο μόριο μεθανίου εξηγείται από το γεγονός ότι
(1) Εμφανίζεται η αμοιβαία απώλεια τεσσάρων ηλεκτρονικών ζεύγων.
(2) άτομο άνθρακα υβριδοποιήθηκε για να σχηματίσει τέσσερα sP 3.τροχιά.
(3) Το άτομο άνθρακα έχει ένα ΜΙΚΡΟ.- και τρία r- Electron Valence;
(4) Το άτομο άνθρακα έχει δύο S- και δύο r- Electron Valence.
Απαντήσεις:
1. (4) Ο αριθμός των ηλεκτρονίων στο επίπεδο εξωτερικής ενέργειας.
2. (1) Με μείωση της ατομικής ακτίνας και αύξηση της ηλεκτροεγχειρητικότητας του ατόμου.
3. (1) νάτριο, 11.
4. (1) Ηλεκτρόνια στο εξωτερικό ηλεκτρονικό επίπεδο.
5. (1) όπως, SE, CL, F.
6. (3) Οι μεταλλικές ιδιότητες των στοιχείων αποδυναμώνουν.
7. (3) Στοιχεία 24, 39, 74, 80.
8. (4) Strontsia, SR.
9. (1) Στην κορυφή της υποομάδας.
10. (1) O, S, SE, αυτά.
11. (2) αυξάνεται.
12. (1) μειώνεται.
14. (2) βάριο.
16. (2) Αύξηση.
18. (3) Z 2 o 5.
20. (4) χλώριο.
22. (2) Γερμανία.
23. (2) από το οξύ στο κύριο.
26. Τα οξείδια τύπου EO 2 σχηματίζουν C, Si, GE και τα υδρίδια του τύπου A 4 - C, SI, GE.
28. H 2S, SEO 3 και H2 SEO 4. (1) Οξικές ιδιότητες.
32. (2) 119 και 169.
33. (2) Αζωτούχο και φωσφόρο.
34. (3) αλογόνα.
36. (3) al και ga.
37. (3) ΡΕ.- Στοιχεία.
41. μειώνεται.
42. (2) Ενέργεια ιονισμού.
43. (4) Η απομόνωση ενέργειας όταν ένα ηλεκτρόνιο συνδέεται με ένα άτομο ή ένα ιόν.
45. (4) περισσότερο από το νάτριο και το αλουμίνιο.
46. \u200b\u200b(1) Καλάμι. (2) χλώριο. (3) υδρογόνο.
47. (1) Si, P, SE, WR, SL, O.
48. (3) O, S, SE, αυτά.
49. (4) Ηλεκτρονικά μέσα σθένους, στον μεγαλύτερο βαθμό που αφαιρείται από τον πυρήνα του ατόμου.
50. (2) Μείωση.
52. Η2Ο, Η2Α.
53. (2) NH4Cl.
54. (1) sp., α) γραμμική.
55. (2) sP 2., (β) επίπεδη.
56. (2) Το άτομο άνθρακα υβριδοποιείται με το σχηματισμό τεσσάρων sP 3.τροχιά.
Εργασίες για μεμονωμένες εκτιμώμενες εργασίες γραφικών:
Για ένα στοιχείο με έναν αριθμό ακολουθίας ίση με τον αριθμό των επιλογών για την εκτέλεση των ακόλουθων υπολογισμών:
1. Γράψτε μια ηλεκτρονική φόρμουλα του στοιχείου και εμφανίστε γραφικά γεμίζετε με ηλεκτρόνια όλων των ατομικών τροχών.
3. Προσδιορίστε τη μάζα ενός ατόμου στοιχείου και του όγκου του.
4. Προσδιορίστε τη μάζα ενός μορίου μιας απλής ουσίας του στοιχείου.
5. Με βάση τη θέση του στοιχείου στο PS, απαριθμεί τους πιθανούς βαθμούς οξείδωσης του ατόμου του στοιχείου σε συνδέσεις με άλλα στοιχεία.
6. Γράψτε έναν τύπο οξειδίου, χλωριούχο, υδρίδιο, σουλφίδιο.
8. Υπολογίστε το μήκος του διπόλου της σύνδεσης υδρογόνου και οξυγόνου του στοιχείου.
9. Ασφάλεια σε επαφή στο μόριο μιας απλής ουσίας του στοιχείου χρησιμοποιώντας τη μέθοδο του ήλιου.
10. Κασσίτερος στο μόριο του στοιχείου απλής ουσίας χρησιμοποιώντας το ενεργειακό διάγραμμα της μεθόδου MO, καθορίζει την πολλαπλότητα της επικοινωνίας και να γράψει έναν τύπο.
11. Καθορίστε τον τύπο υβριδισμού ενός ατόμου ενός στοιχείου σε μόρια όλων των πιθανών οξειδίων (στην περίπτωση των μορίων οξυγόνου των συνδέσεων υδρογόνου).
12. Καθορίστε όλους τους τύπους δεσμών (Σ, Π, Δ) σε μόρια οξειδίου (στην περίπτωση των ενώσεων οξυγόνου - υδρογόνου).
13. Καθορίστε τις τιμές των γωνιών σθένος στα μόρια οξειδίου (στην περίπτωση μορίων οξυγόνου - υδρογόνου μορίων).
14. Καθορίστε τη μορφή μορίων οξειδίου (στην περίπτωση μορίων οξυγόνου - υδρογόνου).
15. Υπολογίστε την ενέργεια της ιοντικής ένωσης της AV και την ενέργεια της αλληλεπίδρασης των ιόντων Α + και Β.
Για τις επιλογές 1, 5, 6, 7, 8, 9, 14, 15, 16, 17: α - κάλιο, Β είναι ένα στοιχείο με έναν αριθμό αλληλουχίας ίσο με τον αριθμό στοιχείου.
Για τις επιλογές 3, 4, 11, 12, 13, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28: β - χλώριο, ένα στοιχείο με έναν αριθμό αλληλουχίας ίσο με τον αριθμό στοιχείου.
Για τις επιλογές 2, 10, 18: Α - ένα στοιχείο με έναν αριθμό αλληλουχίας ίση με (έκδοση +1), το Β είναι ένα στοιχείο με ένα στοιχείο αλληλουχίας ίση με (επιλογή -1).
Βιβλιογραφία.
1. Kulman A.G. Συλλογή εργασιών για τη γενική χημεία, Ed. 2η, αναψυχή., Και προσθέστε. - m.: Υψηλότερη. shk. 1975.
2. Maslov E.I. , Holboray z.e. Συλλογή εργασιών και ασκήσεων στη χημεία, 5η έκδοση, Pererab. και προσθέστε.: υψηλότερη. shk. 1997.
Ο ατομικός αριθμός του στοιχείου δείχνει:
α) τον αριθμό των στοιχειωδών σωματιδίων στο άτομο · β) τον αριθμό των νουκλείων στο άτομο ·
γ) τον αριθμό των νετρονίων στο άτομο · δ) τον αριθμό των πρωτονίων στο άτομο.
Το πιο σωστό είναι η δήλωση ότι τα χημικά στοιχεία στο PSE είναι διατεταγμένα σε αύξουσα σειρά:
α) την απόλυτη μάζα των ατόμων τους · β) σχετική ατομική μάζα ·
γ) τον αριθμό των νουκλείων σε ατομικούς πυρήνες · δ) την επιβάρυνση του ατομικού πυρήνα.
Η συχνότητα αλλαγής των ιδιοτήτων των χημικών στοιχείων είναι το αποτέλεσμα:
α) να αυξήσει τον αριθμό των ηλεκτρονίων σε άτομα.
β) αύξηση των τελών των ατομικών πυρήνων ·
γ) Αύξηση της ατομικής μάζας.
δ) Περιοδικότητα στην αλλαγή στις ηλεκτρονικές δομές των ατόμων.
Από τα χαρακτηριστικά που αναφέρονται παρακάτω, τα άτομα στοιχείων αλλάζουν περιοδικά καθώς αναπτύσσεται ο αριθμός αλληλουχίας του στοιχείου:
α) τον αριθμό των ενεργειακών επιπέδων στο άτομο ·
β) σχετική ατομική μάζα ·
γ) τον αριθμό των ηλεκτρονίων στο επίπεδο εξωτερικής ενέργειας ·
δ) την επιβάρυνση του πυρήνα του Atom.
Επιλέξτε ζεύγη στα οποία κάθε χαρακτηριστικό του ατόμου ποικίλλει περιοδικά με αύξηση του αριθμού πρωτονίων του στοιχείου:
α) την ενέργεια του ιονισμού και της ενέργειας μιας συγγένειας ηλεκτρονίων ·
β) Ακτίνα και μάζα.
γ) Ηλεκτρονομετρία και συνολικά ηλεκτρόνια.
δ) μεταλλικές ιδιότητες και ο αριθμός των ηλεκτρονίων σθένους.
Επιλέξτε την κατάλληλη έγκριση για στοιχείαV.Μία ομάδα:
α) Όλα τα άτομα έχουν τον ίδιο αριθμό ηλεκτρονίων.
β) Όλα τα άτομα έχουν την ίδια ακτίνα.
γ) Όλα τα άτομα έχουν τον ίδιο αριθμό ηλεκτρονίων στο εξωτερικό στρώμα.
δ) Όλα τα άτομα έχουν μέγιστο σθένος ίσο με τον αριθμό ομάδας.
Ορισμένο στοιχείο έχει τα ακόλουθα ηλεκτρόνια διαμόρφωση:ns. 2 (Ν.-1) ΡΕ. 10 np. 4 . Σε ποια ομάδα του περιοδικού συστήματος είναι αυτό το στοιχείο;
α) ομάδα IVT · β) ομάδα Viv; γ) Ομάδα IVA; δ) Μέσω ομάδας.
Σε περιόδους PSE με αυξανόμενες χρεώσεις ατομικών πυρήνωνδεν Αλλαγές: α) τη μάζα των ατόμων · β) τον αριθμό των ηλεκτρονικών στρωμάτων · γ) τον αριθμό των ηλεκτρονίων στο εξωτερικό ηλεκτρονικό στρώμα. δ) Ακτίνα των ατόμων. |
|
Σε ποια σειρά χημικά στοιχεία βρίσκονται κατά σειρά της αύξησης της ατομικής ακτίνας τους; α) Li, Be, B, C; β) να είναι, mg, ca, sr; γ) n, o, f, ne; δ) Να, mg, al, si. |
|
Η χαμηλότερη ενέργεια ιονισμού μεταξύ των σταθερών ατόμων έχει: α) Λιθίου. β) Barry; γ) καίσιο. δ) νατρίου. |
|
Η ηλεκτρική ενέργεια των στοιχείων αυξάνεται στη σειρά: α) p, si, s, o; β) Cl, F, S, O; γ) te, se, s, o; δ) o, s, se, te. |
|
Σε μια σειρά στοιχείωνNa. Mg. Al ΣΙ Π. ΜΙΚΡΟ. Cl. απο αριστερά προς δεξιά: α) αυξάνει την ηλεκτρουργική παραλλαγή · β) Η ενέργεια της ιονισμού μειώνεται. γ) ο αριθμός των ηλεκτροβόλων σθένους αυξάνεται · δ) Μείωση μεταλλικών ιδιοτήτων. |
|
Καθορίστε το πιο ενεργό μέταλλο της τέταρτης περιόδου: α) ασβέστιο; β) κάλιο. γ) Chrome; δ) ψευδάργυρος. |
|
Καθορίστε το πιο ενεργό μέταλλο Ομάδα IIa: α) βηρύλλιο. β) Barry; γ) Μαγνήσιο. δ) ασβέστιο. |
|
Καθορίστε το πιο ενεργό μη μέταλλο Ομάδα VIIa: α) ιώδιο · β) βρώμιο · γ) φθόριο · δ) χλώριο. |
|
Επιλέξτε τις σωστές δηλώσεις: α) στο IA-VIII, μόνο στοιχεία S- και β) στις ομάδες IV-VIIIV υπάρχουν μόνο στοιχεία D. γ) Όλα τα D-στοιχεία είναι μέταλλα. δ) Ο συνολικός αριθμός των στοιχείων του PSE είναι 13. |
|
Με αύξηση του ατομικού αριθμού του στοιχείου στην αύξηση του ομίλου VA: α) μεταλλικές ιδιότητες · β) τον αριθμό των ενεργειακών επιπέδων · γ) τον συνολικό αριθμό ηλεκτρονίων · δ) τον αριθμό των ηλεκτρονίων σθένους. |
|
Τα P-Elements αναφέρονται: α) κάλιο. β) νάτριο; γ) Μαγνήσιο. δ) αρσενικό. |
|
Ποια οικογένεια στοιχείων είναι αλουμίνιο; α) Στοιχεία S. β) Στοιχεία Ρ. γ) τα στοιχεία D · δ) Στοιχεία F. |
|
Καθορίστε μια σειρά στην οποία υπάρχουν μόνοΡΕ.- Στοιχεία: α) al, se, la; β) Ti, GE, SN; γ) ti, v, cr; δ) LA, CE, HF. |
Ποια σειρά δείχνει τους χαρακτήρες των στοιχείων S, P και D-οικογένειες; α) h, αυτός, li; β) Η, ΒΑ, ΑΛ; γ) BE, C, F; δ) mg, p, cu. |
|
Το άτομο του οποίου το στοιχείο της περιόδου IV περιέχει τον μεγαλύτερο αριθμό ηλεκτρονίων; α) ψευδαργύρου · β) Chrome; γ) βρώμιο · δ) Κρυπτον. |
|
Στο άτομο του στοιχείου, τα ηλεκτρόνια του εξωτερικού επιπέδου ενέργειας συνδέονται πιο σταθερά με τον πυρήνα; α) κάλιο. β) άνθρακα · γ) φθόριο · δ) Γαλλία. |
|
Η δύναμη της έλξης των ηλεκτρονίων σθένους στον πυρήνα του ατόμου μειώνεται σε ορισμένα στοιχεία: α) Na, mg, al, si; β) RB, K, Na, Li; γ) SR, CA, MG, BE. δ) Li, Na, K, RB. |
|
Το στοιχείο με τον αριθμό αλληλουχίας 31 είναι: α) στην ομάδα III · β) μικρή περίοδο · γ) τη μεγάλη περίοδο · δ) στην ομάδα Α. |
|
Από τους ακόλουθους ηλεκτρονικούς τύπους, επιλέξτε εκείνους που ταιριάζουν με τα στοιχεία pV. Περίοδος: α) 1s 2 2 2 2 2p 6 3s 2 3p 6 3d 1 4s 2 4p 6 4d 1 5s 2 5p 1; β) 1S 2 2S 2 2P 6 3S 2 3P 6 3D 1 4s 2 4p 6 5s 2; γ) 1S 2 2S 2 2p 6 3S 2 3P 6 3D 1 4s 2 4p 2; δ) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 4p 6 4d 1 5s 2 5p 6. |
|
Από τους παραπάνω ηλεκτρονικούς τύπους, επιλέξτε εκείνα που αντιστοιχούν στα χημικά στοιχεία που σχηματίζουν το υψηλότερο οξείδιο της σύνθεσης 2 ΣΧΕΤΙΚΑ ΜΕ 3 : α) 1s 2 2s 2 2p 6 3s 2 3p 1; β) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 4p 3; γ) 1S 2 2S 2 2P 6 3S 2 3P 6 3D 1 4S 2; δ) 1S 2 2S 2 2p 6 3S 2 3P 6 3D 3 4S 2. |
|
Προσδιορίστε το στοιχείο του οποίου το άτομο περιέχει στο 4Ρ-πυλώνα 4 του ηλεκτρονίου. Ποια περίοδο και ομάδα είναι; α) Αρσενικό, IV περίοδο, Ομάδα VA. β) Tellur, V περίοδο, μέσω ομάδας. γ) Περίοδος σεληνίου, IV, μέσω ομάδας, δ) Tungsten, περίοδος VI, ομάδα VIB. |
Τα άτομα ασβεστίου και σκανδίου διαφέρουν ο ένας στον άλλο: α) τον αριθμό των ενεργειακών επιπέδων · β) Ακτίνα. γ) τον αριθμό των ηλεκτρονίων σθένους · δ) ο τύπος υψηλότερου οξειδίου. |
|
Για τα άτομα θείου και χρωμίου με τον ίδιο τρόπο: α) τον αριθμό των ηλεκτρονίων σθένους · β) τον αριθμό των ενεργειακών επιπέδων · γ) την υψηλότερη σθένος · δ) ο τύπος υψηλότερου οξειδίου. |
|
Τα άτομα αζώτου και φωσφόρου έχουν: α) τον ίδιο αριθμό ηλεκτρονικών στρωμάτων · β) τον ίδιο αριθμό πρωτονίων στον πυρήνα. γ) τον ίδιο αριθμό ηλεκτρονίων σθένους · δ) πανομοιότυπες ακτίνες. |
|
Ο τύπος υψηλότερου οξειδίου της περιόδου στοιχείου III, στο άτομο του οποίου είναι βασικά η κατάσταση περιέχει τρία μη αφυδατωμένα ηλεκτρόνια: α) E 2 o 3 · β) EO 2; γ) E 2 o 5; δ) E 2 o 7. |
|
Ο τύπος του υψηλότερου οξειδίου του στοιχείου EO3. Αναφέρετε τον τύπο της ένωσης του υδρογόνου: α) en 2 · β) en; γ) EL 3 · δ) en 4. |
|
Η φύση των οξειδίων από το κύριο σε οξύ ποικίλλει στις τάξεις: α) NA 2 O, MGO, SiO 2; β) Cl2O, SO 2, P2O5, No2, γ) Beo, MgO, B 2 o 3, al 2 o 3, δ) CO 2, Β2Ο 3, ΑΙ2Ο 3, LI 2 O. ε) Σάο, Fe 2O3, Al2O3, SO 2. |
|
Επιλέξτε γραμμές στις οποίες οι τύποι είναι διατεταγμένοι σε αύξουσα σειρά οξέων ιδιοτήτων των ενώσεων: α) Ν2Ο 5, Ρ2Ο 5, όπως 2 o 5, γ) Η2 SEO 3, Η2, S23, H2S04, β) HF, HBR, HI; δ) al 2 o 3, p 2 o 5, Cl2O 7. |
|
Καθορίστε μια σειρά στην οποία τα υδροξείδια είναι διατεταγμένα κατά την αύξηση των κύριων ιδιοτήτων τους: α) LiOH, KOH, NAOH; γ) Λίοι, CA (ΟΗ) 2, αϊ (ΟΗ) 3; β) Λίοι, ΝαΟΗ, MG (ΟΗ) 2, δ) Λίοι, ΝαΟΗ, ΚΟΗ. |
Καθήκοντα
Το δείγμα φωσφόρου περιέχει δύο νουκληλίδες: φωσφόρο-31 και φωσφόρο-33. Το γραμμομοριακό κλάσμα του φωσφόρου-33 είναι 10%. Υπολογίστε τη σχετική ατομική μάζα του φωσφόρου σε αυτό το δείγμα.
Ο φυσικός χαλκός αποτελείται από νουκλίδια Cu 63 και Cu 65. Η αναλογία του αριθμού των ατόμων Cu 63 στον αριθμό των ατόμων Cu 65 στο μείγμα είναι 2,45: 1,05. Υπολογίστε τη σχετική ατομική μάζα του χαλκού.
Η μέση σχετική ατομική μάζα φυσικού χλωρίου είναι 35,45. Υπολογίστε τα γραμμομοριακά κλάσματα των δύο ισοτόπων της, εάν είναι γνωστό ότι οι μάζοι τους αριθμοί είναι ίσοι με 35 και 37.
Το δείγμα οξυγόνου περιέχει δύο νουκληλίδια: 16Ο και 18Ο, οι μάζες των οποίων είναι αντίστοιχα 4,0 g και 9,0 g. Προσδιορίστε τη σχετική ατομική μάζα οξυγόνου σε αυτό το δείγμα.
Το χημικό στοιχείο αποτελείται από δύο νουκλίδια. Ο πυρήνας του πρώτου νουκλιδίου περιέχει 10 πρωτόνια και 10 νετρόνια. Στον πυρήνα του δεύτερου νουκληλίου των νετρονίων κατά 2 ακόμη. Σε 9 άτομα ελαφρύτερου νουκληλίου αντιπροσωπεύουν ένα άτομο ενός βαρύτερου νουκληλίου. Υπολογίστε το μέσο ατομικό βάρος του στοιχείου.
Ποια σχετική ατομική μάζα θα είχε οξυγόνο εάν στο φυσικό μίγμα για κάθε 4 άτομο οξυγόνου-16 που αντιπροσώπευε 3 άτομα οξυγόνου-17 και 1 άτομο οξυγόνου-18;
Απαντήσεις:1. 31,2. 2. 63,6. 3. 35 CL: 77,5% και 37Cl: 22,5%. 4. 17,3. 5. 20,2. 6. 16,6.
Χημικές επικοινωνίες
Ο κύριος όγκος του εκπαιδευτικού υλικού:
Φύση και τύποι χημικών δεσμών. Οι κύριες παραμέτρους του χημικού δεσμού: ενέργεια, μήκος.
Ομοιοπολική σύνδεση. Ανταλλάσσονται και μηχανισμοί αποδέκτη δωρητών για το σχηματισμό της ομοιοπολικής επικοινωνίας. Την κατεύθυνση και τον κορεσμό του ομοιοπολικού δεσμού. Πολικότητα και πολωσιμότητα ενός ομοιοπολικού δεσμού. Αποτίμηση και βαθμός οξείδωσης. Οι οδικές δυνατότητες και οι συνθήκες σθένος των ατόμων στοιχείων των ομάδων Α. Μονής και πολλαπλών συνδέσμων. Ατομικά κρυστάλλινα πλέγματα. Η έννοια της υβριδοποίησης των ατομικών τροχιών. Τους κύριους τύπους υβριδισμού. Γωνίες δεσμών. Τη χωρική δομή των μορίων. Εμπροσωπικός, μοριακός και δομικός (γραφικός) τύπος μορίων.
Επικοινωνία ιόντων. Ιωνικά κρύσταλλα. Χημικές φόρμουλες ουσιών με μοριακή, ατομική και ιοντική δομή.
Μεταλλική επικοινωνία. Κρύσταλλα μέταλλα.
Διαμολλιακή αλληλεπίδραση. Μοριακό κρυστάλλινο πλέγμα. Ενέργεια της διαμολλιακής αλληλεπίδρασης και της συνολικής κατάστασης των ουσιών.
Δεσμός υδρογόνου.Την αξία των δεσμών υδρογόνου σε φυσικά αντικείμενα.
Ως αποτέλεσμα της μελέτης, οι μαθητές πρέπει να γνωρίζουν:
Τι είναι μια χημική σχέση.
Τους κύριους τύπους χημικών δεσμών.
Ομοιοπολικοί μηχανισμοί εκπαίδευσης επικοινωνίας (ανταλλαγή και δωρητικότητα) ·
τα κύρια χαρακτηριστικά του ομοιοπολικού δεσμού (κορεσμός, κατεύθυνση, πολικότητα, πολλαπλότητα, s- και p-επικοινωνίες).
Τις κύριες ιδιότητες των ιωνικών, των μελών και των ομολόγων υδρογόνου ·
Τους κύριους τύπους κρυσταλλών.
Πώς αλλάζει ο ενεργειακός εφοδιασμός και η φύση των μορίων στη μετάβαση από μια συνολική κατάσταση στην άλλη.
Τι διακρίνονται από ουσίες που έχουν κρυσταλλική δομή από ουσίες που έχουν άμορφη δομή.
Ως αποτέλεσμα της μελέτης του θέματος, οι μαθητές πρέπει να αποκτήσουν δεξιότητες:
ορισμοί του τύπου χημικού δεσμού μεταξύ των ατόμων σε διάφορες ενώσεις ·
τη σύγκριση της αντοχής των χημικών δεσμών από την ενέργεια τους ·
προσδιορίζοντας τους βαθμούς οξείδωσης από τους τύπους διαφόρων ουσιών ·
Ίδρυση του γεωμετρικού σχήματος ορισμένων μορίων με βάση τη θεωρία της υβριδοποίησης των ατομικών τροχών ·
Προβλέποντας και συγκρίνοντας τις ιδιότητες των ουσιών ανάλογα με τη φύση της σχέσης και τον τύπο του κρυστάλλου πλέγματος.
Έχοντας ολοκληρώσει την εκμάθηση του θέματος, οι μαθητές πρέπει να έχουν παρουσίαση:
- επί της χωρικής δομής των μορίων (κατεύθυνση ομοιοπολικών δεσμών, γωνία σθένους) ·
- Στη θεωρία της υβριδοποίησης των ατομικών τροχών (SP 3 -, SP2 -, SP-υβριδισμός)
Έχοντας μελετήσει το θέμα, οι μαθητές πρέπει να θυμούνται:
στοιχεία με σταθερό βαθμό οξείδωσης.
ενώσεις υδρογόνου και οξυγόνου στα οποία αυτά τα στοιχεία δεν είναι χαρακτηριστικά από αυτούς τον βαθμό οξείδωσης.
Το μέγεθος της γωνίας μεταξύ των συνδέσεων στο μόριο νερού.
Τμήμα 1. Φύση και τύποι χημικών
Οι τύποι ουσιών χορηγούνται: Na2O, SO 3, KCI, PCL3, HCl, Η2, Cl2, NaCI, CO2, (ΝΗ4) 2s SO4, Η2Ο2, CO, Η2Α, NH4Cl, SO2, HI, RB2SE SO 4, SR (ΟΗ) 2, Η2 SEO4, αυτός, SCCL3, Ν2, Albr 3, HBr, Η2Α, Η2Ο, 2, CH 4, NH3, KI, CABR 2, BAO, NO, FCL, SIC. Επιλέξτε συνδέσεις:
Μοριακή και μη ελαστική δομή.
μόνο με ομοιοπολικούς πολικούς δεσμούς.
μόνο με ομοιοπολικούς μη πολικούς δεσμούς.
μόνο με ιοντικές συνδέσεις.
συνδυάζοντας στη δομή των ιοντικών και ομοιοπολικών δεσμών ·
συνδυάζοντας ομοιοπολικές πολικές και ομοιοπολικές μη πολικές συνδέσεις.
ικανή να σχηματίζει δεσμούς υδρογόνου.
έχοντας σε δομή της επικοινωνίας που σχηματίζεται από μηχανισμό αποδέκτη δωρητών.
Πώς η πολικότητα των συνδέσεων στις τάξεις;
α) Η2Ο; H 2 s; Η 2 se; Η2 ΤΕ Β) ρΗ 3; H 2 s; HCl.
Σε ποια κατάσταση είναι η κύρια ή ενθουσιασμένη - υπάρχουν άτομα απομονωμένων στοιχείων στις ακόλουθες συνδέσεις:
ΣΙ.CL 3; Π.CL 3; ΣΙO 2; ΕΙΝΑΙ.F 2; Η2. ΜΙΚΡΟ.; ΝΤΟ.H 4; Η. Cl.O 4;
Αυτό που ένα ζευγάρι αυτών των στοιχείων σε χημική αλληλεπίδραση έχει μια μέγιστη τάση να σχηματίσει επικοινωνία ιόντων:
Ca, c, k, o, i, cl, f;
Σε ποιες από τις χημικές ουσίες που προτείνονται κατωτέρω, η ρήξη του δεσμού θα είναι πιο πιθανό να προχωρήσει στο σχηματισμό ιόντων και στις οποίες να σχηματίσουν ελεύθερες ρίζες: NaCl, CS 2, CH4, K2O, H2S04, KOH, Cl 2;
Dana φυλές αλογόνου: HB, HCl, HBR, HI. Επιλέξτε έναν κήπο αλογόνου:
υδατικό διάλυμα του οποίου είναι το ισχυρότερο οξύ (το ασθενέστερο οξύ).
με τον πιο πολικό δεσμό (το λιγότερο πολικό δεσμό).
με το υψηλότερο μήκος επικοινωνίας (με το χαμηλότερο μήκος επικοινωνίας).
με το μεγαλύτερο σημείο βρασμού (με το μικρότερο σημείο βρασμού).
Κατά τη διαμόρφωση ενός χημικού δεσμού, το φθόριο φθορίου κυκλοφορεί 2,64 '
10 -19 J ενέργειας. Υπολογίστε ποιο χημικό αριθμό μορίων φθορίου θα πρέπει να σχηματίζεται για να γίνει διάκριση 1,00 kJ ενέργειας.
Δοκιμή 6.
Όταν το μόριο σχηματίζεται από δύο απομονωμένα άτομα, η ενέργεια στο σύστημα: α) αυξήσεις · β) μειώνεται · γ) δεν αλλάζει. δ) Πιθανό τόσο τη μείωση όσο και την αύξηση της ενέργειας. |
|
Υποδείξτε, σε ποιο ζεύγος ουσιών, τα γενικά ηλεκτρονικά ζεύγη μετατοπίζονται προς το άτομο οξυγόνου: α) 2 και CO. β) CL 2 O και όχι. γ) Η2Ο και Ν2Ο 3. δ) Η2Ο 2 και O 2 F 2. |
|
Καθορίστε τις συνδέσεις με μια ομοιοπολική μη πολική σύνδεση: α) o 2 · β) n 2; γ) CL 2 · δ) PCL 5. |
|
Καθορίστε συνδέσεις με έναν ομοιοπολικό πολικό δεσμό: α) Η2Ο. β) BR 2; γ) CL 2 o; δ) Έτσι 2. |
|
Επιλέξτε ένα ζευγάρι μορίων, όλοι οι σύνδεσμοι στους οποίους είναι ομοιοπολικοί: α) NaCl, HCl. β) CO 2, NA 2 O; γ) CH3CI, CH3 Na; δ) Έτσι 2, αριθ. 2. |
|
Οι συνδέσεις με την ομοιοπολική πολική και ομοιοπολική μη πολική επικοινωνία είναι αντίστοιχα: α) νερό και υδρόθειο · β) κάλιο βρωμιούχο και άζωτο. γ) αμμωνία και υδρογόνο · δ) οξυγόνο και μεθανίου. |
|
Κανένας από τους ομοιοπολικούς δεσμούς δεν σχηματίζεται από μηχανισμό αποδέκτη δότη σε σωματίδιο: α) CO 2 · β) CO; γ) BF 4 -; δ) ΝΗ 4 +. |
|
Καθώς η διαφορά στην ηλεκτρική αρνητικότητα των δεσμευμένων ατόμων παρουσιάζεται: α) μείωση της πολικότητας της επικοινωνίας · β) Ενίσχυση της πολικτικής επικοινωνίας. γ) αύξηση του βαθμού ιονικής επικοινωνίας · δ) μείωση του βαθμού ιονικής επικοινωνίας. |
|
Σε ποια σειρά μορίων βρίσκονται με τη σειρά της αύξησης της πολικότητας της επικοινωνίας; α) HF, HCl, HBr; β) ΝΗ3, ρΗ 3, τέφρα 3, γ) Η2Α, Η2Α, Η2Ο; δ) CO 2, CS 2, ΧΑΚ 2. |
|
Η μεγαλύτερη δέσμευση ενέργειας στο μόριο: α) h 2 te; β) Η 2 se; γ) H 2S; δ) Η2Ο. |
|
Ο χημικός δεσμός είναι ο λιγότερο ανθεκτικός στο μόριο: α) Bromomodorod. β) Χλωριούχο. γ) IODODODOR; δ) φθόριο. |
|
Το μήκος της επικοινωνίας αυξάνεται σε μια σειρά ουσιών που έχουν τύπους: α) CCl4, CBR 4, CF 4; β) Έτσι 2, SEO 2, TEO 2, γ) Η2Α, Η2Ο, Η2Α. δ) HBR, HCl, HF. |
|
Μέγιστος αριθμόςΜΙΚΡΟ.- επικοινωνίες που μπορούν να υπάρχουν μεταξύ δύο ατόμων στο μόριο: Α'1; β) 2; σε 3; δ) 4. |
|
Η τριπλή σύνδεση μεταξύ των δύο ατόμων περιλαμβάνει: α) 2 δευτερόλεπτα και 1 π-δεσμό. β) Επικοινωνία 3 S; γ) 3 π-δεσμοί · δ) Επικοινωνία 1S και 2π-ομόλογα. |
|
Μόριο S. 2 Περιέχει χημικούς συνδέσμους: α) 1S και 1π; β) 2s και 2π; γ) 3s και 1π; δ) 4s. |
|
ΑθροισμαΜΙΚΡΟ.- ΕΓΩ.π- συνδέσεις (ΜΙΚΡΟ. + π) σε μόριοΕΤΣΙ. 2 Cl. 2 ίσο με: α) 3 + 3; β) 3 + 2; γ) 4 + 2; δ) 4 + 3. |
|
Καθορίστε τις συνδέσεις με το Ion Bond: α) χλωριούχο νάτριο · β) οξείδιο του άνθρακα (II). γ) ιώδιο · δ) κάλιο νιτρικού καλίου. |
|
Μόνο οι ιονικές επικοινωνίες υποστηρίζουν τη δομή της ουσίας: α) υπεροξείδιο του νατρίου · β) με ελάχιστη ασβέστη · γ) Sipop χαλκού. δ) Sylvinit. |
|
Αναφέρετε το άτομο του οποίου το στοιχείο μπορεί να συμμετάσχει στο σχηματισμό της επικοινωνίας μετάλλων και ιόντων: α) ως β) br; γ) k; δ) se. |
|
Ο πιο έντονος χαρακτήρας της ιονικής επικοινωνίας στην ένωση: α) χλωριούχο ασβέστιο · β) φθόριο καλίου · γ) φθόριο αλουμινίου · δ) χλωριούχο νάτριο. |
|
Καθορίστε τις ουσίες ότι η συνολική κατάσταση των οποίων υπό κανονικές συνθήκες προσδιορίζεται με δεσμούς υδρογόνου μεταξύ μορίων: α) υδρογόνο · β) Χλωριούχο. γ) υγρό κήπο φθορίου · δ) νερό. |
|
Καθορίστε τον πιο ανθεκτικό δεσμό υδρογόνου: α) -n .... H-; β) -Ο ... H-; γ) -Cl .... H-; δ) -s ... h-. |
|
Ποια χημική σχέση είναι η λιγότερο ισχυρή; α) μέταλλο; β) ιονική · γ) υδρογόνο. δ) ομοιοπολική. |
|
Καθορίστε τον τύπο επικοινωνίας στο μόριο NF 3 : α) ιωνική · β) μη πολική ομοιοπολική · γ) πολική ομοιοπολική δ) υδρογόνο. |
|
Χημικός δεσμός μεταξύ των ατόμων στοιχείων με αριθμούς αλληλουχίας 8 και 16: α) ιωνική · β) ομοιοπολική πολική · γ) ομοιοπολική μη πολική · δ) υδρογόνο. |
|
Περιοδικός νόμος.
Ατόμων κτιρίων
Το άρθρο παρουσιάζει εργασίες δοκιμών σχετικά με το θέμα των εργασιών των δοκιμών που καταρτίζονται από τους συγγραφείς για θεματικό έλεγχο στην 8η τάξη. (Τράπεζα χωρητικότητας - 80 καθήκοντα για κάθε ένα από τα έξι θέματα που μελετήθηκαν στην 8η τάξη και 120 καθήκοντα στο θέμα "Βασική κατηγορία ανόργανων ενώσεων".) Επί του παρόντος, η εκπαίδευση χημείας στην 8η τάξη πραγματοποιείται σε εννέα εγχειρίδια. Ως εκ τούτου, στο τέλος του άρθρου, δίνεται ένας κατάλογος των ελεγχόμενων στοιχείων της γνώσης που αναφέρονται στους αριθμούς εργασίας. Αυτό θα επιτρέπει στους εκπαιδευτικούς να εργάζονται σε διαφορετικά προγράμματα για να επιλέξουν τόσο την κατάλληλη ακολουθία καθηκόντων από ένα θέμα όσο και ένα σύνολο συνδυασμών εργασιών δοκιμών από διαφορετικά θέματα, συμπεριλαμβανομένου του τελικού ελέγχου.
Τα προτεινόμενα 80 εργασίες δοκιμής ομαδοποιούνται από 20 ερωτήσεις σε τέσσερις επιλογές, στις οποίες επαναλαμβάνονται παρόμοια καθήκοντα. Για να συντάξετε περισσότερες επιλογές από τη λίστα των στοιχείων γνώσης, επιλέξτε (τυχαία) αριθμούς εργασιών για κάθε στοιχείο που μελετήθηκε σύμφωνα με τον θεματικό σχεδιασμό σας. Μια τέτοια παρουσίαση των καθηκόντων για κάθε θέμα σάς επιτρέπει να δαπανήσετε μια ανάλυση γρήγορης στοιχείων σφαλμάτων και την έγκαιρη διόρθωσή τους. Η χρήση παρόμοιων εργασιών σε μία υλοποίηση, η εναλλαγή μιας ή δύο σωστών απαντήσεων μειώνει την πιθανότητα εικασίας της ανταπόκρισης. Η πολυπλοκότητα των ζητημάτων, κατά κανόνα, αυξάνεται από τις 1η και 2η επιλογές στις 3 και 4ο επιλογές.
Υπάρχει μια άποψη ότι οι δοκιμές "μαντεύουν". Σας προτείνουμε να ελέγξετε αν είναι. Μετά τη δοκιμή, συγκρίνετε τα αποτελέσματα με τα σημάδια. Εάν τα αποτελέσματα των δοκιμών είναι κάτω, μπορεί να εξηγηθεί με τους ακόλουθους λόγους.
Πρώτον, όπως (δοκιμή) είναι ασυνήθιστο για τους μαθητές. Δεύτερον, ο δάσκαλος δίνει έμφαση στη μελέτη του θέματος (καθορίζοντας το κύριο στο περιεχόμενο της μεθοδολογίας εκπαίδευσης και διδασκαλίας).
Επιλογή 1
Καθήκοντα.
1. Την 4η περίοδο, μέσω της ομάδας είναι ένα στοιχείο με έναν αριθμό ακολουθίας:
1) 25; 2) 22; 3) 24; 4) 34.
2. Το στοιχείο με το φορτίο του πυρήνα του Atom +12 έχει έναν αριθμό ακολουθίας:
1) 3; 2) 12; 3) 2; 4) 24.
3. Ο αριθμός αλληλουχίας του στοιχείου αντιστοιχεί σε αυτά τα χαρακτηριστικά:
1) την επιβάρυνση των πυρήνων ατόμων.
2) τον αριθμό των πρωτονίων.
3) τον αριθμό των νετρονίων.
4. Έξι ηλεκτρόνια στο εξωτερικό επίπεδο ενέργειας στα άτομα των στοιχείων με τον αριθμό ομάδας:
1) II; 2) III; 3) vi; 4) IV.
5. Ο τύπος του υψηλότερου οξειδίου χλωρίου:
1) SL 2 o; 2) CL 2 o 3;
3) CL 2 o 5; 4) CL 2 o 7.
6. Το σθένος του ατόμου αλουμινίου είναι:
1) 1; 2) 2; 3) 3; 4) 4.
7. Ο συνολικός τύπος πτητικών ενώσεων υδρογόνου των στοιχείων της ομάδας VI:
1) EL 4; 2) EL 3;
3) ne; 4) H 2 E.
8. Ο αριθμός του εξωτερικού ηλεκτρονικού στρώματος στο άτομο ασβεστίου:
1) 1; 2) 2; 3) 3; 4) 4.
9.
1) li; 2) na; 3) k; 4) CS.
10. Καθορίστε στοιχεία-μέταλλα:
1) k; 2) Cu; 3) o; 4) Ν.
11. Όπου στον Πίνακα Δ.Ι. Imeleeva, τα στοιχεία βρίσκονται τα άτομα στις χημικές αντιδράσεις μόνο δίνουν ηλεκτρόνια;
1) στην ομάδα II ·
2) στην αρχή της 2ης περιόδου.
3) στη μέση της 2ης περιόδου.
4) Στη Via Group.
12.
2) ve, mg; Al;
3) mg, ca, sr;
13. Καθορίστε στοιχεία μη-metallyle:
1) cl; 2) s; 3) mn; 4) mg.
14. Οι μη μεταλλικές ιδιότητες αυξάνονται σε μια σειρά:
15. Ποια είναι τα χαρακτηριστικά της αλλαγής του ATOM;
1) Φορτίστε το Atom Nucleus.
2) τον αριθμό των ενεργειακών επιπέδων στο άτομο ·
3) τον αριθμό των ηλεκτρονίων στο εξωτερικό επίπεδο ενέργειας ·
4) Αριθμός νετρονίων.
16.
1 έως? 2) al; 3) p; 4) cl.
17. Σε μια περίοδο με αύξηση της επιβάρυνσης του πυρήνα, τις ακτίνες των ατόμων στοιχείων:
1) Μείωση.
2) Μην αλλάζετε.
3) Αύξηση.
4) αλλάζουν περιοδικά.
18. Τα ισότοπα των ατόμων ενός στοιχείου διαφέρουν από:
1) τον αριθμό των νετρονίων.
2) τον αριθμό των πρωτονίων.
3) τον αριθμό των ηλεκτρονίων σθένους.
4) Η διάταξη στον Πίνακα Δ.Ι. Imendeeva.
19. Αριθμός νετρονίων στον πυρήνα του Atom 12 S:
1) 12; 2) 4; 3) 6; 4) 2.
20. Η κατανομή των ηλεκτρονίων με επίπεδα ενέργειας στο άτομο φθορίου:
1) 2, 8, 4; 2) 2,6;
3) 2, 7; 4) 2, 8, 5.
Επιλογή 2.
Καθήκοντα. Επιλέξτε μία ή δύο σωστές απαντήσεις.
21. Το στοιχείο με τον αριθμό αλληλουχίας 35 είναι:
1) 7η περίοδο, ομάδα IVA;
2) 4η περίοδο, ο όμιλος VIIa,
3) 4η περίοδο, ομάδα VIIB;
4) 7η περίοδο, IVB ομάδα.
22. Το στοιχείο με το φορτίο του πυρήνα του Atom +9 έχει έναν αριθμό ακολουθίας:
1) 19; 2) 10; 3) 4; 4) 9.
23. Ο αριθμός των πρωτονίων στο ουδέτερο άτομο συμπίπτει με:
1) τον αριθμό των νετρονίων.
2) ατομική μάζα.
3) τον αριθμό ακολουθίας.
4) τον αριθμό των ηλεκτρονίων.
24. Πέντε ηλεκτρόνια στο εξωτερικό επίπεδο ενέργειας στα άτομα στοιχείων με έναν αριθμό ομάδας:
1) i; 2) III; 3) v; 4) VII.
25. Ο τύπος υψηλότερου οξειδίου του αζώτου:
1) n 2 o; 2) n 2 o 3;
3) n 2 o 5; 4) Όχι;
26. Η σθένος του ατόμου ασβεστίου στο υψηλότερο υδροξείδιο του είναι ίσο με:
1) 1; 2) 2; 3) 3; 4) 4.
27. Η σθένος του ατόμου αρσενικού στην ένωση υδρογόνου είναι:
1) 1; 2) 2; 3) 3; 4) 4.
28. Ο αριθμός του εξωτερικού ηλεκτρονικού στρώματος στο άτομο καλίου:
1) 1; 2) 2; 3) 3; 4) 4.
29. Η μεγαλύτερη ακτίνα του ατόμου από το στοιχείο:
1) b; 2) o; 3) γ; 4) Ν.
30. Καθορίστε στοιχεία-μέταλλα:
1 έως? 2) h; 3) f; 4) Cu.
31. Τα άτομα των στοιχείων που είναι ικανά να λαμβάνουν και να δίνουν ηλεκτρόνια, βρίσκονται:
1) στην ομάδα IA.
2) στην ομάδα VIA.
3) στην αρχή της 2ης περιόδου.
4) στο τέλος της 3ης περιόδου.
32.
1) na, k, li; 2) al, mg, na;
3) p, s, сl; 4) Na, Mg, Al.
33. Καθορίστε στοιχεία μη-metallyle:
1) na; 2) mg; 3) si; 4) P.
34.
35. Το κύριο χαρακτηριστικό του χημικού στοιχείου:
1) ατομική μάζα.
2) την επιβάρυνση του πυρήνα.
3) τον αριθμό των επιπέδων ενέργειας ·
4) Αριθμός νετρονίων.
36. Το σύμβολο του στοιχείου του οποίου τα άτομα σχηματίζουν αμφοτερικά οξείδιο:
1) n; 2) k; 3) s; 4) Zn.
37. Στις κύριες υποομάδες (α) του περιοδικού συστήματος χημικών στοιχείων με αύξηση της επιβάρυνσης του πυρήνα, η ακτίνα Atom:
1) αυξήσεις.
2) μειώνεται.
3) δεν αλλάζει.
4) Διαφέρει περιοδικά.
38. Ο αριθμός των νετρονίων στον πυρήνα του ατόμου είναι:
1) τον αριθμό των ηλεκτρονίων.
2) τον αριθμό των πρωτονίων.
3) τη διαφορά μεταξύ της σχετικής ατομικής μάζας και του αριθμού των πρωτονίων.
4) Ατομική μάζα.
39. Οι ισότοποι υδρογόνου διαφέρουν στον αριθμό:
1) ηλεκτρόνια.
2) νετρόνια.
3) πρωτόνια.
4) θέση στον πίνακα.
40. Η κατανομή των ηλεκτρονίων με επίπεδα ενέργειας στο άτομο νατρίου:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5.
Επιλογή 3.
Καθήκοντα. Επιλέξτε μία ή δύο σωστές απαντήσεις.
41. Καθορίστε τον αριθμό ακολουθίας του στοιχείου, το οποίο βρίσκεται στην ομάδα IVA, η 4η περίοδος του πίνακα D.I. IVELEEVA:
1) 24; 2) 34; 3) 32; 4) 82.
42. Η χρέωση του πυρήνα ενός ατόμου στοιχείου αριθμού 13 είναι:
1) +27; 2) +14; 3) +13; 4) +3.
43. Ο αριθμός των ηλεκτρονίων στο άτομο είναι:
1) τον αριθμό των νετρονίων.
2) τον αριθμό των πρωτονίων.
3) ατομική μάζα.
4) τον αριθμό ακολουθίας.
44. Άτομα των στοιχείων IVA της ομάδας, ο αριθμός των ηλεκτροβόλων είναι:
1) 5; 2) 6; 3) 3; 4) 4.
45. Οξείδια με τον γενικό τύπο R2 O 3 Στοιχεία της σειράς:
1) na, k, li; 2) mg, ca, να είναι?
3) b, al, ga; 4) C, SI, GE.
46. Η σθένος του ατόμου φωσφόρου στο υψηλότερο οξείδιο του είναι:
1) 1; 2) 3; 3) 5; 4) 4.
47. Ενώσεις υδρογόνου στοιχείων της ομάδας VIIa:
1) HCLO 4; 2) HCl;
3) HBRO; 4) HBR.
48. Ο αριθμός των ηλεκτρονικών στρωμάτων στο Atom Selena είναι:
1) 1; 2) 2; 3) 3; 4) 4.
49. Η μεγαλύτερη ακτίνα του ατόμου από το στοιχείο:
1) li; 2) na; 3) mg;
50. Καθορίστε στοιχεία-μέταλλα:
1) na; 2) mg; 3) si; 4) P.
51. Άτομα από τα οποία τα στοιχεία δίνουν εύκολα τα ηλεκτρόνια;
1) k; 2) cl; 3) na; 4) S.
52. Ορισμένα στοιχεία στα οποία αυξάνονται οι μεταλλικές ιδιότητες:
1) C, N, B, F;
2) al, si, p, mg;
53. Καθορίστε στοιχεία μη-metallyle:
1) na; 2) mg; 3) n; 4) S.
54. Ορισμένα στοιχεία στα οποία αυξάνονται οι μη μεταλλικές ιδιότητες:
1) Li, Na, K, N;
2) al, si, p, mg;
3) C, N, O, F;
4) Na, Mg, Al, K.
55. Με αύξηση της χρέωσης του πυρήνα του ατόμου, οι μη μεταλλικές ιδιότητες των στοιχείων:
1) αλλάζουν περιοδικά.
2) ενισχυμένο.
3) Μην αλλάζετε.
4) αποδυναμώσει.
56. Το σύμβολο του στοιχείου του οποίου τα άτομα σχηματίζουν αμφοτερικό υδροξείδιο:
1) na; 2) al; 3) n; 4) S.
57. Η συχνότητα αλλαγής των ιδιοτήτων των στοιχείων και των ενώσεών τους εξηγείται:
1) την επανάληψη της δομής του εξωτερικού ηλεκτρονικού στρώματος.
2) αύξηση του αριθμού των ηλεκτρονικών στρωμάτων ·
3) αύξηση του αριθμού των νετρονίων ·
4) αύξηση της ατομικής μάζας.
58. Ο αριθμός των πρωτονίων στον πυρήνα του ατόμου νατρίου είναι:
1) 23; 2) 12; 3) 1; 4) 11.
59. Ποια είναι η διαφορά μεταξύ των ατόμων των ισοτόπων ενός στοιχείου;
1) τον αριθμό των πρωτονίων.
2) τον αριθμό των νετρονίων ·
3) τον αριθμό των ηλεκτρονίων ·
4) Η επιβάρυνση του πυρήνα.
60. Η κατανομή των ηλεκτρονίων με επίπεδα ενέργειας στο άτομο λιθίου:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5;
Επιλογή 4.
Καθήκοντα. Επιλέξτε μία ή δύο σωστές απαντήσεις.
61. Το στοιχείο με τον αριθμό ακολουθίας 29 είναι:
1) 4η περίοδο, ο όμιλος IA;
2) 4η περίοδο, η IB ομάδα.
3) 1η περίοδο, ο όμιλος IA;
4) 5η περίοδο, ο όμιλος IA.
62. Η χρέωση του πυρήνα ενός ατόμου στοιχείου αριθ. 15 είναι:
1) +31; 2) 5; 3) +3; 4) +15.
63. Η χρέωση του πυρήνα του Atom καθορίζεται από:
1) τον αριθμό ακολουθίας του στοιχείου.
2) αριθμός ομάδας.
3) τον αριθμό της περιόδου ·
4) Ατομική μάζα.
64. Στα άτομα των στοιχείων III της ομάδας, ο αριθμός των ηλεκτροβόλων είναι:
1) 1; 2) 2; 3) 3; 4) 5.
65. Το υψηλότερο οξείδιο του θείου έχει έναν τύπο:
1) H 2 SO 3; 2) H 2 SO 4;
3) έτσι 3; 4) Έτσι 2.
66. Τύπος υψηλότερου οξειδίου του φωσφόρου:
1) P 2 o 3; 2) H3 PO 4;
3) NRU 3; 4) P 2 o 5.
67. Αποτίμηση του ατόμου αζώτου στην ένωση υδρογόνου:
1) 1; 2) 2; 3) 3; 4) 4.
68. Ο αριθμός περιόδου στον Πίνακα Δ.Ι. Το REMEETEEVA αντιστοιχεί στο ακόλουθο χαρακτηριστικό του ατόμου:
1) τον αριθμό των ηλεκτρονίων σθένους.
2) υψηλότερη σθένος στην ένωση με οξυγόνο.
3) ο συνολικός αριθμός των ηλεκτρονίων ·
4) τον αριθμό των ενεργειακών επιπέδων.
69. Η μεγαλύτερη ακτίνα του ατόμου από το στοιχείο:
1) cl; 2) br; 3) i; 4) F.
70. Καθορίστε στοιχεία-μέταλλα:
1) mg; 2) li; 3) h; 4) S.
71. Στο άτομο του οποίου το στοιχείο είναι ευκολότερο να δώσει ένα ηλεκτρόνιο;
1) νάτριο; 2) καίσιο.
3) κάλιο. 4) Λιθίου.
72. Οι μεταλλικές ιδιότητες αυξάνονται σε μια σειρά:
1) Na, Mg, Al; 2) na, k, rb;
3) RB, K, NA; 4) P, S, CL.
73. Καθορίστε στοιχεία μη-metallyle:
1) Cu; 2) στο? 3) n; 4) cr.
74. N-P-AS-SB μη μεταλλικές ιδιότητες:
1) Μείωση.
2) Μην αλλάζετε.
3) Αύξηση.
4) Μείωση και στη συνέχεια αυξάνεται.
75. Ποια χαρακτηριστικά του ατόμου αλλάζουν περιοδικά;
1) σχετική ατομική μάζα.
2) την επιβάρυνση του πυρήνα.
3) τον αριθμό των ενεργειακών επιπέδων στο άτομο ·
4) Ο αριθμός των ηλεκτρονίων σε εξωτερικό επίπεδο.
76. Άτομα από τα οποία το στοιχείο σχηματίζει αμφοτερικότητα οξείδιο;
1 έως. 2) ve; 3) γ; 4) SA.
77. Κατά την περίοδο, με αύξηση της χρέωσης του πυρήνα του Atom αυξάνει την έλξη των ηλεκτρονίων στον πυρήνα και τις μεταλλικές ιδιότητες:
1) ενισχυμένο.
2) αλλαγή περιοδικά.
3) αποδυναμώνει.
4) Μην αλλάζετε.
78. Η σχετική ατομική μάζα του στοιχείου είναι αριθμητικά ίση με:
1) τον αριθμό των πρωτονίων στον πυρήνα.
2) τον αριθμό των νετρονίων στον πυρήνα.
3) Ο συνολικός αριθμός των νετρονίων και των πρωτονίων.
4) Ο αριθμός των ηλεκτρονίων στο άτομο.
79. Ο αριθμός των νετρονίων στον πυρήνα ενός ατόμου 16 O είναι:
1) 1; 2) 0; 3) 8; 4) 32.
80. Η κατανομή των ηλεκτρονίων με επίπεδα ενέργειας στο άτομο πυριτίου:
1) 2, 8, 4; 2) 2, 6;
3) 2, 7; 4) 2, 8, 5.
Κατάλογος ελεγχόμενων στοιχείων της γνώσης σχετικά με το θέμα
"Περιοδικός νόμος. Τη δομή του ατόμου
(Σε παρένθεση δίδονται μέσω αριθμών εργασίας)
Ο αριθμός αλληλουχίας του στοιχείου (1, 3, 21, 41, 61), η φόρτιση του πυρήνα του ατόμου (2, 22, 42, 62, 63), ο αριθμός των πρωτονίων (23) και ο αριθμός των ηλεκτρονίων (43) στο άτομο.
Αριθμός ομάδας, ηλεκτρόνια στο εξωτερικό επίπεδο ενέργειας (4, 24, 44, 64), υψηλότερους τύπους οξειδίου (5, 25, 45, 65), ο υψηλότερος σθένος του στοιχείου (6, 26, 46, 66), των τύπων των ενώσεων υδρογόνου (7, 27, 47, 67).
Αριθμός περιόδου, αριθμός ηλεκτρονικών επιπέδων (8, 28, 48, 68).
Αλλάξτε την ακτίνα ενός ατόμου (9, 17, 29, 37, 49, 67, 69).
Θέση στον Πίνακα Δ.Ι. Στοιχεία REMEFELEEVA-μέταλλα (10, 30, 50, 70) και μη μεταλλικά στοιχεία (13, 33, 53, 73).
Η ικανότητα των ατόμων να δίνουν και να δέχονται ηλεκτρόνια (11, 31, 51, 71).
Αλλαγή των ιδιοτήτων των απλών ουσιών: με ομάδες (12, 14, 34, 52, 54, 74) και περιόδους (32, 72, 77).
Περιοδικές μεταβολές στην ηλεκτρονική δομή των ατόμων και ιδιότητες απλών ουσιών και των ενώσεών τους (15, 35, 55, 57, 75, 77).
Amphotosi οξείδια και υδροξείδια (16, 36, 56, 76).
Αριθμός μάζας, ο αριθμός των πρωτονίων και των νετρονίων στο άτομο, ισότοπα (18, 19, 38, 39, 58, 59, 78, 79).
Η κατανομή των ηλεκτρονίων με επίπεδα ενέργειας στο άτομο (20, 40, 60, 80).
Απαντήσεις σε εργασίες δοκιμής για το θέμα
"Περιοδικός νόμος. Τη δομή του ατόμου
| Επιλογή 1 | Επιλογή 2. | Επιλογή 3. | Επιλογή 4. | ||||
|---|---|---|---|---|---|---|---|
| Αριθμός αναζήτησης | Αριθμός απόκρισης | Αριθμός αναζήτησης | Αριθμός απόκρισης | Αριθμός αναζήτησης | Αριθμός απόκρισης | Αριθμός αναζήτησης | Αριθμός απόκρισης |
| 1 | 4 | 21 | 2 | 41 | 3 | 61 | 2 |
| 2 | 2 | 22 | 4 | 42 | 3 | 62 | 4 |
| 3 | 1, 2 | 23 | 3, 4 | 43 | 2, 4 | 63 | 1 |
| 4 | 3 | 24 | 3 | 44 | 4 | 64 | 3 |
| 5 | 4 | 25 | 3 | 45 | 3 | 65 | 3 |
| 6 | 3 | 26 | 2 | 46 | 3 | 66 | 4 |
| 7 | 4 | 27 | 3 | 47 | 2, 4 | 67 | 3 |
| 8 | 4 | 28 | 4 | 48 | 4 | 68 | 4 |
| 9 | 4 | 29 | 1 | 49 | 5 | 69 | 3 |
| 10 | 1, 2 | 30 | 1, 4 | 50 | 1, 2 | 70 | 1, 2 |
| 11 | 1, 2 | 31 | 2, 4 | 51 | 1, 3 | 71 | 2 |
| 12 | 3 | 32 | 2 | 52 | 3 | 72 | 2 |
| 13 | 1, 2 | 33 | 3, 4 | 53 | 3, 4 | 73 | 2, 3 |
| 14 | 1 | 34 | 4 | 54 | 3 | 74 | 1 |
| 15 | 3 | 35 | 2 | 55 | 1 | 75 | 4 |
| 16 | 2 | 36 | 4 | 56 | 2 | 76 | 2 |
| 17 | 1 | 37 | 1 | 57 | 1 | 77 | 3 |
| 18 | 1 | 38 | 3 | 58 | 4 | 78 | 3 |
| 19 | 3 | 39 | 2 | 59 | 2 | 79 | 3 |
| 20 | 3 | 40 | 2 | 60 | 1 | 80 | 1 |
Βιβλιογραφία
Gorodnichev i.n.. Έλεγχος και επαλήθευση της χημείας. M.: Ενυδρείο, 1997; Sorokin V.V., Zlotnikov, π.χ.. Δοκιμές χημείας. M.: Εκπαίδευση, 1991.
Αναφέρθηκε παραπάνω (σελ. 172) σχετικά με την περιοδικότητα των αλλαγών στις σημαντικότερες ιδιότητες των ατόμων - σθένος. Υπάρχουν άλλες σημαντικές ιδιότητες των οποίων η αλλαγή χαρακτηρίζεται από συχνότητα. Τέτοιες ιδιότητες περιλαμβάνουν το μέγεθος (ακτίνα) του ατόμου. Το άτομο δεν έχει επιφάνειεςΚαι το περίγραμμα είναι ασαφές, καθώς η πυκνότητα των εξωτερικών ηλεκτρονίων σύννεφων καθώς το καταργεί ομαλά μειώνεται. Τα δεδομένα σχετικά με τις ακτίνες ατόμων λαμβάνονται από τον προσδιορισμό των αποστάσεων μεταξύ των κέντρων τους σε μόρια και κρυσταλλικές δομές. Οι υπολογισμοί διεξήχθησαν επίσης με βάση τις εξισώσεις της κβαντικής μηχανικής. Στο ΣΧ. 5.10
Σύκο. 5.10. Τη συχνότητα των αλλαγών στις ατομικές ακτίνες
Η καμπύλη των αλλαγών στις ατομικές ακτίνες, ανάλογα με την επιβάρυνση του πυρήνα.
Από το υδρογόνο έως το ηλίο, η ακτίνα μειώνεται και στη συνέχεια αυξάνεται σημαντικά στο λίθιο. Αυτό οφείλεται στην εμφάνιση ενός ηλεκτρονίου στο δεύτερο επίπεδο ενέργειας. Στη δεύτερη περίοδο από το λίθιο στο Νέο, καθώς η επιβάρυνση του πυρήνα αυξάνεται, οι ακτίνες μειώνεται.
Ταυτόχρονα, η αύξηση του αριθμού των ηλεκτρονίων σε αυτό το επίπεδο ενέργειας οδηγεί σε αύξηση της αμοιβαίας απέλασης τους. Επομένως, μέχρι το τέλος της περιόδου, η μείωση της ακτίνας επιβραδύνεται.
Όταν μετακινείται από νέον σε νάτριο - το πρώτο στοιχείο της τρίτης περιόδου - η ακτίνα αυξάνει και πάλι απότομα, και στη συνέχεια μειώνεται σταδιακά στο αργό. Μετά από αυτό, υπάρχει μια απότομη αύξηση της ακτίνας σε κάλιο. Αποδεικνύεται μια χαρακτηριστική περιοδική καμπύλη πλαγιού. Κάθε τμήμα της καμπύλης αλκαλιμετάλλου σε ένα ευγενές αέριο χαρακτηρίζει την αλλαγή στην ακτίνα κατά την περίοδο: υπάρχει μείωση της ακτίνας κατά τη διάρκεια της μετάβασης από το αριστερό προς τα δεξιά. Είναι επίσης ενδιαφέρον να μάθετε τη φύση της μεταβολής των ακτίνων σε ομάδες στοιχείων. Για να το κάνετε αυτό, πρέπει να κρατήσετε μια γραμμή μέσω των στοιχείων της ίδιας ομάδας. Σύμφωνα με τη θέση των μέγιστων σε αλκαλικό μέταλλο, παρατηρείται άμεσα ότι οι ακτίνες των ατόμων κατά τη μετάβαση στην ομάδα από πάνω προς τα κάτω αυξάνονται. Αυτό οφείλεται στην αύξηση του αριθμού των ηλεκτρονικών κελυφών.
Εργασία 5.17. Πώς οι ακτίνες των ατόμων από το f έως το ur αλλαγή; Προσδιορίστε αυτό στο ΣΧ. 5.10.
Πολλές άλλες ιδιότητες των ατόμων εξαρτώνται από τις ακτίνες, τόσο φυσικά όσο και χημικά. Για παράδειγμα, η αύξηση των ακτίνων των ατόμων μπορεί να εξηγήσει τη μείωση των θερμοκρασιών που τήκεται από αλκαλιμετάλλους από λιθίου προς το καίσιο:
Τα μεγέθη των ατόμων συνδέονται με τις ενεργειακές τους ιδιότητες. Όσο μεγαλύτερη είναι η ακτίνα των εξωτερικών σύννεφων ηλεκτρονίων, τόσο ευκολότερη είναι ένα ηλεκτρόνιο χάνει ένα ηλεκτρόνιο. Την ίδια στιγμή, μετατρέπεται σε θετικά φορτισμένη και αυτος.
Το ιόν είναι μία από τις πιθανές καταστάσεις του ατόμου στις οποίες έχει ηλεκτρικό φορτίο λόγω της απώλειας ή της προσθήκης ηλεκτρονίων.
Η ικανότητα ενός ατόμου να μετακινηθεί σε ένα θετικά φορτισμένο ιόν χαρακτηριστεί Ενέργεια ιονισμού Ε Ι.Αυτή είναι η ελάχιστη ενέργεια που απαιτείται για τον διαχωρισμό ενός εξωτερικού ηλεκτρονίου από ένα άτομο στην κατάσταση αερίου:
![]()
Το προκύπτον θετικό ιόν μπορεί επίσης να χάσει ηλεκτρόνια, να γίνει δύο αλυσίδες, τρία γράφημα κλπ. Το μέγεθος της ενέργειας ιονισμού αυξάνεται σε μεγάλο βαθμό.
Η ενέργεια ιονισμού των ατόμων αυξάνεται κατά την περίοδο κατά τη μετακίνηση από αριστερά προς τα δεξιά και μειώνεται σε ομάδες κατά τη μετάβαση από την κορυφή προς τα κάτω.
Πολλά, αλλά όχι όλα τα άτομα είναι σε θέση να συνδέσουν ένα πρόσθετο ηλεκτρόνιο, μετατρέπονται σε ένα αρνητικά φορτισμένο ιόν α ~. Αυτή η ιδιότητα χαρακτηρίζεται electron Energy E Ενέργεια Ε βρ. Αυτή είναι η ενέργεια που διακρίνεται όταν το ηλεκτρόνιο συνδέεται με το άτομο που βρίσκεται στην κατάσταση αερίου:
![]()
Τόσο η ενέργεια του ιονισμού όσο και η ενέργεια της βλάστησης του ηλεκτρονίου είναι συνηθισμένοι 1 mole άτομα και ρητή στο KJ / Mol. Εξετάστε το ιονισμό του ατόμου νατρίου ως αποτέλεσμα της προσκόλλησης και της απώλειας ενός ηλεκτρονίου (Εικ. 5.11) . Από το σχήμα είναι σαφές ότι για τον αποκλεισμό ενός ηλεκτρονίου από το άτομο νατρίου απαιτείται στο 10 Μόλις περισσότερη ενέργεια από ό, τι κατανέμεται όταν ένα ηλεκτρόνιο είναι συνδεδεμένο. Το αρνητικό ιόν νάτριο ασταθές και σε πολύπλοκες ουσίες δεν βρέθηκε σχεδόν ποτέ.

Σύκο. 5.11. Ιονισμός του ατόμου νατρίου
Η ενέργεια ιονισμού των ατόμων αλλάζει σε περιόδους και ομάδες προς την κατεύθυνση απέναντι από την αλλαγή της ακτίνας των ατόμων. Η αλλαγή στην ενέργεια της συγγένειας με το ηλεκτρόνιο στην περίοδο είναι πιο δύσκολη, δεδομένου ότι τα στοιχεία της συγγένειας IIA- και VIIIA-RPYNN απουσιάζουν. Μπορούμε να υποθέσουμε ότι η ενέργεια μιας συγγένειας ηλεκτρονίων είναι σαν ΕΑυξήσεις σε περιόδους (στην ομάδα VII συμπεριλαμβανομένου) και μειώνεται σε ομάδες από πάνω προς τα κάτω (Εικ. 5.12).
το έργο 5 .δεκαοχτώ. Μπορούν τα άτομα μαγνησίου και αργού σε μια αέρια κατάσταση σχηματισμού αρνητικά φορτισμένων ιόντων;
Τα ιόντα με θετικές και αρνητικές χρεώσεις προσελκύονται μεταξύ τους, οι οποίες οδηγούν σε μια ποικιλία μετασχηματισμών. Η απλούστερη περίπτωση είναι ο σχηματισμός ιονικών συνδέσεων, δηλ. Ενοποίηση ιόντων σε μια ουσία υπό τη δράση της ηλεκτροστατικής έλξης. Στη συνέχεια, εμφανίζεται η ιονική κρυσταλλική δομή, χαρακτηριστική του αλάτι τροφής NaCl και πολλά άλλα άλατα. Αλλά ίσως

Σύκο. 5.12. Τη φύση των αλλαγών στην ενέργεια του ιονισμού και της ενέργειας μιας συγγένειας ηλεκτρονίων σε ομάδες και περιόδους
Έτσι, το αρνητικό ιόν δεν συγκρατείται πολύ σταθερά την περίσσεια ηλεκτρονίων και ένα θετικό ιόν, αντίθετα, επιδιώκει να αποκαταστήσει την ηλεκτρονική του αξία. Στη συνέχεια, η αλληλεπίδραση μεταξύ ιόντων μπορεί να οδηγήσει στο σχηματισμό μορίων. Προφανώς, τα ιόντα του διαφορετικού σημείου της χρέωσης C1 + και C1 ~ προσελκύονται μεταξύ τους. Λόγω του γεγονότος ότι αυτά είναι ιόντα ταυτόσημων ατόμων, σχηματίζουν ένα μόριο C1 2 με μηδενικές χρεώσεις σε άτομα.
Ερωτήσεις και ασκήσεις
1. Από πόσα πρωτόνια, τα νετρόνια και τα ηλεκτρόνια αποτελούνται από άτομα βρωμίου;
2.
Υπολογίστε τα κλάσματα μαζικής φύσης της ισότοπων. ![]()
3. Πόση ενέργεια απελευθερώνεται κατά τη διάρκεια του σχηματισμού 16 ΣΟΛ.Οξυγόνο με αντίδραση ![]() ρέοντας σε βάθη των αστεριών;
ρέοντας σε βάθη των αστεριών;
4. Υπολογίστε την ενέργεια ηλεκτρονίων σε ένα ενθουσιασμένο άτομο υδρογόνου όταν n \u003d3.
5. Γράψτε τις πλήρεις και συντομευμένες ηλεκτρονικές φόρμουλες του ατόμου ιωδίου.
6. Γράψτε μια μειωμένη ηλεκτρονική φόρμουλα ιόντων.
7. Γράψτε πλήρεις και συντομευμένες ηλεκτρονικές φόρμουλες Atom και Iona 2.
8. Δημιουργία ενεργειακών διαγραμμάτων φωσφόρου και ατόμων αρσενικού.
9. Κατασκευάστε πλήρη ενεργειακά διαγράμματα των ατόμων ψευδαργύρου και του γαλλικού.
10. Τοποθετήστε τα ακόλουθα άτομα με τη σειρά της αύξησης της ακτίνας: αλουμίνιο, βόριο, άζωτο.
11. Ποια από τα ακόλουθα ιόντα σχηματίζουν ιοντικές κρυσταλλικές δομές μεταξύ τους: στο R + R -, K +, K -, I +, I - Li +, Li -; Τι μπορεί να αναμένεται όταν η αλληλεπίδραση ιόντων σε άλλους συνδυασμούς;
12. Ας υποθέσουμε ότι η πιθανή φύση της ακτίνας των ατόμων κατά τη μετάβαση στο περιοδικό σύστημα στη διαγώνια κατεύθυνση, για παράδειγμα Li - mg - sc.