Charakteristík uvedených nižšie uvedených prvkov. Chémia
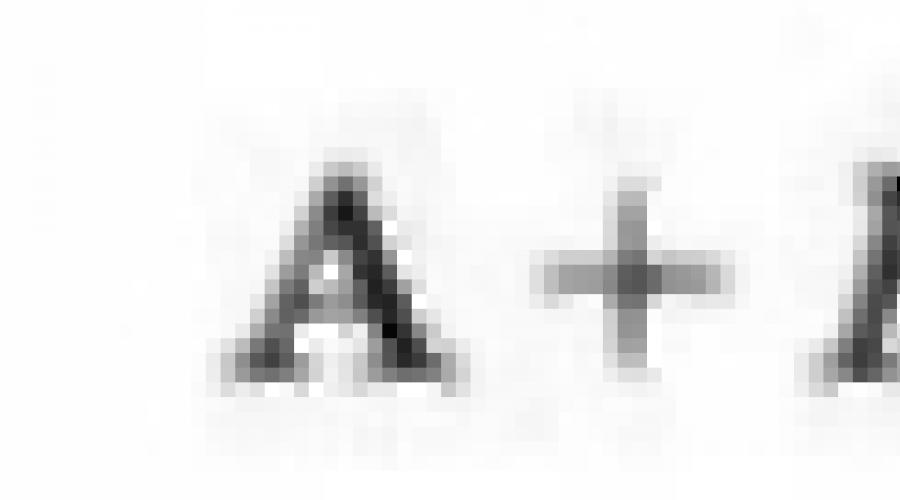
Vyšetrenie č. 2 obsahuje úlohy nasledujúcich tém:
- Periodický systém
- Frekvencia meniacich sa vlastností prvkov a ich zlúčenín.
- Chemická väzba. Metóda Slnka.
- Chemická väzba. Metóda MO.
- Chemická väzba. Iónové pripojenie.
- Chemická väzba v zložitých zlúčeninách.
Skúška kontroly vedomostí:
1. Charakteristiky atómov prvkov uvedených nižšie pravidelne meniť
(1) atóm jadrá;
(2) relatívna atómová hmota;
(3) počet úrovní energie v atóme;
(4) Počet elektrónov na úrovni vonkajšej energie.
2. Vo vnútri obdobia je zvýšenie sekvenčného čísla prvku zvyčajne sprevádzané
(1) so znížením atómového polomeru a zvýšenia elektronickejgativity atómu;
(2) zvýšenie atómového polomeru a zníženie elektronibility atómu;
(3) S poklesom atómového polomeru a zníženie elektronibility atómu;
(4) Zvýšenie atómového polomeru a zvýšenie elektronibility atómu.
3. Atom, ktorého prvok je najjednoduchší spôsob, ako dať jeden elektrón (čísla znamenajú poradové číslo prvku):
(1) sodík, 11; (2) horčík, 12; (3) hliník, 13; (4) Silicon, 14?
4. Atómy prvkov 1A periodického systému prvkov majú rovnaké číslo
(1) elektróny na vonkajšej elektronickej úrovni;
(2) neutróny;
(3) Všetky elektróny.
5. Prvky sú umiestnené v poradí zvyšovania elektronibility v rade
(1) ako, SE, CL, F; (2) C, I, B, SI; (3) br, p, h, sb; (4) O, SE, BR, TE.
6. V druhom a treťom období periodického systému ako veľkosť atómov prvkov klesá
(1) Znižuje sa aj veľkosť ich iónov;
(2) Zníženie elektrickej energie;
(3) Kovové vlastnosti prvkov oslabuje;
(4) Zvyšujú sa kovové vlastnosti prvkov.
7. Ktoré číslo obsahuje iba prechodné prvky:
(1) prvky 11, 14, 22, 42; (2) prvky 13, 33, 54, 83;
(3) prvky 24, 39, 74, 80; (4) prvky 19, 32, 51, 101?
8. Ktoré z nižšie uvedených prvkov má chemické vlastnosti, čo umožňuje hovoriť o svojej podobnosti s vápnikovým prvkom:
(1) uhlík. Z; (2) sodík, Na; (3) draslík. Na; (4) Strontium, SR?
9. Nekovové vlastnosti prvkov nachádzajúcich sa v hlavných podskupinách periodického systému D. I. MENDELEELEV sú najvýraznejšie v tých, ktorí sa nachádzajú
(1) v hornej časti podskupiny;
(2) v spodnej časti podskupiny;
(3) uprostred podskupiny;
(4) Vo všetkých prvkoch je podskupina vyjadrená v rovnakom stupni.
10. Ktorý počet prvkov je zastúpený vo vzostupnom poradí atómového polomeru:
(1) O, S, SE, tí; (2) C, N, O, F; (3) Na, mg, al, si; (4) I, Br, CL, F?
11. Kovová povaha vlastností prvkov v sérii MG-CA-SR-BA
(1) klesá;
(2) sa zvyšuje;
(3) sa nemení;
12. Nekovový charakter vlastností prvkov v množstve n-p-as-sb-bi
(1) klesá;
(2) sa zvyšuje;
(3) sa nemení;
(4) Znižuje sa a potom sa zvyšuje.
13. Ktorá para v špecifikovanej sade prvkov - CA, P, SI, AG, Ni, as - má najpodobnejšie chemické vlastnosti:
(1) SA, SI; (2) AG, Ni; (3) p, as; (4) Ni, R?
14. Podľa jej chemických vlastností je rádioaktívny prvok rádia najbližšie k
(1) cézium; (2) bárium; (3) lantánsky; (4) Actinia.
15. Na základe pozície lanthanového prvku v periodickom systéme je bezpečné tvrdiť, že pre lantanidy bude najviac charakteristický stupeň oxidácie
(1) +1; (2) +2; (3) +3; (4) +4.
16. Hlavné vlastnosti hydroxidov prvkov skupiny 1A, ako sa zvyšuje poradové číslo
(1) Zníženie;
(2) zvýšenie;
(3) zostávajú nezmenené;
(4) Znížiť a potom sa zvýšiť.
17. Na základe pozície prvkov v periodickom systéme môže byť najpravdepodobnejší kĺb Nemecka so selénom znázornený vzorcom.
18. Hypotetický prvok Z tvorí ZCl 5 chlorid. Aký je najpravdepodobnejší vzorec pre jeho oxid:
(1) zo 2; (2) ZO 5; (3) Z205; (4) Z 5 O 2?
19. Jednoduché látky, z ktorých prvky majú najväčšiu podobnosť fyzikálnych a chemických vlastností:
(1) li, s; (2) BE; (3) F, Cl; (4) Li, F?
20. Z prvkov nižšieho tretieho obdobia má najvýraznejšie nekovové vlastnosti
(1) hliník; (2) silikón; (3) síra; (4) chlór.
21. Z vyššie uvedených prvkov IIIa má skupina výrazné nekovové nehnuteľnosti
(1) bor; (2) hliník; (3) gálium; (4) India.
22. Ktorý z vyššie uvedených prvkov štvrtého obdobia periodického systému prejavuje rovnaké hodnoty valencie vo svojej vodíkovej zlúčenine a v najvyššom oxidoch:
(1) bróm; (2) Nemecko; (3) arzén; (4) Selén?
23. Povaha oxidov v rade P 2 O 5 -sio 2 -L 2 O-MGO sa zmení takto:
(1) z hlavného až kyslého;
(2) od kyseliny až po hlavnú;
(3) z hlavného až amfotéru;
(4) z amfotérov na kyslé.
24. Napíšte vzorce vyššieho oxidov prvkov a zodpovedajúcich kyselín; Názov týchto kyselín:
25. Na základe pozície prvku v periodickom systéme napíšte jeho zlúčeniny, ktoré sú uvedené nižšie:
26. Z vyššie uvedeného zoznamu prvkov: BE, B, C, N, AL, SI, P, S, GA, GE, AS, BR - EO2 typu oxidy formy a hydridy typu A4 -.
27. Na základe pozície prvku v periodickom systéme vydávajú vzorce pre svoj najvyšší oxid a hydroxid a označte ich povahu:
28. Prvok s poradovým číslom 34 tvorí zlúčeninu vodíka, vyšší oxid a hydroxid. Ten sa prejavuje
(1) Kyselinové vlastnosti;
(2) základné vlastnosti;
(3) amfotérne vlastnosti.
29. Maximálny počet chemických prvkov, ktoré môžu vyplniť šiesty obdobie periodického systému, by sa mali rovnať
(1) 8; (2) 18; (3) 32; (4) 50.
30. Maximálny počet položiek v sedemnárode by mal byť
(1) 18; (2) 32; (3) 50; (4) 72.
31. V siedmej dobe musí byť tento prvok prvkom sekvenčného čísla
(1) 118; (2) 114; (3) 112; (4) 110.
32. Vlastnosti alkalických kovov by sa mali očakávať od prvkov s poradovými číslami
(1) 111 a 190; (2) 119 a 169; (3) 137 a 187; (4) 155 a 211.
33. Konfigurácia bizmutových orbitálov valenčných elektrónov sa zhoduje s
(1) selén a telurium;
(2) dusík a fosforu;
(3) silikón a germánik;
(4) Niobium a tanthal.
34. Prvok s poradovým číslom 117 by mal byť pripisovaný
(1) lamas alkalických kovov; (3) halogén;
(2) kovy alkalických zemín; (4) Prechodné prvky.
35. Maximálna valencia olova v zmesi kyslíka je:
(1) II; (2) IV; (3) VI; (4) VIII.
36. Typ orbitálov valentných elektrónov v Indii sa zhoduje s
(1) AM a FR; (2) PB a SN; (3) al a GA; (4) CU a AG.
37. Titan odkazuje na
(1) s.-; (2) p. \\ t-; (3) d.-; (4) f.- prvky.
38. Maximálna valencia brómu v zmesi kyslíka
(1) I; (2) III; (3) V; (4) VII.
39. Siedme obdobie systému prvkov musí ukončiť prvku sekvenčným číslom
(1) 108; (2) 110; (3) 118; (4) 128.
40. Uhol medzi väzbami H-E je najväčší v molekule pripojenia
(1) h2, (2) H 2 SE; (3) H 2S; (4) H 2 O.
41. V rade K-CA-SC-Ti sa polomer atómov (znižuje sa, zvyšuje).
42. Energia, ktorá je špecifikovaná v SL ° (G.) → CL + rovnica (G.) + E - 1254 kJ, je pre atóm chlóru
(1) Energia chemickej väzby;
(2) ionizačná energia;
(3) elektronickygitateľnosť;
(4) Afinita k elektrónu.
43. Afinita pre elektrón sa nazýva
(1) Energia potrebná na oddelenie elektrónu z neostupovaného atómu;
(2) schopnosť atómu tejto položky oneskoriť hustotu elektrónov;
(3) prechod elektrónov na vyššiu úroveň energie;
(4) Energia izolácia, keď je elektrón pripojený k atómu alebo iónu.
44. Ktorý z prvkov je najväčšou hodnotou ionizačnej energie:
(1) li; (2) F; (3) FE; (4) I?
45. energia vynaložená na odstránenie jedného elektrónu z atómu prvku v plynnom stave, v horčíku
(1) menej ako sodík a viac ako hliník;
(2) viac ako sodík a menšie ako hliník;
(3) menšie ako sodík a hliník;
(4) Viac ako sodný a hliník.
46. \u200b\u200bNa základe analýzy elektronických štruktúr atómov a pozícií prvkov v periodickom systéme špecifikujú, ktorý z každých dvoch atómov nižšie má väčšiu afinitu k elektrónu:
(1) draslík alebo vápnik;
(2) síra alebo chlór;
(3) vodík alebo lítium?
47. Chemické prvky sa nachádzajú v poradí zvyšujúcej sa elektronibility v rade
(1) Si, P, SE, RR, SL, O; (2) Si, p, R, SE, C1, O;
(3) P, Si, FRA, SE, C1, O; (4) SE, SI, P, R, C1, O.
48. Čo sa nachádza množstvo prvkov, keď zvyšujú ich atómové polomery:
(1) Na, mg, al, si; (3) O, S, SE, tí;
(2) C, O, N, F; (4) I, Br, C1, F?
49. V rade alkalického kovu (z LI na CS) je CESION najmenej elektronegatívne. To je vysvetlené tým, čo má
(1) najväčší počet neutrónov v jadre;
(2) väčší počet varných elektrónov v porovnaní s inými prvkami;
(3) veľká atómová hmota;
(4) Valentované elektróny, do najväčšieho stupňa odstráneného z jadra atómu.
50. Isoelektronika s názvom ióny, ktoré majú rovnaký počet elektrónov a rovnakú štruktúru vonkajšej úrovne elektrónov. Ióny asi 2-, F -, NA +, Mg2 +, A1 3+ majú elektronickú konfiguráciu NOO NOO a sú usporiadané vo vzostupnom poradí atómových hmôt prvkov. Zároveň ich ión Radii
(1) prakticky sa nemenia;
(2) Zníženie;
(3) zvýšenie;
(4) Zníženie, potom sa zvýšiť.
51. Príklad ne-polárnej molekuly, ktorá má polárne kovalentnú väzbu
(1) N2; (2) H20; (3) NH3; (4) CCL4.
52. Z vyššie uvedených molekúl: H2, O2, H20, C02, CH4, H2 S - Polárny.
53. V ktorom zo zlúčenín medzi atómami sa vytvorí kovalentná väzba na mechanizme prijímača darcovstva:
(1) ks; (2) NH4CI; (3) CCI4; (4) CO 2?
54. Valentálne orbitály atómu berýlia v hydridovej molekule berýlium hybridizovaného podľa typu
(1) sp.; (2) sp 2.; (3) sP 3.;(4) d 2 SP 3,
a molekula má štruktúru:
55. Valentálne orbitály atómu bóru v molekule TF3 sú hybridizované podľa typu
(1) sp.; (2) sp 2.; (3) sP 3.;(4) d 2 SP 3,
a molekula má štruktúru:
a) lineárny; c) tetrahedral;
b) byt; (d) Otahedral.
56. Prítomnosť štyroch ekvivalentných väzieb C - H v metánovej molekule je vysvetlená tým, že
(1) Vzájomné odpudzovanie štyroch elektronických párov sa vyskytuje;
(2) Atóm uhlíka hybridizovaný za vzniku štyroch sP 3.orbitály;
(3) Atóm uhlíka má jeden s.- a tri ročník- valencia elektrón;
(4) Atóm uhlíka má dve S- a dve ročník- valencia elektrón.
Odpovede:
1. (4) Počet elektrónov na vonkajšej úrovni energie.
(1) S poklesom atómového polomeru a zvýšenia elektronickejgativity atómu.
3. (1) sodík, 11.
4. (1) Elektrony na vonkajšej elektronickej úrovni.
5. (1) AS, SE, CL, F.
(3) Kovové vlastnosti prvkov oslabuje.
(3) Prvky 24, 39, 74, 80. \\ T
8. (4) Strontia, SR.
9. (1) v hornej časti podskupiny.
10. (1) O, S, SE, tí.
11. (2) Zvýšenie.
12. (1) Zníženie.
14. (2) Bárím.
16. (2) Zvýšenie.
18. (3) Z 2 O 5.
20. (4) chlór.
22. (2) Nemecko.
23. (2) od kyseliny až po hlavnú.
26. EO2 Oxidy typu C, SI, GE a hydridov typu AN 4 - C, SI, GE.
28. H2S, SEO 3 a H2 SEO 4. (1) Kyslé vlastnosti.
32. (2) 119 a 169.
33. (2) dusík a fosforu.
34. (3) halogény.
36. (3) AL a GA.
37. (3) d.- prvky.
41. Zníženie.
42. (2) Ionizačná energia.
43. (4) Energia izolácia, keď je elektrón pripojený k atómu alebo iónu.
45. (4) Viac ako sodík a hliník.
46. \u200b\u200b(1) draslík; (2) chlór; (3) vodík.
47. (1) Si, P, SE, WR, SL, O.
48. (3) O, S, SE, tí.
49. (4) Vhodné elektróny, do najväčšieho stupňa odstráneného z jadra atómu.
50. (2) Zníženie.
52. H20, H2 S.
53. (2) NH4CI.
54. (1) sp., a) lineárne.
55. (2) sp 2., b) byt.
56. (2) Atóm uhlíka je hybridizovaný s tvorbou štyroch sP 3.orbitáty.
Úlohy pre jednotlivé odhadované grafické práce:
Pre prvok s poradovým číslom rovným počtu možností na vykonávanie nasledujúcich výpočtov:
1. Napíšte elektronický vzorec prvku a graficky vyplňte elektrónmi všetkých atómových orbitálov.
3. Určite hmotnosť jedného atómu prvku a jeho objem.
4. Určite hmotnosť jednej molekuly jednoduchej látky prvku.
5. Na základe pozície prvku v PS uvádza možné stupne oxidácie atómu prvku v spojení s inými prvkami.
6. Napíšte oxidový vzorec, chlorid, hydrid, sulfid.
8. Vypočítajte dĺžku dipólu pripojenia vodíka a kyslíka prvku.
9. Vedro na dotyk v molekule jednoduchej látky prvku pomocou metódy SUN.
10. Vedro do molekuly jednoduchej látky prvok pomocou energetickej schémy metódy MO, špecifikujte multiplicity komunikácie a napíšte vzorec.
11. Uveďte typ hybridizácie atómu prvku v molekulách všetkých možných oxidov (v prípade kyslíka - molekuly vodíkových spojení).
12. Uveďte všetky typy dlhopisov (σ, π, ô) v oxidových molekulách (v prípade zlúčenín kyslíka - vodík).
13. Uveďte hodnoty uhlov valencie v molekulách oxidov (v prípade molekúl kyslíka - vodíkových zlúčenín).
14. Uveďte formu oxidových molekúl (v prípade molekúl kyslíka - vodíkových zlúčenín).
15. Vypočítajte energiu iónovej zlúčeniny AV a energie interakcie iónov A + a B.
Pre možnosti 1, 5, 6, 7, 8, 9, 14, 15, 16, 17: A - draslík, B je prvok s poradovým číslom rovným číslom prvku.
Pre možnosti 3, 4, 11, 12, 13, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28: B - chlór, prvok s poradovým číslom rovným číslom prvku.
Pre možnosti 2, 10, 18: A - Prvok s poradovým číslom rovným (verzia +1), B je prvok so sekvenčným prvkom rovným (voliteľným -1).
Literatúra.
1. Kulman A.G. Zbierka úloh pre všeobecnú chémiu, ed. 2., rekreácia. A pridať. - M.: Vyššie. SHK. 1975.
2. MASLOV E.I. , Holboray Z.E. Zbierka úloh a cvičení v chémii, 5. ed., Ererab. a doplnok.: Vyššie. SHK. 1997.
Atómové číslo prvku ukazuje:
a) počet základných častíc v atóme; b) počet nukleónov v atóme;
c) počet neutrónov v atóme; d) počet protónov v atóme.
Najspravom je vyhlásenie, že chemické prvky v PSE sú usporiadané vo vzostupnom poradí:
a) absolútna hmotnosť ich atómov; b) relatívna atómová hmota;
c) počet nukleónov v atómových jadrách; d) náboj atómového jadra.
Výsledkom je frekvencia pri zmene vlastností chemických prvkov:
a) Zvýšte počet elektrónov v atómoch;
b) zvýšenie obvinení z atómových jadier;
c) zvýšenie atómovej hmotnosti;
d) Periodicita v zmene elektronických štruktúr atómov.
Nižšie uvedených charakteristík sa atómy elementu periodicky zmenia, pretože sa pestujú poradové číslo prvku:
a) počet úrovní energie v atóme;
b) relatívna atómová hmota;
c) počet elektrónov na úrovni vonkajšej energie;
d) náboj jadier atómov.
Vybrať páry, v ktorých každá charakteristika atómu sa pravidelne líši so zvýšením protónového čísla prvku:
a) energia ionizácie a energie elektrónovej afinity;
b) polomer a hmotnosť;
c) elektronegativita a celkové elektróny;
d) Kovové vlastnosti a počet valenčných elektrónov.
Vyberte správne schválenie prvkovV.Skupina:
a) Všetky atómy majú rovnaký počet elektrónov;
b) všetky atómy majú rovnaký polomer;
c) všetky atómy majú rovnaký počet elektrónov na vonkajšej vrstve;
d) všetky atómy majú maximálnu valenciu rovnajúcu sa číslom skupiny.
Niektoré prvky má nasledujúce konfiguráciu elektrónov:ns. 2 (n.-1) d. 10 np. 4 . V ktorej skupine periodického systému je tento prvok?
a) skupina IVT; b) viv skupiny; c) skupina IVA; d) cez skupinu.
V období PSE s rastúcimi obvineniami atómových jadiernie Zmeny: a) hmotnosť atómov; b) počet elektronických vrstiev; c) počet elektrónov na vonkajšej elektronickej vrstve; d) polomer atómov. |
|
V akom riadkovom chemických prvkoch sa nachádzajú v poradí zvyšovania ich atómového polomeru? a) Li, BE, B, C; b) BE, Mg, CA, SR; c) n, o, f, ne; d) Na, mg, al, SI. |
|
Najnižšia ionizačná energia medzi stabilnými atómami: a) lítium; b) Barry; c) cézium; d) sodík. |
|
Elektrická energia prvkov sa zvyšuje v rade: a) p, si, s, o; b) CL, F, S, O; c) te, SE, s, o; d) O, S, SE, TE. |
|
V rade prvkovNa. Mg. Al Si P. \\ t S. Cl. Zľava doprava: a) Zvyšuje elektronickú hmotnosť; b) Energia ionizácie klesá; c) Počet sa zvyšuje počtu valenčných elektrónov; d) Zníženie vlastností kovov. |
|
Zadajte najaktívnejší kov štvrtého obdobia: a) vápnik; b) draslík; c) chróm; d) zinok. |
|
Zadajte najaktívnejšiu skupinu IIA: a) beryllium; b) Barry; c) horčík; d) vápnik. |
|
Zadajte najaktívnejšiu skupinu NonMetall VIIA: a) jód; b) bróm; c) fluór; d) chlór. |
|
Vyberte správne vyhlásenia: a) v IA-VIII, iba prvky S- a b) v skupinách IV-VIIIV existujú len D-prvky; c) všetky D-prvky sú kovy; d) Celkový počet prvkov S v PSE je 13. |
|
S nárastom atómového počtu prvku v skupine VA: a) kovové vlastnosti; b) počet úrovní energie; c) celkový počet elektrónov; d) počet varných elektrónov. |
|
P-prvky označujú: a) draslík; b) sodík; c) horčík; d) arzén. |
|
Ktorú rodinu prvkov je hliník? a) S-prvky; b) p-prvky; c) D-prvky; d) F-prvky. |
|
Zadajte sériu, v ktorej sú lend.- prvky: a) al, SE, LA; b) Ti, GE, SN; c) ti, v, cr; d) La, CE, HF. |
Aký riadok ukazuje znaky prvkov S, P a D-rodiny? a) h, on, li; b) H, BA, AL; c) byť, c, f; d) mg, p, cu. |
|
Atom, ktorého prvok obdobia IV obsahuje najväčší počet elektrónov? a) zinok; b) chróm; c) bróm; d) Krypton. |
|
Pri atóme toho prvku sú elektróny vonkajšej úrovne energie najťažšie pripojené k jadru? a) draslík; b) uhlík; c) fluór; d) Francúzsko. |
|
Sila príťažlivosti valenčných elektrónov do jadra atómu klesá na niekoľko prvkov: a) Na, mg, al, si; b) Rb, K, Na, Li; c) sr, ca, mg, byť; d) Li, Na, K, Rb. |
|
Prvok s poradovým číslom 31 je: a) v skupine III; b) malé obdobie; c) veľké obdobie; d) v skupine A. |
|
Z nasledujúcich elektronických vzorcov vyberte tie, ktoré zodpovedajú p-prvkamiV. Obdobie: a) 1s 2 2s 2 2P6 3S 2 3P6 3D 1 4s 2 4P6 4D 1 5s 2 5P1; b) 1s 2 2s 2 2P6 3S 2 3P6 3D 1 4S 2 4P 6 5S 2; c) 1s 2 2s 2 2P6 3s 2 3P6 3D 1 4s 2 4P2; d) 1s 2 2s 2 2P6 3S 2 3P6 3D 1 4S 2 4P 6 4D 1 5s 2 5P6. |
|
Z vyššie uvedených elektronických vzorcov vyberte tie, ktoré zodpovedajú chemickým prvkom tvoriacim najvyšší oxid kompozície 2 O 3 : a) 1s 2 2s 2 2P6 3S 2 3P 1; b) 1s 2 2s 2 2P6 3S 2 3P6 3D 1 4s 2 4P3; c) 1S 2 2s 2 2P6 3S 2 3P6 3D 1 4S 2; d) 1s 2 2s 2 2P 6 3s 2 3P6 3D 3 4s 2. |
|
Určite prvok, ktorého atóm obsahuje na 4P-pylóne 4 elektrónu. Aké obdobie a skupina je? a) Arzén, IV obdobie, skupina VA; b) Tell, V období, prostredníctvom skupiny; c) obdobie selénu, IV, cez skupinu; d) volfrám, obdobie VI, skupina VIB. |
Atómy vápnika a scandium sa navzájom líšia: a) počet úrovní energie; b) polomer; c) počet elektrónov valencií; d) vzorec vyššieho oxidu. |
|
Pre atómy síry a chrómu rovnakým spôsobom: a) počet varných elektrónov; b) počet úrovní energie; c) najvyššia valencia; d) vzorec vyššieho oxidu. |
|
Atómy dusíka a fosforu majú: a) rovnaký počet elektronických vrstiev; b) rovnaký počet protónov v jadre; c) rovnaký počet varných elektrónov; d) identické polomery. |
|
Vzorec vyššieho oxidu periódy prvku III, v atóme, ktorého je v podstate stav obsahuje tri nepárové elektróny: a) e 2 o 3; b) eo 2; c) E 2 O 5; d) E 2 O 7. |
|
Vzorec vyššieho oxidového prvku EO3. Uveďte vzorec jeho zlúčeniny vodíka: a) en 2; b) en; c) en 3; d) en 4. |
|
Povaha oxidov z hlavného kyslosti sa líši v poradí: a) Na2O, MgO, SiO 2; b) Cl 2O, SO 2, p 2O 5, NO2; c) Beo, MgO, B2O3, Al203,; d) CO 2, B 2O, al2O3, li2O; e) Sao, Fe 2 o 3, Al 2 O 3, SO 2. |
|
Vyberte riadky, v ktorých sú vzorce usporiadané vo vzostupnom poradí podľa kyselinových vlastností zlúčenín: a) N2O5, p2O5, ako 2O 5; c) H2 SEO 3, H2S03, H2S04; b) HF, HBr, Ahoj; d) Al203, P205, Cl 2O 7. |
|
Zadajte sériu, v ktorej sú usporiadané hydroxidy, aby sa zvýšila ich hlavné vlastnosti: a) liok, KOH, NaOH; c) LiOH, CA (OH) 2, AL (OH) 3; b) LiOH, NaOH, Mg (OH) 2; d) LiOH, NaOH, KOH. |
Úlohy
Vzorka fosforu obsahuje dva nuklidu: fosforu-31 a fosforu-33. Molárna frakcia fosforu-33 je 10%. V tejto vzorke vypočítajte relatívnu atómovú hmotnosť fosforu.
Prírodná meď pozostáva z nuklidov Cu 63 a Cu 65. Pomer počtu atómov Cu 63 k počtu atómov Cu 65 v zmesi je 2,45: 1,05. Vypočítajte relatívnu atómovú hmotnosť medi.
Priemerná relatívna atómová hmota prírodného chlóru je 35,45. Vypočítajte molárne frakcie svojich dvoch izotopov, ak je známe, že ich hmotnostné čísla sú rovné 35 a 37.
Vzorka kyslíka obsahuje dva nuklid: 16 0 a 180, ktorých hmotnosti sú zodpovedajúcim spôsobom 4,0 g a 9,0 g. Určite relatívnu atómovú hmotnosť kyslíka v tejto vzorke.
Chemický prvok pozostáva z dvoch nuklidov. Jadro prvého nuklidu obsahuje 10 protónov a 10 neutrónov. V jadre druhého nuklidu neutrónov o 2 ďalšie. Na 9 atómoch ľahšieho nuklidu predstavuje jeden atóm ťažšieho nuklidu. Vypočítať priemernú atómovú hmotnosť prvku.
Aká relatívna atómová hmota by mala kyslík, ak v prírodnej zmesi pre každý 4 kyslík ATOM-16 predstavoval 3 atómy kyslíka-17 a 1 kyslík ATOM-18?
Odpovede:1. 31,2. 2. 63,6. 3. 35 Cl: 77,5% a 37 Cl: 22,5%. 4. 17,3. 5. 20,2. 6. 16,6.
Chemická komunikácia
Hlavný objem vzdelávacieho materiálu:
Príroda a typy chemických väzieb. Hlavné parametre chemickej väzby: energie, dĺžka.
Kovalentné pripojenie. Výmenné a darcovské mechanizmy na vytvorenie kovalentnej komunikácie. Smer a nasýtenie kovalentnej väzby. Polarita a polarizovateľnosť kovalentnej väzby. Ocenenie a stupeň oxidácie. Valentálne schopnosti a valentné podmienky atómov prvkov skupín. Jednočné a viac odkazov. Atómové kryštálové mriežky. Koncepcia hybridizácie atómových orbitálov. Hlavné typy hybridizácie. Rohy väzieb. Priestorová štruktúra molekúl. Empirický, molekulárny a konštrukčný (grafický) vzorca molekúl.
Iónová komunikácia. Iónové kryštálové mriežky. Chemické vzorce látok s molekulovou, atómou a iónovou štruktúrou.
Kovová komunikácia. Kryštálové kovy mriežky.
Intermolekulárnej interakcie. Molekulárna kryštalická mriežka. Energie intermolekulárnej interakcie a agregovaného stavu látok.
Vodíková väzba.Hodnota vodíkových väzieb v prírodných objektoch.
V dôsledku štúdie by mali študenti vedieť:
Čo je chemický vzťah;
hlavné typy chemických väzieb;
kovalentné mechanizmy vzdelávania komunikácie (výmena a darcom-akceptor);
hlavné charakteristiky kovalentnej väzby (saturácia, smer, polarita, multiplikátnosť, S- a P-komunikácie);
hlavné vlastnosti iónových, kovových a vodíkových väzieb;
hlavné typy krištáľových mriežok;
ako sa mení dodávka energie a povaha molekúl v prechodnom stave z jedného agregátu do druhého;
to, čo sa rozlišujú látkami, ktoré majú kryštalickú štruktúru z látok, ktoré majú amorfnú štruktúru.
V dôsledku štúdia témy by študenti mali získať zručnosti:
definície typu chemickej väzby medzi atómami v rôznych zlúčeninách;
porovnanie sily chemických väzieb svojou energiou;
stanovenie stupňov oxidácie vzorcami rôznych látok;
vytvorenie geometrického tvaru niektorých molekúl založených na teórii hybridizácie atómových orbitálov;
predpovedanie a porovnanie vlastností látok v závislosti od povahy vzťahu a typu kryštálovej mriežky.
Po dokončení témy by študenti mali mať prezentáciu:
- na priestorovej štruktúre molekúl (smer kovalentnej väzby, uhol valencie);
- Na teóriu hybridizácie atómových orbitálov (SP3 -, SP2 -, SP-Hybridizácia)
Po štúdiu témy by si študenti mali pamätať:
s konštantným stupňom oxidácie;
zlúčeniny vodíka a kyslíka, v ktorých tieto prvky nie sú charakteristické, že stupeň oxidácie;
rozsah uhla medzi pripojeniami vo vodnej molekule.
Časť 1. Príroda a typy chemikálií
Formuláry látok sú uvedené: Na20, SO3, KCl, PCL3, HCl, H2, Cl2, NaCl, C02, (NH4) 2S04, H202, CO, H 2 S, NH4CI, SO 2, HI, Rb 2 SO 4, SR (OH) 2, H2 SEO 4, HE, SCCI3, N2, ALBR3, HBR, H2 SE, H20, z 2, CH 4, NH3, Ki, Cabr 2, BAO, NO, FCL, SIC. Vyberte Pripojenia:
molekulárna a nechalastická štruktúra;
len s kovalentnými polárnymi väzbami;
len s kovalentnými nepolárnymi väzbami;
iba s iónovými spojmi;
kombinovanie v štruktúre iónových a kovalentných väzieb;
kombinovanie kovalentných polárnych a kovalentných nepolárnych spojení;
schopné tvoriť vodíkové väzby;
mať v štruktúre komunikácie tvorenej mechanizmom akceptorov darcu;
Ako sa polarita pripojení v poradí?
a) H20; H 2S; H 2 SE; H 2 TE B) pH 3; H 2S; HCL.
V akom stave je hlavná alebo vzrušená - v nasledujúcich pripojeniach sú atómy izolovaných prvkov:
B.Cl3; P. \\ tCl3; SiO 2; Byť.F 2; H2. S.; C.H4; H. Cl.O 4?
Aký pár týchto prvkov v chemickej interakcii má maximálnu tendenciu vytvárať iónová komunikácia:
CA, C, K, O, I, CL, F?
V ktorom z nižšie uvedených chemikálií, bude prasknutie dlhopisu s väčšou pravdepodobnosťou postupovať s tvorbou iónov, a v ktorom sa vytvárajú voľné radikály: NaCl, Cs2, CH4, K2O, H2S04, KOH, CL2?
Dana Halogénové plemená: HF, HCL, HBR, Ahoj. Vyberte si halogénovú záhradu:
vodný roztok je najsilnejšia kyselina (najslabšia kyselina);
s najviac polárnou väzbou (najmenej polárnou väzbou);
s najvyššou dĺžkou komunikácie (s najnižšou komunikačnou dĺžkou);
s najväčším bodom varu (s najmenším bodom varu).
Pri vytváraní jednej chemickej väzby sa fluór fluór uvoľní 2,64 '
10 -19 J energie. Vypočítajte, aký chemický počet molekúl fluóru by sa mal tvoriť, aby sa rozlíšil 1,00 kJ energie.
Skúška 6.
Keď je molekula vytvorená z dvoch izolovaných atómov, energie v systéme: a) sa zvyšuje; b) klesá; c) sa nemení; d) možné zníženie a zvýšenie energie. |
|
Uveďte, v akom pároch látok sú všeobecné elektronické páry posunuté smerom k atómu kyslíka: a) 2 a CO; b) CL2O a nie; c) H20 a N2O3; d) H202 a 02F2. |
|
Zadajte pripojenia s kovalentným nepolárnym pripojením: a) o 2; b) n2; c) CL2; d) PCL 5. |
|
Zadajte pripojenia s kovalentnou polárnou väzbou: a) H20; b) br 2; c) Cl 2O; d) SO 2. |
|
Vyberte si pár molekúl, všetky odkazy, v ktorých sú kovalentné: a) NaCl, HCl; b) CO 2, Na20; c) CH3CI, CH3 Na; d) SO 2, č. 2. |
|
Pripojenia s kovalentnou polárnou a kovalentnou non-polárnou komunikáciou sú: a) voda a sírovodík; b) draslík bromidu a dusík; c) amoniak a vodík; d) kyslík a metán. |
|
Žiadna z kovalentných dlhopisov nie je tvorená mechanizmom akceptorov darcu v časticiach: a) CO 2; b) čo; c) bf 4 -; d) NH 4 +. |
|
Ako rozdiel v elektrickej negatívnej negatívnej atómov nastáva: a) zníženie polarity komunikácie; b) posilnenie polarity komunikácie; c) zvýšenie stupňa iónovej komunikácie; d) Zníženie stupňa iónovej komunikácie. |
|
V ktorom riadku molekúl sa nachádza v poradí zvyšovania polarity komunikácie? a) HF, HCl, HBr; b) NH3, pH 3, popol 3; c) H2 SE, H 2S, H20; d) CO 2, CS 2, CSE 2. |
|
Najväčšia väzbová energia v molekule: a) h 2 te; b) H 2 SE; c) H 2S; d) H 2 O. |
|
Chemická väzba je najmenej trvanlivá v molekule: a) brómodorod; b) chlorid; c) jódodorodor; d) fluoroodorod. |
|
Dĺžka komunikácie sa zvyšuje v rade látok s vzorcami: a) CCI4, CBR4, CF4; b) SO 2, SEO 2, TEO 2; c) H2S, H20, H2 SE; d) HBr, HCl, HF. |
|
Maximálny počets.- Komunikácia, ktorá môže existovať medzi dvoma atómami v molekule: a) 1; b) 2; v 3; d) 4. |
|
Trojité spojenie medzi týmito dvoma atómami zahŕňa: a) 2 S-väzby a 1 n-väzbu; b) 3 s komunikácia; c) 3 π-väzby; d) 1S komunikácia a 2π-väzby. |
|
Molekula S. 2 Obsahuje chemické odkazy: a) 1s a 1π; b) 2s a 2π; c) 3s a 1π; d) 4s. |
|
Sumas.- I.π- pripojenia (s. + π) v molekuleTakže. 2 Cl. 2 rovná: a) 3 + 3; b) 3 + 2; c) 4 + 2; d) 4 + 3. |
|
Zadajte pripojenia s iónovou väzbou: a) chlorid sodný; b) oxid uhličitý (ii); c) jód; d) draslík dusičnanu. |
|
Iba iónová komunikácia podporuje štruktúru látky: a) peroxid sodný; b) zaradené vápno; c) medené sipop; d) sylvinit. |
|
Uveďte atóm, z ktorého prvok sa môže zúčastniť na tvorbe kovu a iónovej komunikácie: a) ako; b) br; c) k; d) SE. |
|
Najvýraznejší charakter iónovej komunikácie v zlúčenine: a) chlorid vápenatý; b) fluorid draselný; c) fluorid hlinitý; d) chlorid sodný. |
|
Uveďte látky, ktoré je agregovaný stav, ktorého za normálnych podmienok stanoví vodíkové väzby medzi molekulami: a) vodík; b) chlorid; c) kvapalná fluórová záhrada; d) voda. |
|
Zadajte najodolnejšiu vodíkovú väzbu: a) -n .... H-; b) -O .... H-; c) -Cl .... H-; d) -s .... H-. |
|
Aký chemický vzťah je najmenej silný? a) kov; b) iónové; c) vodík; d) kovalentný. |
|
Uveďte typ komunikácie v molekule NF 3 : a) iónový; b) non-polárny kovalentný; c) polárny kovalentný d) vodík. |
|
Chemická väzba medzi atómami prvkov so sekvenčnými číslami 8 a 16: a) iónový; b) kovalentný polárny ľad; c) kovalentné nepolárne; d) vodík. |
|
Periodický zákon.
Stavebný atóm
Článok prezentuje testovacie úlohy na tému testovacích úloh vypracovaných autormi pre tematickú kontrolu v 8. ročníku. (Banková kapacita - 80 úloh pre každú zo šiestich tém študovaných v 8. ročníku a 120 úloh na tému "Základná trieda anorganických zlúčenín".) V súčasnej dobe, školenia chémie v 8. ročníku sa vykonáva na deviatich učebniciach. Na konci článku je preto uvedený zoznam kontrolovaných prvkov vedomostí označujúci čísla úloh. To umožní učiteľom pracovať v rôznych programoch, aby si vybrali vhodnú postupnosť úloh z jednej témy a súbor kombinácií testovacích úloh z rôznych tém vrátane konečnej kontroly.
Navrhované 80 testovacích úloh sú zoskupené o 20 otázok v štyroch možnostiach, v ktorých sa opakujú podobné úlohy. Na kompiláciu viacerých možností zo zoznamu poznatkov, vyberte (náhodne) čísla úloh pre každú študovanú položku v súlade s vaším tematickému plánovaniu. Takáto prezentácia úloh pre každú tému vám umožňuje stráviť rýchly prvok analýzu chýb a ich včasnú korekciu. Použitie podobných úloh v jednom uskutočnení, striedanie jednej alebo dvoch správnych odpovedí znižuje pravdepodobnosť uhádnutia odpovede. Zložitosť problémov spravidla sa zvyšuje od 1. a 2. možnosti na 3. a 4. možnosti.
Existuje názor, že testy sú "hádať". Navrhujeme, aby ste skontrolovali, či je. Po testovaní porovnávajte výsledky so značkami. Ak sú výsledky testov nižšie, možno vysvetliť nasledujúcimi dôvodmi.
Po prvé, taký (test) je pre študentov nezvyčajné. Po druhé, učiteľ kladie dôraz na štúdium témy (určenie hlavného v obsahu metodiky vzdelávania a vyučovania).
možnosť 1
Úloh.
1. V 4. minúte, cez skupinu je prvok s poradovým číslom:
1) 25; 2) 22; 3) 24; 4) 34.
2. Prvok s nábojom jadra ATOM +12 má poradové číslo:
1) 3; 2) 12; 3) 2; 4) 24.
3. Sekvenčné číslo prvku zodpovedá týmto vlastnostiam:
1) náboj jadier atómov;
2) počet protónov;
3) počet neutrónov;
4. Šesť elektrónov na úrovni vonkajšej energie na atómoch prvkov so číslom skupiny:
1) II; 2) III; 3) VI; 4) IV.
5. Vzorec vyššieho oxidu chlóru:
1) SL 2 O; 2) Cl 2O3;
3) Cl 2O 5; 4) Cl 2O 7.
6. Vhodnotenie atómu hliníka je:
1) 1; 2) 2; 3) 3; 4) 4.
7. Celkový vzorec prchavých vodíkových zlúčenín prvkov skupiny VI:
1) EN 4; 2) EN 3;
3) ne; 4) H2 E.
8. Počet vonkajšej elektronickej vrstvy v atóme vápnika:
1) 1; 2) 2; 3) 3; 4) 4.
9.
1) li; 2) Na; 3) k; 4) CS.
10. Zadajte prvky-kovy:
1) k; 2) cu; 3) o; 4) N.
11. Kde sa nachádzajú v tabuľke D.I. Imeleeva, prvky sa nachádzajú, ktorých atómy v chemických reakciách dávajú len elektróny?
1) v skupine II;
2) na začiatku 2. obdobia;
3) V polovici 2. obdobia;
4) V skupine VIA.
12.
2) VE, Mg; Al;
3) Mg, CA, SR;
13. Zadajte nemejové prvky:
1) Cl; 2) s; 3) Mn; 4) mg.
14. Nekovové vlastnosti Zvýšenie riadku:
15. Aké sú charakteristiky atómov sa pravidelne mení?
1) nabíjanie jadra atómu;
2) počet úrovní energie v atóme;
3) počet elektrónov na úrovni vonkajšej energie;
4) Počet neutrónov.
16.
1; 2) al; 3) p; 4) Cl.
17. V období s nárastom nábytok jadra, polomery atómov prvkov:
1) Zníženie;
2) sa nemenia;
3) zvýšenie;
4) Pravidelne sa mení.
18. Izotopy atómov jedného prvku sa líšia:
1) počet neutrónov;
2) počet protónov;
3) Počet elektrónov valencie;
4) ustanovenie v tabuľke D.I. IMENDEEVA.
19. Počet neutrónov v jadre Atom 12 s:
1) 12; 2) 4; 3) 6; 4) 2.
20. Distribúcia elektrónov energetickými hladinami v atóme fluóru:
1) 2, 8, 4; 2) 2,6;
3) 2, 7; 4) 2, 8, 5.
Možnosť 2.
Úloh. Vyberte jednu alebo dve správne odpovede.
21. Prvok s poradovým číslom 35 je v:
1) 7. obdobie, IVA skupina;
2) 4. obdobie, VIIA Skupina;
3) 4. obdobie, viib skupina;
4) 7. obdobie, skupina IVB.
22. Prvok s nábojom jadra ATOM +9 má poradové číslo:
1) 19; 2) 10; 3) 4; 4) 9.
23. Počet protónov v neutrálnom atóme sa zhoduje s:
1) počet neutrónov;
2) atómová hmota;
3) poradové číslo;
4) Počet elektrónov.
24. Päť elektrónov na úrovni vonkajšej energie na atómoch prvkov so číslom skupiny:
1) I; 2) III; 3) V; 4) VII.
25. Vzorec vyššieho oxidu dusíka:
1) N 2O; 2) N2O3;
3) N2O5; 4) Nie;
26. Vhodnotenie atómu vápnika v jeho najvyššom hydroxide sa rovná:
1) 1; 2) 2; 3) 3; 4) 4.
27. Vhodnotenie atómu arzénu vo svojej vodíkovej zlúčenine je:
1) 1; 2) 2; 3) 3; 4) 4.
28. Počet vonkajšej elektronickej vrstvy v atóme draslíka:
1) 1; 2) 2; 3) 3; 4) 4.
29. Najväčší polomer atómu z prvku:
1) B; 2) o; 3) C; 4) N.
30. Zadajte prvky-kovy:
1; 2) H; 3) F; 4) cu.
31. Atómy prvkov, ktoré sú schopné užívania a poskytovať elektróny, sú umiestnené:
1) v skupine IA;
2) vo VIA skupine;
3) na začiatku 2. obdobia;
4) Na konci 3. obdobia.
32.
1) Na, K, Li; 2) Al, Mg, Na;
3) p, s, сl; 4) Na, mg, al.
33. Zadajte nemejové prvky:
1) Na; 2) mg; 3) SI; 4) P.
34.
35. Hlavná charakteristika chemického prvku:
1) atómová hmotnosť;
2) náboj jadra;
3) počet úrovní energie;
4) Počet neutrónov.
36. Symbol prvku, ktorého atómy tvoria amfotérny oxid:
1) n; 2) K; 3) s; 4) Zn.
37. V hlavných podskupinách (a) periodického systému chemických prvkov so zvýšením nábytku jadra, polomer ATOM:
1) Zvýšenie;
2) klesá;
3) sa nemení;
4) Pravidelne sa mení.
38. Počet neutrónov v jadre atómu je:
1) počet elektrónov;
2) počet protónov;
3) Rozdiel medzi relatívnou atómovej hmoty a počtom protónov;
4) Atómová hmota.
39. Hydrogen izotopy sa líšia v čísle:
1) elektróny;
2) neutróny;
3) protóny;
4) Pozícia v tabuľke.
40. Distribúcia elektrónov energetickými hladinami v atóme sodíka:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5.
Možnosť 3.
Úloh. Vyberte jednu alebo dve správne odpovede.
41. Zadajte poradové číslo prvku, ktorý sa nachádza v skupine IVA, 4. obdobie stola d.I. IVELEEVA:
1) 24; 2) 34; 3) 32; 4) 82.
42. Náboj jadra atómu prvku číslo 13 je:
1) +27; 2) +14; 3) +13; 4) +3.
43. Počet elektrónov v atóme je:
1) počet neutrónov;
2) počet protónov;
3) atómová hmota;
4) poradové číslo.
44. Atómy prvkov IVA skupiny, počet valenčných elektrónov je:
1) 5; 2) 6; 3) 3; 4) 4.
45. Oxidy so všeobecným vzorcom R203 Form Formom série:
1) Na, K, Li; 2) mg, ca, byť;
3) B, Al, GA; 4) C, SI, GE.
46. Vhodnotenie atómu fosforu v jeho najvyššom oxide je:
1) 1; 2) 3; 3) 5; 4) 4.
47. Vodíkové zlúčeniny prvkov skupiny VIIa:
1) HCLO 4; 2) HCl;
3) hbro; 4) HBr.
48. Počet elektronických vrstiev v atóme Selena je:
1) 1; 2) 2; 3) 3; 4) 4.
49. Najväčší polomer atómu z prvku:
1) li; 2) Na; 3) mg;
50. Zadajte prvky-kovy:
1) Na; 2) mg; 3) SI; 4) P.
51. Atómy, z ktorých prvky ľahko dávajú elektróny?
1) k; 2) Cl; 3) Na; 4) S.
52. Počet prvkov, v ktorých zvyšuje kovové vlastnosti:
1) C, N, B, F;
2) Al, SI, P, Mg;
53. Zadajte nemejové prvky:
1) Na; 2) mg; 3) n; 4) S.
54. Niekoľko prvkov, v ktorých zvyšujú nekovové vlastnosti:
1) Li, Na, K, N;
2) Al, SI, P, Mg;
3) C, N, O, F;
4) Na, Mg, Al, K.
55. S zvýšením nábytku jadra atómu, nekovové vlastnosti prvkov:
1) pravidelne sa zmení;
2) amplifikované;
3) sa nemenia;
4) oslabenie.
56. Symbol prvku, ktorého atómy tvoria amfotérny hydroxid:
1) Na; 2) al; 3) n; 4) S.
57. Vysvetľuje sa frekvencia zmeny vlastností prvkov a ich zlúčenín:
1) opakovanie štruktúry vonkajšej elektronickej vrstvy;
2) zvýšenie počtu elektronických vrstiev;
3) zvýšenie počtu neutrónov;
4) Zvýšenie atómovej hmoty.
58. Počet protónov v jadre atómu sodíka je:
1) 23; 2) 12; 3) 1; 4) 11.
59. Aký je rozdiel medzi atómami izotopov jedného prvku?
1) počet protónov;
2) počet neutrónov;
3) počet elektrónov;
4) poplatok z jadra.
60. Distribúcia elektrónov energetickými hladinami v atóme lítia:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5;
Možnosť 4.
Úloh. Vyberte jednu alebo dve správne odpovede.
61. Prvok s poradovým číslom 29 je v:
1) 4. obdobie, IA skupina;
2) 4. obdobie, skupina IB;
3) 1. obdobia, IA skupina;
4) 5. obdobie, IA skupina.
62. Náboj jadra atómu prvku č. 15 je:
1) +31; 2) 5; 3) +3; 4) +15.
63. Náboj atómového jadra je určený:
1) sekvenčné číslo prvku;
2) číslo skupiny;
3) číslo obdobia;
4) Atómová hmota.
64. Na atómoch III prvkov skupiny je počet valenčných elektrónov:
1) 1; 2) 2; 3) 3; 4) 5.
65. Najvyšší oxid sírku má vzorec:
1) H 2 SO 3; 2) H2S04;
3) SO 3; 4) SO 2.
66. Vzorec vyššieho oxidu fosforu:
1) p 2O3; 2) H 3 PO 4;
3) NRU 3; 4) p 2 O 5.
67. Ocenenie atómu dusíka vo svojej vodíkovej zlúčenine:
1) 1; 2) 2; 3) 3; 4) 4.
68. Číslo obdobia v tabuľke D.I. REPEELEEEEEVA zodpovedá nasledujúcej charakteristike atómu:
1) počet telesných elektrónov;
2) vyššia valencia zlúčeniny s kyslíkom;
3) Celkový počet elektrónov;
4) Počet úrovní energie.
69. Najväčší polomer atómu z prvku:
1) Cl; 2) br; 3) I; 4) F.
70. Zadajte prvky-kovy:
1) mg; 2) li; 3) H; 4) S.
71. V atóme toho, ktorého prvok je ľahšie dávať elektrón?
1) sodík; 2) CESION;
3) draslík; 4) Lítium.
72. Kovové vlastnosti Zvýšenie riadku:
1) Na, mg, al; 2) Na, K, Rb;
3) Rb, K, Na; 4) P, S, Cl.
73. Zadajte nemejové prvky:
1) cu; 2) v; 3) n; 4) Cr.
74. N-P-AS-SB Nekovové vlastnosti:
1) Zníženie;
2) sa nemenia;
3) zvýšenie;
4) Zníženie a potom sa zvýšiť.
75. Aké charakteristiky atómu sa pravidelne mení?
1) relatívna atómová hmota;
2) náboj jadra;
3) počet úrovní energie v atóme;
4) Počet elektrónov na vonkajšej úrovni.
76. Atómy, ktorého prvok tvoria amfotérny oxid?
1; 2) ve; 3) C; 4) SA.
77. V období s nárastom nabitia atómového jadra zvyšuje príťažlivosť elektrónov do jadra a kovových vlastností:
1) amplifikované;
2) pravidelne sa mení;
3) oslabenie;
4) Nemeňte.
78. Relatívna atómová hmota prvku je numericky rovná:
1) počet protónov v jadre;
2) počet neutrónov v jadre;
3) Celkový počet neutrónov a protónov;
4) Počet elektrónov v atóme.
79. Počet neutrónov v jadre atómu 16 o je:
1) 1; 2) 0; 3) 8; 4) 32.
80. Distribúcia elektrónov energetickými hladinami v atóme kremíka:
1) 2, 8, 4; 2) 2, 6;
3) 2, 7; 4) 2, 8, 5.
Zoznam kontrolovaných prvkov vedomostí na tému
"Pravidelné právo. Štruktúra atómu
(V zátvorkách sa dajú prostredníctvom pracovných čísel)
Sekvenčné číslo prvku (1, 3, 21, 41, 61), nabíjanie jadra atómu (2, 22, 42, 62, 63), počet protónov (23) a počet elektrónov (43) v atóme.
Číslo skupiny, elektróny na vonkajšej úrovni energie (4, 24, 44, 64), vyššie oxidové vzorce (5, 25, 45, 65), najvyššia valencia prvku (6, 26, 46, 66), vzorca vodíkových zlúčenín (7, 27, 47, 67).
Číslo obdobia, počet elektronických úrovní (8, 28, 48, 68).
Zmeňte polomer atómu (9, 17, 29, 37, 49, 67, 69).
Pozícia v tabuľke D.I. RemeefeleEVA prvky-kovy (10, 30, 50, 70) a nekovové prvky (13, 33, 53, 73).
Schopnosť atómov zadávať a akceptovať elektróny (11, 31, 51, 71).
Zmena vlastností jednoduchých látok: podľa skupín (12, 14, 34, 52, 54, 74) a období (32, 72, 77).
Periodická zmena elektronickej štruktúry atómov a vlastností jednoduchých látok a ich zlúčenín (15, 35, 55, 57, 75, 77).
Oxidy a hydroxidy AMPHOTERI (16, 36, 56, 76).
Hmotnostné číslo, počet protónov a neutrónov v atóme, izotopy (18, 19, 38, 39, 58, 59, 78, 79).
Distribúcia elektrónov energiou v atóme (20, 40, 60, 80).
Odpovede na testovacie úlohy na tému
"Pravidelné právo. Štruktúra atómu
| možnosť 1 | Možnosť 2. | Možnosť 3. | Možnosť 4. | ||||
|---|---|---|---|---|---|---|---|
| Číslo hľadania | Číslo odozvy | Číslo hľadania | Číslo odozvy | Číslo hľadania | Číslo odozvy | Číslo hľadania | Číslo odozvy |
| 1 | 4 | 21 | 2 | 41 | 3 | 61 | 2 |
| 2 | 2 | 22 | 4 | 42 | 3 | 62 | 4 |
| 3 | 1, 2 | 23 | 3, 4 | 43 | 2, 4 | 63 | 1 |
| 4 | 3 | 24 | 3 | 44 | 4 | 64 | 3 |
| 5 | 4 | 25 | 3 | 45 | 3 | 65 | 3 |
| 6 | 3 | 26 | 2 | 46 | 3 | 66 | 4 |
| 7 | 4 | 27 | 3 | 47 | 2, 4 | 67 | 3 |
| 8 | 4 | 28 | 4 | 48 | 4 | 68 | 4 |
| 9 | 4 | 29 | 1 | 49 | 5 | 69 | 3 |
| 10 | 1, 2 | 30 | 1, 4 | 50 | 1, 2 | 70 | 1, 2 |
| 11 | 1, 2 | 31 | 2, 4 | 51 | 1, 3 | 71 | 2 |
| 12 | 3 | 32 | 2 | 52 | 3 | 72 | 2 |
| 13 | 1, 2 | 33 | 3, 4 | 53 | 3, 4 | 73 | 2, 3 |
| 14 | 1 | 34 | 4 | 54 | 3 | 74 | 1 |
| 15 | 3 | 35 | 2 | 55 | 1 | 75 | 4 |
| 16 | 2 | 36 | 4 | 56 | 2 | 76 | 2 |
| 17 | 1 | 37 | 1 | 57 | 1 | 77 | 3 |
| 18 | 1 | 38 | 3 | 58 | 4 | 78 | 3 |
| 19 | 3 | 39 | 2 | 59 | 2 | 79 | 3 |
| 20 | 3 | 40 | 2 | 60 | 1 | 80 | 1 |
Literatúra
GORODNICHEV I.N.. Kontrola a overovanie chémie. M.: Aquarium, 1997; Sorokin V.V., Zlotnikov napr.. Chemické testy. M.: Vzdelanie, 1991.
Bolo spomenuté vyššie (s. 172) o periodicite zmien v najdôležitejších vlastnostiach atómov - valencia. Existujú aj iné dôležité vlastnosti, ktorých zmena je charakterizovaná frekvenciou. Takéto vlastnosti zahŕňajú veľkosť (polomer) atómu. Atom nemá povrchya hranica je nejasná, ako hustota externých elektrónových oblakov, pretože to odstráni hladko znižuje. Údaje o atómových polomeroch sa získajú od stanovenia vzdialeností medzi ich centrami v molekulách a kryštalických štruktúrach. Výpočty sa uskutočnili aj na základe rovníc kvantovej mechaniky. Na obr. 5.10
Obr. 5.10. Frekvencia zmien v atómových radiakoch
krivka zmien v atómových radii, v závislosti od náboja jadra.
Z vodíka do hélia sa polomer znižuje a potom prudko zvýši v lítiu. To je spôsobené príchodom elektrónu na druhej úrovni energie. V druhom období od Lithium na neo, ako sa náboj jadra zvyšuje, klesá Radii.
Zároveň sa zvýšenie počtu elektrónov v tejto energetickej hladine vedie k zvýšeniu vzájomného odpudzovania. Preto do konca obdobia zníženie polomeru spomaľuje.
Pri pohybe z Neon na sodík - prvý prvok tretieho obdobia - polomer sa opäť prudko zvyšuje a potom postupne znižuje argónu. Potom existuje ostrý nárast polomeru v draslíku. Ukazuje sa, že charakteristická periodická pätná krivka. Každá časť krivky alkalických kovov na ušľachtilý plyn charakterizuje zmenu v polomere v období: Počas prechodu zľava doprava je zníženie polomeru. Je tiež zaujímavé zistiť povahu zmeny v Radii v skupinách prvkov. Ak to chcete urobiť, musíte držať čiaru prostredníctvom prvkov tej istej skupiny. Podľa polohy maxima v alkalickom kovu je priamo vidieť, že polomery atómov počas prechodu v skupine zhora nadol sa zvyšuje. Je to spôsobené zvýšením počtu elektronických mušlí.
Úloha 5.17. Ako sa menia polomery atómov od f až ur? Určite to na obr. 5.10.
Mnohé ďalšie vlastnosti atómov závisí od polomerov, fyzických aj chemických látok. Napríklad zvýšenie polomerov atómov môže vysvetliť zníženie teploty topenia alkalických kovov z lítia CESIUMU:
Veľkosti atómov sú spojené s ich energetickými vlastnosťami. Čím väčší je polomer externých elektrónových oblakov, tým ľahšie je elektrón stratí elektrón. Zároveň sa zmení na pozitívne nabitý a on.
Ion je jedným z možných stavieb atómu, v ktorom má elektrický náboj kvôli strate alebo pridaniu elektrónov.
Charakterizuje sa schopnosť atómu prejsť do pozitívne nabitého iónu energia ionizácie E I.Toto je minimálna energia potrebná na oddelenie externého elektrónu z atómu v stave plynu:
![]()
Výsledný pozitívny ión môže tiež stratiť elektróny, stáva sa dvojfrízorom, trojčlenným, atď. Rozsah ionizačnej energie sa výrazne zvyšuje.
Ionizačná energia atómov sa zvyšuje v období, keď sa pohybuje zľava doprava a znižuje sa v skupinách pri prechode zhora nadol.
Mnohé, ale nie všetky atómy sú schopné pripojiť ďalší elektrón, ktorý sa mení na negatívne nabitý ión A ~. Táto vlastnosť je charakterizovaná elektronická energia E Energy E CF. Toto je energetická energia, keď je elektrón spojený s atómom umiestneným v stave plynu:
![]()
Energia ionizácie a energie klíčivosti elektrónu je obvyklé 1 mólové atómy a expresné v KJ / MOL. Zvážte ionizáciu atómu sodného v dôsledku upevnenia a straty elektrónu (obr. 5.11) . Z obrázku je zrejmé, že na vylúčenie elektrónu z atómu sodného 10 akonáhle je pripojená elektronika, než je pridelená energia. Negatívny ión sodíka nestabilný a v zložitých látkach sa takmer nikdy nenašiel.

Obr. 5.11. Ionizácia atómu sodíka
Ionizačná energia atómov sa mení v obdobiach a skupinách v smere oproti zmene polomeru atómov. Zmena energie afinity do elektrónu v období je ťažšia, pretože prvky afinity IIa- a VIIII-RPYNNUJÚCE. Môžeme približne predpokladať, že energia elektrónovej afinity je podobná E tozvyšuje sa v období (na skupinu VII vrátane) a znižuje sa v skupinách zhora nadol (obr. 5.12).
úloha 5 .Eight. Môže magnézium a argónové atómy v plynnom stave tvarovania negatívne nabitých iónov?
Ióny s pozitívnymi a negatívnymi obvineniami sú priťahované medzi sebou, čo vedie k rôznym transformáciam. Najjednoduchším prípadom je vytvorenie iónových pripojení, t.j. zjednotenia iónov v látke podľa pôsobenia elektrostatickej príťažlivosti. Potom sa vyskytuje iónová kryštálová štruktúra, ktorá je charakteristická pre potravinovú soľ NaCl a mnoho ďalších solí. Ale možno

Obr. 5.12. Charakter zmien v energii ionizácie a energie elektróny afinity v skupinách a obdobiach
takže negatívny ión nie je veľmi pevne drží svoj prebytočný elektrón, a pozitívny ión, naopak, sa snaží obnoviť jeho elektronickou elektrinou. Potom môže interakcia medzi iónmi viesť k tvorbe molekúl. Je zrejmé, že ióny odlišného znaku náboja C1 + a C1 ~ sú priťahované medzi sebou. Ale vzhľadom k tomu, že ide o ióny rovnakých atómov, tvoria molekulu C12 s nulovými nábojmi na atómoch.
Otázky a cvičenia
1. Z koľko protónov, neutrónov a elektrónov pozostáva z atómov brómu?
2.
Vypočítajte hmotnostné frakcie izotopovej povahy. ![]()
3. Koľko energie sa uvoľňuje počas formácie 16 g.kyslík reakciou ![]() prúdi v hlbinách hviezd?
prúdi v hlbinách hviezd?
4. Vypočítajte elektrónovú energiu v excitovanom atóme vodíka, keď n \u003d3.
5. Napíšte kompletné a skrátené elektronické vzorce atómu jódu.
6. Napíšte znížený elektronický vzorec iónu.
7. Písanie kompletného a skráteného elektronického formulára a IONA 2.
8. Zostavte energetické diagramy fosforu a atómy arzénu.
9. Zostavte plné energetické diagramy zinku a gália.
10. Umiestnite nasledujúce atómy v poradí zvyšovania polomeru: hliník, bór, dusík.
11. Ktorý z nasledujúcich iónov tvoria medzi sebou iónové kryštálové štruktúry: v R + R -, K +, K -, I +, I -, Li +, Li -? Čo možno očakávať, keď interakcia iónov v iných kombináciách?
12. Predpokladajme, že možná povaha polomeru atómov počas prechodu v periodickom systéme v diagonálnom smere, napríklad li - mg - sc.