Расчеты тепловых эффектов реакций. Методы расчета тепловых эффектов химических реакций при различных температурах
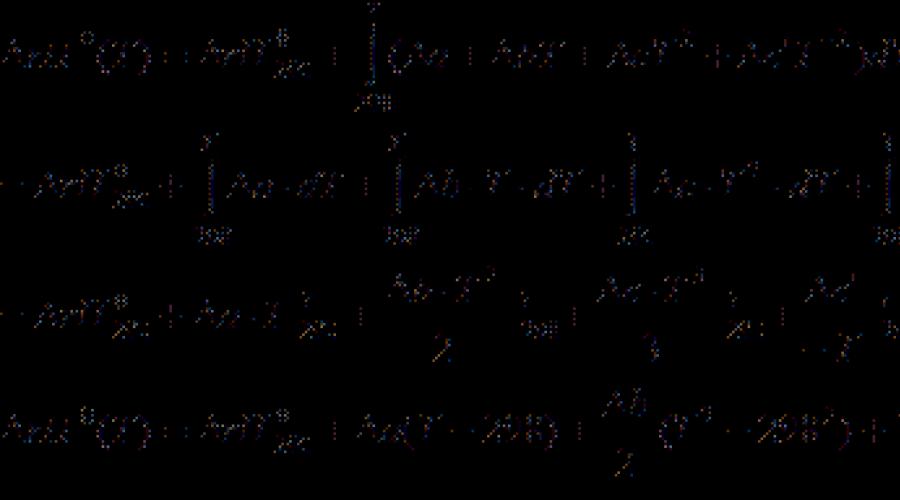
Читайте также
Все методы расчета тепловых эффектов основаны на уравнении Кирхгоффа в интегральной форме.
Чаще всего, в качестве первой температуры используют стандартную 298,15K.
Все методы расчета тепловых эффектов сводятся к способам взятия интеграла правой части уравнения.
Методы взятия интеграла:
I. По средним теплоемкостям. Данный метод является наиболее простым и наименее точным. В этом случае выражение под знаком интеграла заменяется на изменение средней теплоемкости, которая не зависит от температуры в выбранном диапазоне.
Средние теплоемкости табулированы и измерены для большинства реакций. Их легко рассчитать по справочным данным.
II. По Истинным теплоемкостям. (С помощью температурных рядов)
В этом методе подынтегральное выражение теплоемкости записывается как температурный ряд:

III. По высокотемпературным составляющим энтальпии. Данный метод получил большое распространение с развитием ракетной техники при расчете тепловых эффектов химических реакций при высоких температурах. Он основан на определении изобарной теплоемкости:

Высокотемпературная составляющая энтальпии. Она показывает, насколько изменится энтальпия индивидуального вещества при нагревании его на определенное количество градусов.
Для химической реакции записываем:

Таким образом:
Лекция №3.
План лекции:
1. II закон термодинамики, определение, математическая запись.
2. Анализ II закона термодинамики
3. Расчет изменения энтропии в некоторых процессах
здесь и далее индексы i относятся к исходным веществам или реагентам, а индексыj – к конечным веществам или продуктам реакции; и – стехиометрические коэффициенты в уравнении реакции для исходных веществ и продуктов реакции, соответственно.
Пример: Рассчитаем тепловой эффект реакции синтеза метанола при стандартных условиях.
Решение: Для расчетов воспользуемся справочными данными по стандартным теплотам образования, участвующих в реакции веществ (см. табл. 44 на стр.72 справочника ).
Тепловой эффект реакции синтеза метанола в стандартных условиях по первому следствию из закона Гесса (уравнение 1.15) равен:
При расчете тепловых эффектов химических реакции нужно учитывать, что тепловой эффект зависит от агрегатного состояния реагентов и от вида записи химического уравнения реакции:
По второму следствию из закона Гесса тепловой эффект можно рассчитать, используя теплоты сгорания Δ c H , как разность сумм теплот сгорания исходных веществ и продуктов реакции (с учетом стехиометрических коэффициентов):
где Δ r C p – характеризует изменение изобарной теплоемкости системы в результате протекания химической реакции и называется температурным коэффициентом теплового эффекта реакции.
Из дифференциального уравнения Кирхгоффа следует, что зависимость теплового эффекта от температуры определяется знаком Δ r C p , т.е. зависит от того, что больше, суммарная теплоемкость исходных веществ или суммарная теплоемкость продуктов реакции. Проанализируем дифференциальное уравнение Кирхгофа.
1. Если температурный коэффициент Δ r C p
> 0, то производная  > 0 и функция
> 0 и функция  возрастающая. Следовательно, тепловой эффект реакции с ростом температуры увеличивается.
возрастающая. Следовательно, тепловой эффект реакции с ростом температуры увеличивается.
2. Если температурный коэффициент Δ r C p
< 0, то производная  < 0 и функция
< 0 и функция  убывающая. Следовательно, тепловой эффект реакции с ростом температуры уменьшается.
убывающая. Следовательно, тепловой эффект реакции с ростом температуры уменьшается.
3. Если температурный коэффициент Δ r C p
= 0, то производная  = 0 и
= 0 и  . Следовательно, тепловой эффект реакции не зависит от температуры. Этот случай на практике не встречается.
. Следовательно, тепловой эффект реакции не зависит от температуры. Этот случай на практике не встречается.
Дифференциальные уравнения удобны для анализа, но неудобны для расчетов. Чтобы получить уравнение для расчета теплового эффекта химической реакции, проинтегрируем дифференциальное уравнение Кирхгофа, разделив переменные:


Теплоемкости веществ зависят от температуры, следовательно, и  . Однако, в области обычно используемых в химико-технологических процессах температурах эта зависимость не значительна. Для практических целей пользуются средними теплоемкостями веществ в интервале температур от 298 К до заданной температуры
. Однако, в области обычно используемых в химико-технологических процессах температурах эта зависимость не значительна. Для практических целей пользуются средними теплоемкостями веществ в интервале температур от 298 К до заданной температуры  , которые приводятся в справочниках. Температурный коэффициент теплового эффекта, рассчитанный с использованием средних теплоемкостей:
, которые приводятся в справочниках. Температурный коэффициент теплового эффекта, рассчитанный с использованием средних теплоемкостей:
Пример: Рассчитаем тепловой эффект реакции синтеза метанола при температуре 1000 К и стандартном давлении.
Решение: Для расчетов воспользуемся справочными данными по средним теплоемкостям участвующих в реакции веществ в интервале температур от 298 К до 1000 К (см. табл. 40 на стр.56 справочника ):
Изменение средней теплоемкости системы в результате протекания химической реакции:
Второе начало термодинамики
Одной из важнейших задач химической термодинамики является выяснение принципиальной возможности (или невозможности) самопроизвольного протекания химической реакции в рассматриваемом направлении. В тех случаях, когда становится ясно, что данное химическое взаимодействие происходить может, необходимо определить степень превращения исходных веществ и выход продуктов реакции, то есть полноту протекания реакции
Направление протекания самопроизвольного процесса можно определить на основе второго закона или начала термодинамики, сформулированного, например, в виде постулата Клаузиуса:
Теплота сама собой не может переходить от холодного тела к горячему, т. е. невозможен такой процесс, единственным результатом которого был бы переход теплоты от тела с более низкой температурой к телу с более высокой температурой.
Предложено множество формулировок второго начала термодинамики. Формулировка Томсона - Планка:
Невозможен вечный двигатель второго рода, т. е. невозможна такая периодически действующая машина, которая бы позволяла получать работу только за счет охлаждения источника тепла.
Математическая формулировка второго начала термодинамики возникла при анализе работы тепловых машин в трудах Н. Карно и Р. Клаузиуса.
Клаузиусом была введена функция состояния S , названная энтропией, изменение которой равно теплоте обратимого процесса, отнесенной к температуре
Для любого процесса
 | (1.22) |
Полученное выражение представляет собой математическое выражение второго начала термодинамики.
Стандартной теплотой образования (энтальпией образования) вещества называется энтальпия реакции образования 1 моля этого вещества из элементов (простых веществ, то есть состоящих из атомов одного вида), находящихся в наиболее устойчивом стандартном состоянии. Стандартные энтальпии образования веществ (кДж/моль) приводятся в справочниках. При использовании справочных значений необходимо обращать внимание на фазовое состояние веществ, участвующих в реакции. Энтальпия образования наиболее устойчивых простых веществ равна 0.
Следствие из закона Гесса о расчете тепловых эффектов химических реакций по теплотам образования : стандартный тепловой эффект химической реакции равен разности теплот образования продуктов реакции и теплот образования исходных веществ с учетом стехиометрических коэффициентов (количества молей) реагентов :
CH 4 + 2 CO = 3 C ( графит ) + 2 H 2 O.
газ газ тв. газ
Теплоты образования веществ в указанных фазовых состояниях приведены в табл. 1.2.
Таблица 1.2
Теплоты образования веществ
Р е ш е н и е
Так как реакция проходит при P = const, то стандартный тепловой эффект находим в виде изменения энтальпии по известным теплотам образования по следствию из закона Гесса (формула (1.17):
ΔН о 298 = { 2 · (–241,81) + 3·0} – {–74,85 + 2 · (–110,53)} = –187,71 кДж = = –187710 Дж.
ΔН о 298 < 0, реакция является экзотермической, протекает с выделением теплоты.
Изменение внутренней энергии находим на основании уравнения (1.16):
ΔU о 298 = ΔH о 298 – Δ ν · RT .
Для данной реакции изменений числа молей газообразных веществ за счет прохождения химической реакции Δν = 2 – (1 + 2) = –1; Т = 298 К, тогда
Δ U о 298 = –187710 – (–1) · 8,314· 298 = –185232 Дж.
Расчет стандартнвх тепловых эффектов химических реакций по стандартным теплотам сгорания веществ, участвующих в реакции
Стандартной
теплотой сгорания (энтальпией сгорания)
вещества
называется
тепловой эффект полного окисления 1
моля данного вещества (до высших оксидов
или специально указываемых соединений)
кислородом при условии, что исходные и
конечные вещества имеют стандартную
температуру. Стандартные энтальпии
сгорания веществ
 (кДж/моль) приводятся в справочниках.
При использовании справочной величины
необходимо обратить внимание на знак
величины энтальпии реакции сгорания,
которая всегда является экзотермической
(Δ
H
<0), а в таблицах указаны величины
(кДж/моль) приводятся в справочниках.
При использовании справочной величины
необходимо обратить внимание на знак
величины энтальпии реакции сгорания,
которая всегда является экзотермической
(Δ
H
<0), а в таблицах указаны величины
 .
. Энтальпии
сгорания высших оксидов (например, воды
и диоксида углерода) равны 0.
Энтальпии
сгорания высших оксидов (например, воды
и диоксида углерода) равны 0.
Следствие из закона Гесса о расчете тепловых эффектов химических реакций по теплотам сгорания : стандартный тепловой эффект химической реакции равен разности теплот сгорания исходных веществ и теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов (количества молей) реагентов:
C 2 H 4 + H 2 O = С 2 Н 5 ОН.
Подобно тому, как одной из физических характеристик человека является физическая сила, важнейшей характеристикой любой химической связи является сила связи, т.е. её энергия.
Напомним, что энергия химической связи – эта та энергия, которая выделяется при образовании химической связи или та энергия, которую нужно истратить, чтобы эту связь разрушить.
Химическая реакция в общем случае – это превращение одних веществ в другие. Следовательно, в ходе химической реакции происходит разрыв одних связей и образование других, т.е. превращения энергии.
Фундаментальный закон физики гласит, что энергия не возникает из ничего и не исчезает бесследно, а лишь переходит из одного вида в другой. В силу своей универсальности данный принцип, очевидно, применим и к химической реакции.
Тепловым эффектом химической реакции называется количество теплоты,
выделившееся (или поглотившееся) в ходе реакции и относимое к 1 моль прореагировавшего (или образовавшегося) вещества.
Тепловой эффект обозначается буквой Q и, как правило, измеряется в кДж/моль или в ккал/моль.
Если реакция происходит с выделением тепла (Q > 0), она называется экзотермической, а если с поглощением тепла (Q < 0) – эндотермической.
Если схематично изобразить энергетический профиль реакции, то для эндотермических реакций продукты находятся выше по энергии, чем реагенты, а для экзотермических – наоборот, продукты реакции располагаются ниже по энергии (более стабильны), чем реагенты.
Ясно, что чем больше вещества прореагирует, тем большее количество энергии выделится (или поглотится), т.е. тепловой эффект прямо пропорционален количеству вещества. Поэтому отнесение теплового эффекта к 1 моль вещества обусловлено нашим стремлением сравнивать между собой тепловые эффекты различных реакций.
Лекция 6. Термохимия. Тепловой эффект химической реакции Пример 1 . При восстановлении 8,0 г оксида меди(II) водородом образовалась металлическая медь и пары воды и выделилось 7,9 кДж теплоты. Вычислите тепловой эффект реакции восстановления оксида меди(II).
Решение . Уравнение реакции CuO (тв.) + H2 (г.) = Cu (тв.) + H2 O (г.) +Q (*)
Составим пропорцию при восстановлении 0,1 моль – выделяется 7,9 кДж при восстановлении 1 моль – выделяется x кДж
Откуда x = + 79 кДж/моль. Уравнение (*) принимает вид
CuO (тв.) + H2 (г.) = Cu (тв.) + H2 O (г.) +79 кДж
Термохимическое уравнение – это уравнение химической реакции, в котором указаны агрегатное состояние компонентов реакционной смеси (реагентов и продуктов) и тепловой эффект реакции.
Так, чтобы расплавить лед или испарить воду, требуется затратить определенные количества теплоты, тогда как при замерзании жидкой воды или конденсации водяного пара такие же количества теплоты выделяются. Именно поэтому нам холодно, когда мы выходим из воды (испарение воды с поверхности тела требует затрат энергии), а потоотделение является биологическим защитным механизмом от перегрева организма. Напротив, морозильник замораживает воду и нагревает окружающее помещение, отдавая ему избыточное тепло.
На данном примере показаны тепловые эффекты изменения агрегатного состояния воды. Теплота плавления (при 0o C) λ = 3,34×105 Дж/кг (физика), или Qпл. = - 6,02 кДж/моль (химия), теплота испарения (парообразования) (при 100o C) q = 2,26×106 Дж/кг (физика) или Qисп. = - 40,68 кДж/моль (химия).
плавление
испарение |
|||||
обр ,298.
Лекция 6. Термохимия. Тепловой эффект химической реакции Разумеется, возможны процессы сублимации, когда твердое вещество
переходит в газовую фазу, минуя жидкое состояние и обратные процессы осаждения (кристаллизации) из газовой фазы, для них также возможно рассчитать или измерить тепловой эффект.
Ясно, что в каждом веществе есть химические связи, следовательно, каждое вещество обладает некоторым запасом энергии. Однако далеко не все вещества можно превратить друг в друга одной химической реакцией. Поэтому договорились о введении стандартного состояния.
Стандартное состояние вещества – это агрегатное состояние вещества при температуре 298 К, давлении 1 атмосфера в наиболее устойчивой в этих условиях аллотропной модицикации.
Стандартные условия – это температура 298 К и давление 1 атмосфера. Стандартные условия (стандартное состояние) обозначается индексом0 .
Стандартной теплотой образования соединения называется тепловой эффект химической реакции образования данного соединения из простых веществ, взятых в их стандартном состоянии. Теплота образования соединения обозначается символом Q 0 Для множества соединений стандартные теплоты образования приведены в справочниках физикохимических величин.
Стандартные теплоты образования простых веществ равны 0. Например, Q0 обр,298 (O2 , газ) = 0, Q0 обр,298 (C, тв., графит) = 0.
Например . Запишите термохимическое уравнение образования сульфата меди(II). Из справочника Q0 обр,298 (CuSO4 ) = 770 кДж/моль.
Cu (тв.) + S (тв.) + 2O2 (г.) = CuSO4 (тв.) + 770 кДж.
Замечание : термохимическое уравнение можно записать для любого вещества, однако надо понимать, что в настоящей жизни реакция происходит совершенно по-другому: из перечисленных реагентов образуются при нагревании оксиды меди(II) и серы(IV), но сульфат меди(II) не образуется. Важный вывод: термохимическое уравнение – модель, которая позволяет производить расчеты, она хорошо согласуется с другими термохимическими данными, но не выдерживает проверки практикой (т.е. неспособна правильно предсказать возможность или невозможность реакции).
(B j ) - ∑ a i × Q обр 0 ,298 i
Лекция 6. Термохимия. Тепловой эффект химической реакции
Уточнение . Для того, чтобы не вводить Вас в заблуждение, сразу добавлю, что химическая термодинамикаможет предсказывать возможность / невозможность реакции , однако для этого требуются более серьезные «инструменты», которые выходят за рамки школьного курса химии. Термохимическое уравнение по сравнению с этими приемами – первая ступенька на фоне пирамиды Хеопса – без него не обойтись, но высоко не подняться.
Пример 2 . Вычислите тепловой эффект конденсации воды массой 5,8г.Решение . Процесс конденсации описывается термохимическим уравнением H2 O (г.) = H2 O (ж.) + Q – конденсация обычно экзотермический процесс Теплота конденсации воды при 25o C 37 кДж/моль (справочник).
Следовательно, Q = 37 × 0,32 = 11,84 кДж.
В 19 веке русским химиком Гессом, изучавшим тепловые эффекты реакций, был экспериментально установлен закон сохранения энергии применительно к химическим реакциям – закон Гесса .
Тепловой эффект химической реакции не зависит от пути процесса и определяется только разностью конечного и начального состояний.
С точки зрения химии и математики данный закон означает, что мы вольны для расчета процесса выбрать любую «траекторию расчета», ведь результат от нее не зависит. По этой причине очень важный закон Гесса имеет невероятно важное следствие закона Гесса .
Тепловой эффект химической реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования реагентов (с учетом стехиометрических коэффициентов).
С точки зрения здравого смысла данное следствие соответствует процессу, в котором сначала все реагенты превратились в простые вещества, которые затем собрались по-новому, так что получились продукты реакции.
В форме уравнения следствие закона Гесса выглядит так Уравнение реакции: a 1 A 1 + a 2 A 2 + … + a n A n = b 1 B 1 + b 2 B 2 + … b
При этом a i иb j – стехиометрические коэффициенты,A i – реагенты,B j – продукты реакции.
Тогда следствие закона Гесса имеет вид Q = ∑ b j × Q обр 0 ,298
k Bk + Q
(A i )
Лекция 6. Термохимия. Тепловой эффект химической реакции Поскольку стандартные теплоты образования многих веществ
а) сведены в специальные таблицы или б) могут быть определены экспериментально, то становится возможным предсказать (рассчитать) тепловой эффект очень большого количества реакций с достаточно высокой точностью.
Пример 3 . (Следствие закона Гесса). Рассчитайте тепловой эффект паровой конверсии метана, происходящей в газовой фазе при стандартных условиях:
CH4 (г.) + H2 O (г.) = CO (г.) + 3 H2 (г.)
Определите, является ли данная реакция экзотермической или эндотермической?
Решение: Следствие закона Гесса
Q = 3 Q0 | Г ) +Q 0 | (CO ,г ) −Q 0 | Г ) −Q 0 | O , г ) - в общем виде. |
|||||
обр ,298 | обр ,298 | обр ,298 | обр ,298 | ||||||
Q обр0 | 298 (H 2 ,г ) = 0 | Простое вещество в стандартном состоянии |
|||||||
Из справочника находим теплоты образования остальных компонентов смеси.
O ,г ) = 241,8 | (СO ,г ) = 110,5 | Г ) = 74,6 | |||||||||
обр ,298 | обр ,298 | обр ,298 | |||||||||
Подставляем значения в уравнение
Q = 0 + 110,5 – 74,6 – 241,8 = -205,9 кДж/моль, реакция сильно эндотермична.
Ответ: Q = -205,9 кДж/моль, эндотермическая
Пример 4. (Применение закона Гесса). Известны теплоты реакций
C (тв.) + ½ O (г.)= CO (г.) + 110,5 кДж
С (тв.) + O2 (г.) = CO2 (г.) + 393,5 кДж Найти тепловой эффект реакции 2CO (г.) + O2 (г.) = 2CO2 (г.).Решение Умножим первое и второе уравнение на 2
2C (тв.) + O2 (г.)= 2CO (г.) + 221 кДж 2С (тв.) + 2O2 (г.) = 2CO2 (г.) + 787 кДж
Вычтем из второго уравнения первое
O2 (г.) = 2CO2 (г.) + 787 кДж – 2CO (г.) – 221 кДж,
2CO (г.) + O2 (г.) = 2CO2 (г.) + 566 кДж Ответ: 566 кДж/моль.
Замечание: При изучении термохимии мы рассматриваем химическую реакцию извне (снаружи). Напротив, химическая термодинамика – наука о поведении химических систем – рассматривает систему изнутри и оперирует понятием «энтальпии»H как тепловой энергии системы. Энтальпия, таким
Лекция 6. Термохимия. Тепловой эффект химической реакции образом, имеет тот же смысл, что и количество теплоты, но имеет противоположный знак: если энергия выделяется из системы, окружающая среда её получает и греется, а система энергию теряет.
Литература :
1. учебник, В.В. Еремин, Н.Е. Кузьменко и др., Химия 9 класс, параграф 19,
2. Учебно-методическое пособие «Основы общей химии» Часть 1.
Составители – С.Г. Барам, И.Н. Миронова. – взять с собой! на следующее семинарское занятие
3. А.В. Мануйлов. Основы химии. http://hemi.nsu.ru/index.htm
§9.1 Тепловой эффект химической реакции. Основные законы термохимии.
§9.2** Термохимия (продолжение). Теплота образования вещества из элементов.
Стандартная энтальпия образования.
Внимание!
Мы переходим к решению расчетных задач, поэтому на семинары по химии отныне и впредь желателен калькулятор.
Термохимия изучает тепловые эффекты химических реакций. Во многих случаях эти реакции протекают при постоянном объеме или постоянном давлении. Из первого закона термодинамики следует, что при этих условиях теплота является функцией состояния. При постоянном объеме теплота равна изменению внутренней энергии:
а при постоянном давлении - изменению энтальпии:
Эти равенства в применении к химическим реакциям составляют суть закона Гесса :
Тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только состоянием реагентов и продуктов реакции.
Другими словами, тепловой эффект химической
реакции равен изменению функции состояния.
В термохимии, в отличие от других приложений
термодинамики, теплота считается положительной,
если она выделяется в окружающую среду, т.е. если H
< 0 или U
< 0. Под тепловым эффектом химической реакции
понимают значение H
(которое называют просто "энтальпией
реакции") или U
реакции.
Если реакция протекает в растворе или в твердой фазе, где изменение объема незначительно, то
H = U + (pV ) U . (3.3)
Если же в реакции участвуют идеальные газы, то при постоянной температуре
H = U + (pV ) = U + n . RT , (3.4)
где n - изменение числа молей газов в реакции.
Для того, чтобы облегчить сравнение энтальпий различных реакций, используют понятие "стандартного состояния". Стандартное состояние - это состояние чистого вещества при давлении 1 бар (= 10 5 Па) и заданной температуре . Для газов - это гипотетическое состояние при давлении 1 бар, обладающее свойствами бесконечно разреженного газа. Энтальпию реакции между веществами, находящимися в стандартных состояниях при температуре T , обозначают (r означает "reaction"). В термохимических уравнениях указывают не только формулы веществ, но и их агрегатные состояния или кристаллические модификации.
Из закона Гесса вытекают важные следствия, которые позволяют рассчитывать энтальпии химических реакций.
Следствие 1.
![]()
равна разности стандартных энтальпий образования продуктов реакции и реагентов (с учетом стехиометрических коэффициентов):
Стандартной энтальпией (теплотой) образования вещества (f означает "formation") при заданной температуре называют энтальпию реакции образования одного моля этого вещества из элементов , находящихся в наиболее устойчивом стандартном состоянии. Согласно этому определению, энтальпия образования наиболее устойчивых простых веществ в стандартном состоянии равна 0 при любой температуре. Стандартные энтальпии образования веществ при температуре 298 К приведены в справочниках.
Понятия "энтальпия образования"
используют не только для обычных веществ, но и
для ионов в растворе. При этом за точку отсчета
принят ион H + , для которого стандартная
энтальпия образования в водном растворе
полагается равной нулю: ![]()
Следствие 2. Стандартная энтальпия химической реакции
![]()
равна разности энтальпий сгорания реагентов и продуктов реакции (с учетом стехиометрических коэффициентов):
(c означает "combustion"). Стандартной энтальпией (теплотой) сгорания вещества называют энтальпию реакции полного окисления одного моля вещества. Это следствие обычно используют для расчета тепловых эффектов органических реакций.
Следствие 3. Энтальпия химической реакции равна разности энергий разрываемых и образующихся химических связей.
Энергией связи A- B называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечное расстояние:
AB (г) A (г) + B (г) .
Энергия связи всегда положительна.
Большинство термохимических данных в справочниках приведено при температуре 298 К. Для расчета тепловых эффектов при других температурах используют уравнение Кирхгофа :
(дифференциальная форма) (3.7)
 (интегральная форма)
(3.8)
(интегральная форма)
(3.8)
где C p - разность изобарных теплоемкостей продуктов реакции и исходных веществ. Если разница T 2 - T 1 невелика, то можно принять C p = const. При большой разнице температур необходимо использовать температурную зависимость C p (T ) типа:
где коэффициенты a , b , c и т.д. для отдельных веществ берут из справочника, а знак обозначает разность между продуктами и реагентами (с учетом коэффициентов).
ПРИМЕРЫ
Пример 3-1. Стандартные энтальпии образования жидкой и газообразной воды при 298 К равны -285.8 и -241.8 кДж/моль, соответственно. Рассчитайте энтальпию испарения воды при этой температуре.
Решение . Энтальпии образования соответствуют следующим реакциям:
H 2(г) + ЅO 2(г) = H 2 O (ж) , H 1 0 = -285.8;
H 2(г) + ЅO 2(г) = H 2 O (г) , H 2 0 = -241.8.
Вторую реакцию можно провести в две стадии: сначала сжечь водород с образованием жидкой воды по первой реакции, а затем испарить воду:
H 2 O (ж) = H 2 O (г) , H 0 исп = ?
Тогда, согласно закону Гесса,
H 1 0 + H 0 исп = H 2 0 ,
откуда H 0 исп = -241.8 - (-285.8) = 44.0 кДж/моль.
Ответ. 44.0 кДж/моль.
Пример 3-2. Рассчитайте энтальпию реакции
6C (г) + 6H (г) = C 6 H 6(г)
а) по энтальпиям образования; б) по энергиям связи, в предположении, что двойные связи в молекуле C 6 H 6 фиксированы.
Решение . а) Энтальпии образования (в кДж/моль) находим в справочнике (например, P.W.Atkins, Physical Chemistry, 5th edition, pp. C9-C15): f H 0 (C 6 H 6(г)) = 82.93, f H 0 (C (г)) = 716.68, f H 0 (H (г)) = 217.97. Энтальпия реакции равна:
r H 0 = 82.93 - 6 716.68 - 6 217.97 = -5525 кДж/моль.
б) В данной реакции химические связи не разрываются, а только образуются. В приближении фиксированных двойных связей молекула C 6 H 6 содержит 6 связей C- H, 3 связи C- C и 3 связи C=C. Энергии связей (в кДж/моль) (P.W.Atkins, Physical Chemistry, 5th edition, p. C7): E (C- H) = 412, E (C- C) = 348, E (C=C) = 612. Энтальпия реакции равна:
r H 0 = -(6 412 + 3 348 + 3 612) = -5352 кДж/моль.
Разница с точным результатом -5525 кДж/моль обусловлена тем, что в молекуле бензола нет одинарных связей C- C и двойных связей C=C, а есть 6 ароматических связей C C.
Ответ. а) -5525 кДж/моль; б) -5352 кДж/моль.
Пример 3-3. Пользуясь справочными данными, рассчитайте энтальпию реакции
3Cu (тв) + 8HNO 3(aq) = 3Cu(NO 3) 2(aq) + 2NO (г) + 4H 2 O (ж)
Решение . Сокращенное ионное уравнение реакции имеет вид:
3Cu (тв) + 8H + (aq) + 2NO 3 - (aq) = 3Cu 2+ (aq) + 2NO (г) + 4H 2 O (ж) .
По закону Гесса, энтальпия реакции равна:
r H 0 = 4 f H 0 (H 2 O (ж)) + 2 f H 0 (NO (г)) + 3 f H 0 (Cu 2+ (aq)) - 2 f H 0 (NO 3 - (aq))
(энтальпии образования меди и иона H + равны, по определению, 0). Подставляя значения энтальпий образования (P.W.Atkins, Physical Chemistry, 5th edition, pp. C9-C15), находим:
r H 0 = 4 (-285.8) + 2 90.25 + 3 64.77 - 2 (-205.0) = -358.4 кДж
(в расчете на три моля меди).
Ответ. -358.4 кДж.
Пример 3-4. Рассчитайте энтальпию сгорания метана при 1000 К, если даны энтальпии образования при 298 К: f H 0 (CH 4) = -17.9 ккал/моль, f H 0 (CO 2) = -94.1 ккал/моль, f H 0 (H 2 O (г)) = -57.8 ккал/моль. Теплоемкости газов (в кал/(моль. К)) в интервале от 298 до 1000 К равны:
C p (CH 4) = 3.422 + 0.0178 . T , C p (O 2) = 6.095 + 0.0033 . T ,
C p (CO 2) = 6.396 + 0.0102 . T , C p (H 2 O (г)) = 7.188 + 0.0024 . T .
Решение . Энтальпия реакции сгорания метана
CH 4(г) + 2O 2(г) = CO 2(г) + 2H 2 O (г)
при 298 К равна:
94.1 + 2 (-57.8) - (-17.9) = -191.8 ккал/моль.
Найдем разность теплоемкостей как функцию температуры:
C p
= C p
(CO 2)
+ 2C p
(H 2 O (г)) - C p
(CH 4)
- 2C p
(O 2) =
= 5.16 - 0.0094T
(кал/(моль. К)).
Энтальпию реакции при 1000 К рассчитаем по уравнению Кирхгофа:
= +  = -191800 + 5.16
= -191800 + 5.16
(1000-298) - 0.0094 (1000 2 -298 2)/2
= -192500 кал/моль.
Ответ. -192.5 ккал/моль.
ЗАДАЧИ
3-1. Сколько тепла потребуется на перевод 500 г Al (т.пл. 658 о С, H 0 пл = 92.4 кал/г), взятого при комнатной температуре, в расплавленное состояние, если C p (Al тв) = 0.183 + 1.096 10 -4 T кал/(г К)?
3-2. Стандартная энтальпия реакции CaCO 3(тв) = CaO (тв) + CO 2(г) , протекающей в открытом сосуде при температуре 1000 К, равна 169 кДж/моль. Чему равна теплота этой реакции, протекающей при той же температуре, но в закрытом сосуде?
3-3. Рассчитайте стандартную внутреннюю энергию образования жидкого бензола при 298 К, если стандартная энтальпия его образования равна 49.0 кДж/моль.
3-4. Рассчитайте энтальпию образования N 2 O 5 (г) при T = 298 К на основании следующих данных:
2NO(г) + O 2 (г) = 2NO 2 (г), H 1 0 = -114.2 кДж/моль,
4NO 2 (г) + O 2 (г) = 2N 2 O 5 (г), H 2 0 = -110.2 кДж/моль,
N 2 (г) + O 2 (г) = 2NO(г), H 3 0 = 182.6 кДж/моль.
3-5. Энтальпии сгорания -глюкозы,
-фруктозы и сахарозы при 25 о С
равны -2802,
-2810 и -5644 кДж/моль, соответственно. Рассчитайте
теплоту гидролиза сахарозы.
3-6. Определите энтальпию образования диборана B 2 H 6 (г) при T = 298 К из следующих данных:
B 2 H 6 (г) + 3O 2 (г) = B 2 O 3 (тв) + 3H 2 O(г), H 1 0 = -2035.6 кДж/моль,
2B(тв) + 3/2 O 2 (г) = B 2 O 3 (тв), H 2 0 = -1273.5 кДж/моль,
H 2 (г) + 1/2 O 2 (г) = H 2 O(г), H 3 0 = -241.8 кДж/моль.
3-7. Рассчитайте теплоту образования сульфата цинка из простых веществ при T = 298 К на основании следующих данных.