नीचे सूचीबद्ध तत्व परमाणुओं की विशेषताओं में से। रसायन विज्ञान
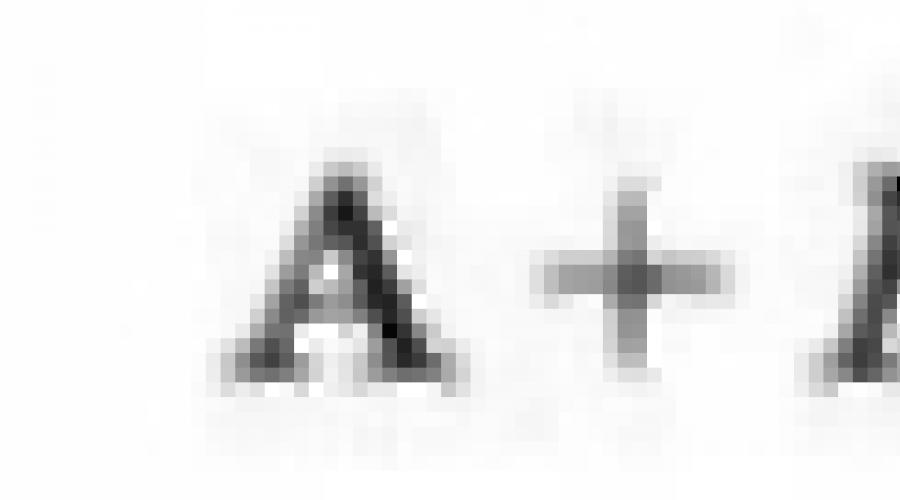
परीक्षा संख्या 2 में निम्नलिखित विषयों के लिए कार्य शामिल हैं:
- आवधिक प्रणाली
- तत्वों और उनके यौगिकों के गुणों को बदलने की आवृत्ति।
- रासायनिक बंध। विधि सूर्य
- रासायनिक बंध। मो विधि।
- रासायनिक बंध। आयन कनेक्शन।
- जटिल यौगिकों में रासायनिक बंधन।
ज्ञान की जांच के लिए परीक्षण:
1. समय-समय पर सूचीबद्ध तत्वों परमाणुओं की विशेषताओं में से
(1) एटम न्यूक्लियस चार्ज;
(2) सापेक्ष परमाणु द्रव्यमान;
(3) परमाणु में ऊर्जा के स्तर की संख्या;
(4) बाहरी ऊर्जा स्तर में इलेक्ट्रॉनों की संख्या।
2. अवधि के अंदर, तत्व की अनुक्रम संख्या में वृद्धि आमतौर पर इसके साथ होती है
(1) परमाणु त्रिज्या में कमी और परमाणु की इलेक्ट्रोनगेटिविटी में वृद्धि के साथ;
(2) परमाणु त्रिज्या में वृद्धि और परमाणु की इलेक्ट्रोनिबिलिटी में कमी;
(3) परमाणु त्रिज्या में कमी के साथ और परमाणु की इलेक्ट्रोनेबिलिटी में कमी;
(4) परमाणु त्रिज्या में वृद्धि और परमाणु की इलेक्ट्रोनिबिलिटी में वृद्धि।
3. एटम किस तत्व को एक इलेक्ट्रॉन देने का सबसे आसान तरीका है (संख्या तत्व की अनुक्रम संख्या का मतलब है):
(1) सोडियम, 11; (2) मैग्नीशियम, 12; (3) एल्यूमिनियम, 13; (4) सिलिकॉन, 14?
4. तत्वों की आवधिक प्रणाली के तत्वों के परमाणुओं में समान संख्या होती है
(1) बाहरी इलेक्ट्रॉनिक स्तर पर इलेक्ट्रॉनों;
(2) न्यूट्रॉन;
(3) सभी इलेक्ट्रॉनों।
5. तत्व पंक्ति में इलेक्ट्रोनबिलिटी बढ़ाने के क्रम में स्थित हैं
(1) के रूप में, एसई, सीएल, एफ; (2) सी, मैं, बी, सी; (3) बीआर, पी, एच, एसबी; (4) ओ, एसई, बीआर, ते।
6. आवधिक प्रणाली की दूसरी और तीसरी अवधि में तत्वों के आकार में कमी आती है
(1) उनके आयनों का आकार भी कम हो गया है;
(2) बिजली घट जाती है;
(3) तत्वों की धातु गुण कमजोर;
(4) तत्वों के धातु गुणों को बढ़ाया जाता है।
7. किस संख्या में केवल संक्रमणकालीन तत्व शामिल हैं:
(1) तत्व 11, 14, 22, 42; (2) तत्व 13, 33, 54, 83;
(3) तत्व 24, 39, 74, 80; (4) तत्व 19, 32, 51, 101?
8. नीचे दिए गए तत्वों में रासायनिक गुण हैं, जो कैल्शियम तत्व के साथ इसकी समानता के बारे में बात करने की इजाजत देते हैं:
(1) कार्बन। से; (2) सोडियम, ना; (3) पोटेशियम। सेवा मेरे; (4) स्ट्रोंटियम, एसआर?
9. आवधिक प्रणाली के मुख्य उपसमूहों में स्थित तत्वों की गैर-धातु गुण डी। I. Mendelevev में सबसे अधिक स्पष्ट हैं जो स्थित हैं
(1) उपसमूह के शीर्ष पर;
(2) उपसमूह के नीचे;
(3) उपसमूह के बीच में;
(4) सभी तत्वों में, उपसमूह एक ही डिग्री के बारे में व्यक्त किया जाता है।
10. परमाणु त्रिज्या के आरोही क्रम में कौन से तत्वों का प्रतिनिधित्व किया जाता है:
(1) ओ, एस, एसई, वे; (2) सी, एन, ओ, एफ; (3) एनए, एमजी, अल, सी; (4) मैं, बीआर, सीएल, एफ?
11. एमजी-सीए-एसआर-बीए की एक श्रृंखला में तत्वों के गुणों की धातु प्रकृति
(1) घटता है;
(2) बढ़ता है;
(3) नहीं बदलता है;
12. एन-पी-ए-एसबी-बीआई में तत्वों के गुणों की गैर-धातु प्रकृति
(1) घटता है;
(2) बढ़ता है;
(3) नहीं बदलता है;
(4) घटता है, और फिर बढ़ता है।
13. तत्वों के निर्दिष्ट सेट में कौन सा भाप - सीए, पी, एसआई, एजी, एनआई, के रूप में - सबसे समान रासायनिक गुण हैं:
(1) एसए, सी; (2) एजी, नी; (3) पी, के रूप में; (4) नी, आर?
14. इसके रासायनिक गुणों के अनुसार, रेडियम का रेडियोधर्मी तत्व निकटतम है
(1) सेसियम; (2) बेरियम; (3) लान्थन; (4) एक्टिनिया।
15. आवधिक व्यवस्था में लान्थन तत्व की स्थिति के आधार पर, यह कहना सुरक्षित है कि लान्थेनेस के लिए, ऑक्सीकरण की सबसे विशेषता डिग्री होगी
(1) +1; (2) +2; (3) +3; (4) +4.
16. अनुक्रम संख्या बढ़ने के रूप में समूह 1 ए के तत्वों के हाइड्रोक्साइड के मुख्य गुण
(1) घटाओ;
(2) वृद्धि;
(3) अपरिवर्तित बने रहें;
(4) कमी, और फिर वृद्धि।
17. आवधिक प्रणाली में तत्वों की स्थिति के आधार पर, सेलेनियम के साथ जर्मनी के सबसे संभावित संयुक्त सूत्र द्वारा चित्रित किया जा सकता है।
18. हाइपोथेटिकल तत्व जेड फॉर्म जेडसीएल 5 क्लोराइड। अपने ऑक्साइड के लिए सबसे अधिक संभावना सूत्र क्या है:
(1) ज़ो 2; (2) ज़ो 5; (3) जेड 2 ओ 5; (4) जेड 5 ओ 2?
19. किस तत्व के तत्वों के भौतिक और रासायनिक गुणों की सबसे बड़ी समानता है:
(1) ली, एस; (2) हो, सीएल; (3) एफ, सीएल; (4) ली, एफ?
20. नीचे तीसरी अवधि के तत्वों में से, सबसे स्पष्ट गैर-धातु गुणों में है
(1) एल्यूमीनियम; (2) सिलिकॉन; (3) सल्फर; (4) क्लोरीन।
21. उपरोक्त तत्वों में से, समूह ने गैर-धातु गुणों का उच्चारण किया है
(1) बोर; (2) एल्यूमिनियम; (3) गैलियम; (4) भारत।
22. आवधिक प्रणाली की चौथी अवधि के उपरोक्त तत्वों में से कौन सा वैलेंस मूल्यों को उनके हाइड्रोजन यौगिक में और उच्चतम ऑक्साइड में प्रकट करता है:
(1) ब्रोमाइन; (2) जर्मनी; (3) आर्सेनिक; (4) सेलेनियम?
23. पंक्ति पी 2 ओ 5 -sio 2 -l 2 o z -mgo में ऑक्साइड की प्रकृति निम्नानुसार बदल दी गई है:
(1) मुख्य से अम्लीय तक;
(2) एसिड से मुख्य तक;
(3) मुख्य से एम्फोटर तक;
(4) एम्फोटेरिक से अम्लीय तक।
24. तत्वों और संबंधित एसिड के उच्च ऑक्साइड के सूत्रों को लिखें; इन एसिड नाम दें:
25. आवधिक प्रणाली में तत्व की स्थिति के आधार पर, नीचे सूचीबद्ध अपने यौगिकों को लिखें:
26. उपरोक्त तत्वों की सूची से: बीई, बी, सी, एन, अल, सी, पी, एस, जीए, जीई, एएस, बीआर - ईओ 2 प्रकार ऑक्साइड फॉर्म, और टाइप ए 4 के हाइड्राइड -।
27. आवधिक प्रणाली में तत्व की स्थिति के आधार पर, सूत्रों को अपने उच्चतम ऑक्साइड और हाइड्रोक्साइड के लिए आउटपुट करें और उनकी प्रकृति को इंगित करें:
28. अनुक्रम संख्या 34 के साथ तत्व एक हाइड्रोजन यौगिक, उच्च ऑक्साइड और हाइड्रोक्साइड बनाता है। उत्तरार्द्ध प्रकट होता है
(1) एसिड गुण;
(2) मूल गुण;
(3) एम्फोटेरिक गुण।
29. आवधिक प्रणाली की छठी अवधि में भरने वाले रासायनिक तत्वों की अधिकतम संख्या बराबर होनी चाहिए
(1) 8; (2) 18; (3) 32; (4) 50.
30. सातवेंमोमेरियोड में अधिकतम संख्या में आइटम होना चाहिए
(1) 18; (2) 32; (3) 50; (4) 72.
31. सातवीं अवधि में, उत्तरार्द्ध अनुक्रम संख्या द्वारा तत्व होना चाहिए
(1) 118; (2) 114; (3) 112; (4) 110.
32. क्षार धातुओं के गुणों को अनुक्रम संख्या वाले तत्वों से उम्मीद की जानी चाहिए
(1) 111 और 190; (2) 119 और 16 9; (3) 137 और 187; (4) 155 और 211।
33. वैलेंस इलेक्ट्रॉनों के बिस्मुथ ऑर्बिटल्स की कॉन्फ़िगरेशन के साथ मेल खाता है
(1) सेलेनियम और टेल्यूरियम;
(2) नाइट्रोजन और फास्फोरस;
(3) सिलिकॉन और जर्मेनियम;
(4) निओबियम और तन्थल।
34. अनुक्रम संख्या 117 के साथ तत्व को जिम्मेदार ठहराया जाना चाहिए
(1) क्षारीय धातु Lamas; (3) हलोजन;
(2) क्षारीय पृथ्वी धातु; (4) संक्रमणकालीन तत्व।
35. ऑक्सीजन यौगिकों में लीड का अधिकतम वैलेंस है:
(1) II; (2) iv; (3) vi; (4) आठवीं।
36. भारत में वैलेंस इलेक्ट्रॉनों के ऑर्बिटल्स के प्रकार के साथ मेल खाता है
(1) एएम और एफआर; (2) पीबी और एसएन; (3) अल और गा; (4) सीयू और एजी।
37. टाइटन को संदर्भित करता है
(1) एस-; (2) पी-; (3) डी-; (4) एफ- तत्व।
38. ऑक्सीजन यौगिकों में ब्रोमाइन का अधिकतम वैलेंस
(1) मैं; (2) III; (3) v; (4) VII।
39. तत्वों की प्रणाली की सातवीं अवधि को अनुक्रम संख्या के साथ तत्व को समाप्त करना होगा
(1) 108; (2) 110; (3) 118; (4) 128.
40. एच-ई के लिंक के बीच कोण कनेक्शन के अणु में सबसे बड़ा है
(1) एच 2, (2) एच 2 एसई; (3) एच 2 एस; (4) एच 2 ओ।
41. के-सीए-एससी-टीआई की एक पंक्ति में, परमाणुओं की त्रिज्या (घटती है, बढ़ जाती है)।
42. ऊर्जा जो एसएल ° (जी) → सीएल + समीकरण (जी) में निर्दिष्ट है + ई - 1254 केजे, क्लोरीन परमाणु के लिए है
(1) रासायनिक बंधन ऊर्जा;
(2) आयनीकरण ऊर्जा;
(3) इलेक्ट्रोनिबिटेबिलिटी;
(4) इलेक्ट्रॉन के प्रति संबंध।
43. इलेक्ट्रॉन के लिए एफ़िनिटी कहा जाता है
(1) एक अनियंत्रित परमाणु से एक इलेक्ट्रॉन को अलग करने के लिए आवश्यक ऊर्जा;
(2) इलेक्ट्रॉन घनत्व में देरी के लिए इस आइटम के परमाणु की क्षमता;
(3) एक उच्च ऊर्जा स्तर के लिए इलेक्ट्रॉन संक्रमण;
(4) ऊर्जा को अलग करना जब एक इलेक्ट्रॉन परमाणु या आयन से जुड़ा होता है।
44. Ionization ऊर्जा का सबसे बड़ा मूल्य कौन सा तत्व है:
(1) ली; (2) एफ; (3) Fe; (4) मैं?
45. मैग्नीशियम में एक गैसीय राज्य में एक तत्व परमाणु से एक इलेक्ट्रॉन को हटाने पर ऊर्जा खर्च की गई
(1) सोडियम से कम, और एल्यूमीनियम से अधिक;
(2) सोडियम से अधिक, और एल्यूमीनियम की तुलना में कम;
(3) सोडियम और एल्यूमीनियम से कम;
(4) सोडियम और एल्यूमीनियम से अधिक।
46. \u200b\u200bआवधिक प्रणाली में परमाणुओं और तत्वों की स्थिति के इलेक्ट्रॉनिक संरचनाओं के विश्लेषण के आधार पर, निर्दिष्ट करें कि नीचे दिए गए प्रत्येक दो परमाणुओं में से कौन सा परमाणु इलेक्ट्रॉन के प्रति अधिक संबंध है:
(1) पोटेशियम या कैल्शियम;
(2) सल्फर या क्लोरीन;
(3) हाइड्रोजन या लिथियम?
47. रासायनिक तत्व पंक्ति में इलेक्ट्रोनिबिलिटी बढ़ाने के क्रम में स्थित हैं
(1) एसआई, पी, एसई, आरआर, एसएल, ओ; (2) एसआई, पी, आर, एसई, सी 1, ओ;
(3) पी, एसआई, एफआरए, एसई, सी 1, ओ; (4) एसई, एसआई, पी, आर, सी 1, ओ।
48. वे अपने परमाणु त्रिज्या को बढ़ाने के रूप में कितने तत्व स्थित हैं:
(1) एनए, एमजी, अल, सी; (3) ओ, एस, एसई, वे;
(2) सी, ओ, एन, एफ; (4) मैं, बीआर, सी 1, एफ?
49. कई क्षार धातु (ली से सीएस से) में, सेसियम कम से कम इलेक्ट्रोनेटिव है। यह समझाया गया है कि उसके पास क्या है
(1) कर्नेल में न्यूट्रॉन की सबसे बड़ी संख्या;
(2) अन्य तत्वों की तुलना में वैलेंस इलेक्ट्रॉनों की एक बड़ी संख्या;
(3) एक बड़ा परमाणु द्रव्यमान;
(4) वैलेंटेड इलेक्ट्रॉनों, परमाणु के नाभिक से हटाए गए सबसे बड़ी डिग्री के लिए।
50. Isoelectronic आयनों नामक इलेक्ट्रॉनों की एक ही संख्या और बाहरी इलेक्ट्रॉन स्तर की एक ही संरचना है। आयनों के बारे में 2-, एफ -, एनए +, एमजी 2+, ए 1 3+ में दोपहर की एनओओ गैस की इलेक्ट्रॉनिक कॉन्फ़िगरेशन है और तत्वों के परमाणु जनता के आरोही क्रम में व्यवस्थित किया जाता है। उसी समय उनके आयन रेडी
(1) व्यावहारिक रूप से नहीं बदलते;
(2) घटाओ;
(3) वृद्धि;
(4) कमी, फिर वृद्धि।
51. एक गैर-ध्रुवीय अणु का एक उदाहरण ध्रुवीय सहसंयोजक बंधन होगा
(1) एन 2; (2) एच 2 ओ; (3) एनएच 3; (4) सीसीएल 4।
52. उपरोक्त अणुओं में: एच 2, ओ 2, एच 2 ओ, सीओ 2, सीएच 4, एच 2 एस - ध्रुवीय हैं।
53. परमाणुओं के बीच यौगिकों में से एक, दाता-स्वीकार्य तंत्र पर एक सहसंयोजक बंधन बनता है:
(1) केएसएल; (2) एनएच 4 सीएल; (3) सीसीएल 4; (4) सीओ 2?
54. Beryllium हाइब्रिडाइज के हाइड्राइड के हाइड्राइड अणु में बेरेलियम परमाणु के वैलिबिटल ऑर्बिटल्स
(1) एसपी।; (2) एसपी 2।; (3) एसपी 3।;(4) डी 2 एसपी 3,
और अणु की संरचना है:
55. टीएफ 3 अणु में बोरॉन एटम के वैलिबिटल ऑर्बिटल्स टाइप द्वारा संकरित हैं
(1) एसपी।; (2) एसपी 2।; (3) एसपी 3।;(4) डी 2 एसपी 3,
और अणु की संरचना है:
(ए) रैखिक; (सी) टेट्राहेड्रल;
(बी फ्लाट; (d) ऑक्टाहेड्रल।
56. मीथेन अणु में सी-एच के चार समकक्ष बंधनों की उपस्थिति इस तथ्य से समझाया गया है कि
(1) चार इलेक्ट्रॉनिक जोड़े के पारस्परिक प्रतिकृति होती है;
(2) चार बनाने के लिए कार्बन परमाणु संकरित एसपी 3।orbitals;
(3) कार्बन परमाणु में एक है एस- और तीन आर- रासायनिक संयोजन इलेक्ट्रॉन;
(4) कार्बन परमाणु में दो एस- और दो हैं आर- रासायनिक संयोजन इलेक्ट्रॉन।
उत्तर:
1. (4) बाहरी ऊर्जा स्तर में इलेक्ट्रॉनों की संख्या।
2. (1) परमाणु त्रिज्या में कमी और परमाणु की इलेक्ट्रोनगेटिविटी में वृद्धि के साथ।
3. (1) सोडियम, 11।
4. (1) बाहरी इलेक्ट्रॉनिक स्तर पर इलेक्ट्रॉनों।
5. (1) एएस, एसई, सीएल, एफ।
6. (3) तत्वों की धातु गुण कमजोर।
7. (3) तत्व 24, 39, 74, 80।
8. (4) स्ट्रोंटिया, सीनियर
9. (1) उपसमूह के शीर्ष पर।
10. (1) ओ, एस, एसई, वे।
11. (2) बढ़ता है।
12. (1) घटता है।
14. (2) बेरियम।
16. (2) वृद्धि।
18. (3) जेड 2 ओ 5।
20. (4) क्लोरीन।
22. (2) जर्मनी।
23. (2) एसिड से मुख्य तक।
26. ईओ 2 प्रकार ऑक्साइड फॉर्म सी, एसआई, जीई, और टाइप के हाइड्राइड एक 4 - सी, एसआई, जीई।
28. एच 2 एस, एसईओ 3 और एच 2 एसईओ 4। (1) एसिड गुण।
32. (2) 119 और 169।
33. (2) नाइट्रोजन और फास्फोरस।
34. (3) हलोजन।
36. (3) अल और गा।
37. (3) डी- तत्व।
41. घटता है।
42. (2) आयनीकरण ऊर्जा।
43. (4) ऊर्जा को अलग करना जब एक इलेक्ट्रॉन परमाणु या आयन से जुड़ा होता है।
45. (4) सोडियम और एल्यूमीनियम से अधिक।
46. \u200b\u200b(1) पोटेशियम; (2) क्लोरीन; (3) हाइड्रोजन।
47. (1) एसआई, पी, एसई, डब्ल्यूआर, एसएल, ओ।
48. (3) ओ, एस, एसई, वे।
49. (4) वैलेंस इलेक्ट्रॉनों, परमाणु के नाभिक से निकाली गई सबसे बड़ी डिग्री के लिए।
50. (2) घटाएं।
52. एच 2 ओ, एच 2 एस।
53. (2) एनएच 4 सीएल।
54. (1) एसपी।, (ए) रैखिक।
55. (2) एसपी 2।, (बी फ्लाट।
56. (2) कार्बन एटम चार के गठन के साथ संकरित है एसपी 3।orbitals।
व्यक्तिगत अनुमानित ग्राफिक्स कार्य के लिए कार्य:
निम्नलिखित गणनाओं को पूरा करने के विकल्पों की संख्या के बराबर अनुक्रम संख्या वाले तत्व के लिए:
1. तत्व का एक इलेक्ट्रॉनिक सूत्र लिखें और सभी परमाणु कक्षाओं के इलेक्ट्रॉनों के साथ ग्राफिक रूप से भरना दिखाएं।
3. एक तत्व परमाणु और इसकी मात्रा के द्रव्यमान का निर्धारण करें।
4. तत्व के एक साधारण पदार्थ के एक अणु के द्रव्यमान का निर्धारण करें।
5. पीएस में तत्व की स्थिति के आधार पर, अन्य तत्वों के संबंध में तत्व के परमाणु के ऑक्सीकरण की संभावित डिग्री सूचीबद्ध करता है।
6. एक ऑक्साइड फॉर्मूला, क्लोराइड, हाइड्राइड, सल्फाइड लिखें।
8. तत्व के हाइड्रोजन और ऑक्सीजन कनेक्शन के द्विध्रुव की लंबाई की गणना करें।
9. सूर्य विधि का उपयोग कर तत्व के एक साधारण पदार्थ के अणु में स्पर्श में पेल करें।
10. एमओ विधि के ऊर्जा आरेख का उपयोग करके तत्व सरल पदार्थ के अणु में पेल, संचार की बहुतायत निर्दिष्ट करें और एक सूत्र लिखें।
11. सभी संभावित ऑक्साइड के अणुओं में एक तत्व के परमाणु के संकरण के प्रकार को निर्दिष्ट करें (ऑक्सीजन के मामले में - हाइड्रोजन कनेक्शन के अणुओं)।
12. ऑक्साइड अणुओं में सभी प्रकार के बॉन्ड (σ, π, δ) निर्दिष्ट करें (ऑक्सीजन - हाइड्रोजन यौगिकों के मामले में)।
13. ऑक्साइड अणुओं में वैलेंस कोणों के मूल्यों को निर्दिष्ट करें (ऑक्सीजन - हाइड्रोजन यौगिक अणुओं के मामले में)।
14. ऑक्साइड अणुओं के रूप को निर्दिष्ट करें (ऑक्सीजन - हाइड्रोजन यौगिक अणुओं के मामले में)।
15. एवी के आयनिक यौगिक की ऊर्जा और आयनों ए + और बी की बातचीत की ऊर्जा की गणना करें
विकल्प 1, 5, 6, 7, 8, 9, 14, 15, 16, 17: ए - पोटेशियम, बी तत्व संख्या के बराबर अनुक्रम संख्या वाला तत्व है।
विकल्प 3, 4, 11, 12, 13, 1 9, 20, 21, 22, 23, 24, 25, 26, 27, 28: बी - क्लोरीन के लिए, तत्व संख्या के बराबर अनुक्रम संख्या वाला तत्व।
विकल्प 2, 10, 18: ए - एक अनुक्रम संख्या के साथ एक तत्व (+1 का संस्करण), बी एक अनुक्रम तत्व के साथ एक तत्व है (विकल्प -1) के बराबर एक तत्व है।
साहित्य।
1. कुलमान ए.जी. सामान्य रसायन शास्त्र, एड के लिए कार्यों का संग्रह। दूसरा, मनोरंजन।, और जोड़ें। - एम।: उच्च। shk। 1975।
2. मास्लोव ई.आई. , होल्बोर जेडई। रसायन विज्ञान, 5 वें संस्करण, पेराब में कार्यों और अभ्यासों का संग्रह। और ऐड-एम।: उच्च। shk। 1997।
तत्व की परमाणु संख्या दिखाती है:
ए) परमाणु में प्राथमिक कणों की संख्या; बी) परमाणु में न्यूक्लियंस की संख्या;
सी) परमाणु में न्यूट्रॉन की संख्या; डी) परमाणु में प्रोटॉन की संख्या।
सबसे सही यह बयान है कि पीएसई में रासायनिक तत्व आरोही क्रम में व्यवस्थित किए जाते हैं:
ए) उनके परमाणुओं का पूर्ण द्रव्यमान; बी) सापेक्ष परमाणु द्रव्यमान;
सी) परमाणु नाभिक में न्यूक्लियंस की संख्या; डी) परमाणु नाभिक का प्रभार।
रासायनिक तत्वों के गुणों को बदलने में आवृत्ति परिणाम है:
ए) परमाणुओं में इलेक्ट्रॉनों की संख्या में वृद्धि;
बी) परमाणु नाभिक के आरोपों में वृद्धि;
सी) परमाणु द्रव्यमान बढ़ाएं;
डी) परमाणुओं के इलेक्ट्रॉनिक संरचनाओं में परिवर्तन में आवधिकता।
नीचे सूचीबद्ध विशेषताओं में से, तत्व परमाणु समय-समय पर बदल जाते हैं क्योंकि तत्व की अनुक्रम संख्या उगाई जाती है:
ए) परमाणु में ऊर्जा के स्तर की संख्या;
बी) सापेक्ष परमाणु द्रव्यमान;
सी) बाहरी ऊर्जा स्तर में इलेक्ट्रॉनों की संख्या;
डी) परमाणु नाभिक का प्रभार।
उन जोड़े का चयन करें जिसमें परमाणु की प्रत्येक विशेषता समय-समय पर तत्व की प्रोटॉन संख्या में वृद्धि के साथ भिन्न होती है:
ए) एक इलेक्ट्रॉन संबंध की आयनीकरण और ऊर्जा की ऊर्जा;
बी) त्रिज्या और द्रव्यमान;
सी) इलेक्ट्रोनगेटिविटी और कुल इलेक्ट्रॉन;
डी) धातु गुण और वैलेंस इलेक्ट्रॉनों की संख्या।
तत्वों के लिए उचित अनुमोदन का चयन करेंवीएक समूह:
ए) सभी परमाणुओं में इलेक्ट्रॉनों की एक ही संख्या होती है;
बी) सभी परमाणुओं के पास एक ही त्रिज्या है;
सी) सभी परमाणुओं में बाहरी परत पर इलेक्ट्रॉनों की एक ही संख्या होती है;
डी) सभी परमाणुओं के पास समूह संख्या के बराबर अधिकतम मूल्य है।
कुछ तत्व में निम्नलिखित इलेक्ट्रॉन कॉन्फ़िगरेशन हैं:एनएस। 2 (एन-1) डी 10 एनपी। 4 । आवधिक प्रणाली के किस समूह में यह तत्व है?
ए) आईवीटी समूह; बी) विव समूह; सी) आईवीए समूह; d) समूह के माध्यम से।
परमाणु नाभिक के बढ़ते आरोपों के साथ पीएसई अवधि मेंनहीं परिवर्तन: ए) परमाणुओं का द्रव्यमान; बी) इलेक्ट्रॉनिक परतों की संख्या; सी) बाहरी इलेक्ट्रॉनिक परत पर इलेक्ट्रॉनों की संख्या; डी) परमाणुओं की त्रिज्या। |
|
अपने परमाणु त्रिज्या को बढ़ाने के क्रम में किस पंक्ति रासायनिक तत्व स्थित हैं? ए) ली, बी, बी, सी; बी) बीई, एमजी, सीए, एसआर; सी) एन, ओ, एफ, एनई; डी) ना, एमजी, अल, सी। |
|
स्थिर परमाणुओं के बीच सबसे कम आयनीकरण ऊर्जा है: ए) लिथियम; b) बैरी; सी) सेसियम; डी) सोडियम। |
|
तत्वों की बिजली एक पंक्ति में बढ़ जाती है: ए) पी, एसआई, एस, ओ; बी) सीएल, एफ, एस, ओ; सी) ते, एसई, एस, ओ; डी) ओ, एस, एसई, ते। |
|
तत्वों की एक पंक्ति मेंना। एमजी। अल सी पी एस सीएल। बाएं से दाएं: ए) इलेक्ट्रोनिटी बढ़ाता है; बी) आयनीकरण की ऊर्जा कम हो जाती है; सी) वैलेंस इलेक्ट्रॉनों की संख्या बढ़ जाती है; डी) धातु गुण घटते हैं। |
|
चौथी अवधि की सबसे सक्रिय धातु निर्दिष्ट करें: ए) कैल्शियम; बी) पोटेशियम; सी) क्रोम; डी) जस्ता। |
|
सबसे सक्रिय धातु IIA समूह निर्दिष्ट करें: ए) बेरेलियम; b) बैरी; सी) मैग्नीशियम; डी) कैल्शियम। |
|
सबसे सक्रिय nonmetall viia समूह निर्दिष्ट करें: ए) आयोडीन; बी) ब्रोमाइन; सी) फ्लोराइन; डी) क्लोरीन। |
|
सही बयान चुनें: ए) आईए-VIII में, केवल तत्व हैं- और बी) IV- VIIIV समूहों में केवल डी-तत्व हैं; सी) सभी डी-तत्व धातु हैं; डी) पीएसई में एस की कुल संख्या 13 है। |
|
वीए समूह में तत्व की परमाणु संख्या में वृद्धि के साथ वृद्धि: ए) धातु गुण; बी) ऊर्जा के स्तर की संख्या; सी) इलेक्ट्रॉनों की कुल संख्या; डी) वैलेंस इलेक्ट्रॉनों की संख्या। |
|
पी-तत्वों का अर्थ है: ए) पोटेशियम; बी) सोडियम; सी) मैग्नीशियम; डी) आर्सेनिक। |
|
तत्वों का कौन सा परिवार एल्यूमीनियम है? ए) एस-तत्व; बी) पी-तत्व; सी) डी-तत्व; डी) एफ-तत्व। |
|
एक श्रृंखला निर्दिष्ट करें जिसमें केवल हैंडी- तत्व: ए) अल, से, ला; बी) टीआई, जीई, एसएन; सी) टीआई, वी, सीआर; डी) ला, सीई, एचएफ। |
कौन सी पंक्ति तत्वों के पात्रों, पी और डी-परिवारों को दिखाती है? ए) एच, वह, ली; बी) एच, बीए, अल; सी) हो, सी, एफ; डी) एमजी, पी, सीयू। |
|
IV अवधि के किस तत्व के एटम में इलेक्ट्रॉनों की सबसे बड़ी संख्या है? a) जिंक; बी) क्रोम; सी) ब्रोमाइन; डी) क्रिप्टन। |
|
किस तत्व के परमाणु पर, बाहरी ऊर्जा स्तर के इलेक्ट्रॉन नाभिक से दृढ़ता से जुड़े हुए हैं? ए) पोटेशियम; बी) कार्बन; सी) फ्लोराइन; डी) फ्रांस। |
|
परमाणु के नाभिक के लिए वैलेंस इलेक्ट्रॉनों के आकर्षण की शक्ति कई तत्वों में घट जाती है: ए) एनए, एमजी, अल, सी; बी) आरबी, के, ना, ली; सी) एसआर, सीए, एमजी, हो; डी) ली, ना, के, आरबी। |
|
अनुक्रम संख्या 31 के साथ तत्व है: ए) समूह III में; बी) छोटी अवधि; ग) बड़ी अवधि; डी) समूह ए में |
|
निम्नलिखित इलेक्ट्रॉनिक सूत्रों से, उन लोगों का चयन करें जो पी-तत्वों से मेल खाते हैंवी अवधि: ए) 1 एस 2 2 एस 2 2 पी 6 3 एस 2 3 पी 6 3 डी 1 4 एस 2 4 पी 6 4 डी 1 5 एस 2 5 पी 1; बी) 1 एस 2 2 एस 2 2 पी 6 3 एस 2 3 पी 6 3 डी 1 4 एस 2 4 पी 6 5 एस 2; सी) 1 एस 2 2 एस 2 2 पी 6 3 एस 2 3 पी 6 3 डी 1 4 एस 2 4 पी 2; डी) 1 एस 2 2 एस 2 2 पी 6 3 एस 2 3 पी 6 3 डी 1 4 एस 2 4 पी 6 4 डी 1 5s 2 5p 6। |
|
उपर्युक्त इलेक्ट्रॉनिक सूत्रों से, उन लोगों का चयन करें जो रचना के उच्चतम ऑक्साइड बनाने वाले रासायनिक तत्वों के अनुरूप हैं 2 के बारे में 3 : ए) 1 एस 2 2 एस 2 2 पी 6 3 एस 2 3 पी 1; बी) 1 एस 2 2 एस 2 2 पी 6 3 एस 2 3 पी 6 3 डी 1 4 एस 2 4 पी 3; सी) 1 एस 2 2 एस 2 2 पी 6 3 एस 2 3 पी 6 3 डी 1 4 एस 2; डी) 1 एस 2 2 एस 2 2 पी 6 3 एस 2 3 पी 6 3 डी 3 4 एस 2। |
|
उस तत्व को निर्धारित करें जिसका परमाणु इलेक्ट्रॉन के 4 पी-पिलोन 4 पर होता है। यह किस अवधि और समूह है? ए) आर्सेनिक, चतुर्थ अवधि, वीए समूह; बी) ग्रुप के माध्यम से टेलर, वी अवधि; सी) सेलेनियम, चतुर्थ अवधि, समूह के माध्यम से; डी) टंगस्टन, वीआई अवधि, वीआईबी समूह। |
कैल्शियम और स्कैंडियम परमाणु एक दूसरे में भिन्न होते हैं: ए) ऊर्जा के स्तर की संख्या; बी) त्रिज्या; सी) वैलेंस इलेक्ट्रॉनों की संख्या; डी) उच्च ऑक्साइड का सूत्र। |
|
सल्फर और क्रोमियम परमाणुओं के लिए उसी तरह: ए) वैलेंस इलेक्ट्रॉनों की संख्या; बी) ऊर्जा के स्तर की संख्या; ग) उच्चतम वैलेंस; डी) उच्च ऑक्साइड का सूत्र। |
|
नाइट्रोजन और फास्फोरस परमाणु हैं: ए) इलेक्ट्रॉनिक परतों की एक ही संख्या; बी) कर्नेल में प्रोटॉन की एक ही संख्या; सी) वैलेंस इलेक्ट्रॉनों की एक ही संख्या; डी) समान त्रिज्या। |
|
तत्व III अवधि के उच्च ऑक्साइड का सूत्र, जिसकी मूल रूप से राज्य में राज्य में तीन अनपेक्षित इलेक्ट्रॉन होते हैं: ए) ई 2 ओ 3; बी) ईओ 2; सी) ई 2 ओ 5; डी) ई 2 ओ 7। |
|
उच्च ऑक्साइड तत्व ईओ 3 का सूत्र। इसके हाइड्रोजन यौगिक के सूत्र को इंगित करें: ए) एन 2; बी) एन; ग) एन 3; डी) एन 4। |
|
मुख्य से एसिड से ऑक्साइड की प्रकृति रैंक में भिन्न होती है: ए) ना 2 ओ, एमजीओ, एसआईओ 2; बी) सीएल 2 ओ, तो 2, पी 2 ओ 5, नहीं 2; सी) बीओ, एमजीओ, बी 2 ओ 3, अल 2 ओ 3,; डी) सीओ 2, बी 2 ओ 3, अल 2 ओ 3, ली 2 ओ; ई) साओ, एफई 2 ओ 3, अल 2 ओ 3, तो 2। |
|
पंक्तियों को चुनें जिनमें यौगिकों के एसिड गुणों के आरोही क्रम में सूत्रों की व्यवस्था की जाती है: ए) एन 2 ओ 5, पी 2 ओ 5, 2 ओ 5 के रूप में; सी) एच 2 एसईओ 3, एच 2 तो 3, एच 2 तो 4; बी) एचएफ, एचबीआर, हाय; डी) अल 2 ओ 3, पी 2 ओ 5, सीएल 2 ओ 7। |
|
एक श्रृंखला निर्दिष्ट करें जिसमें उनके मुख्य गुणों को बढ़ाने के क्रम में हाइड्रोक्साइड की व्यवस्था की जाती है: ए) लियो, कोह, नाओह; सी) लियोह, सीए (ओएच) 2, अल (ओएच) 3; बी) लियो, नाओह, एमजी (ओएच) 2; डी) लियो, नाओह, कोह। |
कार्य
फास्फोरस नमूने में दो न्यूक्लाइड होते हैं: फॉस्फोरस -31 और फॉस्फोरस -33। फॉस्फोरस -33 का दाढ़ी अंश 10% है। इस नमूने में फास्फोरस के सापेक्ष परमाणु द्रव्यमान की गणना करें।
प्राकृतिक तांबा में सीयू 63 और सीयू 65 न्यूक्लाइड होते हैं। मिश्रण में सीयू 65 परमाणुओं की संख्या के लिए सीयू 63 परमाणुओं की संख्या 2.45: 1.05 है। तांबा के सापेक्ष परमाणु द्रव्यमान की गणना करें।
प्राकृतिक क्लोरीन का औसत सापेक्ष परमाणु द्रव्यमान 35.45 है। अपने दो आइसोटोप के दाढ़ी के अंशों की गणना करें, अगर यह ज्ञात है कि उनकी द्रव्यमान संख्याएं 35 और 37 के बराबर हैं।
ऑक्सीजन नमूने में दो न्यूक्लाइड होते हैं: 16 ओ और 18 ओ, जिनमें से द्रव्यमान 4.0 ग्राम और 9.0 जी होते हैं। इस नमूने में ऑक्सीजन के सापेक्ष परमाणु द्रव्यमान का निर्धारण करें।
रासायनिक तत्व में दो न्यूक्लाइड होते हैं। पहले न्यूक्लाइड के मूल में 10 प्रोटॉन और 10 न्यूट्रॉन होते हैं। 2 से अधिक न्यूट्रॉन के दूसरे न्यूक्लाइड के कर्नेल में। भारी न्यूक्लाइड के एक परमाणु के लिए लाइटर न्यूक्लाइड खातों के 9 परमाणुओं पर। तत्व के औसत परमाणु वजन की गणना करें।
प्रत्येक 4 ऑक्सीजन एटम -16 के लिए प्राकृतिक मिश्रण में 3 ऑक्सीजन -17 परमाणु और 1 ऑक्सीजन एटम -18 के लिए प्राकृतिक मिश्रण में ऑक्सीजन होगा?
उत्तर:1. 31,2. 2. 63,6. 3. 35 सीएल: 77.5% और 37 सीएल: 22.5%। 4. 17,3. 5. 20,2. 6. 16,6.
रासायनिक संचार
शैक्षिक सामग्री की मुख्य मात्रा:
प्रकृति और प्रकार के रासायनिक बंधन। रासायनिक बंधन के मुख्य पैरामीटर: ऊर्जा, लंबाई।
सहसंयोजक कनेक्शन। सहसंयोजक संचार के गठन के लिए आदान-प्रदान और दाता-स्वीकार्य तंत्र। सहसंयोजक बंधन की दिशा और संतृप्ति। एक सहसंयोजक बंधन की ध्रुवीयता और ध्रुवीकरण। मूल्यांकन और ऑक्सीकरण की डिग्री। एक समूह के तत्वों के परमाणुओं की वैलेंटल क्षमताओं और वैधता की स्थिति। एकल और एकाधिक लिंक। परमाणु क्रिस्टल जाली। परमाणु कक्षाओं के संकरण की अवधारणा। हाइब्रिडाइजेशन के मुख्य प्रकार। संबंधों के कोनों। अणुओं की स्थानिक संरचना। अणुओं का अनुभवजन्य, आणविक और संरचनात्मक (ग्राफिक) सूत्र।
आयन संचार। आयनिक क्रिस्टल जाली। आणविक, परमाणु और आयनिक संरचना के साथ पदार्थों के रासायनिक सूत्र।
धातु संचार। क्रिस्टल धातु जाली।
इंटरमोल्यूलर इंटरैक्शन। आणविक क्रिस्टल जाली। इंटरमोल्यूलर इंटरैक्शन की ऊर्जा और पदार्थों की कुल स्थिति।
हाइड्रोजन बंध।प्राकृतिक वस्तुओं में हाइड्रोजन बंधन का मूल्य।
अध्ययन के परिणामस्वरूप, छात्रों को पता होना चाहिए:
रासायनिक संबंध क्या है;
मुख्य प्रकार के रासायनिक बंधन;
सहसंयोजक संचार शिक्षा तंत्र (विनिमय और दाता-स्वीकार्य);
सहसंयोजक बंधन (संतृप्ति, दिशा, ध्रुवीयता, बहुतायत, एस- और पी-संचार) की मुख्य विशेषताएं;
आयनिक, धातु और हाइड्रोजन बांड के मुख्य गुण;
क्रिस्टल जाली के मुख्य प्रकार;
ऊर्जा की आपूर्ति कैसे बदली जाती है और एक समग्र अवस्था से दूसरे में संक्रमण में अणुओं की प्रकृति;
पदार्थों से क्रिस्टलीय संरचना वाले पदार्थों से अलग-अलग क्या हैं जिनमें एक असंगत संरचना होती है।
विषय का अध्ययन करने के परिणामस्वरूप, छात्रों को कौशल हासिल करना चाहिए:
विभिन्न यौगिकों में परमाणुओं के बीच रासायनिक बंधन के प्रकार की परिभाषाएं;
उनकी ऊर्जा द्वारा रासायनिक बंधन की ताकत की तुलना;
विभिन्न पदार्थों के सूत्रों द्वारा ऑक्सीकरण की डिग्री निर्धारित करना;
परमाणु कक्षाओं के संकरकरण के सिद्धांत के आधार पर कुछ अणुओं के ज्यामितीय आकार की स्थापना;
रिश्ते की प्रकृति और क्रिस्टल जाली के प्रकार के आधार पर पदार्थों की प्राथमिकताओं की तुलना करना और तुलना करना।
विषय सीखने के बाद, छात्रों को एक प्रस्तुति होनी चाहिए:
- अणुओं की स्थानिक संरचना (सहसंयोजक बांड की दिशा, वैलेंस कोण) पर;
- परमाणु ऑर्बिटल्स (एसपी 3 -, एसपी 2 -, एसपी-हाइब्रिडाइजेशन) के संकरण के सिद्धांत पर
विषय का अध्ययन करने के बाद, छात्रों को याद रखना चाहिए:
ऑक्सीकरण की निरंतर डिग्री के साथ तत्व;
हाइड्रोजन और ऑक्सीजन के यौगिक जिसमें ये तत्व ऑक्सीकरण की डिग्री की विशेषता नहीं हैं;
पानी के अणु में कनेक्शन के बीच कोण की परिमाण।
खंड 1. प्रकृति और रसायन के प्रकार
पदार्थों का सूत्र दिया जाता है: ना 2 ओ, तो 3, केसीएल, पीसीएल 3, एचसीएल, एच 2, सीएल 2, एनएसीएल, सीओ 2, (एनएच 4) 2 तो 4, एच 2 ओ 2, सीओ, एच 2 एस, एनएच 4 सीएल, तो 2, हाय, आरबी 2 एसओ 4, एसआर (ओएच) 2, एच 2 एसईओ 4, हे, एससीसीएल 3, एन 2, एएलबीआर 3, एचबीआर, एच 2 एसई, एच 2 ओ, 2, सी 4, एनएच 3, की, सीएबीआर 2, बाओ, नहीं, एफसीएल, एसआईसी। कनेक्शन का चयन करें:
आणविक और गैर लोचदार संरचना;
केवल सहसंयोजक ध्रुवीय बांड के साथ;
केवल सहसंयोजक गैर-ध्रुवीय बांड के साथ;
केवल आयनिक कनेक्शन के साथ;
आयनिक और सहसंयोजक बंधन की संरचना में संयोजन;
सहसंयोजक ध्रुवीय और सहसंयोजक गैर-ध्रुवीय कनेक्शन का संयोजन;
हाइड्रोजन बंधन बनाने में सक्षम;
दाता-स्वीकार्य तंत्र द्वारा गठित संचार की संरचना में होना;
रैंकों में कनेक्शन की ध्रुवीयता कैसे होती है?
ए) एच 2 ओ; एच 2 एस; एच 2 एसई; एच 2 ते बी) पीएच 3; एच 2 एस; एचसीएल।
किस राज्य में मुख्य या उत्साहित है - निम्नलिखित कनेक्शन में पृथक तत्वों के परमाणु हैं:
बीसीएल 3; पीसीएल 3; सीओ 2; हो।F 2; एच 2। एस; सी।एच 4; एच सीएल।ओ 4?
रासायनिक बातचीत में इन तत्वों की एक जोड़ी में आयन संचार बनाने की अधिकतम प्रवृत्ति है:
सीए, सी, के, ओ, मैं, सीएल, एफ?
नीचे दिए गए रसायनों में, बॉन्ड टूटने के आयनों के गठन के साथ आगे बढ़ने की अधिक संभावना होगी, और जिसमें फ्री रेडिकल बनाने के लिए: एनएसीएल, सीएस 2, सीएच 4, के 2 ओ, एच 2 एसओ 4, कोह, सीएल 2?
दाना हलोजन नस्लों: एचएफ, एचसीएल, एचबीआर, हाय। एक हलोजन गार्डन चुनें:
जलीय घोल जिसमें सबसे मजबूत एसिड (सबसे कमजोर एसिड) है;
सबसे ध्रुवीय बंधन (कम से कम ध्रुवीय बंधन) के साथ;
संचार की उच्चतम लंबाई (सबसे कम संचार लंबाई के साथ) के साथ;
सबसे बड़े उबलते बिंदु (सबसे छोटे उबलते बिंदु के साथ) के साथ।
एक रासायनिक बंधन बनाने के दौरान, फ्लोरो फ्लोरो 2.64 जारी किया जाता है '
10 -19 जे ऊर्जा। 1.00 केजे ऊर्जा को अलग करने के लिए फ्लोराइन अणुओं की रासायनिक संख्या की गणना करें।
टेस्ट 6।
जब अणु दो अलग-अलग परमाणुओं से बना होता है, तो सिस्टम में ऊर्जा: a) बढ़ता है; b) घटता है; ग) नहीं बदलता है; डी) ऊर्जा में कमी और वृद्धि दोनों संभव है। |
|
संकेत दें, किस चीज में, सामान्य इलेक्ट्रॉनिक जोड़े ऑक्सीजन परमाणु की ओर स्थानांतरित हो जाते हैं: ए) 2 और सह; बी) सीएल 2 ओ और नहीं; सी) एच 2 ओ और एन 2 ओ 3; डी) एच 2 ओ 2 और ओ 2 एफ 2। |
|
एक सहसंयोजक गैर-ध्रुवीय कनेक्शन के साथ कनेक्शन निर्दिष्ट करें: a) o 2; b) n 2; सी) सीएल 2; डी) पीसीएल 5। |
|
एक सहसंयोजक ध्रुवीय बंधन के साथ कनेक्शन निर्दिष्ट करें: ए) एच 2 ओ; बी) बीआर 2; सी) सीएल 2 ओ; d) तो 2। |
|
कुछ अणुओं को चुनें, जिनमें सभी लिंक सहसंयोजक हैं: ए) एनएसीएल, एचसीएल; बी) सीओ 2, ना 2 ओ; सी) सीएच 3 सीएल, सी 3 ना; डी) तो 2, नहीं 2। |
|
सहसंयोजक ध्रुवीय और सहसंयोजक गैर-ध्रुवीय संचार के साथ संबंध क्रमशः हैं: ए) पानी और हाइड्रोजन सल्फाइड; बी) ब्रोमाइड पोटेशियम और नाइट्रोजन; सी) अमोनिया और हाइड्रोजन; डी) ऑक्सीजन और मीथेन। |
|
एक कण में दाता-स्वीकार्य तंत्र द्वारा सहसंयोजक बंधन का कोई भी नहीं बनाया जाता है: ए) सीओ 2; बी) सह; सी) बीएफ 4 -; डी) एनएच 4 +। |
|
चूंकि बाध्य परमाणुओं की विद्युत नकारात्मकता में अंतर होता है: ए) संचार की ध्रुवीयता में कमी; बी) संचार की ध्रुवीयता को मजबूत करना; सी) आयनिक संचार की डिग्री में वृद्धि; डी) आयनिक संचार की डिग्री को कम करना। |
|
संचार की ध्रुवीयता को बढ़ाने के क्रम में अणुओं की किस पंक्ति में स्थित हैं? ए) एचएफ, एचसीएल, एचबीआर; बी) एनएच 3, पीएच 3, राख 3; सी) एच 2 एसई, एच 2 एस, एच 2 ओ; डी) सीओ 2, सीएस 2, सीएसई 2। |
|
अणु में सबसे बड़ी बाध्यकारी ऊर्जा: ए) एच 2 ते; बी) एच 2 एसई; सी) एच 2 एस; डी) एच 2 ओ। |
|
अणु में रासायनिक बंधन कम से कम टिकाऊ है: ए) ब्रोमोमोडोरोड; बी) क्लोराइड; सी) iododorodor; डी) फ्लोरूडोरोड। |
|
सूत्रों वाली पदार्थों की एक पंक्ति में संचार की लंबाई बढ़ जाती है: ए) सीसीएल 4, सीबीआर 4, सीएफ 4; बी) तो 2, एसईओ 2, टीओ 2; सी) एच 2 एस, एच 2 ओ, एच 2 एसई; डी) एचबीआर, एचसीएल, एचएफ। |
|
अधिकतम संख्याएस- संचार जो अणु में दो परमाणुओं के बीच मौजूद हो सकते हैं: a) 1; b) 2; 3 में; d) 4। |
|
दो परमाणुओं के बीच ट्रिपल कनेक्शन में शामिल हैं: ए) 2 एस-बॉन्ड और 1 π-बॉन्ड; बी) 3 एस संचार; सी) 3 π-बांड; डी) 1 एस संचार और 2π-बांड। |
|
अणु एस। 2 रासायनिक लिंक शामिल हैं: a) 1s और 1π; b) 2s और 2π; सी) 3 एस और 1π; डी) 4 एस। |
|
योगएस- मैं।π- सम्बन्ध (एस + π) अणु मेंतोह फिर। 2 सीएल। 2 के बराबर: a) 3 + 3; बी) 3 + 2; ग) 4 + 2; डी) 4 + 3। |
|
आयन बॉन्ड के साथ कनेक्शन निर्दिष्ट करें: ए) सोडियम क्लोराइड; बी) कार्बन ऑक्साइड (ii); सी) आयोडीन; डी) नाइट्रेट पोटेशियम। |
|
केवल आयनिक संचार पदार्थ की संरचना का समर्थन करता है: ए) सोडियम पेरोक्साइड; बी) काटा चूना; सी) तांबा Sipop; d) sylvinit। |
|
इंगित करें कि किस तत्व को धातु और आयन संचार के गठन में भाग ले सकते हैं: ए) के रूप में; बी) बीआर; सी) के; d) se। |
|
यौगिक में आयनिक संचार का सबसे स्पष्ट चरित्र: ए) कैल्शियम क्लोराइड; बी) पोटेशियम फ्लोराइड; सी) एल्यूमीनियम फ्लोराइड; डी) सोडियम क्लोराइड। |
|
उन पदार्थों को निर्दिष्ट करें कि सामान्य स्थिति के तहत सामान्य स्थिति के तहत अणुओं के बीच हाइड्रोजन बांड द्वारा निर्धारित किया जाता है: ए) हाइड्रोजन; बी) क्लोराइड; सी) तरल फ्लोराइन गार्डन; डी) पानी। |
|
सबसे टिकाऊ हाइड्रोजन बॉन्ड निर्दिष्ट करें: ए) -n .... एच-; b) -o .... एच-; सी) - .... एच-; डी) -s .... एच-। |
|
कम से कम मजबूत रिश्ते क्या है? ए) धातु; बी) आयनिक; सी) हाइड्रोजन; d) सहसंयोजक। |
|
एनएफ अणु में संचार के प्रकार को निर्दिष्ट करें 3 : ए) आयनिक; बी) गैर-ध्रुवीय सहसंयोजक; सी) ध्रुवीय सहसंयोजक डी) हाइड्रोजन। |
|
अनुक्रम संख्या 8 और 16 के साथ तत्वों के परमाणुओं के बीच रासायनिक बंधन: ए) आयनिक; बी) सहसंयोजक ध्रुवीय; सी) सहसंयोजक गैर-ध्रुवीय; डी) हाइड्रोजन। |
|
आवधिक कानून।
बिल्डिंग परमाणु
आलेख 8 वीं कक्षा में विषयगत नियंत्रण के लिए लेखकों द्वारा तैयार किए गए परीक्षण कार्यों के विषय पर परीक्षण कार्य प्रस्तुत करता है। (बैंक क्षमता - 8 वीं कक्षा में अध्ययन किए गए छह विषयों में से प्रत्येक के लिए 80 कार्य, और "अकार्बनिक यौगिकों के मूल वर्ग" के 120 कार्यों के लिए 80 कार्य। वर्तमान में, 8 वीं कक्षा में रसायन प्रशिक्षण नौ पाठ्यपुस्तकों पर किया जाता है। इसलिए, लेख के अंत में, ज्ञान के नियंत्रित तत्वों की एक सूची कार्य संख्याओं को इंगित करती है। यह शिक्षकों को एक विषय से कार्यों के उचित अनुक्रम और अंतिम नियंत्रण सहित विभिन्न विषयों से परीक्षण कार्यों के संयोजन का एक सेट चुनने के लिए विभिन्न कार्यक्रमों में काम करने की अनुमति देगा।
प्रस्तावित 80 परीक्षण कार्यों को चार विकल्पों में 20 प्रश्नों द्वारा समूहीकृत किया जाता है, जिसमें समान कार्य दोहराए जाते हैं। ज्ञान तत्वों की सूची से अधिक विकल्पों को संकलित करने के लिए, प्रत्येक अध्ययन की गई वस्तु के लिए अपनी विषयगत योजना के अनुसार (यादृच्छिक रूप से) कार्य संख्या का चयन करें। प्रत्येक विषय के लिए कार्यों की इस तरह की प्रस्तुति आपको त्रुटियों और उनके समय पर सुधार का त्वरित तत्व विश्लेषण खर्च करने की अनुमति देती है। एक अवतार में समान कार्यों का उपयोग, एक या दो सही उत्तरों का विकल्प प्रतिक्रिया का अनुमान लगाने की संभावना को कम कर देता है। एक नियम के रूप में, मुद्दों की जटिलता, पहले और दूसरे विकल्पों में से 3 और चौथे विकल्पों तक बढ़ जाती है।
एक राय है कि परीक्षण "अनुमान लगा रहे हैं"। हम सुझाव देते हैं कि यह जांचें कि क्या यह है। परीक्षण के बाद, परिणामों की तुलना अंक के साथ करें। यदि परीक्षण परिणाम नीचे हैं, तो इसे निम्नलिखित कारणों से समझाया जा सकता है।
सबसे पहले, ऐसे (परीक्षण) छात्रों के लिए असामान्य है। दूसरा, शिक्षक विषय के अध्ययन में जोर देता है (शिक्षा और शिक्षण पद्धति की सामग्री में मुख्य निर्धारित करना)।
विकल्प 1
कार्य।
1. चौथी अवधि में, समूह के माध्यम से एक अनुक्रम संख्या वाला तत्व है:
1) 25; 2) 22; 3) 24; 4) 34.
2. एटम +12 के न्यूक्लियस के आरोप के साथ तत्व एक अनुक्रम संख्या है:
1) 3; 2) 12; 3) 2; 4) 24.
3. तत्व की अनुक्रम संख्या इस विशेषताओं से मेल खाती है:
1) परमाणु नाभिक का प्रभार;
2) प्रोटॉन की संख्या;
3) न्यूट्रॉन की संख्या;
4. समूह संख्या के साथ तत्वों के परमाणुओं पर बाहरी ऊर्जा स्तर पर छह इलेक्ट्रॉन:
1) II; 2) III; 3) vi; 4) चतुर्थ।
5. उच्च ऑक्साइड क्लोरीन का सूत्र:
1) एसएल 2 ओ; 2) सीएल 2 ओ 3;
3) सीएल 2 ओ 5; 4) सीएल 2 ओ 7।
6. एल्यूमीनियम परमाणु का वैलेंस है:
1) 1; 2) 2; 3) 3; 4) 4.
7. समूह VI के तत्वों के अस्थिर हाइड्रोजन यौगिकों का कुल सूत्र:
1) एन 4; 2) en 3;
3) ne; 4) एच 2 ई।
8. कैल्शियम परमाणु में बाहरी इलेक्ट्रॉनिक परत की संख्या:
1) 1; 2) 2; 3) 3; 4) 4.
9.
1) ली; 2) ना; 3) के; 4) सीएस।
10. तत्व-धातु निर्दिष्ट करें:
1) के; 2) सीयू; 3) ओ; 4) एन।
11. टेबल में कहां डी.आई. इमेलीवा, तत्व स्थित हैं, जिनके परमाणु रासायनिक प्रतिक्रियाओं में केवल इलेक्ट्रॉनों देते हैं?
1) समूह II में;
2) दूसरी अवधि की शुरुआत में;
3) दूसरी अवधि के मध्य में;
4) वाया समूह में।
12.
2) वी, एमजी; अल;
3) एमजी, सीए, एसआर;
13. गैर-धातु तत्व निर्दिष्ट करें:
1) सीएल; 2) एस; 3) एमएन; 4) एमजी।
14. एक पंक्ति में गैर-धातु गुण वृद्धि:
15. समय-समय पर परमाणु परिवर्तन की विशेषताएं क्या हैं?
1) चार्ज न्यूक्लियस परमाणु;
2) परमाणु में ऊर्जा के स्तर की संख्या;
3) बाहरी ऊर्जा स्तर में इलेक्ट्रॉनों की संख्या;
4) न्यूट्रॉन की संख्या।
16.
1 करने के लिए; 2) अल; 3) पी; 4) सीएल।
17. कर्नेल के प्रभार में वृद्धि के साथ, तत्वों के परमाणुओं की त्रिज्या:
1) घटाओ;
2) मत बदलो;
3) वृद्धि;
4) समय-समय पर बदलें।
18. एक तत्व के परमाणुओं के आइसोटोप इस प्रकार भिन्न होते हैं:
1) न्यूट्रॉन की संख्या;
2) प्रोटॉन की संख्या;
3) वैलेंस इलेक्ट्रॉनों की संख्या;
4) तालिका में प्रावधान डीआई IMENDEEVA।
19. एटम के कर्नेल में न्यूट्रॉन की संख्या 12 एस:
1) 12; 2) 4; 3) 6; 4) 2.
20. फ्लोराइन परमाणु में ऊर्जा के स्तर द्वारा इलेक्ट्रॉनों का वितरण:
1) 2, 8, 4; 2) 2,6;
3) 2, 7; 4) 2, 8, 5.
विकल्प 2।
कार्य। एक या दो सही उत्तरों का चयन करें।
21. अनुक्रम संख्या 35 के साथ तत्व में है:
1) 7 वीं अवधि, आईवीए समूह;
2) चौथा अवधि, वीआईआईए समूह;
3) चौथा अवधि, VIIB समूह;
4) 7 वीं अवधि, आईवीबी समूह।
22. एटम +9 के न्यूक्लियस के आरोप के साथ तत्व एक अनुक्रम संख्या है:
1) 19; 2) 10; 3) 4; 4) 9.
23. तटस्थ परमाणु में प्रोटॉन की संख्या के साथ मेल खाता है:
1) न्यूट्रॉन की संख्या;
2) परमाणु द्रव्यमान;
3) अनुक्रम संख्या;
4) इलेक्ट्रॉनों की संख्या।
24. समूह संख्या के साथ तत्वों के परमाणुओं पर बाहरी ऊर्जा स्तर पर पांच इलेक्ट्रॉन:
1) मैं; 2) III; 3) वी; 4) VII।
25. उच्च नाइट्रोजन ऑक्साइड का सूत्र:
1) एन 2 ओ; 2) एन 2 ओ 3;
3) एन 2 ओ 5; 4) नहीं;
26. अपने उच्चतम हाइड्रॉक्साइड में कैल्शियम परमाणु का वैलेंस बराबर है:
1) 1; 2) 2; 3) 3; 4) 4.
27. अपने हाइड्रोजन यौगिक में आर्सेनिक परमाणु का वैलेंस है:
1) 1; 2) 2; 3) 3; 4) 4.
28. पोटेशियम परमाणु में बाहरी इलेक्ट्रॉनिक परत की संख्या:
1) 1; 2) 2; 3) 3; 4) 4.
29. तत्व से परमाणु का सबसे बड़ा त्रिज्या:
1) बी; 2) ओ; 3) सी; 4) एन।
30. तत्व-धातु निर्दिष्ट करें:
1 करने के लिए; 2) एच; 3) एफ; 4) सीयू।
31. दोनों तत्वों के परमाणुओं को लेने और लेने में सक्षम तत्वों, स्थित हैं:
1) आईए समूह में;
2) वाया समूह में;
3) दूसरी अवधि की शुरुआत में;
4) तीसरी अवधि के अंत में।
32.
1) ना, के, ली; 2) अल, एमजी, ना;
3) पी, एस, Сl; 4) ना, एमजी, अल।
33. गैर-धातु तत्व निर्दिष्ट करें:
1) ना; 2) एमजी; 3) सी; 4) पी।
34.
35. रासायनिक तत्व की मुख्य विशेषता:
1) परमाणु द्रव्यमान;
2) कोर का प्रभार;
3) ऊर्जा के स्तर की संख्या;
4) न्यूट्रॉन की संख्या।
36. उस तत्व का प्रतीक जिसका परमाणु एम्फोटेरिक ऑक्साइड बनाते हैं:
1) एन; 2) के; 3) एस; 4) जेडएन।
37. नाभिक के प्रभारी में वृद्धि के साथ रासायनिक तत्वों की आवधिक प्रणाली की मुख्य उपसमूह (ए) में, परमाणु त्रिज्या:
1) बढ़ता है;
2) घटता है;
3) नहीं बदलता है;
4) समय-समय पर भिन्न होता है।
38. परमाणु के नाभिक में न्यूट्रॉन की संख्या यह है:
1) इलेक्ट्रॉनों की संख्या;
2) प्रोटॉन की संख्या;
3) सापेक्ष परमाणु द्रव्यमान और प्रोटॉन की संख्या के बीच का अंतर;
4) परमाणु द्रव्यमान।
39. हाइड्रोजन आइसोटोप संख्या में भिन्न होते हैं:
1) इलेक्ट्रॉनों;
2) न्यूट्रॉन;
3) प्रोटॉन;
4) मेज में स्थिति।
40. सोडियम एटम में ऊर्जा के स्तर द्वारा इलेक्ट्रॉनों का वितरण:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5.
विकल्प 3।
कार्य। एक या दो सही उत्तरों का चयन करें।
41. आईवीए समूह में स्थित तत्व की अनुक्रम संख्या निर्दिष्ट करें, तालिका की चौथी अवधि डी। आईवीलीवा:
1) 24; 2) 34; 3) 32; 4) 82.
42. तत्व संख्या 13 के परमाणु के नाभिक का प्रभार है:
1) +27; 2) +14; 3) +13; 4) +3.
43. परमाणु में इलेक्ट्रॉनों की संख्या यह है:
1) न्यूट्रॉन की संख्या;
2) प्रोटॉन की संख्या;
3) परमाणु द्रव्यमान;
4) अनुक्रम संख्या।
44. समूह के आईवीए तत्वों के परमाणु, वैलेंस इलेक्ट्रॉनों की संख्या है:
1) 5; 2) 6; 3) 3; 4) 4.
45. श्रृंखला के सामान्य फॉर्मूला आर 2 ओ 3 फॉर्म तत्वों के साथ ऑक्साइड्स:
1) ना, के, ली; 2) एमजी, सीए, हो;
3) बी, अल, गा; 4) सी, एसआई, जीई।
46. अपने उच्चतम ऑक्साइड में फास्फोरस परमाणु का वैलेंस है:
1) 1; 2) 3; 3) 5; 4) 4.
47. समूह VIII के तत्वों के हाइड्रोजन यौगिकों:
1) एचसीएलओ 4; 2) एचसीएल;
3) एचबीआरओ; 4) एचबीआर।
48. सेलेना एटम में इलेक्ट्रॉनिक परतों की संख्या यह है:
1) 1; 2) 2; 3) 3; 4) 4.
49. तत्व से परमाणु का सबसे बड़ा त्रिज्या:
1) ली; 2) ना; 3) एमजी;
50. तत्व-धातु निर्दिष्ट करें:
1) ना; 2) एमजी; 3) सी; 4) पी।
51. परमाणुओं के तत्व आसानी से इलेक्ट्रॉनों देते हैं?
1) के; 2) सीएल; 3) ना; 4) एस।
52. कई तत्व जिनमें धातु गुण वृद्धि होती है:
1) सी, एन, बी, एफ;
2) अल, एसआई, पी, एमजी;
53. गैर-धातु तत्व निर्दिष्ट करें:
1) ना; 2) एमजी; 3) एन; 4) एस।
54. ऐसे कई तत्व जिनमें गैर-धातु गुण वृद्धि होती है:
1) ली, ना, के, एन;
2) अल, एसआई, पी, एमजी;
3) सी, एन, ओ, एफ;
4) ना, एमजी, अल, के।
55. परमाणु के नाभिक के प्रभार में वृद्धि के साथ, तत्वों के गैर-धातु गुण:
1) समय-समय पर बदलें;
2) बढ़ाया;
3) नहीं बदलते;
4) कमजोर।
56. उस तत्व का प्रतीक जिसका परमाणु एम्फोटेरिक हाइड्रोक्साइड बनाते हैं:
1) ना; 2) अल; 3) एन; 4) एस।
57. तत्वों और उनके यौगिकों के गुणों को बदलने की आवृत्ति समझाई गई है:
1) बाहरी इलेक्ट्रॉनिक परत की संरचना की पुनरावृत्ति;
2) इलेक्ट्रॉनिक परतों की संख्या में वृद्धि;
3) न्यूट्रॉन की संख्या में वृद्धि;
4) परमाणु द्रव्यमान में वृद्धि।
58. सोडियम एटम के नाभिक में प्रोटॉन की संख्या यह है:
1) 23; 2) 12; 3) 1; 4) 11.
59. एक तत्व के आइसोटोप के परमाणुओं के बीच क्या अंतर है?
1) प्रोटॉन की संख्या;
2) न्यूट्रॉन की संख्या;
3) इलेक्ट्रॉनों की संख्या;
4) कर्नेल का प्रभार।
60. लिथियम परमाणु में ऊर्जा के स्तर द्वारा इलेक्ट्रॉनों का वितरण:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5;
विकल्प 4।
कार्य। एक या दो सही उत्तरों का चयन करें।
61. अनुक्रम संख्या 2 9 के साथ तत्व में है:
1) चौथी अवधि, आईए समूह;
2) चौथी अवधि, आईबी समूह;
3) पहली अवधि, आईए समूह;
4) 5 वीं अवधि, आईए समूह।
62. तत्व संख्या 15 के परमाणु के नाभिक का प्रभार है:
1) +31; 2) 5; 3) +3; 4) +15.
63. परमाणु नाभिक का प्रभार निर्धारित किया जाता है:
1) तत्व की अनुक्रम संख्या;
2) समूह संख्या;
3) अवधि संख्या;
4) परमाणु द्रव्यमान।
64. समूह के III तत्वों के परमाणुओं पर, वैलेंस इलेक्ट्रॉनों की संख्या यह है:
1) 1; 2) 2; 3) 3; 4) 5.
65. उच्चतम सल्फर ऑक्साइड में एक सूत्र है:
1) एच 2 तो 3; 2) एच 2 सो 4;
3) तो 3; 4) तो 2।
66. उच्च फॉस्फोरस ऑक्साइड का सूत्र:
1) पी 2 ओ 3; 2) एच 3 पीओ 4;
3) एनआरयू 3; 4) पी 2 ओ 5।
67. नाइट्रोजन परमाणु का मूल्यांकन अपने हाइड्रोजन यौगिक में:
1) 1; 2) 2; 3) 3; 4) 4.
68. तालिका में अवधि संख्या D.I. Remeleeva एटम की निम्नलिखित विशेषता के अनुरूप है:
1) वैलेंस इलेक्ट्रॉनों की संख्या;
2) ऑक्सीजन के साथ यौगिक में उच्च वैलेंस;
3) इलेक्ट्रॉनों की कुल संख्या;
4) ऊर्जा के स्तर की संख्या।
69. तत्व से परमाणु का सबसे बड़ा त्रिज्या:
1) सीएल; 2) बीआर; 3) मैं; 4) एफ।
70. तत्व-धातु निर्दिष्ट करें:
1) एमजी; 2) ली; 3) एच; 4) एस।
71. इलेक्ट्रॉन देने के लिए किस तत्व की परमाणु में आसान है?
1) सोडियम; 2) सेसियम;
3) पोटेशियम; 4) लिथियम।
72. एक पंक्ति में धातु गुण वृद्धि:
1) ना, एमजी, अल; 2) ना, के, आरबी;
3) आरबी, के, ना; 4) पी, एस, सीएल।
73. गैर-धातु तत्व निर्दिष्ट करें:
1) सीयू; 2) में; 3) एन; 4) सीआर।
74. एन-पी-ए-एसबी गैर-धातु गुण:
1) घटाओ;
2) मत बदलो;
3) वृद्धि;
4) कमी, और फिर वृद्धि।
75. समय-समय पर परमाणु परिवर्तन की क्या विशेषताएं?
1) सापेक्ष परमाणु द्रव्यमान;
2) कोर का प्रभार;
3) परमाणु में ऊर्जा के स्तर की संख्या;
4) बाहरी स्तर पर इलेक्ट्रॉनों की संख्या।
76. परमाणु किस तत्व के रूप में एम्फोटेरिक ऑक्साइड बनाते हैं?
1 करने के लिए; 2) वी; 3) सी; 4) सा।
77. परमाणु नाभिक के प्रभार में वृद्धि के साथ अवधि में इलेक्ट्रॉन के आकर्षण को कर्नेल और धातु गुणों में बढ़ाया जाता है:
1) बढ़ाया;
2) समय-समय पर बदलें;
3) कमजोर;
4) मत बदलो।
78. तत्व का सापेक्ष परमाणु द्रव्यमान संख्यात्मक रूप से बराबर है:
1) कोर में प्रोटॉन की संख्या;
2) कर्नेल में न्यूट्रॉन की संख्या;
3) न्यूट्रॉन और प्रोटॉन की कुल संख्या;
4) परमाणु में इलेक्ट्रॉनों की संख्या।
79. एक परमाणु 16 ओ के नाभिक में न्यूट्रॉन की संख्या यह है:
1) 1; 2) 0; 3) 8; 4) 32.
80. सिलिकॉन परमाणु में ऊर्जा के स्तर द्वारा इलेक्ट्रॉनों का वितरण:
1) 2, 8, 4; 2) 2, 6;
3) 2, 7; 4) 2, 8, 5.
विषय पर ज्ञान के नियंत्रित तत्वों की सूची
"आवधिक कानून। परमाणु की संरचना
(कोष्ठक में नौकरी संख्या के माध्यम से दिया जाता है)
तत्व की अनुक्रम संख्या (1, 3, 21, 41, 61), एटम (2, 22, 42, 62, 63) के नाभिक का प्रभार, प्रोटॉन की संख्या (23) और इलेक्ट्रॉनों की संख्या (43) परमाणु में।
समूह संख्या, बाहरी ऊर्जा स्तर (4, 24, 44, 64) में इलेक्ट्रॉनों, उच्च ऑक्साइड सूत्र (5, 25, 45, 65), तत्व का उच्चतम वैलेंस (6, 26, 46, 66), सूत्र हाइड्रोजन यौगिकों (7, 27, 47, 67)।
अवधि संख्या, इलेक्ट्रॉनिक स्तर की संख्या (8, 28, 48, 68)।
परमाणु के त्रिज्या को बदलें (9, 17, 2 9, 37, 49, 67, 69)।
तालिका में स्थिति D.I.Mefeleeva तत्व-धातु (10, 30, 50, 70) और गैर धातु तत्व (13, 33, 53, 73)।
इलेक्ट्रॉनों को स्वीकार करने और स्वीकार करने की क्षमता (11, 31, 51, 71)।
सरल पदार्थों के गुणों को बदलना: समूहों द्वारा (12, 14, 34, 52, 54, 74) और अवधि (32, 72, 77)।
परमाणुओं की इलेक्ट्रॉनिक संरचना और सरल पदार्थों और उनके यौगिकों के गुणों में आवधिक परिवर्तन (15, 35, 55, 57, 75, 77)।
एम्फोटेरी ऑक्साइड और हाइड्रोक्साइड्स (16, 36, 56, 76)।
सामूहिक संख्या, परमाणु में प्रोटॉन और न्यूट्रॉन की संख्या, आइसोटोप (18, 1 9, 38, 3 9, 58, 5 9, 78, 79)।
परमाणु में ऊर्जा के स्तर (20, 40, 60, 80) द्वारा इलेक्ट्रॉनों का वितरण।
विषय पर परीक्षण कार्यों के उत्तर
"आवधिक कानून। परमाणु की संरचना
| विकल्प 1 | विकल्प 2। | विकल्प 3। | विकल्प 4। | ||||
|---|---|---|---|---|---|---|---|
| खोज संख्या | प्रतिक्रिया संख्या | खोज संख्या | प्रतिक्रिया संख्या | खोज संख्या | प्रतिक्रिया संख्या | खोज संख्या | प्रतिक्रिया संख्या |
| 1 | 4 | 21 | 2 | 41 | 3 | 61 | 2 |
| 2 | 2 | 22 | 4 | 42 | 3 | 62 | 4 |
| 3 | 1, 2 | 23 | 3, 4 | 43 | 2, 4 | 63 | 1 |
| 4 | 3 | 24 | 3 | 44 | 4 | 64 | 3 |
| 5 | 4 | 25 | 3 | 45 | 3 | 65 | 3 |
| 6 | 3 | 26 | 2 | 46 | 3 | 66 | 4 |
| 7 | 4 | 27 | 3 | 47 | 2, 4 | 67 | 3 |
| 8 | 4 | 28 | 4 | 48 | 4 | 68 | 4 |
| 9 | 4 | 29 | 1 | 49 | 5 | 69 | 3 |
| 10 | 1, 2 | 30 | 1, 4 | 50 | 1, 2 | 70 | 1, 2 |
| 11 | 1, 2 | 31 | 2, 4 | 51 | 1, 3 | 71 | 2 |
| 12 | 3 | 32 | 2 | 52 | 3 | 72 | 2 |
| 13 | 1, 2 | 33 | 3, 4 | 53 | 3, 4 | 73 | 2, 3 |
| 14 | 1 | 34 | 4 | 54 | 3 | 74 | 1 |
| 15 | 3 | 35 | 2 | 55 | 1 | 75 | 4 |
| 16 | 2 | 36 | 4 | 56 | 2 | 76 | 2 |
| 17 | 1 | 37 | 1 | 57 | 1 | 77 | 3 |
| 18 | 1 | 38 | 3 | 58 | 4 | 78 | 3 |
| 19 | 3 | 39 | 2 | 59 | 2 | 79 | 3 |
| 20 | 3 | 40 | 2 | 60 | 1 | 80 | 1 |
साहित्य
GORODNICHEV I.N.। रसायन शास्त्र का नियंत्रण और सत्यापन। एम।: एक्वेरियम, 1 99 7; सोरोकिन वी.वी., zlotnikov ई.जी.। रसायन परीक्षण। एम।: शिक्षा, 1 99 1।
परमाणुओं के सबसे महत्वपूर्ण गुणों में परिवर्तन की आवधिकता पर इसका उल्लेख किया गया था (पृष्ठ 172) - वैलेंस। अन्य महत्वपूर्ण गुण हैं जिनके परिवर्तन की आवृत्ति द्वारा विशेषता है। इस तरह के गुणों में परमाणु के आकार (त्रिज्या) शामिल हैं। परमाणु नहीं है सतहऔर सीमा अस्पष्ट है, बाहरी इलेक्ट्रॉन बादलों की घनत्व के रूप में क्योंकि यह इसे आसानी से घटता है। एटम रेडी पर डेटा अणुओं और क्रिस्टलीय संरचनाओं में अपने केंद्रों के बीच दूरी के निर्धारण से प्राप्त किया जाता है। क्वांटम यांत्रिकी के समीकरणों के आधार पर गणना भी की गई थी। अंजीर में। 5.10
अंजीर। 5.10। परमाणु त्रिज्या में परिवर्तन की आवृत्ति
कर्नेल के प्रभारी के आधार पर, परमाणु त्रिज्या में परिवर्तनों की वक्र।
हाइड्रोजन से हीलियम तक, त्रिज्या घट जाती है, और फिर लिथियम में तेजी से बढ़ जाती है। यह दूसरे ऊर्जा स्तर पर एक इलेक्ट्रॉन के आगमन के कारण है। लिथियम से नियो तक दूसरी अवधि में, कर्नेल का आरोप बढ़ता है, रेडी घटता है।
साथ ही, इस ऊर्जा स्तर में इलेक्ट्रॉनों की संख्या में वृद्धि उनके पारस्परिक प्रतिकृति में वृद्धि की ओर ले जाती है। इसलिए, अवधि के अंत तक, त्रिज्या में कमी धीमी हो जाती है।
नियॉन से सोडियम तक पहुंचने पर - तीसरी अवधि का पहला तत्व - त्रिज्या फिर से तेजी से बढ़ता है, और फिर धीरे-धीरे आर्गन को कम हो जाता है। उसके बाद, पोटेशियम में त्रिज्या में तेज वृद्धि हुई है। यह एक विशेषता आवधिक दृश्य वक्र निकलता है। एक महान गैस के लिए क्षार धातु वक्र के प्रत्येक खंड की अवधि में त्रिज्या में परिवर्तन की विशेषता है: बाएं से दाएं संक्रमण के दौरान त्रिज्या में कमी आई है। तत्वों के समूहों में त्रिज्या में परिवर्तन की प्रकृति को जानना भी दिलचस्प है। ऐसा करने के लिए, आपको एक ही समूह के तत्वों के माध्यम से एक रेखा पकड़ने की आवश्यकता है। क्षार धातु में मैक्सिमा की स्थिति के अनुसार, यह सीधे देखा जाता है कि समूह में संक्रमण के दौरान परमाणुओं की त्रिज्या ऊपर से नीचे की वृद्धि होती है। यह इलेक्ट्रॉनिक गोले की संख्या में वृद्धि के कारण है।
कार्य 5.17। एफ से परमाणुओं की त्रिज्या कैसे बदलती है? इसे चित्र में निर्धारित करें। 5.10।
परमाणुओं के कई अन्य गुण शारीरिक और रासायनिक दोनों, त्रिज्या पर निर्भर हैं। उदाहरण के लिए, परमाणुओं की त्रिज्या में वृद्धि लिथियम से सेसियम तक क्षार धातु पिघलने वाले तापमान में कमी की व्याख्या कर सकती है:
परमाणुओं के आकार उनकी ऊर्जा गुणों से जुड़े होते हैं। बाहरी इलेक्ट्रॉन बादलों की त्रिज्या जितनी अधिक होगी, उतनी ही आसान एक इलेक्ट्रॉन इलेक्ट्रॉन खो देता है। उसी समय, यह सकारात्मक रूप से चार्ज में बदल जाता है ओर वह।
आयन एटम के संभावित राज्यों में से एक है जिसमें इलेक्ट्रॉनों के नुकसान या अतिरिक्त के कारण इसका विद्युत शुल्क है।
एक सकारात्मक चार्ज आयन में जाने के लिए परमाणु की क्षमता की विशेषता है आयनीकरण ई I की ऊर्जा।यह गैस स्थिति में एक परमाणु से बाहरी इलेक्ट्रॉन को अलग करने के लिए आवश्यक न्यूनतम ऊर्जा है:
![]()
परिणामी सकारात्मक आयन इलेक्ट्रॉनों को भी खो सकता है, दो-श्रृंखला, तीन-चार्ट इत्यादि बन सकता है। आयनीकरण ऊर्जा की परिमाण काफी बढ़ रही है।
बाएं से दाएं स्थानांतरित होने पर परमाणुओं की आयनीकरण ऊर्जा बढ़ जाती है और शीर्ष से नीचे तक संक्रमण करते समय समूहों में घट जाती है।
बहुत से, लेकिन सभी परमाणु एक अतिरिक्त इलेक्ट्रॉन संलग्न करने में सक्षम नहीं हैं, एक नकारात्मक रूप से चार्ज आयन ~ में बदल रहे हैं। इस संपत्ति की विशेषता है इलेक्ट्रॉन ऊर्जा ई ऊर्जा ई सीएफ यह ऊर्जा प्रतिष्ठित है जब इलेक्ट्रॉन गैस राज्य में स्थित परमाणु से जुड़ा हुआ है:
![]()
आयनीकरण की ऊर्जा और इलेक्ट्रॉन के अंकुरण की ऊर्जा पर प्रथागत है 1 केजे / एमओएल में तिल परमाणु और एक्सप्रेस। एक इलेक्ट्रॉन के अनुलग्नक और हानि के परिणामस्वरूप सोडियम एटम के आयनीकरण पर विचार करें (चित्र 5.11) . आकृति से यह स्पष्ट है कि सोडियम परमाणु से एक इलेक्ट्रॉन के बहिष्कार के लिए आवश्यक है 10 एक बार एक इलेक्ट्रॉन से अधिक ऊर्जा आवंटित की जाती है जब एक इलेक्ट्रॉन जुड़ा होता है। नकारात्मक सोडियम आयन अस्थिर और जटिल पदार्थों में लगभग कभी नहीं मिला।

अंजीर। 5.11। सोडियम परमाणु का आयनीकरण
परमाणुओं की आयनीकरण ऊर्जा परमाणुओं के त्रिज्या में परिवर्तन के विपरीत दिशा में अवधि और समूहों में बदल जाती है। इस अवधि में इलेक्ट्रॉन के लिए प्रभाव की ऊर्जा में परिवर्तन अधिक कठिन है, क्योंकि आईआईए- और VIIIA-RPYNN एफ़िनिटी के तत्व अनुपस्थित हैं। हम लगभग मान सकते हैं कि एक इलेक्ट्रॉन संबंध की ऊर्जा की तरह है ईअवधि में वृद्धि (समूह VII समावेशी) और शीर्ष से नीचे तक समूहों में कमी (चित्र 5.12)।
कार्य 5 .eighteen। नकारात्मक चार्ज आयनों बनाने की गैसीय स्थिति में मैग्नीशियम और आर्गन परमाणु सकते हैं?
सकारात्मक और नकारात्मक आरोप वाले आयन स्वयं के बीच आकर्षित होते हैं, जिससे विभिन्न प्रकार के परिवर्तन होते हैं। सबसे सरल मामला आयनिक कनेक्शन का गठन है, यानी, इलेक्ट्रोस्टैटिक आकर्षण की क्रिया के तहत एक पदार्थ में आयनों का एकीकरण। फिर आयनिक क्रिस्टल संरचना होती है, एनएसीएल खाद्य नमक की विशेषता और कई अन्य लवण। लेकिन हो सकता है

अंजीर। 5.12। समूहों और अवधि में एक इलेक्ट्रॉन संबंध की आयनीकरण और ऊर्जा की ऊर्जा में परिवर्तन की प्रकृति
इसलिए, नकारात्मक आयन इसके अतिरिक्त इलेक्ट्रॉन, और सकारात्मक आयन को दृढ़ता से पकड़ नहीं रहा है, इसके विपरीत, इसकी इलेक्ट्रॉनिकता को बहाल करना चाहता है। फिर आयनों के बीच बातचीत अणुओं के गठन का कारण बन सकती है। जाहिर है, चार्ज सी 1 + और सी 1 ~ के विभिन्न संकेतों के आयनों को खुद के बीच आकर्षित किया जाता है। लेकिन इस तथ्य के कारण कि ये समान परमाणुओं के आयन हैं, वे परमाणुओं पर शून्य शुल्क के साथ एक सी 1 2 अणु बनाते हैं।
प्रश्न और व्यायाम
1. कितने प्रोटॉन, न्यूट्रॉन और इलेक्ट्रॉनों से ब्रोमाइन परमाणु होते हैं?
2.
आइसोटोपिंग प्रकृति के बड़े अंशों की गणना करें। ![]()
3. गठन के दौरान कितनी ऊर्जा जारी की जाती है 16 जीप्रतिक्रिया द्वारा ऑक्सीजन ![]() सितारों की गहराई में बह रहा है?
सितारों की गहराई में बह रहा है?
4. जब एक उत्साहित हाइड्रोजन परमाणु में इलेक्ट्रॉन ऊर्जा की गणना करें n \u003d3.
5. आयोडीन परमाणु के पूर्ण और संक्षिप्त इलेक्ट्रॉनिक सूत्रों को लिखें।
6. आयन का एक कम इलेक्ट्रॉनिक सूत्र लिखें।
7. पूर्ण और संक्षिप्त इलेक्ट्रॉनिक फॉर्मूला एटम और आईओएनए 2 लिखें।
8. फास्फोरस और आर्सेनिक परमाणुओं के ऊर्जा आरेखों का निर्माण।
9. जस्ता और गैलियम परमाणुओं के पूर्ण ऊर्जा आरेखों का निर्माण करें।
10. त्रिज्या बढ़ाने के क्रम में निम्नलिखित परमाणु रखें: एल्यूमीनियम, बोरॉन, नाइट्रोजन।
11. निम्नलिखित में से कौन सा आयन अपने बीच आयनिक क्रिस्टल संरचनाओं का निर्माण कर रहा है: आर + आर - के +, के -, i +, i -, ली +, ली -? अन्य संयोजनों में आयनों की बातचीत के दौरान क्या उम्मीद की जा सकती है?
12. मान लीजिए कि विकर्ण दिशा में आवधिक प्रणाली में संक्रमण के दौरान परमाणुओं के त्रिज्या की संभावित प्रकृति, उदाहरण के लिए ली - एमजी - एससी।