حسابات الآثار الحرارية من ردود الفعل. طرق لحساب الآثار الحرارية للتفاعلات الكيميائية في درجات حرارة مختلفة
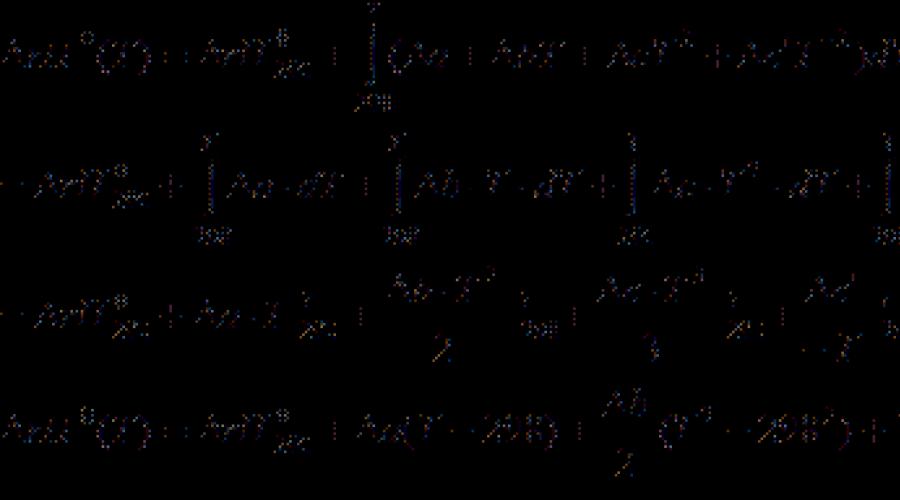
تعتمد جميع الطرق لحساب الآثار الحرارية على معادلة Kirchoff في النموذج المتكامل.
في معظم الأحيان، يستخدم المعيار 298.15K كدرجة حرارة الأولى.
يتم تقليل جميع طرق حساب الآثار الحرارية إلى أساليب أخذ الجزء الأيمن من المعادلة.
طرق اتخاذ جزء لا يتجزأ:
I. قبعات الحرارة الأوسط. هذه الطريقة هي الأسهل والأكثر دقة. في هذه الحالة، يتم استبدال التعبير بموجب علامة غير متكاملة بالتغيير في متوسط \u200b\u200bالسعة الحرارية، والتي لا تعتمد على درجة الحرارة في النطاق المحدد.
يتم جدولة متوسط \u200b\u200bالسعة الحرارية وقياس لمعظم ردود الفعل. من السهل حساب البيانات المرجعية.
II. وفقا لقبعات الحرارة الحقيقية. (بمساعدة صفوف درجة الحرارة)
في هذه الطريقة، تتم كتابة التعبير المعدني عن السعة الحرارية كدحة درجات الحرارة:

III. وفقا لمكونات درجة الحرارة العالية من enthalpy. تم توزيع هذه الطريقة على نطاق واسع مع تطوير تكنولوجيا الصواريخ عند حساب الآثار الحرارية للتفاعلات الكيميائية في درجات حرارة عالية. إنه يستند إلى تعريف سعة حرارة ISOBAR:

ارتفاع درجات الحرارة مكونات من enthalpy. يوضح كم ستتغير المادة القاسية الفردية عندما يتم تسخينها إلى عدد معين من الدرجات.
للتفاعل الكيميائي، الكتابة:

في هذا الطريق:
محاضرة رقم 3.
خطة المحاضرة:
1. الثاني قانون الديناميكا الحرارية، التعريف، السجل الرياضي.
2. تحليل الثاني من قانون الديناميكا الحرارية
3. حساب تغييرات الانتروبي في بعض العمليات
هنا ومهارس أخرى أنا. الرجوع إلى المواد الأولية أو الكواشف، والمؤشرات ج.- إلى مواد محددة أو منتجات رد الفعل؛ و - معاملات Stoichiometric في معادلة التفاعل للمواد البداية ومنتجات التفاعل، على التوالي.
مثال:احسب التأثير الحراري لتفاعل تخليق الميثانول بموجب الظروف القياسية.
قرار: لحسابات، سوف نستخدم البيانات المرجعية وفقا للحرارة القياسية للتشكيل المشترك في رد فعل المواد (انظر الجدول. 44 في الصفحة 72 من الكتاب المرجعي).
التأثير الحراري لتفاعل تخليق الميثانول بموجب الظروف القياسية بموجب النتيجة الأولى لقانون جيس (المعادلة 1.15) متساوية:
عند حساب الآثار الحرارية للتفاعلات الكيميائية، من الضروري أن تأخذ في الاعتبار أن التأثير الحراري يعتمد على الحالة الإجمالية للكواشف وعلى نوع تسجيل معادلة التفاعل الكيميائي:
في النتيجة الثانية لقانون جيسا، يمكن حساب التأثير الحراري باستخدام حرارة الاحتراق δ C H.كما الفرق في حرارة حرارة الاحتراق من مواد البداية ومنتجات التفاعل (مع مراعاة المعاملات العالية):
حيث δ. r c p. - يميز التغيير في السعة الحرارية ISOBARIC للنظام نتيجة تدفق التفاعل الكيميائي ويسمى معامل درجة حرارة التأثير الحراري للتفاعل.
من معادلة Kirchhoff التفاضلية، يتبع أن الاعتماد على التأثير الحراري على درجة الحرارة يتم تحديده بواسطة علامة δ r c p.وبعد ذلك يعتمد على حقيقة أن إجمالي القدرة الحرارية للمواد الأولية أو القدرة الحرارية الإجمالية لمنتجات التفاعل. دعونا نحلل المعادلة التفاضلية ل Kirchhoff.
1. إذا كانت معامل درجة الحرارة r c p.\u003e 0، ثم المشتق  \u003e 0 وظيفة
\u003e 0 وظيفة  في ازدياد. وبالتالي، فإن التأثير الحراري للرد على زيادة درجة الحرارة الزائدة.
في ازدياد. وبالتالي، فإن التأثير الحراري للرد على زيادة درجة الحرارة الزائدة.
2. إذا كانت معامل درجة الحرارة r c p.< 0, то производная  < 0 и функция
< 0 и функция  تنازلي. وبالتالي، فإن التأثير الحراري لرد الفعل مع زيادة درجة الحرارة المتزايدة.
تنازلي. وبالتالي، فإن التأثير الحراري لرد الفعل مع زيادة درجة الحرارة المتزايدة.
3. إذا كانت معامل درجة الحرارة r c p. \u003d 0، ثم المشتق  \u003d 0 أولا
\u003d 0 أولا  وبعد وبالتالي، فإن التأثير الحراري للتفاعل لا يعتمد على درجة الحرارة. لا تحدث هذه القضية في الممارسة العملية.
وبعد وبالتالي، فإن التأثير الحراري للتفاعل لا يعتمد على درجة الحرارة. لا تحدث هذه القضية في الممارسة العملية.
المعادلات التفاضلية مريحة للتحليل، ولكن غير مريحة للحسابات. من أجل الحصول على معادلة لحساب التأثير الحراري لتفاعل كيميائي، في عبور المعادلة التفاضلية ل Kirchhoff، تفصل المتغيرات:


تعتمد قدرة المواد الحرارية على درجة الحرارة، وبالتالي  وبعد ومع ذلك، في منطقة درجات الحرارة الشائعة الاستخدام في العمليات الكيميائية والتكنولوجية، فإن هذا الاعتماد غير مهم. بالنسبة للأغراض العملية، يتم استخدام مواد سعة الحرارة المتوسطة في نطاق درجة الحرارة من 298 إلى درجة الحرارة المحددة.
وبعد ومع ذلك، في منطقة درجات الحرارة الشائعة الاستخدام في العمليات الكيميائية والتكنولوجية، فإن هذا الاعتماد غير مهم. بالنسبة للأغراض العملية، يتم استخدام مواد سعة الحرارة المتوسطة في نطاق درجة الحرارة من 298 إلى درجة الحرارة المحددة.  التي تعطى في الكتب المرجعية. معامل درجة الحرارة من التأثير الحراري، محسوب باستخدام سعة حرارة متوسطة:
التي تعطى في الكتب المرجعية. معامل درجة الحرارة من التأثير الحراري، محسوب باستخدام سعة حرارة متوسطة:
مثال:احسب التأثير الحراري لتفاعل تخليق الميثانول عند درجة حرارة 1000 إلى الضغط القياسي.
قرار: لحسابات، سنستخدم البيانات المرجعية على متوسط \u200b\u200bسعة الحرارة للمواد التي تنطوي على رد الفعل في درجة الحرارة في نطاق درجة الحرارة من 298 إلى 1000 ك (انظر الجدول 40 في الصفحة 56 من الدليل):
التغييرات في متوسط \u200b\u200bالسعة الحرارية للنظام نتيجة تدفق التفاعل الكيميائي:
البداية الثانية من الديناميكا الحرارية
واحدة من أهم مهام الديناميكا الحرارية الكيميائية هي توضيح الاحتمال الرئيسي (أو عدم القدرة) للتدفق التلقائي لتفاعل كيميائي في الاتجاه قيد الدراسة. في الحالات التي يصبح فيها من الواضح أن هذا التفاعل الكيميائي قد يحدث، من الضروري تحديد درجة تحويل المواد المصدر والعائد من منتجات التفاعل، أي ملء التفاعل
يمكن تحديد اتجاه مسار العملية التلقائية على أساس القانون الثاني أو بداية الديناميكا الحرارية المصممة، على سبيل المثال، في شكل postement clausius:
لا يمكن للحرارة نفسها الانتقال من جسم بارد إلى ساخن، وهذا هو، مثل هذه العملية مستحيلة، والنتيجة الوحيدة التي كان الانتقال للحرارة من الجسم بدرجة حرارة أقل إلى الجسم مع درجة حرارة أعلى.
تم اقتراح مجموعة متنوعة من تركيبات البداية الثانية من الديناميكا الحرارية. صياغة طومسون - بلانك:
المحرك الأبدي من النوع الثاني مستحيل، أي مثل هذا الجهاز النشط بشكل دوري أمر مستحيل، مما سيسمح للحصول على تشغيل فقط عن طريق تبريد مصدر الحرارة.
يحدث الصيغة الرياضية للبدء الثاني من الديناميكا الحرارية عند تحليل تشغيل الأجهزة الحرارية في أعمال N. Carno و R. Clausius.
تم تقديم كلوسيوس وظيفة الدولة س.، اسمه Entopy، التغيير الذي يساوي حرارة العملية التي يمكن عكسها، يشار إلى درجة الحرارة
لأية عملية
 | (1.22) |
التعبير الناتج هو تعبير رياضي عن البداية الثانية من الديناميكا الحرارية.
الدفء القياسي للتربية (Enthalpy of Education) وتسمى Enthalpy من تشكيل تكوين 1 الصلاة من هذه المادة من العناصر (مواد بسيطة، وهذا يتكون من ذرات نوع واحد) في الحالة القياسية الأكثر استقرارا. يتم تقديم القطبين البيئي القياسي (CJ / MOL) في الكتب المرجعية. عند استخدام القيم المرجعية، من الضروري إيلاء الاهتمام لحالة المرحلة من المواد المشاركة في رد الفعل. enthalpy من تشكيل المواد البسيطة الأكثر استقرارا هو 0.
نتيجة نسبية من قانون GESS على حساب الآثار الحرارية للتفاعلات الكيميائية على حرارة التعليم : اساسي يتساوى التأثير الحراري للتفاعل الكيميائي حرارة حرارة تكوين منتجات التفاعل وحرارة تكوين المواد المصدر، مع مراعاة معاملات Stoichiometric (كميات الشامات) من الكواشف:
ش. 4 + 2 CO \u003d 3 ج ( الجرافيت ) + 2 H. 2 في
تلفزيون الغاز الغاز. غاز
تظهر حرارة تشكيل المواد في هذه الدول في الجدول. 1.2.
الجدول 1.2.
تشكيل دافئ من المواد
قرار
لأن رد الفعل يمر عندما P.\u003d CONT، ثم تم العثور على التأثير الحراري القياسي كتغيير في Enthalpy وفقا للحرارة المعروفة للتعليم نتيجة لقانون GESS (الصيغة (1.17):
н. حول 298 \u003d (2 · (-241.81) + 3 · 0) - (-74.85 + 2 · (-110،53)) \u003d -187،71 KJ \u003d -187710 J.
н. حول 298 < 0, реакция является экзотермической, протекает с выделением теплоты.
التغيير في الطاقة الداخلية نجد على أساس المعادلة (1.16):
u. حول 298 = hh. حول 298 – Δ ν · RT..
لهذا رد الفعل من التغييرات في عدد مولاات المواد الغازية بسبب مرور التفاعل الكيميائي Δν = 2 – (1 + 2) = –1; T.\u003d 298 ك، ثم
Δ U. حول 298 \u003d -187710 - (-1) · 8،314 · 298 \u003d -185232 J.
حساب الآثار الحرارية القياسية للتفاعلات الكيميائية وفقا للحرارة القياسية للاختراق المواد المشاركة في التفاعل
الاحتراق الحراري القياسي (مواد احتراق enthalpy)
يطلق عليه التأثير الحراري للأكسدة الكاملة من 1 الصلاة من مادة معينة (ما يصل إلى أكاسيد أعلى أو مركبات مبين خصيصا) مع الأكسجين، بشرط أن تكون المواد الأولية والثيقة درجة حرارة قياسية. مواد الاحتراق القياسية  (KJ / MOL) تعطى في الكتب المرجعية. عند استخدام القيم المرجعية، من الضروري الانتباه إلى علامة الفيل من رد فعل الاحتراق، وهو دائما ذكاء ( Δ
حاء
<0), а в таблицах указаны величины
(KJ / MOL) تعطى في الكتب المرجعية. عند استخدام القيم المرجعية، من الضروري الانتباه إلى علامة الفيل من رد فعل الاحتراق، وهو دائما ذكاء ( Δ
حاء
<0), а в таблицах указаны величины
 .
. الاحتراق enthalpy من أكاسيد أعلى (على سبيل المثال، ثاني أكسيد الماء والكربون) يساوي 0.
الاحتراق enthalpy من أكاسيد أعلى (على سبيل المثال، ثاني أكسيد الماء والكربون) يساوي 0.
نتيجة نسبية من قانون GESS على حساب الآثار الحرارية للتفاعلات الكيميائية على حرارة الاحتراق : يتساوى التأثير الحراري القياسي للتفاعل الكيميائي في حرارة حرارة الاحتراق من المواد الأولية وحرارة احتراق منتجات التفاعل، مع مراعاة معاملات Stoichiometric (كمية الشامات) للكواشف:
جيم 2 حاء 4 + حاء 2 في \u003d S. 2 ن. 5 هل هو.
مثلما تتمثل إحدى الخصائص الفيزيائية للشخص في القوة البدنية، فإن أهم مميزة لأي اتصال كيميائي هو قوة الاتصال، أي طاقتها.
أذكر أن الطاقة السندات الكيميائية - هذه الطاقة المخصصة في تكوين سند كيميائي أو الطاقة التي يجب إنفاقها لتدمير هذا الصدد.
التفاعل الكيميائي بشكل عام هو تحويل مواد واحدة إلى الآخرين. وبالتالي، خلال التفاعل الكيميائي، هناك كسر لبعض الاتصالات وتشكيل الآخرين، أي. تحول الطاقة.
ينص القانون الأساسي للفيزياء على أن الطاقة لا تنشأ من أي شيء ولا تختفي دون تتبع، ولكن يمر فقط من نوع واحد إلى آخر. بحكم عالمياتها، من الواضح أن هذا المبدأ ينطبق على رد فعل كيميائي.
التأثير الحراري للتفاعل الكيميائي دعا كمية الحرارة،
تخصيص (أو امتصاص) أثناء التفاعل والاستحقاق الذي كان رد فعل 1 مول (أو الناتجة).
يشار إلى التأثير الحراري بالحرف Q، وكما يتم قياس قاعدة، في KJ / MOL أو KCAL / MOL.
إذا حدث التفاعل مع الإصدار الحراري (Q\u003e 0)، فإنه يسمى emothermic، وإذا كان مع امتصاص الحرارة (Q< 0) – эндотермической.
إذا كان تخطيطي لتصوير ملف تعريف الطاقة لرد الفعل، فمن أجل ردود الفعل الواقية من الحرارة، تكون المنتجات فوق الطاقة من الكواشف، وللطاقة غير العكسية - على العكس من ذلك، توجد منتجات التفاعل أسفل الطاقة (أكثر استقرارا) من الكواشف.
من الواضح أن الأكبر تتفاعل المواد، أكبر كمية الطاقة منفصلة (أو امتصاصها)، أي التأثير الحراري يتناسب مباشرة مع كمية المادة. لذلك، فإن موقف التأثير الحراري ل 1 مول للمادة يرجع إلى رغبتنا في مقارنة الآثار الحرارية لردود الفعل المختلفة.
محاضرة 6. الكيمياء الحرارية. التأثير الحراري لمثال التفاعل الكيميائي 1. مع استعادة 8.0 غرام من أكسيد النحاس (II) من الهيدروجين، تم تشكيل أزواج النحاس والمعادن و 7.9 KJ الحرارة. احسب التأثير الحراري لتفاعل تخفيض أكسيد النحاس (II).
قرار . معادلة رد فعل CUO (TV.) + H2 (G.) \u003d CU (TV.) + H2 O (G.) + Q (*)
قم بعمل نسبة أثناء استعادة 0.1 مول - 7.9 KJ مخصص أثناء استعادة 1 مول - X KJ
حيث x \u003d + 79 kj / mole. المعادلة (*) تأخذ
Cuo (TV.) + H2 (G.) \u003d CU (TV.) + H2 O (G.) +79 KJ
المعادلة الحرارية- هذه معادلة تفاعل كيميائية تشير إلى الحالة الإجمالية لمكونات خليط التفاعل (الكواشف والمنتجات) والتأثير الحراري للرد الفعل.
من أجل تذوب الماء أو يتبخر الماء، من الضروري إنفاق كميات معينة من الحرارة، بينما أثناء تجميد المياه السائلة أو التكثيف بخار الماء يتم تخصيص نفس المبالغ. هذا هو السبب في أنه بارد عندما نخرج من الماء (يتطلب تبخر المياه من سطح الجسم تكاليف الطاقة)، \u200b\u200bوالتعرق هو آلية واقية بيولوجية من ارتفاع درجة الحرارة للجسم. على العكس من ذلك، يتجمد الفريزر الماء ويتزود الغرفة المحيطة بها، مما يمنحها حرارة مفرطة.
يوضح هذا المثال الآثار الحرارية للتغيرات في الحالة الإجمالية للمياه. حرارة الذوبان (في 0O C) λ \u003d 3.34 × 105 j / kg (الفيزياء) أو ql. \u003d - 6.02 KJ / MOL (الكيمياء)، تبخر الحرارة (التبخير) (في 100o C) Q \u003d 2.26 × 106 j / kg (الفيزياء) أو qisp. \u003d - 40.68 KJ / MOL (الكيمياء).
ذيل
تبخر |
|||||
oBR، 298.
محاضرة 6. الكيمياء الحرارية. التأثير الحراري للتفاعل الكيميائي هو بالطبع، عمليات التسامي ممكنة عند الصلبة
يذهب إلى مرحلة الغاز، متجاوزة الحالة السائلة والعمليات العكسية لترسب (التبلور) من مرحلة الغاز، من الممكن أيضا حساب أو قياس التأثير الحراري.
من الواضح أنه في كل مادة هناك روابط كيميائية، لذلك، تتمتع كل مادة ببعض احتياطي الطاقة. ومع ذلك، لا يمكن تحويل جميع المواد إلى بعضها البعض مع تفاعل كيميائي واحد. لذلك، وافق على تقديم دولة قياسية.
حالة القياسية للمادة- هذه هي حالة إجمالية للمادة عند درجة حرارة 298 ك، وهو ضغط من الغلاف الجوي الأول في الاعضاء الأكثر ثباتا في هذه الظروف.
الظروف القياسية- هذه هي درجة حرارة 298 K والضغط 1 الغلاف الجوي. يشار إلى الشروط القياسية (الحالة القياسية) بواسطة Index0.
اتصال تكوين الحرارة القياسي يطلق عليه التأثير الحراري للتفاعل الكيميائي لتشكيل هذا المركب من المواد البسيطة التي اتخذت في حالتها القياسية. يشار إلى حرارة التكوين المركب بواسطة رمز Q.0 لمجموعة متنوعة من المركبات، يتم تقديم التعليم الحراري القياسي في الكتب المرجعي للقيم الكيميائية الفيزيائية.
الحرارة القياسية لتكوين المواد البسيطة تساوي 0. على سبيل المثال، Q0 ARR.، 298 (O2، GAS) \u003d 0، Q0 ARR.، 298 (C، TV، الجرافيت) \u003d 0.
على سبيل المثال . سجل المعادلة العليا لتشكيل كبريتات النحاس (II). من كتاب المرجع Q0 ARR، 298 (Cuso4) \u003d 770 KJ / MOL.
Cu (TV.) + S (TV.) + 2O2 (G.) \u003d Cuso4 (TV) + 770 KJ.
ملاحظة: يمكن تسجيل المعادلة الكيميائية الكيميائية لأي مادة، ومع ذلك، فمن الضروري أن نفهم أنه في الحياة الحقيقية يحدث التفاعل بطريقة مختلفة تماما: من الكواشف المدرجة يتم تشكيلها عند أوكسيد ساخنة من النحاس (II) وكبريت )، لكن كبريتات النحاس (II) لا يتم تشكيلها. استنتاج مهم: المعادلة الكيميائية الكيميائية هي نموذج يسمح بالحسابات، وهو متسق بشكل جيد مع البيانات الرئيسية الأخرى الكيميائية، ولكنه لا يتحقق من التحقق من الممارسة (أي غير قادر على التنبؤ بإمكانية أو عدم القدرة على التفاعل بشكل صحيح).
(B J) - σ a i × q arr 0، 298
محاضرة 6. الكيمياء الحرارية. التأثير الحراري للتفاعل الكيميائي
توضيح. من أجل عدم تضليلك، سأضيف على الفور أن الديناميكا الحرارية الكيميائية قد تتنبأ بإمكانية / استحالة رد الفعلومع ذلك، فإن هذا يتطلب "أدوات" أكثر خطورة تتجاوز المسار الدراسي للكيمياء. المعادلة العليا مقارنة بهذه التقنيات هي الخطوة الأولى في خلفية هرم Hopse - دون أنه لا يمكن أن تفعل، ولكن ليس مرتفعا.
مثال 2. حساب التأثير الحراري لتعثث المياه وزنها 5،8G. يتم وصف عملية التكثيف من قبل المعادلة الحرارية H2 O (G.) \u003d H2 O (G.) + Q - التكثيف عادة عملية تكثيف الحرارة غير دقيقة في 25O C 37 KJ / MOL (الدليل).
وبالتالي، Q \u003d 37 × 0.32 \u003d 11.84 كيلو جي.
في القرن التاسع عشر، أنشأ الكيميائي الروسي، الذي درس الآثار الحرارية لردود الفعل، تجريبيا قانون الحفاظ على الطاقة فيما يتعلق بالتفاعلات الكيميائية - قانون هترة.
لا يعتمد التأثير الحراري للتفاعل الكيميائي على مسار العملية ويتم تحديده إلا من خلال الفرق في الدول المحدودة والأولي.
من وجهة نظر الكيمياء والرياضيات، يعني هذا القانون أننا أحرصنا على حساب العملية لاختيار أي "مسار للحساب"، لأن النتيجة لا تعتمد على ذلك. لهذا السبب، فإن قانون هيس مهم للغاية له أهمية لا يصدق نتيجة بقانون جيس.
يتساوى التأثير الحراري للتفاعل الكيميائي بمجموع حرارة تشكيل منتجات التفاعل صافي حرارة تكوين الكواشف (مع مراعاة معاملات Stoichiometric).
من وجهة نظر الحس السليم، يتوافق هذا التحقيق مع العملية التي تحولت فيها جميع الكواشف إلى مواد بسيطة، والتي تم جمعها بعد ذلك بطريقة جديدة، بحيث تم الحصول على منتجات التفاعل.
في شكل المعادلة، يبدو أن نتيجة قانون GESS يشبه معادلة التفاعل: A 1 A 1 + A 2 A 2 + ... + A N A \u003d B 1 B 1 + B 2 B 2 + ... ب
في الوقت نفسه، أنا I IB J هو معاملات Stoichiometric، A I-HADEGETS، B J - منتجات رد الفعل.
ثم نتيجة قانون جيسا لديه نموذج Q \u003d σ b j × q arr. 0، 298
ك bk + q
(أنا)
محاضرة 6. الكيمياء الحرارية. التأثير الحراري للتفاعل الكيميائي منذ الحرارة القياسية لتشكيل العديد من المواد
يمكن تحديد جدول) ملتزما جداول خاصة أو ب) تجريبيا، يصبح من الممكن التنبؤ (بحساب) التأثير الحراري لعدد كبير جدا من ردود الفعل ذات الدقة عالية بما فيه الكفاية.
مثال 3. (نتيجة قانون GESS). احسب التأثير الحراري للتحويل البخاري للميثان الذي يحدث في مرحلة الغاز في ظل ظروف قياسية:
CH4 (G.) + H2 O (G.) \u003d Co (G.) + 3 H2 ()
تحديد ما إذا كان رد الفعل هذا مغلقا أو حراري؟
الحل: نتيجة قانون GESS
س \u003d 3 Q0 | د) + Q 0 | (CO، D) -q 0 | د) -q 0 | س، د) - بشكل عام. |
|||||
oBR، 298. | oBR، 298. | oBR، 298. | oBR، 298. | ||||||
Q OB0. | 298 (ح 2، د) \u003d 0 | مادة بسيطة في حالة قياسية |
|||||||
من الكتاب المرجعي، نجد دفء تكوين المكونات المتبقية من الخليط.
س، د) \u003d 241.8 | (CO، D) \u003d 110.5 | د) \u003d 74.6 | |||||||||
oBR، 298. | oBR، 298. | oBR، 298. | |||||||||
نحن استبدل القيم إلى المعادلة
Q \u003d 0 + 110.5 - 74.6 - 241.8 \u003d -205.9 KJ / Mol، فإن التفاعل هو indothermich للغاية.
الجواب: Q \u003d -205.9 KJ / MOL، حريري
مثال 4. (تطبيق جيسا). دفء ردود الفعل معروفة
C (TV.) + o o (g.) \u003d co (g.) + 110.5 kj
C (TV.) + O2 (G.) \u003d CO2 (G.) + 393.5 KJ ابحث عن التأثير الحراري لرد الفعل 2CO (G.) + O2 (G.) \u003d 2CO2 (ز.). القرار مضاعفة الأول والثاني المعادلة في 2.
2C (TV.) + O2 (ز.) \u003d 2CO (G.) + 221 KJ 2C (TV.) + 2O2 (G.) \u003d 2CO2 (G.) + 787 KJ
تقديم من المعادلة الثانية الأول
O2 (G.) \u003d 2CO2 (G.) + 787 KJ - 2CO (G.) - 221 KJ،
2CO (G.) + O2 (G.) \u003d 2CO2 (G.) + 566 KJ الإجابة: 566 KJ / MOL.
ملاحظة: عند دراسة الكيمياء الحرارية، نعتبر التفاعل الكيميائي من الخارج (خارج). على العكس من ذلك، فإن الديناميكا الحرارية الكيميائية - علم سلوك السلوك الكيميائي - يعتبر النظام من الداخل ويعمل مع مفهوم "Enthalpy" H مثل الطاقة الحرارية للنظام. entalpy، مثل
محاضرة 6. الكيمياء الحرارية. التأثير الحراري للتفاعل الكيميائي هو نفس المعنى مثل كمية الحرارة، ولكن لديه علامة المعاكسة: إذا تم تمييز الطاقة من النظام، فإن بيئتها تحصل وتسخينها، والنظام يفقد الطاقة.
المؤلفات:
1. البرنامج التعليمي، V.V. Eremin، N.E. Kuzmenko et al.، الكيمياء الصف 9، الفقرة 19،
2. دليل تعليمي ومنهجي "أساسيات الكيمياء العامة" الجزء 1.
المجمعين - S.G. برام، I.N. ميرونوفا. - خذ معك! للاحتلال الندوة القادم
3. أ. مانع. أساسيات الكيمياء. http://hemi.nsu.ru/index.htm.
§9.1 التأثير الحراري للتفاعل الكيميائي. القوانين الرئيسية للكيمياء الحرارية.
§9.2 ** الكيمياء الحرارية (تابع). حرارة تشكيل المادة من العناصر.
التعليم المعياري enthalpy.
انتباه!
نذهب لحل مهام التسوية، وبالتالي، فإن الآلة الحاسبة مرغوبة أيضا في الندوات في الكيمياء.
تدرس الكيمياء الحرارية الآثار الحرارية للتفاعلات الكيميائية. في كثير من الحالات، تحدث هذه التفاعلات في حجم ثابت أو ضغط دائم. من القانون الأول من الديناميكا الحرارية، يتبع ذلك في ظل ظروف الحرارة هذه وظيفة وظيفة. مع حجم ثابت من الحرارة يساوي التغيير في الطاقة الداخلية:
وفي الضغط المستمر، التغيير في Enthalpy:
هذه المساواة في تطبيق ردود الفعل الكيميائية ضرورية قانون جيسا:
لا يعتمد التأثير الحراري للتفاعل الكيميائي المتدفن عند الضغط المستمر أو حجم ثابت على مسار التفاعل، ويتم تحديده فقط من قبل حالة الكواشف ومنتجات رد الفعل.
بمعنى آخر، فإن التأثير الحراري للتفاعل الكيميائي هو تغيير وظيفة الحالة.
في الكيمياء الحر، على النقيض من التطبيقات الديناميكية الحرارية الأخرى، تعتبر الحرارة إيجابية إذا تم تسليط الضوء عليها في البيئة، أي. اذا كان حاء < 0 или U.
< 0. Под тепловым эффектом химической реакции
понимают значение حاء (الذي يسمى ببساطة "رد فعل enthalpy") أو U. تفاعلات.
إذا عائدات التفاعل في الحل أو المرحلة الصلبة، حيث يكون التغيير في الحجم قليلا،
حاء = U. + (كاهن) U.. (3.3)
إذا كانت الغازات المثالية تشارك في رد الفعل، ثم في درجة حرارة ثابتة
حاء = U. + (كاهن) = U. + ن. راجع, (3.4)
حيث N هو تغيير في عدد مولاات الغازات في التفاعل.
من أجل تسهيل مقارنة Inthalpium من التفاعلات المختلفة، استخدم مفهوم "الدولة القياسية". الشرط القياسي هي حالة مادة نقية في ضغط من 1 بار (\u003d 10 5 سنويا) ودرجة حرارة معينة. بالنسبة للغازات، هذه حالة افتراضية في ضغط من 1 بار، والتي لديها خصائص الغاز المتنزع بلا حدود. enthalpy من رد الفعل بين المواد في الظروف المعيارية في درجات الحرارة T.، تدل على ( رديئة يعني "رد الفعل"). في المعادلات الحرارية، ليس فقط صياغ المواد، ولكن أيضا تشير الدول الإجمالية أو التعديلات البلورية.
من قانون هيس، تدفق العواقب الهامة، والتي تسمح بحساب enthalpy من التفاعلات الكيميائية.
كوربا 1.
![]()
يساوي الفرق في تشكيل المعيار المعياري لمنتجات التفاعل والكواشف (مع الأخذ في الاعتبار المعاملات Stoichiometric):
Standard enthalpy (الحرارة) من تكوين المواد (f. يعني "التكوين") في درجة حرارة معينة تسمى enthalpy من تشكيل تكوين صلاة واحدة من هذه المادة من العناصرتقع في الدولة القياسية الأكثر استدامة. وفقا لهذا التعريف، فإن Enthalpy من تشكيل المواد البسيطة الأكثر استقرارا في الدولة القياسية هو 0 في أي درجة حرارة. يتم إعطاء enthalpies القياسية لتشكيل المواد عند درجة حرارة 298 ك في الكتب المرجعية.
تستخدم مفاهيم "Enthalpy of Education" ليس فقط للمواد التقليدية، ولكن أيضا للأيونات في الحل. في الوقت نفسه، يتم استلام H + ION في كل نقطة مرجعية، والتي من المفترض أن يكون من المفترض أن يكون من المفترض أن يكون النموذج المعياري في الحل المائي صفر: ![]()
كوربا 2. قياسي enthalpy من التفاعل الكيميائي
![]()
يساوي اختلاف enthalpy من احتراق منتجات الكواشف ورد الفعل (مع الأخذ في الاعتبار معاملات المعاملات الزائفة):
(جيم يعني "creccucer"). يسمى Standard Enthealpy (Heat) من احتراق المادة Enthalpy من رد فعل الأكسدة الكلية لمادة صلاة واحدة. عادة ما تستخدم هذه النتيجة لحساب الآثار الحرارية للتفاعلات العضوية.
كوربا 3. إن enthalpy من التفاعل الكيميائي يساوي اختلاف طاقة تمزق السندات الكيميائية الناتجة.
مجال الاتصالات يسمى A- B الطاقة اللازمة لكسر سندات وتخفيف الجزيئات الناتجة عن المسافة اللانهائية:
AB (G) A (G) + B (G).
طاقة الاتصالات دائما إيجابية.
يتم تقديم معظم البيانات الرئيسية الكيميائية في الكتب المرجعية عند درجة حرارة 298 ك. لحساب الآثار الحرارية في استخدام درجات الحرارة الأخرى كيرشوف المعادلة:
(نموذج تفاضلي) (3.7)
 (النموذج المتكامل) (3.8)
(النموذج المتكامل) (3.8)
أين ج ب - اختلاف سعة حرارة ISOBARIC لمنتجات التفاعل ومواد البداية. إذا الفرق T. 2 - T. 1 صغير، ثم يمكنك أن تأخذ ج ب \u003d const. مع اختلاف كبير في درجة الحرارة، من الضروري استخدام الاعتماد على درجة الحرارة ج ب(T.) يكتب:
حيث المعاملات أ., ب., جيم إلخ. بالنسبة للمواد الفردية، فإنها تأخذ من الدليل، وتشير الإشارة إلى الفرق بين المنتجات والكواشف (مع مراعاة المعاملات).
أمثلة
مثال 3-1. المعياريين المعياري لتشكيل المياه السائلة والغازية في 298 k يساوي -285.8 و -241.8 كيلو جي / مول، على التوالي. حساب Enthalpy من تبخر المياه في درجة الحرارة هذه.
قراروبعد تتوافق التعليم enthalpy مع ردود الفعل التالية:
H 2 (g) + o 2 (g) \u003d h 2 O (g)، حاء 1 0 = -285.8;
H 2 (g) + o 2 (g) \u003d h 2 O (g)، حاء 2 0 = -241.8.
يمكن إجراء التفاعل الثاني في مرحلتين: أولا حرق الهيدروجين لتشكيل المياه السائلة من خلال رد الفعل الأول، ثم تتبخر الماء:
H 2 O (G) \u003d H 2 O (G)، حاء 0 هو \u003d؟
ثم، وفقا لقانون هيس،
حاء 1 0 + حاء 0 هو \u003d. حاء 2 0 ,
من عند حاء 0 ISP \u003d -241.8 - (-285.8) \u003d 44.0 KJ / MOL.
إجابه. 44.0 KJ / مول.
مثال 3-2. حساب رد فعل enthalpy
6C (g) + 6h (g) \u003d c 6 h 6 (g)
أ) على enthalpies التعليم؛ ب) عند طاقات الاتصالات، بموجب افتراض أن السندات المزدوجة في الجزيء C 6 H 6 ثابتة.
قراروبعد أ) التعليم Enthalpy (في KJ / MOLE) نجد في الدليل (على سبيل المثال، p.w.atkins، الكيمياء الفيزيائية، الطبعة الخامسة، PP. C9-C15): F H. 0 (C 6 H 6 (G)) \u003d 82.93، F H. 0 (C (G)) \u003d 716.68، F H. 0 (ح (ز)) \u003d 217.97. رد الفعل enthalpy هو:
ص ح 0 \u003d 82.93 - 6 716.68 - 6 217.97 \u003d -5525 KJ / MOL.
ب) في هذا التفاعل، لا يتم كسر الروابط الكيميائية، ولكن تشكلت فقط. في تقريب السندات المزدوجة الثابتة، يحتوي جزيء C 6 H 6 على 6 سندات C-H، 3 من الاتصالات C - C و 3 من الاتصالات C \u003d C. روابط الطاقة (في KJ / MOL) (p.w.atkins، الكيمياء الفيزيائية، الطبعة الخامسة، ص. C7): هيا(ج- ح) \u003d 412، هيا(ج- ج) \u003d 348، هيا(ج \u003d ج) \u003d 612. رد الفعل enthealpy يساوي:
ص ح 0 \u003d - (6 412 + 3 348 + 3 612) \u003d -5352 KJ / MOL.
الفرق مع النتيجة الدقيقة هو -5525 KJ / MOL يرجع إلى حقيقة أنه في جزيء البنزين لا توجد روابط واحدة من C - C والسندات المزدوجة C \u003d C، وهناك 6 روابط عطرية مع C C.
إجابه. أ) -5525 كيلو جي / مول؛ ب) -5352 KJ / الخلد.
مثال 3-3. استخدام البيانات المرجعية، حساب enthalpy من التفاعل
3CU (TV) + 8hno 3 (AQ) \u003d 3CU (رقم 3) 2 (AQ) + 2NO (G) + 4H 2 O (G)
قراروبعد المعادلة التفاعل الأيونية المختصرة لديها النموذج:
3CU (TV) + 8H + (AQ) + 2NO 3 - (AQ) \u003d 3CU 2+ (AQ) + 2NO (G) + 4H 2 O (G).
وفقا لقانون GESS، فإن رد الفعل enthalpy يساوي:
ص ح 0 = 4 F H. 0 (H 2 O (G)) + 2 F H. 0 (لا (g)) + 3 F H. 0 (CU 2+ (AQ)) - 2 F H. 0 (رقم 3 - (AQ))
(تنشيط تكوين النحاس والأيون H + متساوية، بحكم التعريف، 0). تعليم تعليمي فرعي (P.W.ATKINS، الكيمياء الفيزيائية، الطبعة الخامسة، ص. C9-C15)، نجد:
ص ح 0 \u003d 4 (-285.8) + 2 90.25 + 3 64.77 - 2 (-205.0) \u003d -358.4 KJ
(لكل ثلاثة صلاة النحاس).
إجابه. -358.4 KJ.
مثال 3-4. احسب enthalpy من احتراق الميثان بسعر 1000 ك إذا تم تقديم enthalpy of Formation في 298 إلى: F H. 0 (الفصل 4) \u003d -17.9 KCAL / MOL F H. 0 (CO 2) \u003d -94.1 KCAL / MOL F H. 0 (H 2 O (G)) \u003d -57.8 KCAL / MOL. سعة حرارة للغازات (في كال / (العثة. ك)) في النطاق من 298 إلى 1000 ك يساوي:
C P (CH 4) \u003d 3.422 + 0.0178. T., ج ب(O 2) \u003d 6.095 + 0.0033. T.,
C P (CO 2) \u003d 6.396 + 0.0102. T., ج ب(H 2 O (D)) \u003d 7.188 + 0.0024. T..
قراروبعد enhaulpia رد فعل الاحتراق غيظ
CH 4 (G) + 2O 2 (g) \u003d co 2 (g) + 2h 2 O (g)
في 298 إلى المساواة:
94.1 + 2 (-57.8) - (-17.9) \u003d -191.8 KCAL / MOL.
ابحث عن اختلاف سعة الحرارة كدالة لدرجة الحرارة:
ج ب = ج ب(CO 2) + 2 ج ب(ح 2 O (ز)) - ج ب(الفصل 4) - 2 ج ب(O 2) \u003d
= 5.16 - 0.0094T. (كال / (العثة. ك)).
enthalpy من رد الفعل على 1000 لحساب وفقا لمعادلة Kirchhoff:
= +  = -191800 + 5.16
= -191800 + 5.16
(1000-298) - 0.0094 (1000 2 -298 2) / 2 \u003d -192500 كال / مول.
إجابه. -192.5 KCAL / MOL.
مهام
3-1. كم ستكون هناك حاجة للحرارة للترجمة التي تبلغ 500 جم (t.pl. 658 o C، حاء 0 pl \u003d 92.4 كال / ز)، أخذت في درجة حرارة الغرفة، في الحالة المنصهرة، إذا ج ب(Al TV) \u003d 0.183 + 1.096 10 -4 T. كال / (G ك)؟
3-2. تفاعل Standard Enthealpy Caco 3 (TV) \u003d CAO (TV) + CO 2 (G) يحدث في وعاء مفتوح عند درجة حرارة 1000 ك، يساوي 169 كيلو جي / مول. ما يساوي حرارة هذا التفاعل يتدفق في نفس درجة الحرارة، ولكن في الأوعية المغلقة؟
3-3. احسب الطاقة الداخلية القياسية لتشكيل البنزين السائل عند 298 ك، إذا كانت Enthalpy القياسية من تشكيلها 49.0 كيلو جي / مول.
3-4. حساب enthalpy formation n 2 o 5 (d) في T. \u003d 298 ك بناء على البيانات التالية:
2no (g) + o 2 (g) \u003d 2no 2 (g)، حاء 1 0 \u003d -114.2 KJ / MOL،
4NO 2 (G) + O 2 (G) \u003d 2N 2 O 5 (G)، حاء 2 0 \u003d -110.2 KJ / MOL،
n 2 (g) + o 2 (g) \u003d 2no (g)، حاء 3 0 \u003d 182.6 KJ / MOL.
3-5. إن الانحاذن الاحتراق - الجلوكوز، وهو -2802 يساوي -2802،
-2810 و -5644 كيلو جي / مول، على التوالي. حساب دفء التحلل المائي للسكروز.
3-6. تحديد تشكيل enthalpy لتشكيل B 2 H 6 (G) متى T. \u003d 298 إلى البيانات التالية:
B 2 H 6 (G) + 3O 2 (G) \u003d B 2 O 3 (TV) + 3H 2 O (G)، حاء 1 0 \u003d -2035.6 KJ / MOL
2B (TV) + 3/2 O 2 (G) \u003d B 2 O 3 (TV)، حاء 2 0 \u003d -1273.5 KJ / MOL،
H 2 (G) + 1/2 O 2 (G) \u003d H 2 O (G)، حاء 3 0 \u003d -2241.8 KJ / MOL.
3-7. حساب حرارة تكوين كبريتات الزنك من المواد البسيطة عندما T. \u003d 298 ك بناء على البيانات التالية.