การคำนวณผลกระทบทางความร้อนของปฏิกิริยา วิธีการคำนวณผลกระทบทางความร้อนของปฏิกิริยาเคมีในอุณหภูมิที่แตกต่างกัน
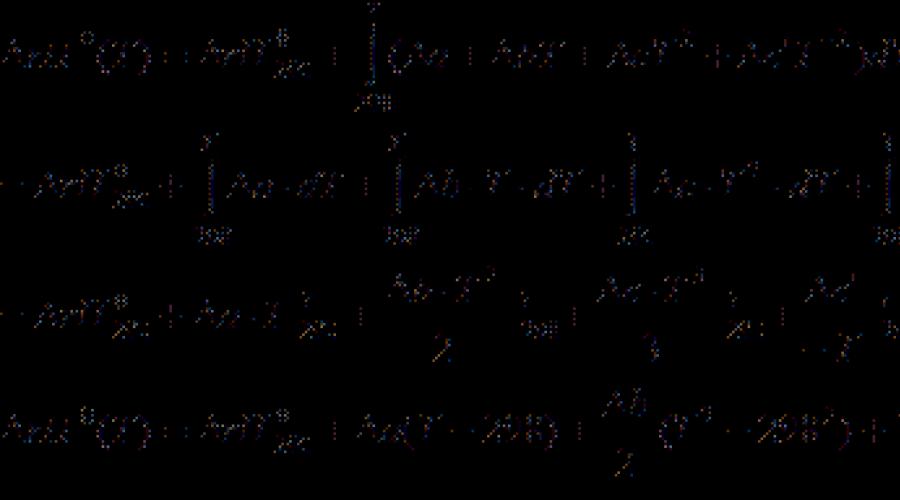
วิธีการทั้งหมดสำหรับการคำนวณเอฟเฟกต์ความร้อนจะขึ้นอยู่กับสมการ Kirchoff ในรูปแบบอินทิกรัล
ส่วนใหญ่มักใช้มาตรฐาน 298.15k เป็นอุณหภูมิแรก
วิธีการทั้งหมดสำหรับการคำนวณผลกระทบความร้อนจะลดลงเป็นวิธีการรับส่วนสำคัญของส่วนที่ถูกต้องของสมการ
วิธีการใช้งานรวม:
I. หมวกความร้อนกลาง วิธีนี้เป็นวิธีที่ง่ายและแม่นยำที่สุด ในกรณีนี้การแสดงออกภายใต้เครื่องหมายอินทิกรัลจะถูกแทนที่ด้วยการเปลี่ยนแปลงความจุความร้อนเฉลี่ยซึ่งไม่ได้ขึ้นอยู่กับอุณหภูมิในช่วงที่เลือก
ความจุความร้อนเฉลี่ยจะถูกจัดตารางและวัดสำหรับปฏิกิริยาส่วนใหญ่ ง่ายต่อการคำนวณข้อมูลอ้างอิง
ครั้งที่สอง ตามที่หมวกความร้อนที่แท้จริง (ด้วยความช่วยเหลือของแถวอุณหภูมิ)
ในวิธีนี้การแสดงออกของการรวมความจุความร้อนเป็นช่วงอุณหภูมิ:

สาม. ตามส่วนประกอบที่อุณหภูมิสูงของเอนทัลปี วิธีนี้มีการกระจายอย่างกว้างขวางด้วยการพัฒนาเทคโนโลยีจรวดเมื่อคำนวณผลกระทบทางความร้อนของปฏิกิริยาเคมีที่อุณหภูมิสูง มันขึ้นอยู่กับคำจำกัดความของความจุความร้อน Isobar:

ส่วนประกอบอุณหภูมิสูงของเอนทัลปี มันแสดงให้เห็นว่าความเอนทัลปีของสารแต่ละชนิดจะเปลี่ยนไปเมื่อมีความร้อนกับองศาจำนวนหนึ่ง
สำหรับปฏิกิริยาเคมีเขียน:

ทางนี้:
การบรรยายหมายเลข 3
แผนการบรรยาย:
1. II กฎของอุณหพลศาสตร์นิยามบันทึกทางคณิตศาสตร์
2. การวิเคราะห์ II ของกฎหมายของอุณหพลศาสตร์
3. การคำนวณการเปลี่ยนแปลงเอนโทรปีในบางกระบวนการ
ที่นี่และดัชนีเพิ่มเติม ผม. อ้างถึงสารเริ่มต้นหรือรีเอเจนต์และดัชนี เจ.- เพื่อสาร จำกัด หรือผลิตภัณฑ์ปฏิกิริยา; และ - สัมประสิทธิ์ Stoichiometric ในสมการปฏิกิริยาสำหรับวัสดุเริ่มต้นและผลิตภัณฑ์ปฏิกิริยาตามลำดับ
ตัวอย่าง:คำนวณผลความร้อนของปฏิกิริยาการสังเคราะห์เมทานอลภายใต้เงื่อนไขมาตรฐาน
การตัดสินใจ: สำหรับการคำนวณเราจะใช้ข้อมูลอ้างอิงตามความร้อนมาตรฐานของการก่อตัวที่เกี่ยวข้องกับปฏิกิริยาสาร (ดูตาราง 44 ในหน้า 72 ของหนังสืออ้างอิง)
ผลความร้อนของปฏิกิริยาการสังเคราะห์เมทานอลภายใต้เงื่อนไขมาตรฐานภายใต้ผลแรกของกฎหมาย GESS (สมการ 1.15) เท่ากับ:
เมื่อคำนวณผลกระทบทางความร้อนของปฏิกิริยาทางเคมีจำเป็นต้องคำนึงถึงว่าเอฟเฟกต์ความร้อนขึ้นอยู่กับสถานะรวมของรีเอเจนต์และประเภทของการบันทึกของสมการปฏิกิริยาเคมี:
ในผลที่สองของกฎหมาย Gessa สามารถคำนวณผลความร้อนได้โดยใช้ความร้อนของการเผาไหม้ δ C H.เป็นความแตกต่างในความร้อนของความร้อนของการเผาไหม้ของวัสดุเริ่มต้นและผลิตภัณฑ์ปฏิกิริยา (คำนึงถึงค่าสัมประสิทธิ์ stoichiometric):
ที่ไหนδ r c p. - กำหนดลักษณะการเปลี่ยนแปลงในความจุความร้อน Isobaric ของระบบเป็นผลมาจากการไหลของปฏิกิริยาเคมีและเรียกว่าค่าสัมประสิทธิ์อุณหภูมิของผลความร้อนของปฏิกิริยา
จากสมการ Kirchhoff ที่แตกต่างกันมันตามมาว่าการพึ่งพาของผลความร้อนที่มีต่ออุณหภูมิจะถูกกำหนดโดยเครื่องหมายδ r c p.. ขึ้นอยู่กับความจริงที่ว่าความจุความร้อนทั้งหมดของสารเริ่มต้นหรือความจุความร้อนรวมของผลิตภัณฑ์ปฏิกิริยา ให้เราวิเคราะห์สมการเชิงอนุพันธ์ของ Kirchhoff
1. หากค่าสัมประสิทธิ์อุณหภูมิδ r c p.\u003e 0 จากนั้นอนุพันธ์  \u003e 0 และฟังก์ชั่น
\u003e 0 และฟังก์ชั่น  เพิ่มขึ้น ดังนั้นผลความร้อนของปฏิกิริยาที่เพิ่มขึ้นของอุณหภูมิที่เพิ่มขึ้น
เพิ่มขึ้น ดังนั้นผลความร้อนของปฏิกิริยาที่เพิ่มขึ้นของอุณหภูมิที่เพิ่มขึ้น
2. หากค่าสัมประสิทธิ์อุณหภูมิδ r c p.< 0, то производная  < 0 и функция
< 0 и функция  จากมากไปน้อย ดังนั้นผลความร้อนของปฏิกิริยาที่มีอุณหภูมิเพิ่มขึ้นลดลง
จากมากไปน้อย ดังนั้นผลความร้อนของปฏิกิริยาที่มีอุณหภูมิเพิ่มขึ้นลดลง
3. หากค่าสัมประสิทธิ์อุณหภูมิδ r c p. \u003d 0 จากนั้นอนุพันธ์  \u003d 0 I.
\u003d 0 I.  . ดังนั้นผลความร้อนของปฏิกิริยาไม่ได้ขึ้นอยู่กับอุณหภูมิ กรณีนี้ไม่ได้เกิดขึ้นในทางปฏิบัติ
. ดังนั้นผลความร้อนของปฏิกิริยาไม่ได้ขึ้นอยู่กับอุณหภูมิ กรณีนี้ไม่ได้เกิดขึ้นในทางปฏิบัติ
สมการเชิงอนุพันธ์สะดวกสำหรับการวิเคราะห์ แต่อึดอัดสำหรับการคำนวณ เพื่อให้ได้สมการสำหรับการคำนวณผลความร้อนของปฏิกิริยาเคมีในการข้ามสมการเชิงอนุพันธ์ของ Kirchhoff แยกตัวแปร:


ความจุความร้อนของสารนั้นขึ้นอยู่กับอุณหภูมิดังนั้นและ  . อย่างไรก็ตามในภูมิภาคของอุณหภูมิที่ใช้กันทั่วไปในกระบวนการทางเคมีและเทคโนโลยีการพึ่งพานี้ไม่สำคัญ เพื่อวัตถุประสงค์ในทางปฏิบัติสารความจุความร้อนปานกลางจะใช้ในช่วงอุณหภูมิตั้งแต่ 298 ไปจนถึงอุณหภูมิที่ระบุ
. อย่างไรก็ตามในภูมิภาคของอุณหภูมิที่ใช้กันทั่วไปในกระบวนการทางเคมีและเทคโนโลยีการพึ่งพานี้ไม่สำคัญ เพื่อวัตถุประสงค์ในทางปฏิบัติสารความจุความร้อนปานกลางจะใช้ในช่วงอุณหภูมิตั้งแต่ 298 ไปจนถึงอุณหภูมิที่ระบุ  ซึ่งได้รับในหนังสืออ้างอิง ค่าสัมประสิทธิ์อุณหภูมิของผลความร้อนคำนวณโดยใช้ความจุความร้อนปานกลาง:
ซึ่งได้รับในหนังสืออ้างอิง ค่าสัมประสิทธิ์อุณหภูมิของผลความร้อนคำนวณโดยใช้ความจุความร้อนปานกลาง:
ตัวอย่าง:คำนวณผลความร้อนของปฏิกิริยาการสังเคราะห์เมทานอลที่อุณหภูมิ 1,000 ถึงและแรงดันมาตรฐาน
การตัดสินใจ: สำหรับการคำนวณเราจะใช้ข้อมูลอ้างอิงเกี่ยวกับความจุความร้อนเฉลี่ยของสารที่เกี่ยวข้องกับปฏิกิริยาในช่วงอุณหภูมิตั้งแต่ 298 ถึง 1,000 K (ดูตารางที่ 40 ในหน้า 56 ของไดเรกทอรี):
การเปลี่ยนแปลงในความจุความร้อนเฉลี่ยของระบบอันเป็นผลมาจากการไหลของปฏิกิริยาเคมี:
จุดเริ่มต้นที่สองของอุณหพลศาสตร์
หนึ่งในภารกิจที่สำคัญที่สุดของอุณหพลศาสตร์เคมีคือการชี้แจงความเป็นไปได้หลัก (หรือการไร้ความสามารถ) ของการไหลของปฏิกิริยาทางเคมีในทิศทางภายใต้การพิจารณาภายใต้การพิจารณา ในกรณีที่ชัดเจนว่าการมีปฏิสัมพันธ์ทางเคมีนี้อาจเกิดขึ้นได้มีความจำเป็นต้องกำหนดระดับของการเปลี่ยนแปลงของสารต้นฉากและผลผลิตของผลิตภัณฑ์ปฏิกิริยานั่นคือความบริบูรณ์ของปฏิกิริยา
ทิศทางของกระบวนการที่เกิดขึ้นเองสามารถกำหนดได้บนพื้นฐานของกฎหมายที่สองหรือการโจมตีของ Thermodynamics สูตรตัวอย่างเช่นในรูปแบบของ Clausius Postulate:
ความร้อนนั้นไม่สามารถขยับจากร่างกายเย็น ๆ เพื่อร้อนนั่นคือกระบวนการดังกล่าวเป็นไปไม่ได้ผลลัพธ์เพียงอย่างเดียวซึ่งคือการเปลี่ยนความร้อนจากร่างกายด้วยอุณหภูมิที่ต่ำกว่ากับร่างกายที่มีอุณหภูมิสูงขึ้น
มีการเสนอสูตรที่หลากหลายของการเริ่มต้นที่สองของอุณหพลศาสตร์ ถ้อยคำของ Thomson - Planck:
เครื่องยนต์นิรันดร์ชนิดที่สองเป็นไปไม่ได้ I.e. เครื่องที่ใช้งานเป็นระยะ ๆ เป็นไปไม่ได้ซึ่งจะช่วยให้สามารถดำเนินการได้โดยการระบายความร้อนจากแหล่งความร้อนเท่านั้น
สูตรทางคณิตศาสตร์ของการเริ่มต้นที่สองของอุณหพลศาสตร์เกิดขึ้นเมื่อวิเคราะห์การทำงานของเครื่องความร้อนในผลงานของ N. Carno และ R. Clausius
Clausius ได้รับการแนะนำให้รู้จักกับการทำงานของรัฐ S., ชื่อเอนโทรปี, การเปลี่ยนแปลงที่เท่ากับความร้อนของกระบวนการที่สามารถย้อนกลับได้เรียกว่าอุณหภูมิ
สำหรับกระบวนการใด ๆ
 | (1.22) |
การแสดงออกที่เกิดขึ้นคือการแสดงออกทางคณิตศาสตร์ของการเริ่มต้นที่สองของอุณหพลศาสตร์
สัดส่วนมาตรฐานความอบอุ่นของการศึกษา (Enthalpy of Education) มันเรียกว่า Enthalpy ของการก่อตัวของการก่อตัวของ 1 การสวดอ้อนวอนของสารนี้จากองค์ประกอบ (สารที่เรียบง่ายนั่นคือประกอบด้วยอะตอมของหนึ่งชนิด) ในสถานะมาตรฐานที่มั่นคงที่สุด Enthalpies สิ่งแวดล้อมมาตรฐาน (CJ / MOL) จะได้รับในหนังสืออ้างอิง เมื่อใช้ค่าอ้างอิงจำเป็นต้องใส่ใจกับสถานะของสารที่เกี่ยวข้องในปฏิกิริยา Enthalpy ของการก่อตัวของสารง่าย ๆ ที่เสถียรที่สุดคือ 0
บทกวับจากกฎหมาย GESS เกี่ยวกับการคำนวณผลกระทบทางความร้อนของปฏิกิริยาเคมีต่อความร้อนของการศึกษา : มาตรฐาน ผลความร้อนของปฏิกิริยาเคมีเท่ากับความร้อนของความร้อนของการก่อตัวของผลิตภัณฑ์ปฏิกิริยาและความร้อนของการก่อตัวของสารต้นฉากโดยคำนึงถึงค่าสัมประสิทธิ์ stoichiometric (ปริมาณของโมล) ของรีเอเจนต์:
Ch 4 + 2 co \u003d 3 c ( กราไฟท์ ) + 2 H 2 O.
แก๊สแก๊สทีวี. แก๊ส
ความร้อนของการก่อตัวของสารในสถานะเฟสเหล่านี้จะแสดงในตาราง 1.2
ตารางที่ 1.2
การก่อตัวที่อบอุ่นของสาร
การตัดสินใจ
ตั้งแต่ปฏิกิริยาผ่านไปเมื่อ พี.\u003d const จากนั้นเอฟเฟ็กต์ความร้อนมาตรฐานจะพบว่าเป็นการเปลี่ยนแปลงในเอนทาลปีตามความร้อนที่รู้จักของการศึกษาโดยผลของกฎหมาย GESS (สูตร (1.17):
δн. เกี่ยวกับ 298 \u003d (2 · (-241.81) + 3 · 0) - (-74.85 + 2 · (-110,53)) \u003d -187,71 KJ \u003d -187710 J.
δн. เกี่ยวกับ 298 < 0, реакция является экзотермической, протекает с выделением теплоты.
การเปลี่ยนแปลงพลังงานภายในเราพบบนพื้นฐานของสมการ (1.16):
δU เกี่ยวกับ 298 = . เกี่ยวกับ 298 – Δ ν· RT.
สำหรับปฏิกิริยาของการเปลี่ยนแปลงนี้ในจำนวนโมลของสารก๊าซเนื่องจากเนื้อเรื่องของปฏิกิริยาเคมี Δν = 2 – (1 + 2) = –1; ต.\u003d 298 k แล้ว
Δ ยู. เกี่ยวกับ 298 \u003d -187710 - (-1) · 8,314 · 298 \u003d -185232 J.
การคำนวณผลกระทบทางความร้อนมาตรฐานของปฏิกิริยาเคมีตามความร้อนมาตรฐานของการเผาไหม้ของสารที่เกี่ยวข้องกับปฏิกิริยา
สารเผาไหม้ความร้อนมาตรฐาน (การเผาไหม้เอนทาลปี) สาร
มันเรียกว่าผลความร้อนของการเกิดออกซิเดชันที่สมบูรณ์ของ 1 สวดมนต์ของสารที่กำหนด (มากถึงออกไซด์ที่สูงขึ้นหรือสารประกอบที่ระบุเป็นพิเศษ) ด้วยออกซิเจนโดยมีเงื่อนไขว่าสารเริ่มต้นและตัว จำกัด มีอุณหภูมิมาตรฐาน สารการเผาไหม้มาตรฐาน Entralpia  (KJ / MOL) ได้รับในหนังสืออ้างอิง เมื่อใช้ค่าอ้างอิงมีความจำเป็นต้องใส่ใจกับสัญลักษณ์ของช้างของปฏิกิริยาการเผาไหม้ซึ่งมีความคึกคักเสมอ ( Δ
เอช.
<0), а в таблицах указаны величины
(KJ / MOL) ได้รับในหนังสืออ้างอิง เมื่อใช้ค่าอ้างอิงมีความจำเป็นต้องใส่ใจกับสัญลักษณ์ของช้างของปฏิกิริยาการเผาไหม้ซึ่งมีความคึกคักเสมอ ( Δ
เอช.
<0), а в таблицах указаны величины
 .
. การเผาไหม้ Enthalpy ของออกไซด์ที่สูงขึ้น (เช่นน้ำและก๊าซคาร์บอนไดออกไซด์) เท่ากับ 0
การเผาไหม้ Enthalpy ของออกไซด์ที่สูงขึ้น (เช่นน้ำและก๊าซคาร์บอนไดออกไซด์) เท่ากับ 0
บทกวับจากกฎหมาย GESS เกี่ยวกับการคำนวณผลกระทบทางความร้อนของปฏิกิริยาเคมีต่อความร้อนของการเผาไหม้ : ผลความร้อนมาตรฐานของปฏิกิริยาทางเคมีเท่ากับความร้อนของความร้อนของการเผาไหม้ของสารเริ่มต้นและความร้อนของการเผาไหม้ของผลิตภัณฑ์ปฏิกิริยาโดยคำนึงถึงค่าสัมประสิทธิ์ stoichiometric (ปริมาณของโมล) ของรีเอเจนต์:
ค. 2 เอช. 4 + เอช. 2 O. \u003d S. 2 น. 5 เขาคือ.
เช่นเดียวกับหนึ่งในลักษณะทางกายภาพของบุคคลคือกำลังทางกายภาพลักษณะที่สำคัญที่สุดของการสื่อสารทางเคมีใด ๆ คือพลังของการสื่อสาร I.e. พลังงานของเธอ
จำได้ว่าพลังงานพันธบัตรเคมี - พลังงานนี้ที่จัดสรรในการก่อตัวของพันธบัตรเคมีหรือพลังงานที่ต้องใช้ในการทำลายการเชื่อมต่อนี้
ปฏิกิริยาเคมีโดยทั่วไปคือการแปลงของสารหนึ่งเป็นหนึ่งในผู้อื่น ดังนั้นในระหว่างปฏิกิริยาเคมีมีการแตกหักของการเชื่อมต่อบางอย่างและการก่อตัวของผู้อื่น I.e. พลังงานเปลี่ยน
กฎหมายพื้นฐานของฟิสิกส์ระบุว่าพลังงานไม่ได้เกิดจากอะไรและไม่หายไปโดยไม่มีร่องรอย แต่ผ่านสายพันธุ์หนึ่งไปยังอีกสายหนึ่งเท่านั้น โดยอาศัยอำนาจตามความเป็นสากลหลักการนี้ใช้ได้กับปฏิกิริยาทางเคมี
ผลความร้อนของปฏิกิริยาเคมี เรียกว่าปริมาณความร้อน
จัดสรร (หรือดูดซึม) ในระหว่างปฏิกิริยาและเมื่อเทียบกับ 1 mol ปฏิกิริยา (หรือผลลัพธ์)
เอฟเฟกต์ความร้อนจะถูกระบุด้วยตัวอักษร Q และตามกฎแล้วจะถูกวัดใน KJ / MOL หรือ KCAL / MOL
หากปฏิกิริยาเกิดขึ้นกับการปล่อยความร้อน (Q\u003e 0) มันเรียกว่า exothermic และหากมีการดูดซับความร้อน (Q< 0) – эндотермической.
หากเป็นแผนผังที่จะแสดงให้เห็นถึงโปรไฟล์พลังงานของปฏิกิริยาจากนั้นสำหรับปฏิกิริยา undothermic ผลิตภัณฑ์ที่อยู่เหนือพลังงานมากกว่ารีเอเจนต์และสำหรับความคึกคัก - ในทางตรงกันข้ามผลิตภัณฑ์ปฏิกิริยาอยู่ต่ำกว่าพลังงาน (มีเสถียรภาพมากขึ้น) กว่ารีเอเจนต์
เป็นที่ชัดเจนว่ายิ่งมีการตอบสนองต่อสารมากเท่าใดปริมาณพลังงานจะถูกแยกออกจากกัน (หรือดูดซับ), I. เอฟเฟกต์ความร้อนเป็นสัดส่วนโดยตรงกับปริมาณของสาร ดังนั้นทัศนคติของผลการระบายความร้อนถึง 1 โมลของสารนั้นเกิดจากความปรารถนาของเราที่จะเปรียบเทียบผลกระทบทางความร้อนของปฏิกิริยาต่าง ๆ
การบรรยาย 6. Thermochemistry เอฟเฟกต์ความร้อนของปฏิกิริยาเคมีตัวอย่าง 1 ด้วยการฟื้นฟู 8.0 กรัมของทองแดง (II) ออกไซด์ของไฮโดรเจน, ทองแดงโลหะและคู่น้ำถูกสร้างขึ้นและ 7.9 kJ out out คำนวณผลความร้อนของปฏิกิริยาของการลดการลดของทองแดงออกไซด์ (II)
การตัดสินใจ สมการปฏิกิริยา Cuo (ทีวี.) + H2 (G. ) \u003d CU (ทีวี.) + H2 O (G. ) + Q (*)
สัดส่วนในระหว่างการฟื้นฟู 0.1 Mol - 7.9 KJ ถูกจัดสรรในระหว่างการฟื้นฟู 1 Mol - X KJ
โดยที่ x \u003d + 79 kj / mole สมการ (*) ใช้เวลา
Cuo (ทีวี.) + H2 (G. ) \u003d Cu (ทีวี.) + H2 O (G. ) +79 KJ
สมการเทอร์เคมี- นี่คือสมการปฏิกิริยาทางเคมีซึ่งบ่งชี้สถานะการรวมของส่วนประกอบของส่วนผสมของปฏิกิริยา (รีเอเจนต์และผลิตภัณฑ์) และผลความร้อนของปฏิกิริยา
เพื่อที่จะละลายน้ำแข็งหรือน้ำระเหยมันเป็นสิ่งจำเป็นที่จะต้องใช้ความร้อนจำนวนหนึ่งในขณะที่ในระหว่างการแช่แข็งของน้ำของเหลวหรือการควบแน่นของไอน้ำจำนวนเดียวกันจะถูกจัดสรร นั่นคือเหตุผลที่มันเย็นเมื่อเราออกมาจากน้ำ (การระเหยของน้ำจากพื้นผิวร่างกายต้องใช้พลังงานพลังงาน) และเหงื่อออกเป็นกลไกการป้องกันชีวภาพจากความร้อนสูงเกินไปของร่างกาย ในทางตรงกันข้ามตู้แช่แข็งค้างน้ำและให้ความร้อนในห้องโดยรอบให้ความร้อนมากเกินไป
ตัวอย่างนี้แสดงให้เห็นถึงผลกระทบทางความร้อนของการเปลี่ยนแปลงในสภาวะการรวมของน้ำ ความร้อนของการละลาย (ที่ 0o c) λ \u003d 3.34 × 105 J / KG (ฟิสิกส์) หรือ QL \u003d - 6.02 kj / mol (เคมี), การระเหยความร้อน (vaporization) (ที่ 100o c) q \u003d 2.26 × 106 j / kg (ฟิสิกส์) หรือ QISP \u003d - 40.68 kJ / mol (เคมี)
การละลาย
การระเหย |
|||||
oBR, 298
การบรรยาย 6. Thermochemistry ผลความร้อนของปฏิกิริยาเคมีเป็นของหลักสูตรกระบวนการระเหิดเป็นไปได้เมื่อแข็ง
มันเข้าไปในเฟสแก๊ส, ข้ามสถานะของเหลวและกระบวนการผกผันของการสะสม (การตกผลึก) จากเฟสก๊าซนอกจากนี้ยังเป็นไปได้ที่จะคำนวณหรือวัดผลความร้อน
เป็นที่ชัดเจนว่าในแต่ละสารมีพันธะเคมีดังนั้นสารแต่ละชนิดมีพลังงานสำรองบางอย่าง อย่างไรก็ตามไม่สามารถเปลี่ยนสารทั้งหมดได้ซึ่งกันและกันด้วยปฏิกิริยาเคมีเดียว ดังนั้นตกลงที่จะแนะนำสถานะมาตรฐาน
สถานะมาตรฐานของสาร- นี่คือสถานะรวมของสารที่อุณหภูมิ 298 พันแรงกดดัน 1 บรรยากาศในการปรับเปลี่ยน allotropic ที่มีเสถียรภาพมากที่สุดในเงื่อนไขเหล่านี้
เงื่อนไขมาตรฐาน- นี่คืออุณหภูมิของ 298 K และความดัน 1 บรรยากาศ เงื่อนไขมาตรฐาน (สถานะมาตรฐาน) ถูกระบุโดยดัชนี 0
การเชื่อมต่อการสร้างความร้อนมาตรฐาน มันเรียกว่าผลความร้อนของปฏิกิริยาเคมีของการก่อตัวของสารประกอบนี้จากสารง่าย ๆ ที่ใช้ในสถานะมาตรฐานของพวกเขา ความร้อนของการก่อตัวของสารประกอบจะถูกระบุโดยสัญลักษณ์ Q0 สำหรับสารประกอบที่หลากหลายการศึกษาความร้อนมาตรฐานจะได้รับในหนังสืออ้างอิงของคุณค่าทางเคมีกายภาพ
ความร้อนมาตรฐานของการก่อตัวของสารง่าย ๆ เท่ากับ 0 ตัวอย่างเช่น Q0 ARR, 298 (O2, แก๊ส) \u003d 0, Q0 ARR., 298 (C, TV, Graphite) \u003d 0
ตัวอย่างเช่น . บันทึกสมการ Therochemical สำหรับการก่อตัวของ Copper Sulfate (II) จากสมุดอ้างอิง Q0 ARR, 298 (CUSO4) \u003d 770 kJ / mol
CU (TV.) + S (ทีวี.) + 2O2 (G. ) \u003d CUSO4 (TV) + 770 KJ
หมายเหตุ: สมการ Thermochemical สามารถบันทึกได้สำหรับสารใด ๆ อย่างไรก็ตามจำเป็นต้องเข้าใจว่าในชีวิตจริงปฏิกิริยาเกิดขึ้นในวิธีที่แตกต่างอย่างสิ้นเชิง: จากรีเอเจนต์ที่ระบุไว้จะเกิดขึ้นเมื่อเกิดอุ่นออกไซด์ของทองแดง (II) และซัลเฟอร์ (IV ) แต่ไม่เกิดขึ้นทองแดงซัลเฟต (II) ข้อสรุปที่สำคัญ: สมการเทอร์โมเคมีเป็นแบบจำลองที่ช่วยให้การคำนวณมันสอดคล้องกับข้อมูลความร้อนอื่น ๆ แต่ไม่สามารถทนต่อการปฏิบัติ (นั่นคือไม่สามารถทำนายความเป็นไปได้หรือไม่สามารถเกิดปฏิกิริยาได้อย่างถูกต้อง)
(B J) - σ a i × q ar 0, 298 i
การบรรยาย 6. Thermochemistry ผลความร้อนของปฏิกิริยาเคมี
ชี้แจง เพื่อที่จะไม่ทำให้เข้าใจผิดคุณฉันจะเพิ่มอุณหพลศาสตร์ของสารเคมีทันที อาจทำนายความเป็นไปได้ / ความเป็นไปไม่ได้ของปฏิกิริยาอย่างไรก็ตามสิ่งนี้ต้องการ "เครื่องมือ" ที่รุนแรงมากขึ้นที่นอกเหนือไปจากหลักสูตรวิชาเคมี สมการ Therochemical เมื่อเทียบกับเทคนิคเหล่านี้เป็นขั้นตอนแรกบนพื้นหลังของปิรามิด heopse - โดยไม่ต้องทำไม่ได้ แต่ไม่สูง
ตัวอย่างที่ 2 คำนวณผลความร้อนของการควบแน่นของน้ำที่มีน้ำหนัก 5,8G กระบวนการควบแน่นอธิบายโดยสมการเทอร์โมเคมี H2 O (G. ) \u003d H2 O (g.) + q - การควบแน่นมักจะเกิดกระบวนการควบแน่นความร้อนที่ 25o c 37 kj / mol (ไดเรกทอรี)
ดังนั้น Q \u003d 37 × 0.32 \u003d 11.84 kJ
ในศตวรรษที่ 19 นักเคมีรัสเซียที่ศึกษาผลกระทบทางความร้อนของปฏิกิริยาได้รับการพิสูจน์กฎหมายการอนุรักษ์พลังงานที่เกี่ยวข้องกับปฏิกิริยาเคมี - กฎหมายของ Hess
ผลความร้อนของปฏิกิริยาเคมีไม่ได้ขึ้นอยู่กับเส้นทางกระบวนการและถูกกำหนดโดยความแตกต่างในสถานะ จำกัด และเริ่มต้นเท่านั้น
จากมุมมองของเคมีและคณิตศาสตร์กฎหมายนี้หมายความว่าเรามีอิสระในการคำนวณกระบวนการในการเลือก "วิถีการคำนวณ" ใด ๆ เพราะผลลัพธ์ไม่ได้ขึ้นอยู่กับมัน ด้วยเหตุนี้กฎที่สำคัญของ Hess จึงมีความสำคัญอย่างไม่น่าเชื่อ ข้อพิสูจน์ของกฎหมาย GESS.
ผลความร้อนของปฏิกิริยาเคมีเท่ากับผลรวมของความร้อนของการก่อตัวของผลิตภัณฑ์ปฏิกิริยาสุทธิจากความร้อนของการก่อตัวของรีเอเจนต์ (คำนึงถึงค่าสัมประสิทธิ์ stoichiometric)
จากมุมมองของสามัญสำนึกการสอบสวนนี้สอดคล้องกับกระบวนการที่รีเอเจนต์ทั้งหมดกลายเป็นสารง่าย ๆ ซึ่งถูกรวบรวมในรูปแบบใหม่เพื่อให้ได้รับผลิตภัณฑ์ปฏิกิริยา
ในรูปแบบของสมการผลที่ตามมาของกฎหมาย GESS ดูเหมือนสมการปฏิกิริยา: 1 a 1 + a 2 a 2 + ... + a n an \u003d b 1 b 1 + b 2 b 2 + ... ข
ในเวลาเดียวกันฉัน i ib j เป็นสัมประสิทธิ์ stoichiometric, i - reagents, ผลิตภัณฑ์ J - ปฏิกิริยา
จากนั้นผลที่ตามมาของกฎหมาย Gessa มีแบบฟอร์ม Q \u003d σ B J × Q ARR 0, 298
k bk + q
(a i)
การบรรยาย 6. Thermochemistry ผลความร้อนของปฏิกิริยาเคมีเนื่องจากความร้อนมาตรฐานของการก่อตัวของสารจำนวนมาก
a) มุ่งมั่นที่จะตารางพิเศษหรือ b) สามารถกำหนดได้ทดลองมันเป็นไปได้ที่จะคาดการณ์ (คำนวณ) ผลความร้อนของปฏิกิริยาจำนวนมากที่มีความแม่นยำสูงพอสมควร
ตัวอย่างที่ 3 (ผลที่ตามมาของกฎหมาย GESS) คำนวณผลความร้อนของการแปลงไอน้ำของก๊าซมีเทนที่เกิดขึ้นในระยะก๊าซภายใต้เงื่อนไขมาตรฐาน:
CH4 (G. ) + H2 O (G. ) \u003d CO (G. ) + 3 H2 ()
ตรวจสอบว่าปฏิกิริยานี้มีความร้อนหรือความร้อนเกินไปหรือไม่?
วิธีการแก้ปัญหา: ผลของกฎหมาย GESS
Q \u003d 3 Q0 | d) + Q 0 | (co, d) -q 0 | d) -q 0 | o, d) - โดยทั่วไป |
|||||
oBR, 298 | oBR, 298 | oBR, 298 | oBR, 298 | ||||||
q ob0 | 298 (H 2, D) \u003d 0 | สารง่ายในสภาพมาตรฐาน |
|||||||
จากหนังสืออ้างอิงเราพบความอบอุ่นของการก่อตัวของส่วนประกอบที่เหลือของส่วนผสม
o, d) \u003d 241.8 | (CO, D) \u003d 110.5 | d) \u003d 74.6 | |||||||||
oBR, 298 | oBR, 298 | oBR, 298 | |||||||||
เราแทนที่ค่าให้กับสมการ
Q \u003d 0 + 110.5 - 74.6 - 241.8 \u003d -205.9 kJ / mol ปฏิกิริยาเป็น endothermich สูง
คำตอบ: Q \u003d -205.9 KJ / MOL, endothermal
ตัวอย่างที่ 4 (การประยุกต์ใช้ Gessa) ความอบอุ่นของปฏิกิริยาเป็นที่รู้จักกัน
C (ทีวี.) + ½ o (g.) \u003d co (g.) + 110.5 kJ
C (ทีวี.) + O2 (G. ) \u003d CO2 (G. ) + 393.5 kJ ค้นหาผลความร้อนของปฏิกิริยา 2CO (G. ) + O2 (G. ) \u003d 2co2 (g.) การตัดสินใจคูณการคูณครั้งแรกและครั้งที่สอง สมการ 2
2C (ทีวี.) + O2 (g.) \u003d 2co (g.) + 221 KJ 2C (ทีวี) + 2O2 (G. ) \u003d 2co2 (G. ) + 787 KJ
Submount จากสมการที่สองครั้งแรก
O2 (G. ) \u003d 2co2 (G. ) + 787 KJ - 2CO (G. ) - 221 kJ,
2co (G. ) + O2 (G. ) \u003d 2co2 (G. ) + 566 KJ ตอบ: 566 kJ / mol
หมายเหตุ: เมื่อศึกษา Thermochemistry เราพิจารณาปฏิกิริยาทางเคมีจากภายนอก (นอก) ในทางตรงกันข้ามอุณหพลศาสตร์เคมี - วิทยาศาสตร์ของพฤติกรรมของระบบเคมี - พิจารณาระบบจากภายในและดำเนินงานด้วยแนวคิดของ "Enthalpy" H เป็นพลังงานความร้อนของระบบ entalpy เช่น
การบรรยาย 6. Thermochemistry ผลความร้อนของปฏิกิริยาทางเคมีเป็นความหมายเช่นเดียวกับปริมาณความร้อน แต่มีเครื่องหมายตรงข้าม: หากพลังงานแตกต่างจากระบบสภาพแวดล้อมที่ได้รับและความร้อนและระบบสูญเสียพลังงาน
วรรณกรรม:
1. บทช่วยสอน, v.v. Eremin, N.E. Kuzmenko et al., เคมีเกรด 9, วรรค 19,
2. คู่มือการศึกษาและระเบียบวิธี "พื้นฐานของเคมีทั่วไป" ตอนที่ 1
คอมไพเลอร์ - S.G Baram, I.N. มิโรโนวา - รับกับคุณ! สำหรับอาชีพการสัมมนาครั้งต่อไป
3. A.V manuilles พื้นฐานของเคมี http://hemi.nsu.ru/index.htm
§9.1ผลความร้อนของปฏิกิริยาเคมี กฎหมายหลักของ Thermochemistry
§9.2 ** Thermochemistry (ต่อ) ความร้อนของการก่อตัวของสารจากองค์ประกอบ
Ethalpy Education มาตรฐาน
ความสนใจ!
เราไปแก้ปัญหาการตั้งถิ่นฐานดังนั้นเครื่องคิดเลขก็เป็นที่ต้องการสำหรับการสัมมนาในเคมี
เทอร์โมเคมีศึกษาผลกระทบทางความร้อนของปฏิกิริยาเคมี ในหลายกรณีปฏิกิริยาเหล่านี้เกิดขึ้นที่ระดับเสียงคงที่หรือความดันคงที่ จากกฎแห่งแรกของอุณหพลศาสตร์มันเป็นไปตามเงื่อนไขของความร้อนเหล่านี้เป็นฟังก์ชั่นฟังก์ชั่น ด้วยปริมาณความร้อนคงที่เท่ากับการเปลี่ยนแปลงพลังงานภายใน:
และที่ความดันคงที่การเปลี่ยนแปลงใน Enthalpy:
ความเสมอภาคในแอปพลิเคชันต่อปฏิกิริยาเคมีเป็นสิ่งจำเป็น กฎหมาย Gessa:
ผลความร้อนของปฏิกิริยาทางเคมีที่ไหลในความดันคงที่หรือปริมาณคงที่ไม่ได้ขึ้นอยู่กับเส้นทางปฏิกิริยาและถูกกำหนดโดยสถานะของรีเอเจนต์และผลิตภัณฑ์ปฏิกิริยาเท่านั้น
กล่าวอีกนัยหนึ่งผลความร้อนของปฏิกิริยาเคมีคือการเปลี่ยนฟังก์ชั่นสถานะ
ใน Thermochemistry ตรงกันข้ามกับแอปพลิเคชั่นทางอุณหพลศาสตร์อื่น ๆ ความร้อนถือว่าเป็นบวกหากมีการเน้นในสภาพแวดล้อม I.e. ถ้าเป็น เอช. < 0 или ยู.
< 0. Под тепловым эффектом химической реакции
понимают значение เอช. (ซึ่งเรียกว่า "ปฏิกิริยา enthalpy") หรือ ยู. ปฏิกิริยา
หากปฏิกิริยาตอบสนองในการแก้ปัญหาหรือเฟสที่เป็นของแข็งซึ่งการเปลี่ยนแปลงในระดับเสียงเล็กน้อย
เอช. = ยู. + (พีวี) ยู.. (3.3)
หากก๊าซที่สมบูรณ์แบบมีส่วนร่วมในปฏิกิริยาแล้วที่อุณหภูมิคงที่
เอช. = ยู. + (พีวี) = ยู. + n rt, (3.4)
โดยที่ n คือการเปลี่ยนแปลงจำนวนโมลของก๊าซในปฏิกิริยา
เพื่ออำนวยความสะดวกในการเปรียบเทียบความกระตือรือร้นของปฏิกิริยาต่าง ๆ ให้ใช้แนวคิดของ "สถานะมาตรฐาน" เงื่อนไขมาตรฐานคือสถานะของสารบริสุทธิ์ที่ความดัน 1 บาร์ (\u003d 10 5 pa) และอุณหภูมิที่กำหนด. สำหรับก๊าซนี่เป็นเงื่อนไขทางกายภาพที่ความดัน 1 บาร์ซึ่งมีคุณสมบัติของก๊าซที่กระจัดกระจาย Enthalpy ของปฏิกิริยาระหว่างสารในสภาวะมาตรฐานที่อุณหภูมิ ต.แสดง ( อาร์ หมายถึง "ปฏิกิริยา") ในสมการเทอร์โมเคมีไม่เพียง แต่สูตรของสาร แต่ยังระบุสถานะรวมของพวกเขาหรือการดัดแปลงผลึก
จากกฎหมายของ Hess การไหลที่สำคัญที่สำคัญซึ่งอนุญาตให้คำนวณ Enthalpy ของปฏิกิริยาเคมี
Conollary 1.
![]()
เท่ากับความแตกต่างในการก่อตัวของ enthalpy มาตรฐานของผลิตภัณฑ์ปฏิกิริยาและรีเอเจนต์ (คำนึงถึงค่าสัมประสิทธิ์ stoichiometric):
Standard Enthalpy (ความร้อน) ของการก่อตัวของสาร (f. หมายถึง "การก่อตัว") ที่อุณหภูมิที่กำหนดเรียกว่า Enthalpy ของการก่อตัวของการก่อตัวของการสวดอ้อนวอนของสารนี้ จากองค์ประกอบตั้งอยู่ในสถานะมาตรฐานที่ยั่งยืนที่สุด ตามคำจำกัดความนี้ Enthalpy ของการก่อตัวของสารง่าย ๆ ที่เสถียรที่สุดในสถานะมาตรฐานคือ 0 ที่อุณหภูมิใด ๆ ความกระตือรือร้นมาตรฐานของการก่อตัวของสารที่อุณหภูมิ 298 K ได้รับในหนังสืออ้างอิง
แนวคิดของ "Enthalpy of Education" ไม่เพียง แต่ใช้สำหรับสารธรรมดาเท่านั้น แต่ยังรวมถึงไอออนในการแก้ปัญหา ในขณะเดียวกัน H + ION จะได้รับต่อจุดอ้างอิงซึ่งความเอนทาล์ปีมาตรฐานของการก่อตัวในสารละลายน้ำควรจะเป็นศูนย์: ![]()
Conollary 2. Enthalpy มาตรฐานของปฏิกิริยาเคมี
![]()
เท่ากับความแตกต่างของ Enthalpy ของการเผาไหม้ของรีเอเจนต์และผลิตภัณฑ์ปฏิกิริยา (คำนึงถึงค่าสัมประสิทธิ์ stoichiometric):
(ค. หมายถึง "combucer") Standard Enthalpy (ความร้อน) ของการเผาไหม้ของสารเรียกว่า Enthalpy ของปฏิกิริยาของการเกิดออกซิเดชันทั้งหมดของสารสวดอ้อนวอนหนึ่ง ผลที่ตามมานี้มักใช้ในการคำนวณผลกระทบทางความร้อนของปฏิกิริยาอินทรีย์
COOLLARY 3. Enthalpy ของปฏิกิริยาเคมีมีค่าเท่ากับความแตกต่างของพลังงานของฉีกขาดและพันธะเคมีที่เกิดขึ้น
พลังงานการสื่อสาร A- B เรียกว่าพลังงานที่จำเป็นในการทำลายความผูกพันและการเจือจางของอนุภาคที่เกิดขึ้นในระยะที่ไม่มีที่สิ้นสุด:
AB (g) a (g) + b (g)
พลังงานการสื่อสารเป็นบวกเสมอ
ข้อมูลความร้อนส่วนใหญ่ในหนังสืออ้างอิงจะได้รับที่อุณหภูมิ 298 K เพื่อคำนวณผลกระทบความร้อนที่อุณหภูมิอื่นใช้ สมการ Kirchhoff:
(แบบที่แตกต่างกัน) (3.7)
 (แบบฟอร์มรวม) (3.8)
(แบบฟอร์มรวม) (3.8)
ที่ไหน C P. - ความแตกต่างของความจุความร้อน Isobaric ของผลิตภัณฑ์ปฏิกิริยาและวัสดุเริ่มต้น ถ้าแตกต่าง ต. 2 - ต. 1 มีขนาดเล็กแล้วคุณสามารถรับได้ C P. \u003d const ด้วยความแตกต่างของอุณหภูมิขนาดใหญ่จำเป็นต้องใช้การพึ่งพาอุณหภูมิ C P.(ต.) ประเภท:
ที่มีค่าสัมประสิทธิ์ ก., b., ค. เป็นต้น สำหรับสารส่วนบุคคลพวกเขาใช้จากไดเรกทอรีและเครื่องหมายบ่งชี้ความแตกต่างระหว่างผลิตภัณฑ์และรีเอเจนต์ (คำนึงถึงค่าสัมประสิทธิ์)
ตัวอย่าง
ตัวอย่างที่ 3-1 ความกระตือรือร้นมาตรฐานของการก่อตัวของน้ำของเหลวและก๊าซที่ 298 k เท่ากับ -285.8 และ -241.8 kj / mol ตามลำดับ คำนวณ Enthalpy ของการระเหยของน้ำที่อุณหภูมินี้
การตัดสินใจ. Enthalpy การศึกษาสอดคล้องกับปฏิกิริยาต่อไปนี้:
h 2 (g) + ѕo 2 (g) \u003d h 2 o (g), เอช. 1 0 = -285.8;
h 2 (g) + ѕo 2 (g) \u003d h 2 o (g), เอช. 2 0 = -241.8.
ปฏิกิริยาที่สองสามารถดำเนินการได้ในสองขั้นตอนคือการเผาไหม้ไฮโดรเจนครั้งแรกเพื่อสร้างน้ำของเหลวโดยปฏิกิริยาแรกแล้วระเหยน้ำ:
h 2 o (g) \u003d h 2 o (g), เอช. 0 คือ \u003d?
จากนั้นตามกฎหมายของ Hess
เอช. 1 0 + เอช. 0 คือ \u003d เอช. 2 0 ,
จาก เอช. 0 ISP \u003d -241.8 - (-285.8) \u003d 44.0 kj / mol
ตอบ. 44.0 kj / mol
ตัวอย่างที่ 3-2 คำนวณปฏิกิริยา enthalpy
6C (g) + 6h (g) \u003d c 6 h 6 (g)
a) เกี่ยวกับความกระตือรือร้นของการศึกษา; ข) เกี่ยวกับพลังงานการสื่อสารภายใต้สมมติฐานที่ว่าพันธะคู่ในโมเลกุล C 6 H 6 ได้รับการแก้ไข
การตัดสินใจ. a) การศึกษาเอนทัลปี้ (ใน kj / mole) เราพบในไดเรกทอรี (ตัวอย่างเช่น p.w.atkins, เคมีทางกายภาพ, รุ่นที่ 5, pp. c9-c15): f เอช. 0 (c 6 h 6 (g)) \u003d 82.93, f เอช. 0 (c (g)) \u003d 716.68, f เอช. 0 (h (g)) \u003d 217.97 ปฏิกิริยา Enthalpy คือ:
r เอช 0 \u003d 82.93 - 6 716.68 - 6 217.97 \u003d -5525 kj / mol
b) ในปฏิกิริยานี้พันธะเคมีไม่แตก แต่เกิดขึ้นเท่านั้น ในการประมาณของพันธบัตรคู่คงที่ C 6 H 6 โมเลกุลประกอบด้วย 6 พันธบัตร C-H, 3 ของการสื่อสาร C - C และ 3 ของการสื่อสาร c \u003d c ลิงค์พลังงาน (ใน KJ / MOL) (p.w.atkins, เคมีทางกายภาพ, รุ่นที่ 5, หน้า c7): อี.(c- h) \u003d 412, อี.(c- c) \u003d 348, อี.(c \u003d c) \u003d 612 enthalpy ปฏิกิริยาเท่ากับ:
r เอช 0 \u003d - (6 412 + 3 348 + 3 612) \u003d -5352 kj / mol
ความแตกต่างกับผลลัพธ์ที่แน่นอนคือ -5525 kj / mol เป็นเพราะความจริงที่ว่าในโมเลกุลเบนซีนไม่มีพันธะเดียวของ C - C และพันธะคู่ c \u003d c และมี 6 พันธะหอมกับ C C C.
ตอบ. a) -5525 kj / mol; b) -5352 kj / mol
ตัวอย่างที่ 3-3 การใช้ข้อมูลอ้างอิงคำนวณ Enthalpy ของปฏิกิริยา
3CU (TV) + 8HNO 3 (AQ) \u003d 3CU (NO 3) 2 (AQ) + 2NO (G) + 4H 2 O (g)
การตัดสินใจ. สมการปฏิกิริยา Ionic ตัวย่อมีรูปแบบ:
3CU (TV) + 8H + (AQ) + 2NO 3 - (AQ) \u003d 3CU 2+ (AQ) + 2NO (G) + 4H 2 O (g)
ตามกฎหมาย GESS ปฏิกิริยา Enthalpy เท่ากับ:
r เอช 0 = 4 f เอช. 0 (h 2 o (g)) + 2 f เอช. 0 (ไม่มี (g)) + 3 f เอช. 0 (CU 2+ (AQ)) - 2 f เอช. 0 (หมายเลข 3 - (AQ))
(enhaulpia ของการก่อตัวของทองแดงและไอออน h + เท่ากันตามคำจำกัดความ 0) การศึกษาการศึกษาการศึกษา (p.w.atkins, เคมีทางกายภาพ, ฉบับที่ 5, pp. c9-c15), เราค้นหา:
r เอช 0 \u003d 4 (-285.8) + 2 90.25 + 3 64.77 - 2 (-205.0) \u003d -358.4 kj
(ต่อสามทองแดงสวดมนต์)
ตอบ. -358.4 kj
ตัวอย่างที่ 3-4 คำนวณ Enthalpy ของการเผาไหม้ของมีเธนที่ 1,000 k หาก Enthalpy มีการก่อตัวที่ 298 ถึง: f เอช. 0 (ch 4) \u003d -17.9 kcal / mol f เอช. 0 (co 2) \u003d -94.1 kcal / mol f เอช. 0 (h 2 o (g)) \u003d -57.8 kcal / mol ความจุความร้อนของก๊าซ (ใน cal / (มอด k)) ในช่วงจาก 298 ถึง 1,000 k เท่ากับ:
C P (CH 4) \u003d 3.422 + 0.0178 ต., C P.(o 2) \u003d 6.095 + 0.0033 ต.,
c p (co 2) \u003d 6.396 + 0.0102 ต., C P.(H 2 O (g)) \u003d 7.188 + 0.0024 ต..
การตัดสินใจ. enhaulpia ปฏิกิริยาการเผาไหม้มีเทน
CH 4 (g) + 2o 2 (g) \u003d co 2 (g) + 2H 2 O (g)
ที่ 298 ถึงเท่ากับ:
94.1 + 2 (-57.8) - (-17.9) \u003d -191.8 kcal / mol
ค้นหาความแตกต่างของความร้อนความร้อนเป็นฟังก์ชั่นของอุณหภูมิ:
C P. = C P.(CO 2) + 2 C P.(H 2 O (D)) - C P.(CH 4) - 2 C P.(o 2) \u003d
= 5.16 - 0.0094ต. (CAL / (มอด. k))
Enthalpy ของปฏิกิริยาที่ 1,000 ในการคำนวณตามสมการ Kirchhoff:
= +  = -191800 + 5.16
= -191800 + 5.16
(1,000-298) - 0.0094 (1000 2 -298 2) / 2 \u003d -192500 cal / mol
ตอบ. -192.5 kcal / mol
ภารกิจ
3-1 จะต้องใช้ความร้อนเท่าใดสำหรับการแปล 500 กรัม al (t.pl. 658 o c, เอช. 0 pl \u003d 92.4 cal / g) ถ่ายที่อุณหภูมิห้องในรัฐหลอมเหลวถ้า C P.(AL TV) \u003d 0.183 + 1.096 10 -4 ต. cal / (g k)?
3-2 Standard Enthalpy Reacy Caco 3 (TV) \u003d CAO (TV) + CO 2 (G) เกิดขึ้นในเรือเปิดที่อุณหภูมิ 1,000 K เท่ากับ 169 kJ / mol สิ่งที่เท่ากับความร้อนของปฏิกิริยานี้ไหลที่อุณหภูมิเดียวกัน แต่ในภาชนะปิด?
3-3 คำนวณพลังงานภายในมาตรฐานของการก่อตัวของน้ำมันเบนซินเหลวที่ 298 K ถ้า Enterthalpy มาตรฐานของการก่อตัวของมันคือ 49.0 kJ / mol
3-4 คำนวณ Enthalpy ของการก่อตัว n 2 o 5 (d) ที่ ต. \u003d 298 k ตามข้อมูลต่อไปนี้:
2no (g) + o 2 (g) \u003d 2no 2 (g), เอช. 1 0 \u003d -114.2 kj / mol
4no 2 (g) + o 2 (g) \u003d 2n 2 o 5 (g), เอช. 2 0 \u003d -110.2 kj / mol,
n 2 (g) + o 2 (g) \u003d 2no (g), เอช. 3 0 \u003d 182.6 kj / mol
3-5 enhaulpia เผาไหม้กลูโคส, -fructosis และซูโครสที่ 25 ° C เท่ากับ -2802
-2810 และ -5644 kj / mol ตามลำดับ คำนวณความอบอุ่นของการไฮโดรไลซิสของซูโครส
3-6 กำหนดเอนทัลปีของการก่อตัวของการก่อตัวของ B 2 H 6 (g) เมื่อ ต. \u003d 298 จากข้อมูลต่อไปนี้:
B 2 H 6 (g) + 3o 2 (g) \u003d B 2 O 3 (TV) + 3H 2 O (g), เอช. 1 0 \u003d -2035.6 kj / mol
2b (TV) + 3/2 O 2 (G) \u003d B 2 O 3 (TV) เอช. 2 0 \u003d -1273.5 kj / mol,
h 2 (g) + 1/2 o 2 (g) \u003d h 2 o (g), เอช. 3 0 \u003d -2241.8 kj / mol
3-7 คำนวณความร้อนของการก่อตัวของสังกะสีซัลเฟตจากสารง่าย ๆ เมื่อ ต. \u003d 298 k ตามข้อมูลต่อไปนี้