Из перечисленных ниже характеристик атомов элементов. Химия
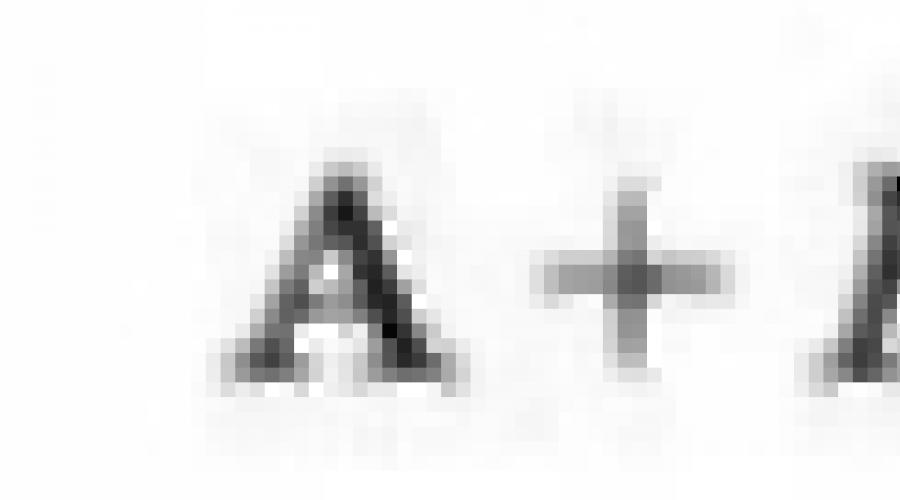
Контрольная работа № 2 содержит задачи на следующие темы:
- Периодическая система
- Периодичность изменения свойств элементов и их соединений.
- Химическая связь. Метод ВС.
- Химическая связь. Метод МО.
- Химическая связь. Ионная связь.
- Химическая связь в комплексных соединениях.
Тест для проверки знаний:
1. Из перечисленных ниже характеристик атомов элементов периодически изменяется
(1) заряд ядра атома;
(2) относительная атомная масса;
(3) число энергетических уровней в атоме;
(4) число электронов на внешнем энергетическом уровне.
2. Внутри периода увеличение порядкового номера элемента обычно сопровождается
(1) уменьшением атомного радиуса и возрастанием электроотрицательности атома;
(2) возрастанием атомного радиуса и уменьшением электроотрицательности атома;
(3) уменьшением атомного радиуса и уменьшением электроотрицательности атома;
(4) возрастанием атомного радиуса и возрастанием электроотрицательности атома.
3. Атом какого элемента легче всего отдает один электрон (числа означают порядковый номер элемента):
(1) натрий,11; (2) магний, 12; (3) алюминий, 13; (4) кремний, 14?
4. Атомы элементов 1А группы периодической системы элементов имеют одинаковое число
(1) электронов на внешнем электронном уровне;
(2) нейтронов;
(3) всех электронов.
5. Элементы расположены в порядке возрастания электроотрицательности в ряду
(1) As, Se, Cl, F; (2) C, I, B, Si; (3) Br, P, H, Sb; (4) О, Se, Br, Te.
6. Во втором и третьем периодах периодической системы по мере уменьшения размеров атомов элементов
(1) размер их ионов также уменьшается;
(2) электроотрицательность уменьшается;
(3) металлические свойства элементов ослабевают;
(4) металлические свойства элементов усиливаются.
7. Какой ряд включает только переходные элементы:
(1) элементы 11, 14, 22, 42; (2) элементы 13, 33, 54, 83;
(3) элементы 24, 39, 74, 80; (4) элементы 19, 32, 51, 101?
8. Какой из приведенных ниже элементов имеет химические свойства, позволяющие говорить о его сходстве с элементом кальцием:
(1) углерод. С; (2) натрий, Na; (3) калий. К; (4) стронций, Sr?
9. Неметаллические свойства элементов, расположенных в главных подгруппах периодической системы Д. И. Менделеева, наиболее ярко выражены у тех из них, которые находятся
(1) в верхней части подгруппы;
(2) в нижней части подгруппы;
(3) в середине подгруппы;
(4) у всех элементов подгруппы выражены примерно в одинаковой степени.
10. Какой ряд элементов представлен в порядке возрастания атомного радиуса:
(1)О, S, Se, Те; (2) C, N, О, F; (3) Na, Mg, Al, Si; (4) I, Br, Cl, F?
11. Металлический характер свойств элементов в ряду Mg-Ca-Sr-Ba
(1) уменьшается;
(2) возрастает;
(3) не изменяется;
12. Неметаллический характер свойств элементов в ряду N-P-As-Sb-Bi
(1) уменьшается;
(2) возрастает;
(3) не изменяется;
(4) уменьшается, а затем возрастает.
13. Какая пара в указанной совокупности элементов - Са, Р, Si, Ag, Ni, As - обладает наиболее сходными химическими свойствами:
(1) Са, Si; (2) Ag, Ni; (3) Р, As; (4) Ni, Р?
14. По своим химическим свойствам радиоактивный элемент радий ближе всего к
(1) цезию; (2) барию; (3) лантану; (4) актинию.
15. На основании положения элемента лантана в периодической системе можно с уверенностью утверждать, что для лантаноидов наиболее характерной степенью окисления будет
(1) +1; (2) +2; (3) +3; (4) +4.
16. Основные свойства гидроксидов элементов 1А группы по мере увеличения порядкового номера
(1) уменьшаются;
(2) возрастают;
(3) остаются неизменными;
(4) уменьшаются, а затем возрастают.
17. На основе положения элементов в периодической системе наиболее вероятное соединение германия с селеном можно изобразить формулой .
18. Гипотетический элемент Z образует хлорид ZCl 5 . Какая наиболее вероятная формула у его оксида:
(1) ZO 2 ; (2) ZO 5 ; (3) Z 2 O 5 ; (4) Z 5 O 2 ?
19. Простые вещества каких элементов обладают наибольшим сходством физических и химических свойств:
(1) Li, S; (2) Be, Cl; (3) F, Cl; (4) Li, F?
20. Из приведенных ниже элементов третьего периода наиболее ярко выраженными неметаллическими свойствами обладает
(1) алюминий; (2) кремний; (3) сера; (4) хлор.
21. Из приведенных элементов IIIA группы ярко выраженными неметаллическими свойствами обладает
(1) бор; (2) алюминий; (3) галлий; (4) индий.
22. Какой из приведенных элементов четвертого периода периодической системы проявляет одинаковые значения валентности в своем водородном соединении и в высшем оксиде:
(1) бром; (2) германий; (3) мышьяк; (4) селен?
23. Характер оксидов в ряду P 2 O 5 -SiO 2 -Аl 2 О з -MgO изменяется следующим образом:
(1) от основного к кислотному;
(2) от кислотного к основному;
(3) от основного к амфотерному;
(4) от амфотерного к кислотному.
24. Напишите формулы высших оксидов элементов и соответствующих кислот; назовите эти кислоты:
25. На основании положения элемента в периодической системе напишите его соединения, формы которых указаны ниже:
26. Из приведенного перечня элементов: Be, В, С, N, Al, Si, Р, S, Ga, Ge, As, Br - оксиды типа ЭО 2 образуют , а гидриды типа ЭН 4 - .
27. На основании положения элемента в периодической системе выведите формулы его высшего оксида и гидроксида и укажите их характер:
28. Элемент с порядковым номером 34 образует водородное соединение , высший оксид и гидроксид . Последний проявляет
(1) кислотные свойства;
(2) основные свойства;
(3) амфотерные свойства.
29. Максимальное число химических элементов, которое может заполнить шестой период периодической системы, должно быть равно
(1) 8; (2) 18; (3) 32; (4) 50.
30. Максимальное число элементов в седьмомпериоде должно быть
(1) 18; (2) 32; (3) 50; (4) 72.
31. В седьмом периоде последним должен быть элементс порядковым номером
(1) 118; (2) 114; (3) 112; (4) 110.
32. Свойства щелочных металлов следует ожидать у элементов с порядковыми номерами
(1) 111 и 190; (2) 119 и 169; (3) 137 и 187; (4) 155 и 211.
33. Конфигурация орбиталей валентных электронов висмута совпадает с
(1) селеном и теллуром;
(2) азотом и фосфором;
(3) кремнием и германием;
(4) ниобием и танталом.
34. Элемент с порядковым номером 117 следует отнести к
(1) щелочным метал лам; (3) галогенам;
(2) щелочноземельным металлам; (4) переходным элементам.
35. Максимальная валентность свинца в кислородных соединениях равна:
(1) II; (2) IV; (3) VI; (4) VIII.
36. Вид орбиталей валентных электронов у индия совпадает с
(1) Am и Fr; (2) Pb и Sn; (3) Аl и Ga; (4) Сu и Ag.
37. Титан относится к
(1) s -; (2) p -; (3) d -; (4) f -элементам.
38. Максимальная валентность брома в кислородных соединениях
(1) I; (2) III; (3) V; (4) VII.
39. Седьмой период системы элементов должен закончиться элементом с порядковым номером
(1) 108; (2) 110; (3) 118; (4) 128.
40. Угол между связями Н-Э наибольший в молекуле соединения
(1) Н 2 Те; (2) H 2 Se; (3) H 2 S; (4) H 2 О.
41. В ряду К-Са-Sc-Ti радиус атомов (уменьшается, увеличивается).
42. Энергия, которая указана в уравнении Сl° (г.) → Cl + (г.) +e - 1254 кДж, является для атома хлора
(1) энергией химической связи;
(2) энергией ионизации;
(3) электроотрицательностью;
(4) сродством к электрону.
43. Сродством к электрону называют
(1) энергию, необходимую для отрыва электрона от невозбужденного атома;
(2) способность атома данного элемента к оттягиванию на себя электронной плотности;
(3) переход электрона на более высокий энергетический уровень;
(4) выделение энергии при присоединении электрона к атому или иону.
44. Какой из элементов имеет наибольшее значение энергии ионизации:
(1) Li; (2) F; (3) Fе; (4) I?
45. Энергия, затрачиваемая на удаление одного электрона от атома элемента в газообразном состоянии, у магния
(1) меньше,чем у натрия, и больше, чем у алюминия;
(2) больше, чем у натрия, и меньше, чем у алюминия;
(3) меньше, чем у натрия и алюминия;
(4) больше, чем у натрия и алюминия.
46. Исходя из анализа электронных структур атомов и положения элементов в периодической системе, укажите, какой из каждых двух приведенных ниже атомов имеет большее сродство к электрону:
(1) калий или кальций;
(2) сера или хлор;
(3) водород или литий?
47. Химические элементы расположены в порядке возрастания электроотрицательности в ряду
(1) Si, P, Se, Вr, Сl, О; (2) Si, P, Вr, Se, C1, О;
(3) P, Si, Вr, Se, C1, О; (4) Se, Si, P, Вr, C1, О.
48. Какой ряд элементов расположен по мере возрастания их атомных радиусов:
(1) Na, Mg, Al, Si; (3)O, S, Se, Те;
(2) С, О, N, F; (4) I, Br, C1, F?
49. В ряду щелочных металлов (от Li до Cs) цезий является наименее электроотрицательным. Это объясняется тем, что он имеет
(1) наибольшее число нейтронов в ядре;
(2) большее число валентных электронов по сравнению с другими элементами;
(3) большую атомную массу;
(4) валентные электроны, в наибольшей степени удаленные от ядра атома.
50. Изоэлектронными называют ионы, имеющие одно и то же число электронов и одинаковую структуру внешнего электронного уровня. Ионы О 2- , F - , Na + , Mg 2+ , A1 3+ имеют электронную конфигурацию благородного газа неона и расположены в порядке возрастания атомных масс элементов. При этом их ионные радиусы
(1) практически не изменяются;
(2) уменьшаются;
(3) увеличиваются;
(4) уменьшаются, затем увеличиваются.
51. Примером неполярной молекулы, имеющей полярную ковалентную связь, будет
(1) N 2 ; (2) H 2 О; (3) NH 3 ; (4) CCl 4 .
52. Из приведенных молекул: Н 2 , О 2 , Н 2 О, СО 2 , СН 4 , H 2 S - полярными являются .
53. В каком из соединений между атомами образуется ковалентная связь по донорно-акцепторному механизму:
(1) КСl; (2) NH 4 Cl; (3) ССl 4 ; (4) CO 2 ?
54. Валентные орбитали атома бериллия в молекуле гидрида бериллия гибридизованы по типу
(1) sp ; (2) sp 2 ; (3) sp 3 ;(4) d 2 sp 3 ,
а молекула имеет структуру:
55. Валентные орбитали атома бора в молекуле ВF 3 гибридизованы по типу
(1) sp ; (2) sp 2 ; (3) sp 3 ;(4) d 2 sp 3 ,
а молекула имеет структуру:
(а) линейную; (в) тетраэдрическую;
(б) плоскую; (г) октаэдрическую.
56. Наличие четырех эквивалентных связей С-Н в молекуле метана объясняется тем, что
(1) происходит взаимное отталкивание четырех электронных пар;
(2) атом углерода гибридизован с образованием четырех sp 3 орбиталей;
(3) атом углерода имеет один s - и три р - валентных электрона;
(4) атом углерода имеет два s- и два р - валентных электрона.
Ответы:
1. (4) число электронов на внешнем энергетическом уровне.
2. (1) уменьшением атомного радиуса и возрастанием электроотрицательности атома.
3. (1) натрий,11.
4. (1) электронов на внешнем электронном уровне.
5. (1) As, Se, Cl, F.
6. (3) металлические свойства элементов ослабевают.
7. (3) элементы 24, 39, 74, 80.
8. (4) стронций, Sr.
9. (1) в верхней части подгруппы.
10.(1)О, S, Se, Те.
11. (2) возрастает.
12. (1) уменьшается.
14. (2) барию.
16. (2) возрастают.
18. (3) Z 2 O 5 .
20. (4) хлор.
22. (2) германий.
23. (2) от кислотного к основному.
26. оксиды типа ЭО 2 образуют С, Si, Ge , а гидриды типа ЭН 4 - С, Si, Ge.
28. Н 2 Sе, SеО 3 и Н 2 SeО 4 . (1) кислотные свойства.
32. (2) 119 и 169.
33. (2) азотом и фосфором.
34. (3) галогенам.
36. (3) Аl и Ga.
37. (3) d -элементам.
41. Уменьшается.
42. (2) энергией ионизации.
43. (4) выделение энергии при присоединении электрона к атому или иону.
45. (4) больше, чем у натрия и алюминия.
46. (1) калий; (2) хлор; (3) водород.
47. (1) Si, P, Se, Вr, Сl, О.
48. (3)O, S, Se, Те.
49. (4) валентные электроны, в наибольшей степени удаленные от ядра атома.
50. (2) уменьшаются.
52. Н 2 О, H 2 S.
53. (2) NH 4 Cl.
54. (1) sp , (а) линейную.
55. (2) sp 2 , (б) плоскую.
56. (2) атом углерода гибридизован с образованием четырех sp 3 орбиталей.
Задания для индивидуальной расчетно-графической работы:
Для элемента с порядковым номером равным номеру варианта провести следующие расчеты:
1. Написать электронную формулу элемента и показать графически заполнение электронами всех атомных орбиталей.
3. Определить массу одного атома элемента и его объем.
4. Определить массу одной молекулы простого вещества элемента.
5. Исходя из положения элемента в ПС, перечислить возможные степени окисления атома элемента в соединениях с другими элементами.
6. Написать формулу оксида, хлорида, гидрида, сульфида.
8. Вычислить длину диполя водородного и кислородного соединения элемента.
9. Изобразить связь в молекуле простого вещества элемента с помощью метода ВС.
10. Изобразить связь в молекуле простого вещества элемента с помощью энергетической диаграммы метода МО, указать кратность связи и написать формулу.
11. Указать тип гибридизации атома элемента в молекулах всех возможных оксидов (в случае кислорода – молекулы водородных соединений).
12. Указать все виды связей (σ, π, δ) в молекулах оксидов (в случае кислорода – молекулы водородных соединений).
13. Указать значения валентных углов в молекулах оксидов (в случае кислорода – молекулы водородных соединений).
14. Указать форму молекул оксидов (в случае кислорода – молекулы водородных соединений).
15. Вычислить энергию образования ионного соединения АВ и энергию взаимодействия ионов А+ и В-.
Для вариантов 1, 5, 6, 7, 8, 9, 14, 15, 16, 17: А – калий, В – элемент с порядковым номером, равным номеру элемента.
Для вариантов 3, 4, 11, 12, 13, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28: В – хлор, А– элемент с порядковым номером, равным номеру элемента.
Для вариантов 2, 10, 18: А – элемент с порядковым номером равным (номер варианта +1), В – элемент с порядковым элементом равным (номер варианта -1).
Литература.
1. Кульман А.Г. Сборник задач по общей химии, Изд. 2-е, перераб., и доп. - М.: Высш. шк. 1975.
2. Маслов Е.И. , Гольбрайх З.Е. Сборник задач и упражнений по химии, 5-е изд., перераб. и доп.- М.: Высш. шк. 1997.
Атомный номер элемента показывает:
а) число элементарных частиц в атоме; б) число нуклонов в атоме;
в) число нейтронов в атоме; г) число протонов в атоме.
Наиболее верным является утверждение, что химические элементы в ПСЭ расположены в порядке возрастания:
а) абсолютной массы их атомов; б) относительной атомной массы;
в) числа нуклонов в атомных ядрах; г) заряда атомного ядра.
Периодичность в изменении свойств химических элементов является результатом:
а) увеличения числа электронов в атомах;
б) возрастания зарядов атомных ядер;
в) увеличения атомной массы;
г) периодичности в изменении электронных структур атомов.
Из перечисленных ниже характеристик атомов элементов периодически изменяются по мере роста порядкового номера элемента:
а) число энергетических уровней в атоме;
б) относительная атомная масса;
в) число электронов на внешнем энергетическом уровне;
г) заряд ядра атома.
Выберите пары, в которых каждая характеристика атома изменяется периодически с увеличением значения протонного числа элемента:
а) энергия ионизации и энергия сродства к электрону;
б) радиус и масса;
в) электроотрицательность и общее число электронов;
г) металлические свойства и число валентных электронов.
Выберите правильное утверждение для элементов V А группы:
а) все атомы имеют одинаковое число электронов;
б) все атомы имеют одинаковый радиус;
в) все атомы имеют одинаковое число электронов на внешнем слое;
г) все атомы имеют максимальную валентность, равную номеру группы.
Некоторый элемент имеет следующую конфигурацию электронов: ns 2 (n -1) d 10 np 4 . В какой группе периодической системы находится этот элемент?
а) IVВ группа; б) VIВ группа; в) IVА группа; г) VIА группа.
В периодах ПСЭ с увеличением зарядов атомных ядер не изменяется: а) масса атомов; б) число электронных слоев; в) число электронов на внешнем электронном слое; г) радиус атомов. |
|
В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса? а) Li, Be, B, C; б) Be, Mg, Ca, Sr; в) N, O, F, Ne; г) Na, Mg, Al, Si. |
|
Самой низкой энергией ионизации среди стабильных атомов обладает: а) литий; б) барий; в) цезий; г) натрий. |
|
Электроотрицательность элементов возрастает в ряду: а) P, Si, S, O; б) Cl, F, S, O; в) Te, Se, S, O; г) O, S, Se, Te. |
|
В ряду элементов Na Mg Al Si P S Cl слева направо: а) увеличивается электроотрицательность; б) уменьшается энергия ионизации; в) увеличивается число валентных электронов; г) уменьшаются металлические свойства. |
|
Укажите наиболее активный металл четвертого периода: а) кальций; б) калий; в) хром; г) цинк. |
|
Укажите наиболее активный металл IIA группы: а) бериллий; б) барий; в) магний; г) кальций. |
|
Укажите наиболее активный неметалл VIIA группы: а) йод; б) бром; в) фтор; г) хлор. |
|
Выберите правильные утверждения: а) в IА–VIIIА группах ПСЭ расположены только элементы s- и б) в IВ–VIIIВ группах расположены только d-элементы; в) все d-элементы являются металлами; г) общее число s -элементов в ПСЭ равно 13. |
|
С увеличением атомного номера элемента в VА группе возрастают: а) металлические свойства; б) число энергетических уровней; в) общее число электронов; г) число валентных электронов. |
|
К р-элементам относится: а) калий; б) натрий; в) магний; г) мышьяк. |
|
К какому семейству элементов относится алюминий? а) s-элементов; б) p-элементов; в) d-элементов; г) f-элементов. |
|
Укажите ряд, в котором находятся только d -элементы: а) Al, Se, La; б) Ti, Ge, Sn; в) Ti, V, Cr; г) La, Ce, Hf. |
В каком ряду указаны символы элементов s, p и d-семейств? а) H, He, Li; б) H, Ba, Al; в) Be, C, F; г) Mg, P, Cu. |
|
Атом какого элемента IV периода содержит наибольшее число электронов? а) цинк; б) хром; в) бром; г) криптон. |
|
У атома какого элемента, электроны внешнего энергетического уровня наиболее прочно связаны с ядром? а) калий; б) углерод; в) фтор; г) франций. |
|
Сила притяжения валентных электронов к ядру атома уменьшается в ряду элементов: а) Na, Mg, Al, Si; б) Rb, K, Na, Li; в) Sr, Ca, Mg, Be; г) Li, Na, K, Rb. |
|
Элемент с порядковым номером 31 находится: а) в III группе; б) малом периоде; в) большом периоде; г) в группе А. |
|
Из приведенных ниже электронных формул выберите те, которые соответствуют р-элементам V периода: а) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 4p 6 4d 1 5s 2 5p 1 ; б) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 4p 6 5s 2 ; в) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 4p 2 ; г) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 4p 6 4d 1 5s 2 5p 6 . |
|
Из приведенных электронных формул выберите те, которые соответствуют химическим элементам, образующим высший оксид состава Э 2 О 3 : а) 1s 2 2s 2 2p 6 3s 2 3p 1 ; б) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 4p 3 ; в) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 ; г) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 . |
|
Определите элемент, атом которого содержит на 4р-подуровне 4 электрона. В каком периоде и группе он находится? а) мышьяк, IV период, VА группа; б) теллур, V период, VIА группа; в) селен, IV период, VIА группа; г) вольфрам, VI период, VIВ группа. |
Атомы кальция и скандия различаются между собой: а) числом энергетических уровней; б) радиусом; в) числом валентных электронов; г) формулой высшего оксида. |
|
Для атомов серы и хрома одинаково: а) число валентных электронов; б) число энергетических уровней; в) высшая валентность; г) формула высшего оксида. |
|
Атомы азота и фосфора имеют: а) одинаковое число электронных слоев; б) одинаковое число протонов в ядре; в) одинаковое число валентных электронов; г) одинаковые радиусы. |
|
Формула высшего оксида элемента III периода, в атоме которого в основном состоянии содержится три неспаренных электрона: а) Э 2 О 3 ; б) ЭО 2 ; в) Э 2 О 5 ; г) Э 2 О 7 . |
|
Формула высшего оксида элемента ЭО 3 . Укажите формулу его водородного соединения: а) ЭН 2 ; б) ЭН; в) ЭН 3 ; г) ЭН 4 . |
|
Характер оксидов от основному к кислотному изменяется в рядах: а) Na 2 O, MgO, SiO 2 ; б) Cl 2 O, SO 2 , P 2 O 5 , NO 2 ; в) BeO, MgO, B 2 O 3 , Al 2 O 3 ,; г) CO 2 , B 2 O 3 , Al 2 O 3 , Li 2 O; д) СаО, Fe 2 O 3 , Al 2 O 3 , SO 2 . |
|
Выберите ряды, в которых формулы расположены в порядке возрастания кислотных свойств соединений: а) N 2 O 5 , P 2 O 5 , As 2 O 5 ; в) H 2 SeO 3 , H 2 SO 3 , H 2 SO 4 ; б) HF, HBr, HI; г) Al 2 O 3 , P 2 O 5 , Cl 2 O 7 . |
|
Укажите ряд, в котором гидроксиды расположены в порядке возрастания их основных свойств: а) LiOH, KOH, NaOH; в) LiOH, Ca(OH) 2 , Al(OH) 3 ; б) LiOH, NaOH, Mg(OH) 2 ; г) LiOH, NaOH, KOH. |
Задачи
Образец фосфора содержит два нуклида: фосфор-31 и фосфор-33. Мольная доля фосфора-33 равна 10 %. Рассчитайте относительную атомную массу фосфора в данном образце.
Природная медь состоит из нуклидов Cu 63 и Cu 65 . Отношение числа атомов Cu 63 к числу атомов Cu 65 в смеси равно 2,45:1,05. Рассчитайте относительную атомную массу меди.
Средняя относительная атомная масса природного хлора равна 35,45. Вычислите молярные доли его двух изотопов, если известно, что их массовые числа равны 35 и 37.
Образец кислорода содержит два нуклида: 16 О и 18 О, массы которых соответственно равны 4,0 г и 9,0 г. Определите относительную атомную массу кислорода в данном образце.
Химический элемент состоит из двух нуклидов. Ядро первого нуклида содержит 10 протонов и 10 нейтронов. В ядре второго нуклида нейтронов на 2 больше. На 9 атомов более легкого нуклида приходится один атом более тяжелого нуклида. Вычислите среднюю атомную массу элемента.
Какую относительную атомную массу имел бы кислород, если бы в природной смеси на каждых 4 атома кислорода-16 приходилось 3 атома кислорода-17 и 1 атом кислорода-18?
Ответы: 1. 31,2. 2. 63,6. 3. 35 Cl: 77,5 % и 37 Cl: 22,5 %. 4. 17,3. 5. 20,2. 6. 16,6.
Химическая связь
Основной объем учебного материала:
Природа и типы химической связи. Основные параметры химической связи: энергия, длина.
Ковалентная связь. Обменный и донорно-акцепторный механизмы образования ковалентной связи. Направленность и насыщаемость ковалентной связи. Полярность и поляризуемость ковалентной связи. Валентность и степень окисления. Валентные возможности и валентные состояния атомов элементов А-групп. Одинарные и кратные связи. Атомные кристаллические решетки. Концепция гибридизации атомных орбиталей. Основные типы гибридизации. Углы связей. Пространственное строение молекул. Эмпирическая, молекулярная и структурная (графическая) формулы молекул.
Ионная связь . Ионные кристаллические решетки. Химические формулы веществ с молекулярным, атомным и ионным строением.
Металлическая связь . Кристаллические решетки металлов.
Межмолекулярное взаимодействие. Молекулярная кристаллическая решетка. Энергия межмолекулярного взаимодействия и агрегатное состояние веществ.
Водородная связь. Значение водородной связи в природных объектах.
В результате изучения темы учащиеся должны знать:
что такое химическая связь;
основные типы химических связей;
механизмы образования ковалентной связи (обменный и донорно-акцепторный);
основные характеристики ковалентной связи (насыщаемость, направленность, полярность, кратность, s- и p-связи);
основные свойства ионной, металлической и водородной связей;
основные типы кристаллических решеток;
как изменяется запас энергии и характер движения молекул при переходе из одного агрегатного состояния в другое;
чем отличаются вещества, имеющие кристаллическое строение, от веществ, имеющих аморфное строение.
В результате изучения темы учащиеся должны приобрести навыки:
определения типа химической связи между атомами в различных соединениях;
сравнения прочности химических связей по их энергии;
определения степеней окисления по формулам различных веществ;
установления геометрической формы некоторых молекул на основании теории гибридизации атомных орбиталей;
прогнозирования и сравнения свойств веществ в зависимости от характера связей и типа кристаллической решетки.
Закончив изучение темы, учащиеся должны иметь представление:
– о пространственном строении молекул (направленность ковалентных связей, валентный угол);
– о теории гибридизации атомных орбиталей (sp 3 -,sp 2 -,sp-гибридизация)
Изучив тему, учащиеся должны запомнить:
элементы с постоянной степенью окисления;
соединения водорода и кислорода, в которых эти элементы имеют не характерные для них степени окисления;
величину угла между связями в молекуле воды.
Раздел 1. Природа и типы химической связи
Даны формулы веществ: Na 2 O, SO 3 , KCl, PCl 3 , HCl, H 2 , Cl 2 , NaCl, CO 2 , (NH 4) 2 SO 4 , H 2 O 2 , CO, H 2 S, NH 4 Сl, SO 2 , HI, Rb 2 SO 4 , Sr(OH) 2 , H 2 SeO 4 , He, ScCl 3 , N 2 , AlBr 3 , HBr, H 2 Se, H 2 O, OF 2, CH 4 , NH 3 , KI, CaBr 2 , BaO, NO, FCl, SiC. Выберите соединения:
молекулярного и немолекулярного строения;
только с ковалентными полярными связями;
только с ковалентными неполярными связями;
только с ионными связями;
сочетающие в структуре ионные и ковалентные связи;
сочетающие в структуре ковалентные полярные и ковалентные неполярные связи;
способные к образованию водородных связей;
имеющие в структуре связи, образованные по донорно-акцепторному механизму;
Как изменяется полярность связей в рядах?
а) H 2 O; H 2 S; H 2 Se; H 2 Te б) PH 3 ; H 2 S; HCl.
В каком состоянии - основном или возбужденном - находятся атомы выделенных элементов в следующих соединениях:
B Cl 3 ; P Cl 3 ; Si O 2 ; Be F 2 ; H 2 S ; C H 4 ; HCl O 4 ?
Какая пара из указанных элементов при химическом взаимодействии имеет максимальную тенденцию к образованию ионной связи:
Са, С, К, О, I, Cl, F?
В каких из предложенных ниже химических веществ, разрыв связей будет более вероятно протекать с образованием ионов, а в каких с образованием свободных радикалов: NaCl, CS 2 , CH 4 , K 2 O, H 2 SO 4 , KOH, Cl 2 ?
Даны галогеноводороды: НF, HCl, HBr, HI. Выберите галогеноводород:
водный раствор которого является наиболее сильной кислотой (наиболее слабой кислотой);
с наиболее полярной связью (наименее полярной связью);
с наибольшей длиной связи (с наименьшей длиной связи);
с наибольшей температурой кипения (с наименьшей температурой кипения).
При образовании одной химической связи фтор–фтор выделяется 2,64 ´
10 –19 Дж энергии. Рассчитайте, какое химическое количество молекул фтора должно образоваться для того, чтобы выделился 1,00 кДж энергии.
ТЕСТ 6.
При образовании молекулы из двух изолированных атомов энергия в системе: а) увеличивается; б) уменьшается; в) не изменяется; г) возможно как уменьшение, так и увеличение энергии. |
|
Укажите, в какой паре веществ общие электронные пары смещены в сторону атома кислорода: а) OF 2 и CO; б) Cl 2 O и NO; в) H 2 O и N 2 O 3 ; г) Н 2 O 2 и O 2 F 2 . |
|
Укажите соединения с ковалентной неполярной связью: а) O 2 ; б) N 2 ; в) Cl 2 ; г) PCl 5 . |
|
Укажите соединения с ковалентной полярной связью: а) H 2 O; б) Br 2 ; в) Cl 2 O; г) SO 2 . |
|
Выберите пару молекул, все связи в которых - ковалентные: а) NaCl, HCl; б) CO 2 , Na 2 O; в) CH 3 Cl, CH 3 Na; г) SO 2 , NO 2 . |
|
Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно: а) вода и сероводород; б) бромид калия и азот; в) аммиак и водород; г) кислород и метан. |
|
Ни одна из ковалентных связей не образуется по донорно-акцепторному механизму в частице: а) CO 2 ; б) CO; в) BF 4 – ; г) NH 4 + . |
|
По мере увеличения разницы в электроотрицательностях связанных атомов происходит: а) уменьшение полярности связи; б) усиление полярности связи; в) увеличение степени ионности связи; г) уменьшение степени ионности связи. |
|
В каком ряду молекулы расположены в порядке увеличения полярности связи? а) HF, HCl, HBr; б) NH 3 , PH 3 , AsH 3 ; в) H 2 Se, H 2 S, H 2 O; г) CO 2 , CS 2 , CSe 2 . |
|
Наибольшая энергия связи в молекуле: а) H 2 Te; б) H 2 Se; в) H 2 S; г) H 2 O. |
|
Химическая связь наименее прочна в молекуле: а) бромоводорода; б) хлороводорода; в) йодоводорода; г) фтороводорода. |
|
Длина связи увеличивается в ряду веществ, имеющих формулы: а) ССl 4 , CBr 4 , CF 4 ; б) SO 2 , SeO 2 , TeO 2 ; в) H 2 S, H 2 O, H 2 Se; г) HBr, HCl, HF. |
|
Максимальное число s -связей, которые могут существовать между двумя атомами в молекуле: а) 1; б) 2; в) 3; г) 4. |
|
Тройная связь между двумя атомами включает: а) 2 s-связи и 1 π-связь; б) 3 s-связи; в) 3 π-связи; г) 1s-связь и 2π-связи. |
|
Молекула СО 2 содержит химические связи: а) 1s и 1π; б) 2s и 2π; в) 3s и 1π; г) 4s. |
|
Сумма s - и π- связей (s + π) в молекуле SO 2 Cl 2 равна: а) 3 + 3; б) 3 + 2; в) 4 + 2; г) 4 + 3. |
|
Укажите соединения с ионной связью: а) хлорид натрия; б) оксид углерода (II); в) йод; г) нитрат калия. |
|
Только ионные связи поддерживают структуру вещества: а) пероксид натрия; б) гашеная известь; в) медный купорос; г) сильвинит. |
|
Укажите, атом какого элемента может участвовать в образовании металлической и ионной связи: а) As; б) Br; в) K; г) Se. |
|
Наиболее выражен характер ионной связи в соединении: а) хлорид кальция; б) фторид калия; в) фторид алюминия; г) хлорид натрия. |
|
Укажите вещества, агрегатное состояние которых при обычных условиях определяется водородными связями между молекулами: а) водород; б) хлороводород; в) жидкий фтороводород; г) вода. |
|
Укажите наиболее прочную водородную связь: а) –N....H–; б) –O....H–; в) –Cl....H–; г) –S....H–. |
|
Какая химическая связь наименее прочная? а) металлическая; б) ионная; в) водородная; г) ковалентная. |
|
Укажите тип связи в молекуле NF 3 : а) ионная; б) неполярная ковалентная; в) полярная ковалентная; г) водородная. |
|
Химическая связь между атомами элементов с порядковыми номерами 8 и 16: а) ионная; б) ковалентная полярная; в) ковалентная неполярная; г) водородная. |
|
Периодический закон.
Строение атома
В статье приведены тестовые задания по теме из банка тестовых заданий, составленных авторами для тематического контроля в 8-м классе. (Емкость банка – по 80 заданий на каждую из шести тем, изучаемых в 8-м классе, и 120 заданий по теме «Основные классы неорганических соединений».) В настоящее время обучение химии в 8-м классе проводится по девяти учебникам. Поэтому в конце статьи приведен перечень контролируемых элементов знаний с указанием номеров заданий. Это позволит учителям, работающим по разным программам, выбирать как соответствующую последовательность заданий из одной темы, так и набор комбинаций тестовых заданий из разных тем, в том числе и для итогового контроля.
Предложенные 80 тестовых заданий сгруппированы по 20 вопросов в четыре варианта, в которых аналогичные задания повторяются. Для составления большего количества вариантов из перечня элементов знаний выбираем (случайным образом) номера заданий по каждому изученному элементу в соответствии со своим тематическим планированием. Такое представление заданий по каждой теме позволяет провести быстрый поэлементный анализ ошибок и своевременную их коррекцию. Использование аналогичных заданий в одном варианте и чередование одного или двух правильных ответов снижает вероятность угадывания ответа. Сложность вопросов, как правило, увеличивается от 1-го и 2-го вариантов к 3-му и 4-му вариантам.
Существует мнение, что тесты – это «угадайка». Предлагаем вам проверить, так ли это. После проведения тестирования сравните результаты с отметками в журнале. Если результаты тестирования ниже, это можно объяснять следующими причинами.
Во-первых, для учащихся непривычна такая (тестовая) форма контроля. Во-вторых, учитель по-иному расставляет акценты при изучении темы (определение главного в содержании образования и методике преподавания).
Вариант 1
Задания.
1. В 4-м периоде, VIa группе находится элемент с порядковым номером:
1) 25; 2) 22; 3) 24; 4) 34.
2. Элемент с зарядом ядра атома +12 имеет порядковый номер:
1) 3; 2) 12; 3) 2; 4) 24.
3. Порядковый номер элемента соответствует таким его характеристикам:
1) заряду ядра атома;
2) числу протонов;
3) числу нейтронов;
4. Шесть электронов на внешнем энергетическом уровне у атомов элементов с номером группы:
1) II; 2) III; 3) VI; 4) IV.
5. Формула высшего оксида хлора:
1) Сl 2 О; 2) Сl 2 O 3 ;
3) Сl 2 O 5 ; 4) Сl 2 O 7 .
6. Валентность атома алюминия равна:
1) 1; 2) 2; 3) 3; 4) 4.
7. Общая формула летучих водородных соединений элементов VI группы:
1) ЭН 4 ; 2) ЭН 3 ;
3) НЭ; 4) Н 2 Э.
8. Номер внешнего электронного слоя в атоме кальция:
1) 1; 2) 2; 3) 3; 4) 4.
9.
1) Li; 2) Na; 3) K; 4) Cs.
10. Укажите элементы-металлы:
1) K; 2) Cu; 3) О; 4) N.
11. Где в таблице Д.И.Менделеева расположены элементы, атомы которых в химических реакциях только отдают электроны?
1) Во II группе;
2) в начале 2-го периода;
3) в середине 2-го периода;
4) в VIa группе.
12.
2) Ве, Мg; Аl;
3) Мg, Са, Sr;
13. Укажите элементы-неметаллы:
1) Сl; 2) S; 3) Mn; 4) Mg.
14. Неметаллические свойства возрастают в ряду:
15. Какая характеристика атома изменяется периодически?
1) Заряд ядра атома;
2) число энергетических уровней в атоме;
3) число электронов на внешнем энергетическом уровне;
4) число нейтронов.
16.
1) К; 2) Аl; 3) Р; 4) Сl.
17. В периоде с ростом заряда ядра радиусы атомов элементов:
1) уменьшаются;
2) не изменяются;
3) увеличиваются;
4) изменяются периодически.
18. Изотопы атомов одного элемента отличаются по:
1) числу нейтронов;
2) числу протонов;
3) числу валентных электронов;
4) положению в таблице Д.И.Менделеева.
19. Число нейтронов в ядре атома 12 С:
1) 12; 2) 4; 3) 6; 4) 2.
20. Распределение электронов по энергетическим уровням в атоме фтора:
1) 2, 8, 4; 2) 2,6;
3) 2, 7; 4) 2, 8, 5.
Вариант 2
Задания. Выберите один или два правильных ответа.
21. Элемент с порядковым номером 35 находится в:
1) 7-м периоде, IVа группе;
2) 4-м периоде, VIIa группе;
3) 4-м периоде, VIIб группе;
4) 7-м периоде, IVб группе.
22. Элемент с зарядом ядра атома +9 имеет порядковый номер:
1) 19; 2) 10; 3) 4; 4) 9.
23. Число протонов в нейтральном атоме совпадает с:
1) числом нейтронов;
2) атомной массой;
3) порядковым номером;
4) числом электронов.
24. Пять электронов на внешнем энергетическом уровне у атомов элементов с номером группы:
1) I; 2) III; 3) V; 4) VII.
25. Формула высшего оксида азота:
1) N 2 O; 2) N 2 O 3 ;
3) N 2 O 5 ; 4) NO;
26. Валентность атома кальция в его высшем гидроксиде равна:
1) 1; 2) 2; 3) 3; 4) 4.
27. Валентность атома мышьяка в его водородном соединении равна:
1) 1; 2) 2; 3) 3; 4) 4.
28. Номер внешнего электронного слоя в атоме калия:
1) 1; 2) 2; 3) 3; 4) 4.
29. Наибольший радиус атома у элемента:
1) B; 2) O; 3) C; 4) N.
30. Укажите элементы-металлы:
1) К; 2) H; 3) F; 4) Сu.
31. Атомы элементов, способных как принимать, так и отдавать электроны, расположены:
1) в Ia группе;
2) в VIa группе;
3) в начале 2-го периода;
4) в конце 3-го периода.
32.
1) Nа, К, Li; 2) Аl, Мg, Nа;
3) Р, S, Сl; 4) Na, Mg, Al.
33. Укажите элементы-неметаллы:
1) Na; 2) Мg; 3) Si; 4) P.
34.
35. Основная характеристика химического элемента:
1) атомная масса;
2) заряд ядра;
3) число энергетических уровней;
4) число нейтронов.
36. Символ элемента, атомы которого образуют амфотерный оксид:
1) N; 2) K; 3) S; 4) Zn.
37. В главных подгруппах (а) периодической системы химических элементов с увеличением заряда ядра радиус атома:
1) увеличивается;
2) уменьшается;
3) не изменяется;
4) изменяется периодически.
38. Число нейтронов в ядре атома равно:
1) числу электронов;
2) числу протонов;
3) разности между относительной атомной массой и числом протонов;
4) атомной массе.
39. Изотопы водорода различаются числом:
1) электронов;
2) нейтронов;
3) протонов;
4) положением в таблице.
40. Распределение электронов по энергетическим уровням в атоме натрия:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5.
Вариант 3
Задания. Выберите один или два правильных ответа.
41. Укажите порядковый номер элемента, который находится в IVa группе, 4-м периоде таблицы Д.И.Менделеева:
1) 24; 2) 34; 3) 32; 4) 82.
42. Заряд ядра атома элемента № 13 равен:
1) +27; 2) +14; 3) +13; 4) +3.
43. Число электронов в атоме равно:
1) числу нейтронов;
2) числу протонов;
3) атомной массе;
4) порядковому номеру.
44. У атомов элементов IVa группы число валентных электронов равно:
1) 5; 2) 6; 3) 3; 4) 4.
45. Оксиды с общей формулой R 2 О 3 образуют элементы ряда:
1) Na, К, Li; 2) Мg, Ca, Be;
3) В, Аl, Gа; 4) С, Si, Gе.
46. Валентность атома фосфора в его высшем оксиде равна:
1) 1; 2) 3; 3) 5; 4) 4.
47. Водородные соединения элементов VIIa группы:
1) HClO 4 ; 2) HCl;
3) HBrO; 4) HBr.
48. Число электронных слоев в атоме селена равно:
1) 1; 2) 2; 3) 3; 4) 4.
49. Наибольший радиус атома у элемента:
1) Li; 2) Na; 3) Mg;
50. Укажите элементы-металлы:
1) Na; 2) Mg; 3) Si; 4) P.
51. Атомы каких элементов легко отдают электроны?
1) K; 2) Cl; 3) Na; 4) S.
52. Ряд элементов, в котором возрастают металлические свойства:
1) С, N, В, F;
2) Al, Si, P, Mg;
53. Укажите элементы-неметаллы:
1) Na; 2) Мg; 3) Н; 4) S.
54. Ряд элементов, в котором возрастают неметаллические свойства:
1) Li, Nа, К, Н;
2) Аl, Si, Р, Мg;
3) С, N, О, F;
4) Na, Мg, Аl, К.
55. С увеличением заряда ядра атома неметаллические свойства элементов:
1) изменяются периодически;
2) усиливаются;
3) не изменяются;
4) ослабевают.
56. Символ элемента, атомы которого образуют амфотерный гидроксид:
1) Na; 2) Al; 3) N; 4) S.
57. Периодичность изменения свойств элементов и их соединений объясняется:
1) повторением строения внешнего электронного слоя;
2) увеличением числа электронных слоев;
3) увеличением числа нейтронов;
4) увеличением атомной массы.
58. Число протонов в ядре атома натрия равно:
1) 23; 2) 12; 3) 1; 4) 11.
59. Чем отличаются атомы изотопов одного элемента?
1) Числом протонов;
2) числом нейтронов;
3) числом электронов;
4) зарядом ядра.
60. Распределение электронов по энергетическим уровням в атоме лития:
1) 2, 1; 2) 2, 8, 1;
3) 2, 4; 4) 2, 5;
Вариант 4
Задания. Выберите один или два правильных ответа.
61. Элемент с порядковым номером 29 находится в:
1) 4-м периоде, Ia группе;
2) 4-м периоде, Iб группе;
3) 1-м периоде, Iа группе;
4) 5-м периоде, Iа группе.
62. Заряд ядра атома элемента № 15 равен:
1) +31; 2) 5; 3) +3; 4) +15.
63. Заряд ядра атома определяется по:
1) порядковому номеру элемента;
2) номеру группы;
3) номеру периода;
4) атомной массе.
64. У атомов элементов III группы число валентных электронов равно:
1) 1; 2) 2; 3) 3; 4) 5.
65. Высший оксид серы имеет формулу:
1) Н 2 SO 3 ; 2) Н 2 SO 4 ;
3) SO 3 ; 4) SO 2 .
66. Формула высшего оксида фосфора:
1) Р 2 О 3 ; 2) Н 3 РО 4 ;
3) НРО 3 ; 4) Р 2 О 5 .
67. Валентность атома азота в его водородном соединении:
1) 1; 2) 2; 3) 3; 4) 4.
68. Номер периода в таблице Д.И.Менделеева соответствует следующей характеристике атома:
1) числу валентных электронов;
2) высшей валентности в соединении с кислородом;
3) общему числу электронов;
4) числу энергетических уровней.
69. Наибольший радиус атома у элемента:
1) Сl; 2) Br; 3) I; 4) F.
70. Укажите элементы-металлы:
1) Мg; 2) Li; 3) H; 4) С.
71. Атом какого элемента легче отдает электрон?
1) Натрия; 2) цезия;
3) калия; 4) лития.
72. Металлические свойства возрастают в ряду:
1) Na, Mg, Al; 2) Nа, К, Rb;
3) Rb, К, Nа; 4) Р, S, Cl.
73. Укажите элементы-неметаллы:
1) Сu; 2) Вr; 3) Н; 4) Сr.
74. Неметаллические свойства в ряду N–Р–As–Sb:
1) уменьшаются;
2) не изменяются;
3) возрастают;
4) уменьшаются, а затем возрастают.
75. Какие характеристики атома изменяются периодически?
1) Относительная атомная масса;
2) заряд ядра;
3) число энергетических уровней в атоме;
4) число электронов на внешнем уровне.
76. Атомы какого элемента образуют амфотерный оксид?
1) К; 2) Ве; 3) С; 4) Са.
77. В периоде с увеличением заряда ядра атома увеличивается притяжение электронов к ядру и металлические свойства:
1) усиливаются;
2) изменяются периодически;
3) ослабевают;
4) не изменяются.
78. Относительная атомная масса элемента численно равна:
1) числу протонов в ядре;
2) числу нейтронов в ядре;
3) суммарному числу нейтронов и протонов;
4) числу электронов в атоме.
79. Число нейтронов в ядре атома 16 О равно:
1) 1; 2) 0; 3) 8; 4) 32.
80. Распределение электронов по энергетическим уровням в атоме кремния:
1) 2, 8, 4; 2) 2, 6;
3) 2, 7; 4) 2, 8, 5.
Перечень контролируемых элементов
знаний по теме
«Периодический закон. Строение атома»
(в скобках даны сквозные номера заданий)
Порядковый номер элемента (1, 3, 21, 41, 61), заряд ядра атома (2, 22, 42, 62, 63), число протонов (23) и число электронов (43) в атоме.
Номер группы, число электронов на внешнем энергетическом уровне (4, 24, 44, 64), формулы высшего оксида (5, 25, 45, 65), высшая валентность элемента (6, 26, 46, 66), формулы водородных соединений (7, 27, 47, 67).
Номер периода, число электронных уровней (8, 28, 48, 68).
Изменение радиуса атома (9, 17, 29, 37, 49, 67, 69).
Положение в таблице Д.И.Менделеева элементов-металлов (10, 30, 50, 70) и элементов-неметаллов (13, 33, 53, 73).
Способность атомов отдавать и принимать электроны (11, 31, 51, 71).
Изменение свойств простых веществ: по группам (12, 14, 34, 52, 54, 74) и периодам (32, 72, 77).
Периодическое изменение электронного строения атомов и свойств простых веществ и их соединений (15, 35, 55, 57, 75, 77).
Амфотериые оксиды и гидроксиды (16, 36, 56, 76).
Массовое число, число протонов и нейтронов в атоме, изотопы (18, 19, 38, 39, 58, 59, 78, 79).
Распределение электронов по энергетическим уровням в атоме (20, 40, 60, 80).
Ответы на тестовые задания по теме
«Периодический закон. Строение атома»
| Вариант 1 | Вариант 2 | Вариант 3 | Вариант 4 | ||||
|---|---|---|---|---|---|---|---|
| № задания | № ответа | № задания | № ответа | № задания | № ответа | № задания | № ответа |
| 1 | 4 | 21 | 2 | 41 | 3 | 61 | 2 |
| 2 | 2 | 22 | 4 | 42 | 3 | 62 | 4 |
| 3 | 1, 2 | 23 | 3, 4 | 43 | 2, 4 | 63 | 1 |
| 4 | 3 | 24 | 3 | 44 | 4 | 64 | 3 |
| 5 | 4 | 25 | 3 | 45 | 3 | 65 | 3 |
| 6 | 3 | 26 | 2 | 46 | 3 | 66 | 4 |
| 7 | 4 | 27 | 3 | 47 | 2, 4 | 67 | 3 |
| 8 | 4 | 28 | 4 | 48 | 4 | 68 | 4 |
| 9 | 4 | 29 | 1 | 49 | 5 | 69 | 3 |
| 10 | 1, 2 | 30 | 1, 4 | 50 | 1, 2 | 70 | 1, 2 |
| 11 | 1, 2 | 31 | 2, 4 | 51 | 1, 3 | 71 | 2 |
| 12 | 3 | 32 | 2 | 52 | 3 | 72 | 2 |
| 13 | 1, 2 | 33 | 3, 4 | 53 | 3, 4 | 73 | 2, 3 |
| 14 | 1 | 34 | 4 | 54 | 3 | 74 | 1 |
| 15 | 3 | 35 | 2 | 55 | 1 | 75 | 4 |
| 16 | 2 | 36 | 4 | 56 | 2 | 76 | 2 |
| 17 | 1 | 37 | 1 | 57 | 1 | 77 | 3 |
| 18 | 1 | 38 | 3 | 58 | 4 | 78 | 3 |
| 19 | 3 | 39 | 2 | 59 | 2 | 79 | 3 |
| 20 | 3 | 40 | 2 | 60 | 1 | 80 | 1 |
Литература
Городничева И.Н . Контрольные и проверочные работы по химии. М.: Аквариум, 1997; Сорокин В.В., Злотников Э.Г . Тесты по химии. М.: Просвещение, 1991.
Выше говорилось (с. 172) о периодичности изменения важнейшего для химии свойства атомов - валентности. Есть и другие важные свойства, изменение которых характеризуется периодичностью. К таким свойствам относится размер (радиус) атома. Атом не имеет поверхности, и граница его расплывчата, так как плотность внешних электронных облаков по мере удаления от ядра плавно убывает. Данные о радиусах атомов получают из определения расстояний между их центрами в молекулах и кристаллических структурах. Проведены также расчеты на основе уравнений квантовой механики. На рис. 5.10 пред-
Рис. 5.10. Периодичность изменения атомных радиусов
ставлена кривая изменения атомных радиусов в зависимости от заряда ядра.
От водорода к гелию радиус уменьшается, а затем резко увеличивается у лития. Это объясняется появлением электрона на втором энергетическом уровне. Во втором периоде от лития до неона по мере увеличения заряда ядра радиусы уменьшаются.
В то же время увеличение числа электронов на данном энергетическом уровне ведет к возрастанию их взаимного отталкивания. Поэтому к концу периода уменьшение радиуса замедляется.
При переходе от неона к натрию - первому элементу третьего периода - радиус снова резко возрастает, а потом постепенно уменьшается до аргона. После этого снова происходит резкое увеличение радиуса у калия. Получается характерная периодическая пилообразная кривая. Каждый участок кривой от щелочного металла до благородного газа характеризует изменение радиуса в периоде: наблюдается уменьшение радиуса при переходе слева направо. Интересно также выяснить характер изменения радиусов в группах элементов. Для этого надо провести линию через элементы одной группы. По положению максимумов у щелочных металлов непосредственно видно, что радиусы атомов при переходе в группе сверху вниз увеличиваются. Это связано с увеличением числа электронных оболочек.
задание 5.17. Как изменяются радиусы атомов от F к Вr? Определите это по рис. 5.10.
От радиусов зависят многие другие свойства атомов, как физические, так и химические. Например, увеличением радиусов атомов можно объяснить понижение температур плавления щелочных металлов от лития к цезию:
Размеры атомов связаны с их энергетическими свойствами. Чем больше радиус внешних электронных облаков, тем легче атом теряет электрон. При этом он превращается в положительно заряженный ион.
Ион - одно из возможных состояний атома, в котором он имеет электрический заряд вследствие потери или присоединения электронов.
Способность атома переходить в положительно заряженный ион характеризуется энергией ионизации Е И. Это минимальная энергия, необходимая для отрыва внешнего электрона от атома в газовом состоянии:
![]()
Образовавшийся положительный ион тоже может терять электроны, становясь двухзарядным, трехзарядным и т. д. Величина энергии ионизации при этом сильно возрастает.
Энергия ионизации атомов увеличивается в периоде при переходе слева направо и уменьшается в группах при переходе сверху вниз.
Многие, но не все атомы способны присоединять дополнительный электрон, превращаясь в отрицательно заряженный ион А~. Это свойство характеризуется энергией сродства к электрону E ср. Это энергия, выделяющаяся при присоединении электрона к атому, находящемуся в газовом состоянии:
![]()
Как энергию ионизации, так и энергию сродства к электрону принято относить к 1 моль атомов и выражать в кДж/моль. Рассмотрим ионизацию атома натрия в результате присоединения и потери электрона (рис. 5.11). Из рисунка видно, что для отнятия электрона от атома натрия требуется в 10 раз больше энергии, чем выделяется при присоединении электрона. Отрицательный ион натрия неустойчив и в сложных веществах почти не встречается.

Рис. 5.11. Ионизация атома натрия
Энергия ионизации атомов изменяется в периодах и группах в направлении, противоположном изменению радиуса атомов. Изменение энергии сродства к электрону в периоде более сложно, так как у элементов IIА- и VIIIA-rpynn сродство к электрону отсутствует. Приближенно можно считать, что энергия сродства к электрону, подобно Е к, увеличивается в периодах (до группы VII включительно) и уменьшается в группах сверху вниз (рис. 5.12).
задание 5 .18. Могут ли атомы магния и аргона в газообразном состоянии образовать отрицательно заряженные ионы?
Ионы с положительными и отрицательными зарядами притягиваются между собой, что ведет к разнообразным превращениям. Наиболее простой случай - это образование ионных связей, т. е. объединение ионов в вещество под действием электростатического притяжения. Тогда возникает ионная кристаллическая структура, характерная для пищевой соли NaCl и множества других солей. Но может быть

Рис. 5.12. Характер изменения энергии ионизации и энергии сродства к электрону в группах и периодах
так, что отрицательный ион не очень прочно удерживает свой лишний электрон, а положительный ион, наоборот, стремится восстановить свою электронейтральность. Тогда взаимодействие между ионами может привести к образованию молекул. Очевидно, что ионы разного знака заряда С1 + и С1~ притягиваются между собой. Но в силу того, что это ионы одинаковых атомов, они образуют молекулу С1 2 с нулевыми зарядами на атомах.
ВОПРОСЫ И УПРАЖНЕНИЯ
1. Из скольких протонов, нейтронов и электронов состоят атомы брома?
2.
Рассчитайте массовые доли изотоповв природе. ![]()
3. Сколько энергии выделяется при образовании 16 г
кислорода по реакции ![]() протекающей в недрах звезд?
протекающей в недрах звезд?
4. Рассчитайте энергию электрона в возбужденном атоме водорода при п = 3.
5. Напишите полную и сокращенную электронные формулы атома иода.
6. Напишите сокращенную электронную формулу иона Г.
7. Напишите полную и сокращенную электронные формулы атома Ва и иона Ва 2 ".
8. Постройте энергетические диаграммы атомов фосфора и мышьяка.
9. Постройте полные энергетические диаграммы атомов цинка и галлия.
10. Расположите следующие атомы в порядке увеличения радиуса: алюминий, бор, азот.
11. Какие из следующих ионов образуют между собой ионные кристаллические структуры: Вr + Вr - , К + , К - , I + , I - , Li + , Li - ? Что можно ожидать при взаимодействии ионов в других комбинациях?
12. Предположите возможный характер изменения радиуса атомов при переходе в периодической системе в диагональном направлении, например Li - Mg - Sc.